斜纹夜蛾核型多角体病毒Ⅱ型分离株同源重复区hr1的结构功能分析
2019-01-03刘惠芬衣葵花刘文光董亚茹张志芳李云芝王安皆
刘惠芬 衣葵花 刘文光 董亚茹 张志芳 李云芝 王安皆


摘要:斜纹夜蛾核型多角体病毒Ⅱ型(Spodoptera litura nucleopolyhedrovirus Ⅱ,SpltNPVⅡ)基因组DNA同源重复区hr1大小为1 746 bp,含有6个64 bp不完全回文序列、4个正向重复序列以及7个与病毒基因组DNA复制相关的基序。瞬时表达分析结果表明,SpltNPVⅡhr1在感染野生型家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)和苜蓿丫纹夜蛾多粒包埋型核多角体病毒(Autographa californica multiple nucleopolyhedrovirus,AcMNPV)的BmN和Sf21细胞中均具有增强早期基因ie1启动子活性的功能,增强效率分别为30、350倍;实时荧光定量PCR结果显示,hr1在BmN和Sf21细胞中具有基因组DNA复制起始原点的功能,拷贝数分别为(8.46×104±6.13×103)、(592×106±2.95×105)copies/μg DNA。研究证明,SpltNPVⅡ hr1在异源细胞BmN和Sf21中具有复制起始原点和增强子的双功能作用。
关键词:斜纹夜蛾;核型多角体病毒;同源重复区;hr1
中图分类号: S433.4;Q78文献标志码: A
文章编号:1002-1302(2019)21-0100-03
收稿日期:2019-08-09
基金项目:山东省自然科学基金(编号:ZR2017BC080);山东省现代农业产业技术体系蚕桑产业创新团队建设项目(编号:SDAIT-18-03)。
作者简介:刘惠芬(1982—),女,山东滕州人,博士,助理研究员,主要从事昆虫病毒学研究。Tel:(0535)6527628;E-mail:liuhuifen77@163.com。
通信作者:李云芝,研究员,主要从事家蚕病理研究,Tel:(0535)6527628,E-mail:yzli888@163.com;王安皆,副研究员,主要从事家蚕病理研究,Tel:(0535)6527628,E-mail:wangaj77@126.com。
杆状病毒是一类环状双链DNA病毒,其基因组大小为80~180 kb。在杆状病毒的发育循环中,DNA复制是其生命周期中最重要的一环,也是病毒增殖周期最重要的事件[1]。DNA复制原点是最为重要的顺式作用元件,对DNA的复制极为重要。研究发现,杆状病毒DNA复制原点有2种类型,分别为同源重复区(homologous repeat regions,hr)和非同源重复区起始位点(non-hr)[2-4]。其中,hr存在于大多数杆状病毒基因组中,是目前研究较多的类型。
hr作为核型多角体病毒(nucleopolyhedrovirus,NPV)DNA复制原点已在众多杆状病毒中得到证实[5-9]。苜蓿丫纹夜蛾多粒包埋型核多角体病毒(Autographa californica multiple nucleopolyhedrovirus,AcMNPV)基因组含有8个复制原点,包括7个hr和1个HindⅢ-K片段,研究发现7个AcMNPVhr均具有复制原点功能[5]。家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)基因组含有8个复制原点,其中hr3和hr5不仅在宿主细胞中具有复制原点功能,在AcMNPV感染的非宿主Sf21细胞中亦可得到复制,而且hr5在AcMNPV感染的Sf21细胞中的复制功能比在BmNPV感染的BmN细胞中高一些[6,10-11],表明与AcMNPV复制有关的因子亦能作用于BmNPV的hrs。hr除具有复制原点的功能外,还具有早期基因表达增强子的功能。BmNPV ZJ-8株 hr3具有增强ie1和hel基因启动子活性的功能,其增强转录活性分别高达2 400、7 000倍左右,即使仅含有hr3中1个典型完整的回文序列,其增强能力也高达79倍[12-13]。在Sf9细胞中,AcMNPVhr1序列除具有复制原点的功能外,还能够增强多角体启动子和果蝇hsp70基因启动子的转录活性[14]。
斜纹夜蛾核型多角体病毒Ⅱ型(Spodoptera litura nucleopolyhedrovirus Ⅱ,SpltNPVⅡ)基因组DNA含有7个hrs,前期研究证实7个hrs在宿主细胞Spli221中具有复制原点和增强子的功能[7],本研究拟对SpltNPVⅡhr1进行结构分析,并采用脂质体介导的质粒转染法与实时荧光定量聚合酶链式反应(PCR)相结合的方法,探讨hr1在非敏感宿主BmNPV-BmN和AcMNPV-Sf21細胞系统中是否具有复制原点和增强子的功能。
1材料与方法
1.1试验材料和主要试剂
BmN和Sf21细胞均由中国农业科学院生物技术研究所提供。质粒pBm-ie1P-hr1和pAc-ie1P-hr1分别含有BmNPVie1和AcMNPVie1启动子序列以及SpltNPVⅡ hr1序列,质粒pUC19-hr1含有SpltNPVⅡ hr1序列,均为笔者所在研究室保存。寡核苷酸引物的合成由北京三博远志生物技术有限责任公司完成。昆虫细胞培养基TC-100、胎牛血清及脂质体(lipofectin)试剂均购自GIBCO公司。SYBR Green Ⅰ试剂购自Promega公司。
1.2试验方法
1.2.1细胞培养
BmN和Sf21细胞用含10%胎牛血清(FBS)的TC-100培养基在27 ℃按Summers等的方法[15]进行培养。
1.2.2SpltNPVⅡhr1序列分析
利用ClustalW、DNAMAN、Lasergene 7.1和MEGA 4等生物软件对SpltNPVⅡ hr1序列进行分析。
1.2.3脂质体法转染昆虫细胞
接种约5×105个细胞于12 cm2 25 mL培养瓶中,贴壁培养过夜。除去含FBS的培养基,用无血清培养基洗2次细胞,加入1 mL无血清培养基,接种野生型NPV病毒(感染复数=1),感染1 h。然后倾去培养基,加入3 mL 含血清的完全培养基,27 ℃培养2 h。移去上述完全培养基,用无血清培养基洗2次细胞,再加1 mL无血清培养基。事先在50 μL反应体系中加入2 μg质粒DNA和适量的lipofectin试剂,用ddH2O补足体积,轻轻混匀,27 ℃温育15 min 使DNA被脂质体包埋,制成转染液。将转染液逐滴加入培养瓶中,并轻轻转动混匀。转染4~5 h后倾去含转染液的无血清培养基,补加3 mL含FBS的培养基,27 ℃培养。
1.2.4瞬时表达分析
将功能质粒pBm-ie1P-hr1和pAc-ie1P-hr1 DNA分别转染野生型病毒BmNPV和AcMNPV感染的BmN和Sf21细胞或未感染细胞,培养48 h,用细胞刮将贴壁细胞刮下,5 000 r/min离心5 min,收集细胞。加入适量磷酸缓冲液,重悬细胞后,5 000 r/min离心5 min,弃上清,如此反复清洗细胞2~3次。加入细胞裂解液将细胞重悬,裂解5~10 min,使之充分裂解。在每个样品管中加入100 μL荧光素酶反应底物,加入一定体积的细胞裂解混合液,振荡混匀。将样品放入荧光仪,按照设定程序开始测量读数[16]。设置3组重复试验。以pRL-CMV质粒作为内参质粒,以只含ie1启动子的pBm-ie1P和pAc-ie1P质粒作对照。将牛血清白蛋白配制成标准浓度(0.5 mg/mL)蛋白质,用酶标仪进行蛋白质定量测定。
1.2.5实时荧光定量PCR
将功能质粒pUC19-hr1 DNA转染野生型病毒BmNPV和AcMNPV感染的BmN和Sf21细胞。48 h后收集细胞,提取细胞总DNA,经DpnⅠ酶切后,进行实时荧光定量PCR,并制作标准曲线[7]。用实时荧光定量PCR获得的CT值及标准曲线来计算功能质粒在BmN和Sf21细胞中的拷贝数。
2结果与分析
2.1SpltNPVⅡhr1序列分析
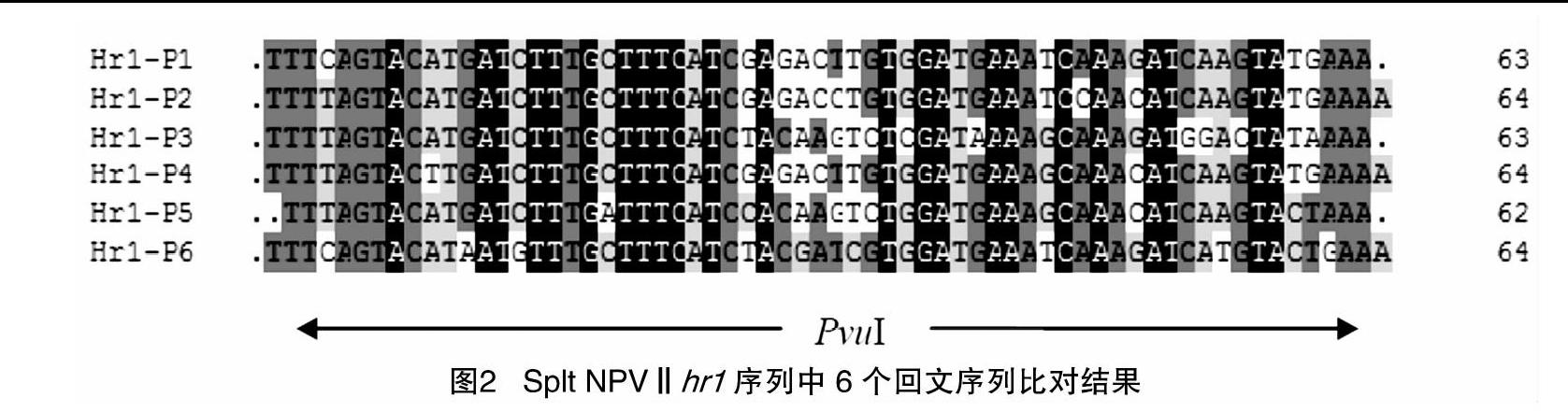
SpltNPVⅡ hr1大小为1 746 bp,位于基因组127 816~130 509 bp、开放阅读框(ORF)8~ORF9之间。hr1含6个64 bp 不完全回文序列(图1),其序列的核苷酸一致性高达90%以上,回文序列的中心均含有1个PvuⅠ限制性酶切位点,含有4个正向重复序列,并且存在7个不规则重复序列和7个与病毒基因组DNA复制相关的motif基序(图2)。
2.2SpltNPVⅡhr1对BmNPV和AcMNPVie1启动子转录活性的增强作用
采用脂质体介导功能质粒在昆虫细胞中的转染与瞬时表达方法,将构建的含有BmNPV和AcMNPVie1启动子以及SpltNPVⅡhr1的功能质粒分别转染感染野生型BmNPV和AcMNPV的BmN和Sf21细胞,以只含ie1启动子的pBmie1-P和pAc-ie1P质粒作对照。结果显示,SpltNPVⅡhr1在非敏感宿主细胞BmN中,增强BmNPVie1启动子转录活性的效率是对照的30倍,增强AcMNPVie1启动子转录活性的功能较强,其增强效率为对照的350倍(表1)。
将功能质粒pUC19-hr1按照108~104个拷贝进行梯度稀释,作为模板进行实时荧光定量PCR。以所得CT值对相应拷贝数的对数作图,即得所需标准曲线及其线性方程y=ax+b,结果显示,标准曲线线性关系良好,r2>0.99(图3)。
用含有SpltNPVⅡhr1的功能质粒分别转染BmNPV和AcMNPV感染的BmN和Sf21细胞,培养48 h后提取细胞总DNA,经DpnⅠ酶切后进行实时荧光定量PCR,将获得的CT值代入图3中制作的标准曲线,计算出含有SpltNPVⅡhr1的功能质粒在BmN和Sf21细胞中的拷贝数。结果显示,SpltNPVⅡhr1在BmN细胞中的拷贝数为(8.46×104±6.13×103)copies/μg DNA,在Sf21细胞中的拷贝数为(5.92×106±2.95×105)copies/μg DNA。
3讨论与结论
大多数杆状病毒基因组都含有同源重复序列,分布于基因组的多个位置,具有基因组DNA复制起始原点和增强基因启动子转录活性的双重功能。本研究通过序列分析发现,SpltNPVⅡhr1具有作为病毒基因组DNA复制起始原点的特征结构,并探讨了SpltNPVⅡhr1在非敏感宿主BmN和Sf21細胞中是否具有复制起始原点以及增强BmNPVie1和AcMNPVie1基因启动子转录活性的功能,发现hr1在2种非敏感宿主细胞中均具有复制起始原点和增强子功能,但复制和增强效率各不相同。在Sf21细胞中的复制和增强效率远高于在BmN细胞中,并且同样处理条件下,在异源细胞中的复制和增强效率高于在宿主细胞Spli221中[7]。
胡建新等通过Southern杂交检测发现,含BmNPVhr5的质粒在AcMNPV-Sf细胞系统中的复制起始原点功能要比在BmNPV-BmN细胞系统中高一些[11]。Chen等曾报道,BmNPVhr3具有增强BmNPVie1和AcMNPVie1基因启动子转录活性的功能,并且在异源Sf21细胞中的增强作用远高于宿主细胞BmN[13]。这可能是由于细胞转化和感染方法等都是仿照细胞Sf21/AcMNPV系统所采用的方法,对于其他细胞株来说可能不是最适合的条件。张志芳等研究发现,BmNPVhr3和hr5与AcMNPV同源性高达90%以上,并且在AcMNPV感染的Sf21细胞中均能得到显著复制,推测hr作为病毒复制起始原点与其结构以及所需病毒因子的同源性可能有关[6,11]。
参考文献:
[1]吕鸿声. 昆虫病毒分子生物学[M]. 北京:中国农业科学技术出版社,1998:217-274.
[2]Pearson M N,Bjornson R M,Ahrens C,et al. Identification and characterization of a putative origin of DNA replication in the genome of a baculoviruspathogenic for Orgyia pseudotsugata[J]. Virology,1993,197(2):715-725.
[3]Huang J H,Levin D B. Identification and functional analysis of a putative non-hr origin of DNA replication from the Spodoptera littoralis type B multinucleocapsid nucleopolyhedrovirus[J]. Journal of General Virology,1999,80(8):2263-2274.
[4]Jehle J A. The expansion of a hypervariable,non-hr ori-like region in the genome of Cryptophlebia leucotreta granulovirus provides in vivo evidence for the utilization of baculovirus non-hr oris during replication[J]. Journal of General Virology,2002,83(8):2025-2034.
[5]Kool M,Voeten J T,Goldbach R W,et al. Identification of seven putative origins of Autographa californica multiple nucleocapsid nuclear polyhedrosis virus DNA replication[J]. Journal of General Virology,1993,74(12):2661-2668.
[6]张志芳,张颖,吕鸿声,等. 家蚕核多角体病毒DNA复制起始点hr3的结构功能[J]. 中国科学,1995,25(9):949-955.
[7]Liu H F,Gao H J,Guo G,et al. The homologous regions of Spodoptera litura(Lepidoptera:Noctuidae)nucleopolyhedrovirus Ⅱhave both the function as origin of DNA replication and enhancer[J]. Journal of Insect Science,2015,15(1):89-96.
[8]Kuzio J,Faulkner P. Regions of repeated DNA in the genome of Choristoneura fumifefana nuclear polyhedrosis virus[J]. Virology,1984,139(1):185-188.
[9]Alves C A,Ikeda M,Kobayashi M. Identification and characterization
of Hyphantria cunea nucleopolyhedrovirus homologous repeated regions[J]. Virus Genes,2002,25(3):281-290.
[10]Cheng R L,Xu Y P,Zhang C X. Genome sequence of a Bombyx mori nucleopolyhedrovirus strain with cubic occlusion bodies[J]. Journal of Virology,2012,86(18):10245.
[11]胡建新,吳祥甫,李载平,等. 家蚕核型多角体病毒同源重复区hr5的结构和功能[J]. 中国科学(C辑:生命科学),1996,26(3):194-199.
[12]肖庆利,张志芳,易咏竹,等. 家蚕核多角体病毒解旋酶基因启动子及增强子hr3功能分析[J]. 生物化学与生物物理学报,2001,33(5):525-530.
[13]Chen Y,Yao B,Zhu Z Z,et al. A constitutive super-enhancer:homologous region 3 of Bombyx mori nucleopolyhedrovirus[J]. Biochemical and Biophysical Research Communications,2004,318(4):1039-1044.
[14]Viswanathan P,Venkaiah B,Kumar M S,et al. The homologous region sequence (hr1) of Autographa californica multinucleocapsid polyhedrosis virus can enhance transcription from non-baculoviral promoters in mammalian cells[J]. Journal of Biological Chemistry,2003,278(52):52564-52571.
[15]Summers M D,Smith G E. A manual of methods for baculovirus vectors and insect cell culture procedures[M]. Texas:Texas Agricultural Experiment Station Bulletin,1987:1555-1556.
[16]Idahl L A,Sandstrm P E,Sehlin J. Measurements of serum glucose using the luciferin/luciferase system and a liquid scintillation spectrometer[J]. Analytical Biochemistry,1986,155(1):177-181.
