干燥方式对滁菊抗氧化、抑菌活性和挥发性风味物质的影响
2019-01-03孙艳辉严佳慧王金涛孙梦媛
詹 歌 孙艳辉 严佳慧 王金涛 孙梦媛 龙 门
(1. 滁州学院生物与食品工程学院,安徽 滁州 239000;2. 安徽省热敏性物料加工工程技术中心,安徽 滁州 239000)
滁菊属菊目菊科植物,又名“白菊”“甘菊”,产于安徽滁州,属药、茶两用佳品。滁菊入药时可治疗高血压、冠心病等病症;做茶饮时,可以清风散热、舒筋活血和排毒养颜。此外,滁菊还可作枕明目、治疗目赤肿痛和头痛弦晕,其药用价值名列中国四大药菊(滁菊、杭菊、怀菊、亳菊)之首[1]。滁菊含有黄酮类化合物、氨基酸、挥发油和微量元素等有效成分[2],具有很好的抗氧化、抑菌、抗衰老、抗病毒和抗炎功效[3-4]。
鲜菊花水分含量较高,不易贮藏保鲜,因此通常采用杀青后直接干燥的加工方法进行贮藏。而不同的干燥方式各有优缺点,对菊花品质的影响也有差异。Yuan等[5]考察了阴干、晒干、直接烘干对小白菊品质的影响;结果显示阴干小白菊中的酚类物质含量最高,具有最强的抗氧化活性;Kim等[6]研究显示远红外干燥野菊花中总酚含量、总黄酮含量和抗肿瘤活性显著高于阴干野菊花。目前针对滁菊的研究主要集中在药理作用、化学成分等方面[7-9],而关于干燥方式对滁菊品质影响的研究较少,仅徐建[10]就5种传统干燥方式滁菊中绿原酸、木犀草苷、二咖啡酰基奎宁酸的含量进行了分析和比较,缺乏新型干燥方式对滁菊生物活性及风味影响的研究。
本研究拟以滁菊为研究对象,分别通过真空冷冻、热泵、热风干燥3种干燥方式对其进行处理,并比较分析不同干燥方式对滁菊的抗氧化和抑菌性能、香气成分以及感官特性的影响,以期确定滁菊干燥工艺,为滁菊的稳定加工提供技术支持。
1 材料与方法
1.1 材料与试剂
新鲜滁菊:滁州市滁菊研究所;
金黄色葡萄球菌(NCTC 6538)、大肠杆菌(ATC25922):北京陆桥技术有限公司;
DPPH、ABTS、TBA、BHT、VC、亚油酸、卵黄脂蛋白等生化试剂:国药集团试剂有限公司。
1.2 仪器与设备
电子天平:JA2003B型,上海越平科学仪器有限公司;
紫外可见分光光度计:T6新世纪型,北京普析通用仪器有限责任公司;
冷冻干燥机:SCIENTZ-10ND型,宁波新芝生物科技股份有限公司;
生化培养箱:LRH-250A型,韶关市泰宏医疗器械有限公司;
电热鼓风干燥箱:GZX-9240 MBE型,上海博迅实业有限公司医疗设备厂;
台式低速离心机:L530型,湖南湘仪实验室仪器开发有限公司;
旋转蒸发器:YRE-301型,巩义市予华仪器有限责任公司;
CAR/PDMS萃取头:75 μm,美国Supelco公司;
气相色谱—质谱联用仪:7890A/5975C型,美国安捷伦公司;
数控超声波清洗器:KQ3200DA型,昆山市超声仪器有限公司。
1.3 方法
1.3.1 样品制备方法 选择没有虫害和病斑的新鲜滁菊,100 ℃ 杀青5 min,沥干冷却,分别采用如下工艺对滁菊进行干燥处理:
(1) 真空冷冻干燥工艺(T1):将平铺一层滁菊的料盘置于干燥仓隔板上,设置隔板温度-30 ℃,常压下冷冻4 h;然后搁板温度30 ℃、真空度8 Pa条件下将样品干燥至含水率为10%左右时停止干燥,密封保存备用并记录干燥时间。
(2) 热泵干燥工艺(T2):将平铺一层滁菊的料盘置于冷风干燥室中,然后在温度为40 ℃、风速为2.5 m/s、相对湿度40%的条件下将样品干燥至含水率为10%左右时停止干燥,密封保存备用并记录干燥时间。
(3) 热风干燥工艺(T3):将平铺一层滁菊的料盘置于鼓风干燥箱中,然后在60 ℃条件下将样品干燥至含水率为10%左右时停止干燥,密封保存备用并记录干燥时间。
1.3.2 滁菊水提物制备 称取100 g干燥滁菊,按料水比为1∶7.5 (g/mL)加入沸水浸提3次,每次浸提10 min,合并滤液并通过真空浓缩、冷冻干燥得到滁菊水提物。
1.3.3 抗氧化能力测定
(1) DPPH自由基和ABTS自由基清除能力:参照Zhan等[11]的测定方法。分析3种干燥方式滁菊水提物在添加量分别为1.0,2.0,3.0,4.0,5.0,6.0 mg/mL时对两种自由基的清除能力,同时以VC为阳性对照(n=3)。
(2) 脂质过氧化抑制能力:分别参照And等[12]和陈彩薇等[13]的测定方法。分析3种不同的滁菊水提物在添加量为1.0,2.0,3.0,4.0,5.0,6.0 mg/mL时对亚油酸及卵黄脂蛋白的抑制能力,同时以BHT为阳性对照(n=3)。
1.3.4 抑菌活性测定 参考Edziri等[14]的方法测定最低抑菌浓度(MIC)及最低杀菌浓度(MBC)。将滁菊水提物用Muller-Hinton broth(MHB)液体培养基调节为不同浓度梯度。取95 μL 样品溶液与5 μL菌液(106CFU/mL)在96微孔板中混匀,置于37 ℃恒温箱中培养24 h。MIC是指完全抑制细菌的生长所需样品的最低浓度。吸取澄清孔中培养液涂布在Muller-Hinton agar(MHA)固体培养基平皿上,于37 ℃培养24 h,将无菌生长的最小样品浓度定义为MBC。
1.3.5 挥发性风味物质测定 取滁菊4 g放于100 mL烧杯中,锡箔纸密封后在60 ℃平衡10 min,再将萃取头(75 μm CAR/PDMS)置于滁菊上方吸附30 min,立即插入气相色谱—质谱联用仪(gas chromatography-mass spectrometer,GC-MS)进样,解析时间2 min。
色谱条件:HP-5毛细管柱(30 m×250 μm,0.25 μm);进样口采用不分流模式;温度250 ℃;载气(He)流量为1.2 mL/min;升温程序:起始柱温40 ℃,保持3 min,以3 ℃/min 升到160 ℃,保持2 min,然后以8 ℃/min升至220 ℃,保持3 min。
质谱条件:离子源EI,接口温度250 ℃,离子源温度230 ℃,四极杆温度150 ℃。电子能量70 eV,质量扫描范围(m/z)40~450 amu。
挥发性风味化合物分析:将分离出的化合物的质谱数据与计算机检索标准谱图库进行对比确认挥发性物质的组成;采用峰面积归一法确定挥发性风味物质的相对含量[15]。
1.3.6 感官评定方法 参照GB/T 19692—2008和黄风格等[16]的方法对不同干燥方式的滁菊干花及冲泡后滁菊茶进行感官评定,具体评分标准见表1。
1.3.7 数据统计分析 所有数据利用Microsoft Excel 2010进行统计处理,用SAS 9.2进行ANOVA分析,不同平均值之间利用LSD(Least-Significant Difference)法进行差异显著性检验(X±SDV,n=3)。
2 结果与分析
2.1 对滁菊抗氧化性能的影响
2.1.1 自由基清除能力 图1对不同干燥方式的滁菊水提物对DPPH自由基及ABTS自由基的清除作用进行了比较。测试样品均有不同程度的清除作用,且在相应的浓度范围内,清除率和样品浓度呈现较好的量效关系。其中,真空冷冻干燥后的滁菊水提物(T1)对2种自由基的清除作用最强,显著(P<0.05)高于其他处理组;其次为热泵干燥处理组(T2);而热风干燥的滁菊水提物(T3)自由基清除能力相对较差。此外,与VC处理组相比,当不同水提物添加量分别超过4,3 mg/mL 时,其对DPPH自由基和ABTS自由基的清除能力均超过同量VC的。

表1 滁菊感官评分标准
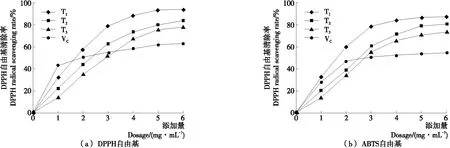
图1 干燥方式对滁菊自由基清除能力的影响
2.1.2 脂质过氧化抑制能力 不同处理组滁菊水提物的亚油酸和卵黄脂质过氧化抑制能力结果见图2。从图2可以看出,滁菊水提物能显著(P<0.05)抑制亚油酸及卵黄脂的氧化,并呈浓度依赖关系。其中,真空冷冻干燥处理组(T1)对2种脂质的氧化抑制率最大,在添加量为6 mg/mL时,对亚油酸和卵黄脂的氧化抑制率分别为59.52%和54.53%;其次为热泵干燥处理组(T2),最后为热风处理组(T3)。3个处理组对脂质氧化的抑制率均显著(P<0.05)低于等量BHT的。
综上,不同干燥方式滁菊水提物的抗氧化活性均随着添加量的增加而提高,并且表现为T1>T2>T3。这主要是因为菊花中有较多的黄酮、多酚、挥发油等抗氧化物质[17-19],而较高温度的热风干燥会加速这些物质的分解[20]。
2.2 对滁菊抑菌性能的影响
MIC和MBC值是用来定量分析抑菌物质的抑菌效力,表现为MIC和MBC值越小抑菌能力越强[21]。由表2可看出,真空冷冻干燥处理组(T1)对2种供试菌具有最小的MIC值,即抑制效果最好,分别为40(金黄色葡萄球菌),35(大肠杆菌)mg/mL;而热泵干燥处理组(T2)和热风处理组(T3)对2种致病菌具有相同的抑制效力,且明显弱于T1,MIC值均为45(金黄色葡萄球菌),40(大肠杆菌) mg/mL;但3种不同干燥方式的滁菊水提物对2种供试菌具有相同的MBC(60 mg/mL)。此外,不同处理组对金黄色葡萄球菌作用的MIC均大于大肠杆菌,表明滁菊水提物对大肠杆菌的杀菌作用效果更明显。这主要是因为金黄色葡萄球菌为革兰氏阳性菌,其细胞壁对细胞膜及其内容物有较强的保护作用[22]。

图2 干燥方式对滁菊脂质过氧化抑制能力的影响
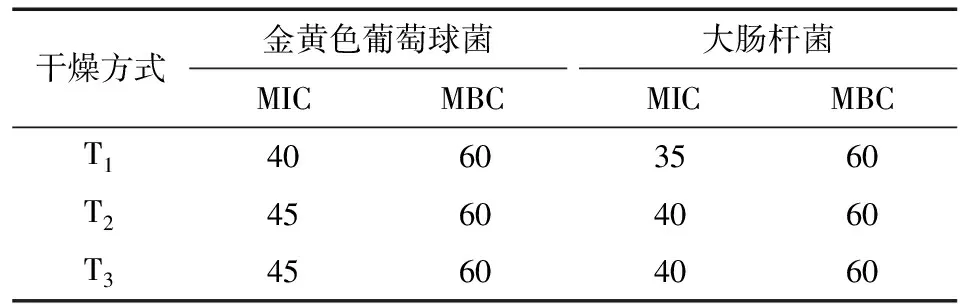
表2 干燥方式对滁菊抑菌能力的影响
菊花中富含丰富的有机酸、黄酮类、萜类、甾体类等有效成分,其中含有大量的还原基团,对致病菌具有抑制作用[23]。而真空冷冻干燥能够较好地保留滁菊中原有组分,因此该方式处理的滁菊具有更明显的抑菌效果。
2.3 对挥发性风味物质影响
由表3可知,从干制滁菊中共检测到121种挥发性风味物质,包括31种烃类、48种萜烯类、10种酮类、6种醛类、9种醇类、5种酯类、4种含氮化合物、3种酚类、3种酸类、异丙基乙烯基醚和白菖油萜环氧化物。T1、T2、T3组中分别检测到71,88,56种挥发性风味物质。
从表3还可以看出,萜烯类是干制滁菊最主要的风味物质,含量分别为59.74%(T1),46.70%(T2),63.28%(T3),种类也均为最多。其中β-瑟林烯和月桂烯在3种干制滁菊中占有比例较高(>8%),它们具有强烈持久辛香、药草香气,常被用于调配香水、化妆品、香皂香精,具有抗病毒、抗生育、抗溃荡等多种活性[24-25];而α-长叶蒎烯是热风干燥滁菊中(T3)特有的萜烯类香气成分,含量达到14.34%。其他种类的萜烯类物质在不同产品中的种类和含量也存在一定的差异,但对滁菊的香味也有一定的贡献,如β-榄香烯是菊花辛辣气味的主要风味成分[26];别罗勒烯和罗勒烯具有草香、花香并伴有橙花油气息[27]。
在3种干制滁菊中烃类物质的种类和含量仅次于萜烯类,其中姜黄烯含量最为丰富,是T2(17.89%)和T3(18.61%)中含量最高的挥发性物质,在T1中的含量也仅次于β-瑟林烯(22.02%),达到12.38%,对滁菊的风味起到重要作用。姜黄烯是姜制品中常见的风味物质,具有独特的芳香风味和辛辣口感,同时显示出良好的生理活性[28]。其他烃类物质风味阈值普遍较高且含量较低,对原料整体风味变化影响不大。
酮类化合物贡献的花果香味具有优异持久的特点。其中3,5-辛二烯-2-酮、6-甲基-3,5-戊二烯-2-酮和3-甲基苯乙酮为3种滁菊共有物质;2-茨酮、3,3-二氯樟脑仅存在于T1、T2中,它们赋予滁菊清凉的草药香味。
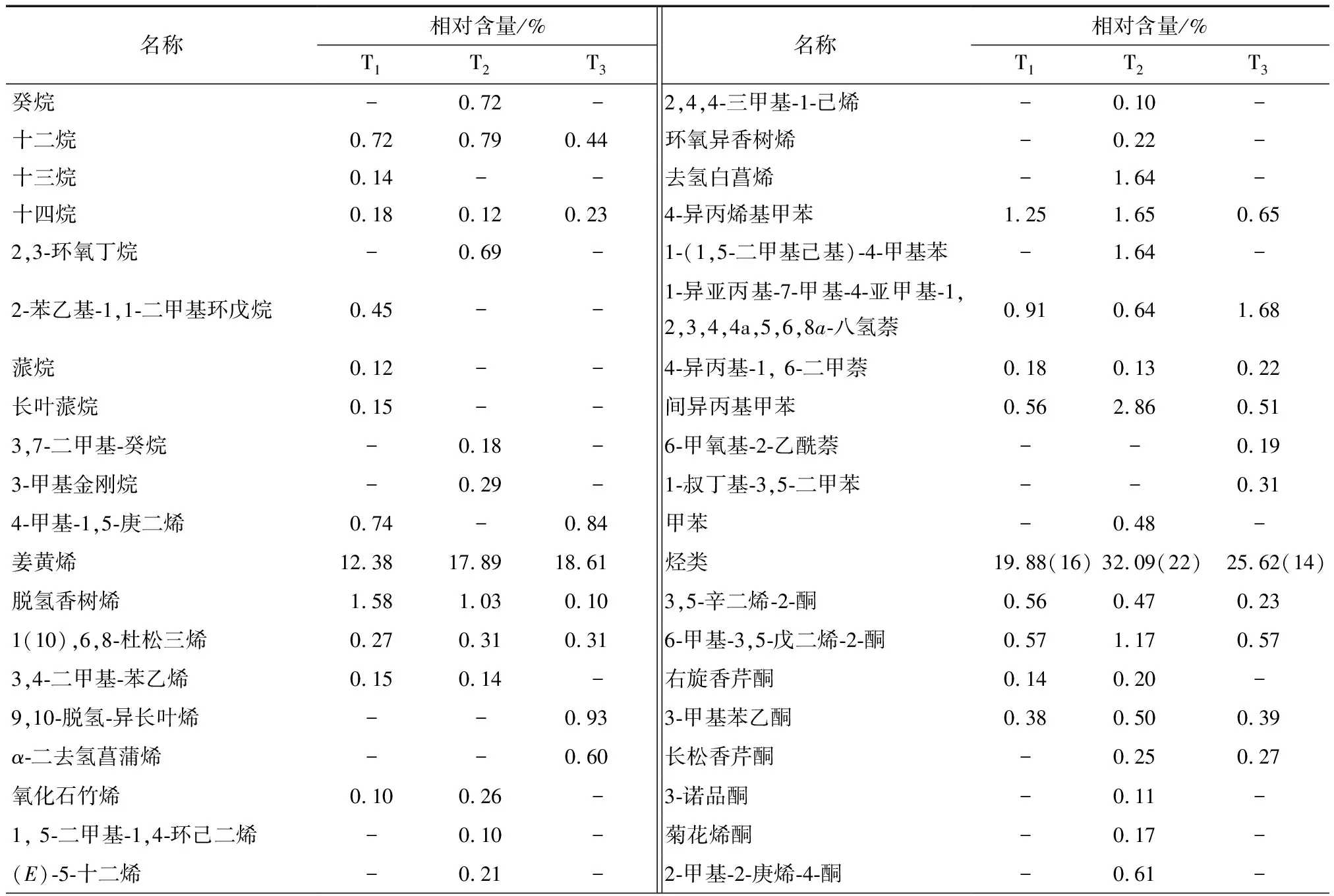
表3 干燥方式对滁菊挥发性成分的影响†
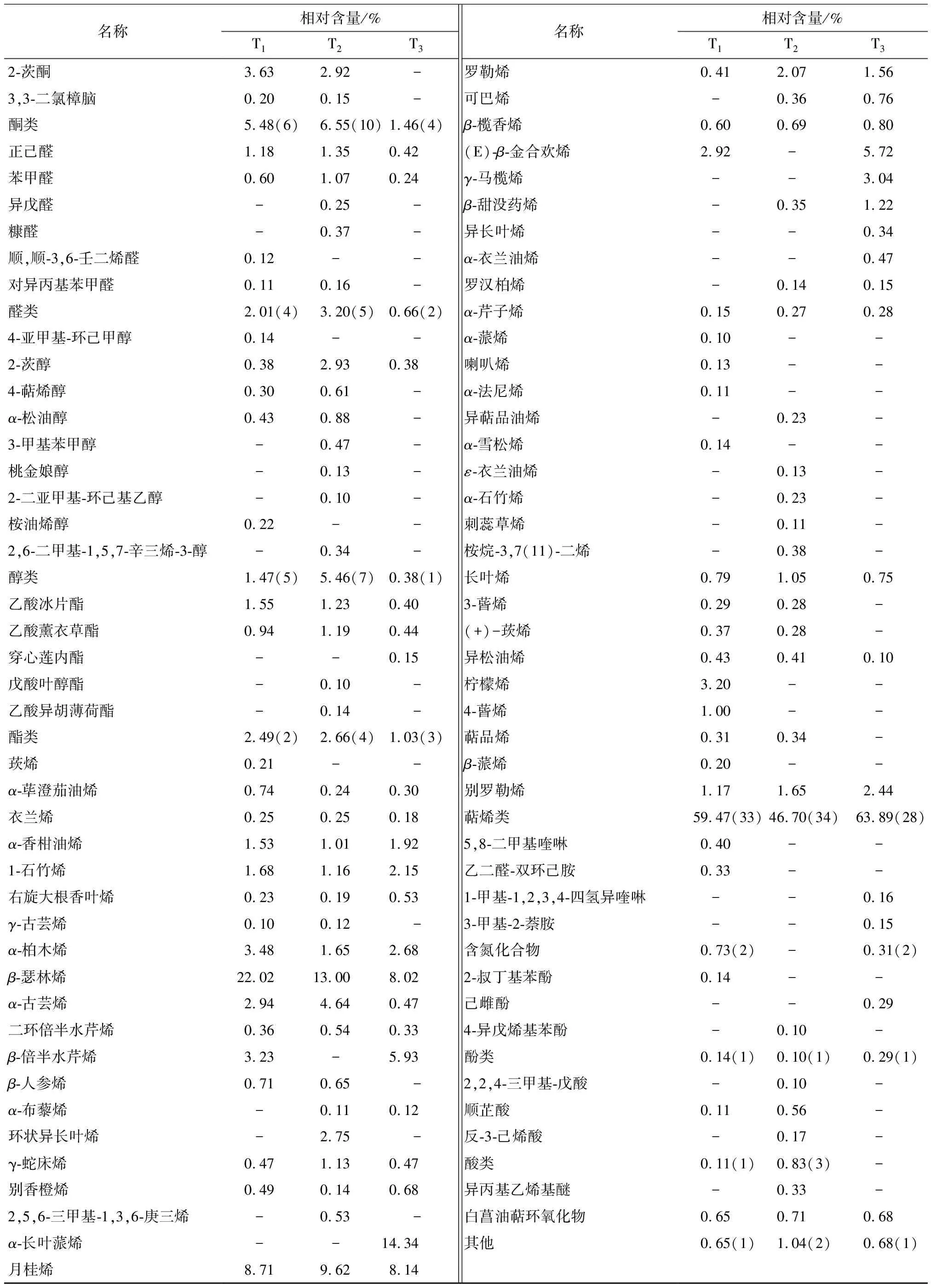
续表3
† “-”表示未检出。
3种方式干燥滁菊的醛类、醇类和酯类呈香物质主要包括正己醛、苯甲醛、2-茨醇、乙酸冰片酯、乙酸薰衣草酯,其中正己醛具有青草味[29];苯甲醛具有特殊的杏仁气味[30];2-茨醇和乙酸冰片酯具有樟脑香气[31];乙酸薰衣草酯带有薰衣草的香韵[32]。而含氮化合物、酚类、酸类、异丙基乙烯基醚和白菖油萜环氧化物等风味物质在干制滁菊中检测到的含量较少。
综上可以看出,在不同干燥处理的滁菊中,挥发性风味物质的种类和含量均存在一定的差异。这可能是滁菊在不同方式干燥过程中发生了多种反应造成的,如美拉德反应、脂肪酸氧化、聚合及降解等[33]。
2.4 感官评价结果
表4为不同干燥处理滁菊的感官评分结果。从表4中可以看出,T1组滁菊有最高的感官评分为84.33,其次为T2组(79.00),评分最低组为T3组(64.00),显著(P<0.05)低于其他2组。并且在外形、颜色、气味、滋味方面,T1及T2的评分结果均显著(P<0.05)高于T3的,即真空冷冻干燥处理工艺及热泵干燥均能更有效地完成对采后滁菊的脱水干燥处理,并且干燥后的滁菊有相对较高的感官品质。
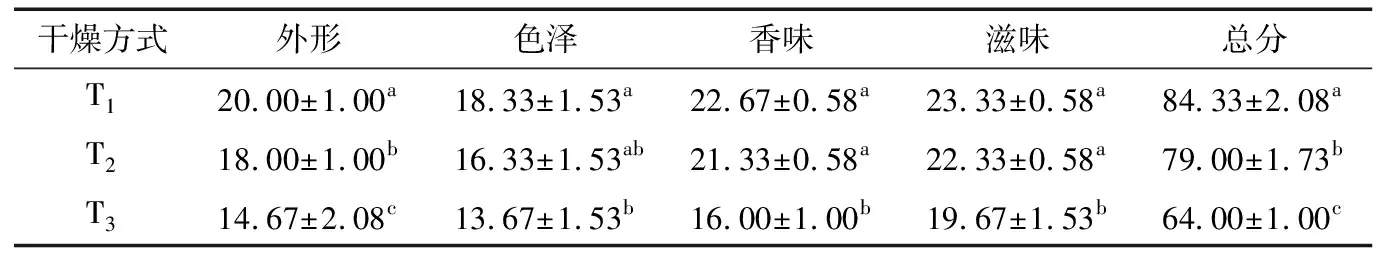
表4 干燥方式对滁菊感官评价的影响†
† 同列不同字母表示差异显著(P<0.05)。
2.5 干燥工艺耗时分析
3种干燥工艺耗时测试结果如图3所示,其中真空冷冻干燥方式(T1)冻结时间为3 h,干燥时间为16.5 h,总干燥工艺耗时为19.5 h;热泵干燥工艺(T2,18 h)耗时显著低于T1(P<0.05),是热风干燥(T3,7.5 h)耗时的2倍以上。

不同字母表示差异显著(P<0.05)
3 结论
经3种干燥方法制备的滁菊都具有一定的抗氧化和抑菌能力,表现为T1>T2>T3。萜烯类是3种干制滁菊的主要挥发性风味物质,相对含量均达到45%以上。其他风味物质在不同产品中的种类和含量均存在一定的差异,它们共同对滁菊的风味做出贡献。感官评价结果显示真空冷冻干燥(T1)能够较好地保持新鲜滁菊的外形和色泽,冲泡后具有滁菊特有的香气和滋味。综上,真空冷冻干燥适用于高品质、高附加值滁菊干制品加工,值得进一步推广应用,但由于该方法干制时间相对较长,后期还需进一步对干燥工艺进行优化,缩短干制时间,以适应滁菊干制品的大规模生产。
