壳聚糖酶解液的纳滤分离技术研究
2019-01-03于沛沛夏文水仲伟伟刘晓丽
于沛沛 夏文水 仲伟伟 刘晓丽 王 斌
(1. 江南大学食品学院,江苏 无锡 214122; 2. 江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122)
壳寡糖是由乙酰氨基葡萄糖苷(GlcNAc)和/或氨基葡萄糖苷(GlcN)通过β-1,4糖苷键连接而成的聚合度为2~20的寡糖。壳寡糖具有多种优越的生理功能和生物活性[1],尤其是聚合度为3~6的壳寡糖,因具有调节免疫[2]、抗衰老[3]、抗疲劳[4]、清除自由基[5]等功能而引起了广泛的关注。
由于壳寡糖分子中含有较多的氨基和羟基,其分子间或分子内作用力较强,分离纯化相对困难。目前,壳寡糖的分离纯化方法主要有:膜分离法、凝胶渗透色谱法、薄层色谱法和离子交换色谱法等。凝胶色谱法是根据被分离组分的分子尺寸大小进行分离的一种方法,可利用此法将少量壳寡糖分离成不同组分,但较难实现工业化生产[6];薄层色谱法是根据各聚合度的寡糖极性不同,利用其在层析液中移动速度差异来进行分离,由于壳寡糖极性较大,点样承载量少,不适用于大量制备,一般常用来检测和监测反应进程[7];离子交换色谱法是以离子交换树脂或化学键合离子交换剂为固定相,根据被分离组分的离子交换能力的不同或选择性系数的差别实现分离,该方法分离成本较高,连续性较差,仅适合实验室研究,难以放大生产[8]。
目前工业上一般采用生物酶法对壳聚糖进行降解后,进行喷雾干燥而获得壳寡糖,但得到的壳寡糖产品分子量分布较宽,其中含有一些未充分降解的壳聚糖大分子、壳聚糖水解酶、无机盐、酸根离子及单糖、二糖等生物活性较低的糖等。因此,为得到聚合度为3~6的含量较高的壳寡糖产品,必须选择合适的分离技术对酶解液进行纯化。
膜分离技术是根据被分离物质与膜孔径大小的差异来实现分离的,目前在低聚果糖的分离纯化领域应用十分广泛[9-10],但在壳寡糖的分离纯化中应用相对较少,工业化应用尚未得到推广。本研究拟从壳寡糖分离纯化效果和工业化生产要求等方面综合考虑,对壳聚糖酶解液在实验室前期超滤[11]基础上进一步进行纳滤操作,提高产品纯度,并对纳滤操作参数进行优化,研究操作压力、操作温度、料液pH值对壳聚糖酶解液纳滤纯化分离效果的影响,以确定纳滤操作的最佳工艺参数,为得到高活性的聚合度为3~6的壳寡糖的工业化分离纯化提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
壳聚糖:Mw=5.8×105,脱乙酰度85.2%,水分11.2%,灰分0.62%,黏度60 cp,南通双林海洋生物药业有限公司;
复合纤维素酶:355 U/mL,浙江金壳生物化学有限公司;
高效硅胶板:10 cm×20 cm,青岛海洋化工分厂;
其他试剂:分析纯,国药集团化学试剂有限公司。
1.1.2 仪器与设备
雷磁电导率仪:DDS307型,上海仪电科学仪器股份有限公司;
紫外—可见分光光度计:UV1800型,日本岛津科技有限公司;
膜分离装置:RO(NF)-UF-4050型,上海昊清环保科技有限公司;
卷式超滤膜:HPS-10型,MWCO=10 kDa,膜面积0.4 m2,上海昊清环保科技有限公司;
纳滤膜名称:1812型,截留分子质量为500 Da,膜面积0.4 m2,上海昊清环保科技有限公司;
高效液相色谱仪:1525型,美国沃特世公司。
1.2 方法
1.2.1 壳聚糖酶解液制备 酶解条件:复合纤维素酶添加量8 U/g,底物浓度5%,酶解温度45 ℃,pH 4.5,酶解时间6 h,经5 μm的微滤膜微滤处理后,参照文献[11]进行超滤处理。
1.2.2 纳滤最优工艺条件的确定
(1) 操作压力:取1.5 L超滤液,控制料液浓度2%、操作温度30 ℃、pH 5.0,分别在0.4~0.6 MPa压力下,以纳滤截留液的膜通量、氨基葡萄糖脱除率、电导率和pH值为指标,研究操作压力对酶解液纳滤纯化效果的影响。
(2) 操作温度:取1.5 L超滤液,控制料液浓度2%、操作压力0.5 MPa、pH 5.0,分别在25~40 ℃条件下,以纳滤截留液的膜通量、氨基葡萄糖脱除率、电导率和pH值为指标,研究操作温度对酶解液纳滤纯化效果的影响。
(3) 初始pH值:取1.5 L超滤液,控制料液浓度2%、操作压力0.5 MPa、操作温度35 ℃,分别在初始pH 2.0~6.0条件下,以纳滤截留液的膜通量、氨基葡萄糖脱除率、电导率和pH值为指标,研究初始pH值对酶解液纳滤纯化效果的影响。
1.2.3 各指标的测定
(1) 膜通量的计算:
(1)
式中:
J——膜通量,L/ (m2·h);
V——透过液体积,L;
A——有效膜面积,m2;
t——时间,h。
(2) 氨基葡萄糖的测定:采用Elson-Morgan法[12-13]。氨基葡萄糖标准曲线:y=8.583 4x+0.032 7,R2=0.995 5。其中y为A525 nm;x为氨基葡萄糖浓度(mg/mL)。
(3) 电导率的测定:用电导率仪测定。
(4) 壳寡糖平均分子质量的测定:采用乙酰丙酮法[14]。
(5) 分离产物TLC分析:用毛细吸管分别吸取5%的超滤前后的壳寡糖溶液1 μL,点于高效硅胶板上,各点之间间距0.5 cm,距底端距离1.0 cm,置于展开体系为异丙醇∶水∶氨水=60∶30∶4(体积比)的层析缸中,待展开距顶端为1.0 cm时取出并吹干。硅胶板上喷洒0.5%的茚三酮显色剂,置于100 ℃烘箱中加热5 min显色。
(6) 壳寡糖的HPLC分析:采用高效液相色谱检测器[15],色谱条件:1525型高效液相色谱仪,蒸发光反射检测器,Shodex Asahipak NH2P-50 4E(4.6 mmID×250 mmL)色谱柱;柱温30 ℃;流动相为乙腈∶水=75∶25(体积比);流速1.0 mL/min;进样量10 μL;样品浓度5%。
1.2.4 数据处理与统计方法 进行3次平行试验,采用SPSS 19.0软件对数据差异显著性分析,以P<0.05为差异显著,结果均以平均值±标准差表示,采用Origin 8.6软件作图。
2 结果与分析
2.1 纳滤分离条件
2.1.1 操作压力对纳滤分离效果的影响 由图1可知,膜通量随操作压力的增强而增大,但压力越大,膜通量下降速率也越快。纳滤后期,在0.5,0.6 MPa下,膜通量均稳定在20 L/(m2·h) 左右。这是由于随压力增强,溶质对流迁移到膜表面的速率增大,浓差极化层压实或增厚,导致膜通量迅速衰减。由图2可知,纳滤截留液pH值随运行时间的延长而逐渐上升,最终稳定在pH 5.0左右,不同操作压力下截留液pH值变化不明显。由图3可知,氨基葡萄糖脱除率随操作压力的增强而增大,并随运行时间的延长逐渐上升,35 min 后趋于平缓,0.5,0.6 MPa下氨基葡萄糖脱除率均在81%左右。由图4可知,在各压力条件下,纳滤前期截留液电导率均随运行时间延长而下降,且操作压力越大,电导率越低。纳滤后期,截留液电导率差别不明显。综合以上结果,虽然操作压力越大,氨基葡萄糖的脱除效果越好,但纳滤后期,对盐和氢离子的脱除效果差别不大;且操作压力再加大,由浓差极化造成的膜污染导致通量衰减越快,膜污染层不断压实,膜孔逐渐减小,会造成膜的不可逆污染。随时间的延长,在0.5,0.6 MPa下膜通量均在20 L/(m2·h)左右,运行效率较高。因此,从膜的使用寿命和纯化效果综合考虑,确定操作压力为0.5 MPa。

图1 膜通量随运行时间的变化

图2 pH值随运行时间的变化

图3 氨基葡萄糖脱除率随运行时间的变化
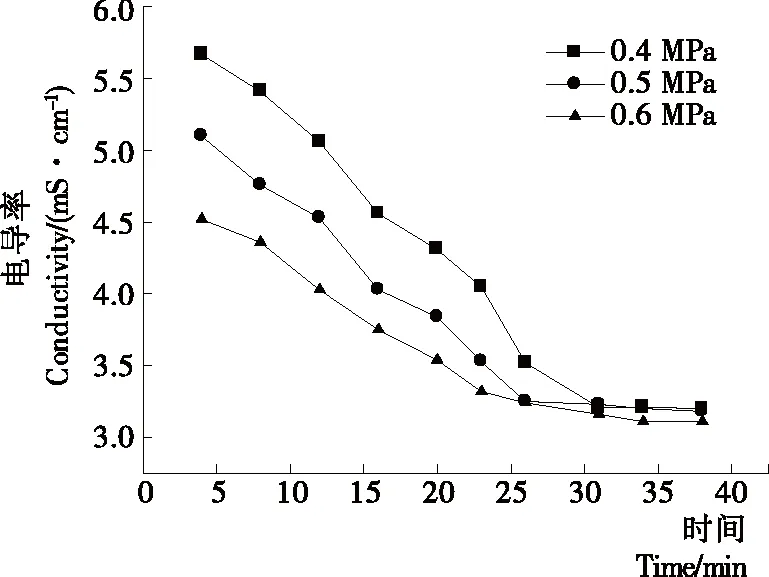
图4 电导率随运行时间的变化
2.1.2 操作温度对纳滤分离效果的影响 由图5、6可知,膜通量随温度升高而增大,这是由于温度升高使溶液中的分子热运动加剧,溶液动力黏度减小[16-17],溶质扩散系数增加,膜通量增加;不同操作温度下,截留液pH值差别不明显,pH值随运行时间的延长而逐渐上升,最终稳定在5.0左右;由图7可知,随温度升高,氨基葡萄糖脱除率增大,但在纳滤后期,35,40 ℃下的氨基葡萄糖脱除率无显著性差异(P>0.05),最终稳定在85%左右;由图8可知,在各温度条件下,截留液电导率均随运行时间延长先逐渐减小后趋于平缓,温度越高,截留液电导率越低,但温度过高容易使寡糖发生褐变,也使得能耗增加。在35,40 ℃下的氨基葡萄糖脱除率无显著性差异(P>0.05),且在35 ℃时,膜通量约为20 L/(m2·h),运行效率较高。因此,在保证较高的氨基葡萄糖脱除效率和膜通量前提下,确定操作温度为35 ℃。

图5 膜通量随运行时间的变化

图6 pH值随运行时间的变化

图7 氨基葡萄糖脱除率随运行时间的变化
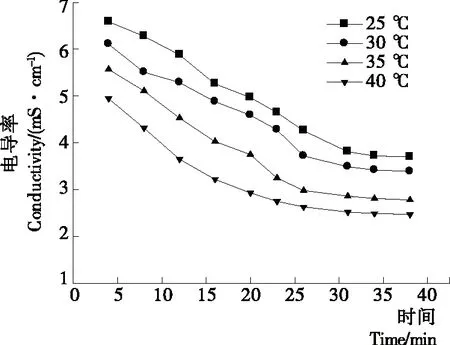
图8 电导率随运行时间的变化
2.1.3 料液初始pH值对纳滤分离效果的影响 如图9所示,膜通量随料液初始pH值的增大而减小,且随运行时间的延长,膜通量呈缓慢下降的趋势;由图10可知,pH值为2.0,3.0,4.0的制备液随纳滤运行时间的延长,截留液pH值逐渐上升,最终稳定在pH 5.0左右,而pH值为5.0,6.0的制备液在整个纳滤过程中,截留液pH值基本保持不变;由图11 可知,氨基葡萄糖脱除率随料液初始pH值的升高而逐渐上升后趋于稳定;图12中溶液电导率随运行时间延长而不断下降,最终趋于稳定。这是由于改变溶液pH值能够改变溶液中聚电解质的构型和分散性,从而减小或防止对膜的污染[18],使膜通量增加。酸性条件下,壳寡糖氨基质子化带正电荷,分子之间存在静电排斥,pH越低,分子之间作用力越强[19],分子结构折叠越少,越容易透过,随pH升高,寡糖分子上的电荷减少,排斥力减弱,分子间形成氢键,在氢键的作用下相互卷曲、折叠,在膜表面产生堆积,导致膜通量下降,氨基葡萄糖脱除率降低,脱盐效果变差。韩永萍等[17]、董惠忠等[20]通过调节溶液pH值来提高膜分离效果,也得到相似结论。考虑到膜的最低耐受pH值为2.0,长时间在此条件下进行纳滤操作可能会造成膜的不可逆性损坏,且pH值2.0,3.0时氨基葡萄糖脱除率差别不大,因此,综合纯化效果与实际生产要求,将纳滤料液初始pH值确定为3.0。

图9 膜通量随运行时间的变化
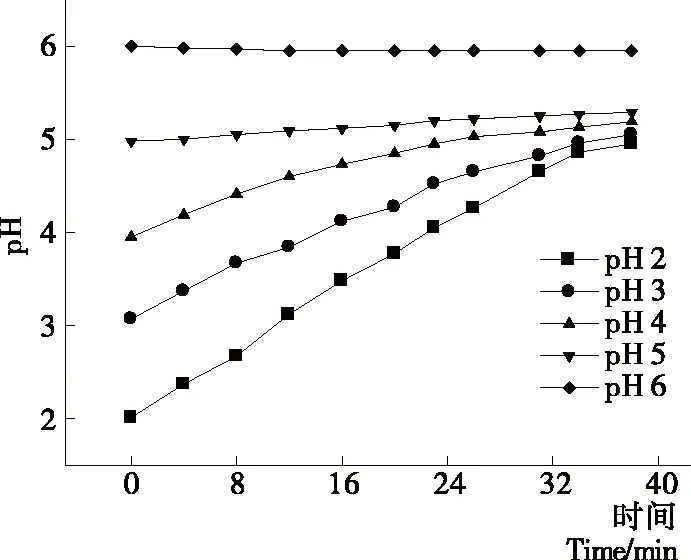
图10 pH值随运行时间的变化
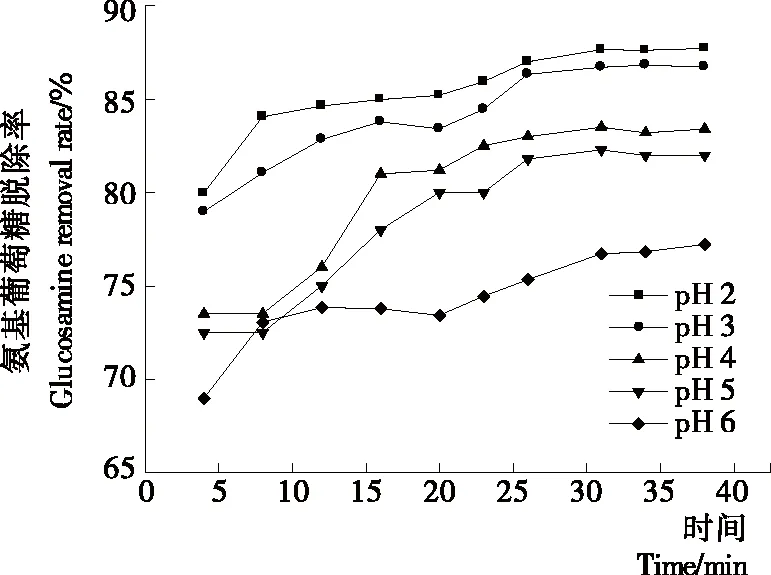
图11 氨基葡萄糖脱除率随运行时间的变化

图12 电导率随运行时间的变化
2.2 纳滤后壳寡糖各指标分析
在操作压力0.50 MPa、操作温度35 ℃、料液pH 3.0条件下,对壳聚糖超滤液进行纳滤操作,图13为纳滤前后壳寡糖的薄层色谱图,根据壳二糖标准品判断,从上到下依次为氨基葡萄糖、聚合度为2~6寡糖。从图13可以看出,纳滤截留液中氨基葡萄糖显色点非常浅,说明其含量很少,进一步对壳寡糖的纳滤截留液和透过液进行HPLC分析,从图14 可以看出,截留液的HPLC图中有5个峰出现,出峰时间7.102 min时为氨基葡萄糖,往后依次为壳二糖、壳三糖、壳四糖、壳五糖、壳六糖,氨基葡萄糖峰面积小,说明其含量低。从图15可以看出,透过液中只有杂质和氨基葡萄糖,无其他聚合度的壳寡糖出现,说明此纳滤膜对聚合度为2及以上的寡糖不能透过。从表1中可以看出,纳滤后样品中氨基葡萄糖含量为1.21%,脱除率为85.52%,灰分由1.12%降为0.15%,脱盐率达95.54%,聚合度为3~6寡糖含量为70.25%,最终产品得率为70.12%,1%壳寡糖水溶液pH值为4.92。

表1 纳滤分离前后壳寡糖主要理化指标

1. 壳二糖标品 2. 纳滤截留液 3. 纳滤原液 4. 纳滤透过液

图14 纳滤截留液高效液相色谱图

图15 纳滤透过液高效液相色谱图
3 结论
本研究在前期采用相对截留分子质量为10 kDa的卷式超滤膜,对壳聚糖酶解液进行超滤的基础上,进一步利用高效率、低成本的纳滤技术对壳聚糖酶解液进行分离纯化,即用相对截留分子质量为500 Da的卷式纳滤膜进行纳滤,确定了最佳的操作参数为:操作压力0.50 MPa、操作温度35 ℃、滤液pH 3.0。纳滤后测定产品成分:氨基葡萄糖含量为1.21%、灰分为0.15%、聚合度为3~6寡糖的含量提高到70.25%、最终产品得率为70.12%。研究结果表明,在前期超滤操作的基础上,对壳聚糖酶解液进一步进行纳滤操作,能有效地提高产品中聚合度为3~6寡糖的含量,且膜分离技术操作简单,是工业化纯化壳寡糖的理想工艺技术。本试验选择截留分子质量为500 Da的纳滤膜,可以有效去除氨基葡萄糖,但对壳二糖去除作用不强,需进一步选择不同孔径或材料的膜,提高产品中聚合度为3~6寡糖的含量。后续将对壳寡糖在纳滤分离过程中的传质机理,不同分离条件对寡糖分子微观结构的影响等作进一步探讨。
