基于前列腺影像报告和数据系统第2版的机器学习模型诊断高级别前列腺癌
2018-12-21曾小辉高月琴牛翔科陈雪卉张仕慧陈志凡
曾小辉,彭 涛,高月琴,牛翔科,陈雪卉,张仕慧,陈志凡
(成都大学附属医院放射科,四川 成都 610081)
前列腺癌居恶性肿瘤导致男性死亡的第2位[1]。随着人民生活质量提高和人口老龄化,我国前列腺癌发病率呈上升趋势[2]。前列腺多参数MRI是目前诊断前列腺癌的主要无创检查方法。为提高前列腺癌诊断率和报告的规范化,2012年欧洲泌尿生殖放射协会提出前列腺影像报告和数据系统第1版(prostate imaging reporting and data system version 1, PI-RADS v1),但存在诸多不足,2014年底由美国放射学会、欧洲泌尿生殖放射学会及AdMeTech基金会共同对PI-RADS v1进行修订,在线颁布了前列腺影像报告和数据系统第2版(prostate imaging reporting and data system version 2, PI-RADS v2)[3-4]。随着对前列腺癌的深入研究,有学者[5-6]发现高级别前列腺癌(Gleason评分≥7分)和非高级别癌患者预后明显不同,但通过多种模型结合影像学表现及临床相关指标诊断高级别前列腺癌的报道较少见。本研究探讨支持向量机(support vector machine, SVM)、决策树(decision tree, DT)和Logistic回归3种机器学习模型在诊断高级别前列腺癌中的价值。
1 资料与方法
1.1一般资料 回顾性分析2013年1月—2018年2月于我院接受前列腺多参数MR扫描并取得病理结果的194例患者的资料,年龄50~90岁,平均(74.7±8.9)岁。MRI显示中位前列腺体积为55.16(35.47,77.77)cm3;中位总前列腺特异抗原(total prostate specific antigen, tPSA)为16.30(8.32,46.52)ng/ml,中位游离前列腺特异抗原(free prostate specific antigen, fPSA)为2.08(1.23,4.65)ng/ml,前列腺特异性抗原密度(adjusted-prostate-specific antigen density, adjusted-PSAD)为0.28(0.14,1.16)ng/(ml·cm3)。根据Gleason评分[7]将患者分为2组,高级别癌组63例(Gleason评分≥7分),Gleason评分分别为:3+4=7分10例、4+3=7分5例、4+4=8分13例、3+5=8分1例、5+4=9分8例、4+5=9分14例、5+5=10分12例;非高级别癌组131例,Gleason评分<7分。纳入标准:①临床资料及相关检查完整;②MR检查前3个月内未接受前列腺穿刺、手术及前列腺癌内分泌治疗;③MR检查后1个月内经直肠超声引导下穿刺或前列腺全切术,并取得病理结果。排除标准:①图像质量不佳;②MR序列不完整;③既往有前列腺相关手术或治疗病史。
1.2仪器与方法 采用Siemens Avanto 1.5T超导型MR扫描仪,相控阵体线圈,扫描前嘱患者排空膀胱。仰卧位扫描,先行常规T2WI及DWI,后行动态增强扫描。T2WI参数:FOV 200 mm×200 mm,扫描层数20层,层厚3 mm,层间距0.6 mm,采用自旋回波-回波平面成像序列,TR 4 300 ms,TE 101 ms,矩阵256×205;DWI:b值取800 s/mm2,FOV 260 mm×220 mm,扫描层数20层,层厚3.6 mm,层间距0,TR 3 700 ms,TE 80 ms,矩阵160×100,NEX 6次。动态增强扫描时,采用高压注射器经肘前静脉注射Gd-DTPA 0.2 mmol/kg体质量,流率2.5 ml/s;3D-Flash-T1WI,FOV 260 mm×260 mm,扫描层数20层,层厚3.6 mm,体块(slab)为1,TR 5 ms,TE 1.69 ms,矩阵192×138,扫描次数36次。
1.3相关指标收集及处理 通过临床信息系统(clinical information system, CIS)查阅获得临床指标,包括年龄、fPSA、前列腺抗原比值(fPSA/tPSA)和adjusted-PSAD。由2名具有5年工作经验的、泌尿系统影像学诊断医师利用盲法对患者进行PI-RADS v2评分[7],如有分歧经协商达成一致。在T2WI上结合轴位、冠状位和矢状位图像测量前列腺左右径、前后径及上下径,根据公式计算前列腺体积(V)及adjusted-PSAD:V=左右径(cm)×前后径(cm)×上下径(cm)×0.52,adjusted-PSAD=tPSA/V。
1.4模型建立 采用IBM SPSS Modeler软件中的SVM、DT和Logistic回归分别对高级别前列腺癌建立预测模型,数据流示意图见图1。对各评价因素和相关诊断数据建立数据库,录入后建立SVM、DT和Logistic回归3种模型:对5个评价因素(年龄、PI-RADS v2评分、fPSA、fPSA/tPSA及adjusted-PSAD)建立SVM流、DT流和Logistic回归数据流,并分析3种学习模型诊断高级别前列腺癌的准确率。采用IBM SPSS Modeler软件随机抽样选出173例(高级别前列腺癌组55例、非高级别前列腺癌组118例)作为训练集,用于筛选变量和建立预测模型;21例(高级别前列腺癌组8例、非高级别前列腺癌组13例)作为测试集,用于评价模型预测效果。
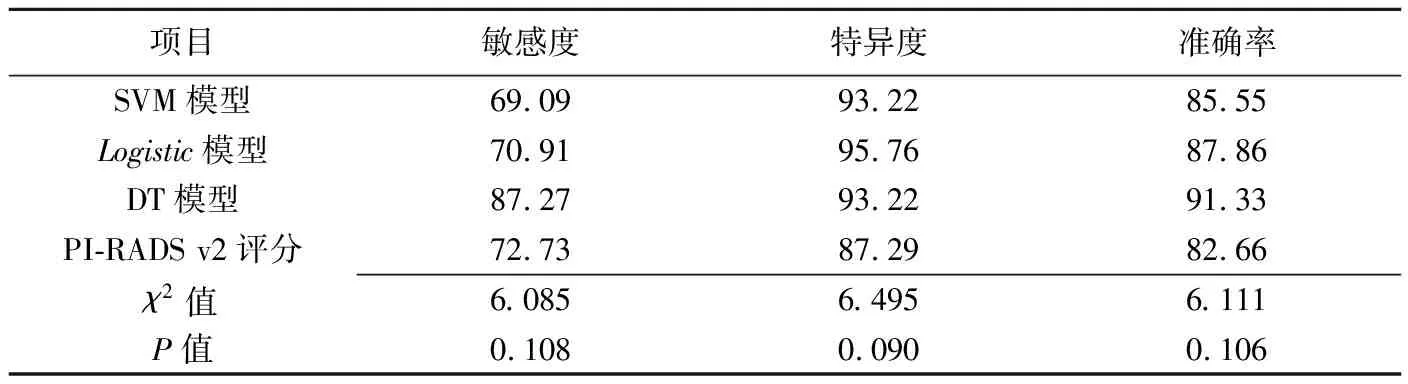
表1 测试集3种机器学习模型及PI-RADS v2评分诊断高级别前列腺癌的比较分析(%)
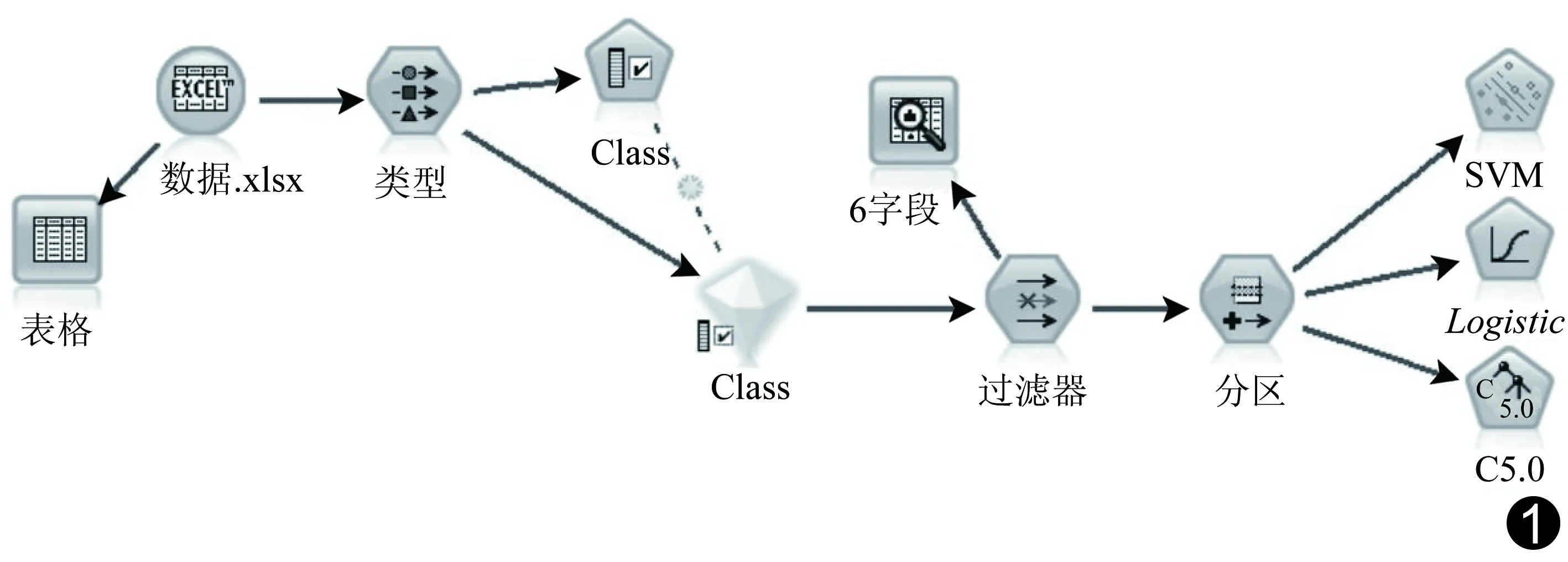
图1 3种机器学习模型数据流示意图
1.5统计学分析 采用SPSS 20.0统计分析软件。对数据进行正态分析(Kolmogorov-Smirnov检验)和方差齐性(Levene检验)检验,计量资料符合正态分布以±s表示,非正态分布以中位数(上下四分位数)表示。绘制ROC曲线评价PI-RADS v2评分和3种机器学习模型诊断高级别前列腺癌的效能;并以DeLong方法比较AUC;以病理Gleason评分结果为金标准,采用χ2检验比较PI-RADS v2评分及3种模型诊断高级别前列腺癌的敏感度、特异度及准确率的差异。P<0.05为差异有统计学意义。
2 结果
2.1模型评价及数据 以PI-RADS v2评分预测高级别前列腺癌的准确率为82.66%。训练集SVM、DT和Logistic回归3种机器学习模型经学习后诊断高级别前列腺癌的准确率、敏感度及特异度见表1,PI-RADS v2评分及3种机器学习模型诊断高级别前列腺癌的敏感度、特异度、准确率差异均无统计学意义(P均>0.05)。测试集SVM、DT和Logistic回归3种机器学习模型经学习后诊断高级别前列腺癌准确率分别为76.19%、80.95%及76.19%。通过IBM SPSS Modeler软件经训练集学习后,自动获得3种学习模型诊断高级别前列腺癌变量的重要性,并按所占比例进行排序:SVM模型前3位预测变量为PI-RADS v2、adjusted-PSAD及年龄,所占比例分别为50.00%、15.00%及13.00%;DT模型前3位预测变量为adjusted-PSAD、PI-RADS v2及fPSA,所占比例分别为49.00%、23.00%及14.00%;Logistic回归模型前3位预测变量为PI-RADS v2、fPSA/tPSA及adjusted-PSAD,所占比例分别为36.00%、27.00%及21.00%。
2.2ROC曲线分析 173例训练集PI-RADS v2评分和SVM、DT和Logistic回归3种机器学习模型诊断高级别前列腺癌的AUC分别为0.83、0.81、0.90及0.83(P均<0.01),其中DT模型的AUC最大(图2),且与PI-RADS v2评分(Z=1.96,P=0.049)、SVM(Z=2.87,P=0.004)和Logistic回归(Z=2.31,P=0.021)差异均有统计学意义,其模型树状图见图3;而SVM与Logistic回归(Z=1.25,P=0.21)及PI-RADS v2评分(Z=0.98,P=0.32)、Logistic回归与PI-RADS v2评分(Z=0.04,P=0.96)的AUC差异均无统计学意义。

图2 PI-RADS v2评分及3种机器学习预测高级别前列腺癌的ROC曲线
3 讨论
多参数MRI[8]是目前诊断前列腺癌的主要影像学检查方法,有助于提高诊断前列腺癌的准确率,但影像学报告不规范等问题限制了其广泛应用。与PI-RADS v1相比,PI-RADS v2评分系统主要针对临床显著性癌或高级别肿瘤[9],其将临床显著性高级别肿瘤前列腺癌定义为符合以下条件之一者:①前列腺穿刺活检任何一针Gleason评分>6分;②前列腺穿刺活检任何一针癌组织长度大于5 mm。Albertsen等[10]回顾性分析发现高级别前列腺癌患者10年死亡率高于非高级别前列腺癌,并提出应着重诊断高级别前列腺癌,以便临床减少不必要的前列腺穿刺活检及降低对非高级别前列腺癌的过度治疗。De Visschere等[11]研究报道,应用单一评分系统对前列腺癌进行预测具有一定风险。本研究联合应用3种机器学习模型对前列腺癌影像学表现和临床指标进行分析。
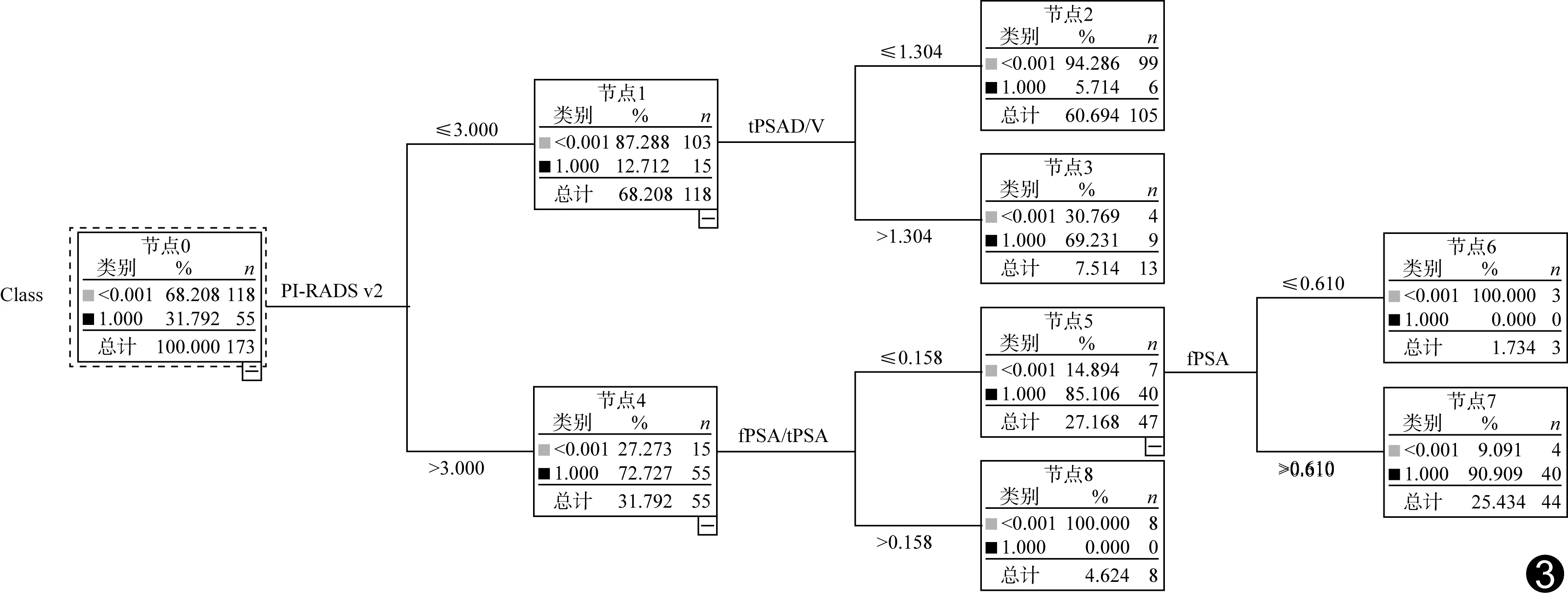
图3 DT模型树状图
机器学习模型能根据疾病与相关危险因素的内在规律近似地以数学方式表达,已成为预测疾病的主流方法。本研究采用SVM、DT和Logistic回归建立对高级别前列癌的预测模型。SVM的优点为解决小样本、非线性及高维模式识别问题,追求现有信息情况下的最优解,可提高学习方法的推广能力;DT具备对未来新数据的分类预测能力,可将大量数据有目的地分类,从中找到潜在的、有价值的信息,且准确性良好,同时还可揭示重要预测因子之间的复杂关系;Logistic回归的优点是能较好地表现评价因素与因变量之间的依存关系。
本研究中,DT模型诊断高级别前列腺癌的AUC最大,且与PI-RADS v2评分、SVM和Logistic回归的AUC差异均有统计学意义,而SVM与Logistic回归及PI-RADS v2评分、Logistic回归与PI-RADS v2评分的AUC差异均无统计学意义。DT模型预测高级别前列腺癌诊断准确率、敏感度及特异度均较高,但与其他模型相比差异无统计学意义,可能与阳性样本量较少有关。IBM SPSS Modeler软件建立的3种预测高级别前列腺癌模型前3位变量中均有PI-RADS v2评分,且单纯采用PI-RADS v2评分的诊断价值也较高,与模型预测变量重要性基本相符。van Leeuwen等[12]发现运用前列腺癌相关临床指标联合PI-RADS v1评分建立Logistic模型预测前列腺高级别癌的AUC为0.88。Bermejo等[13]认为基于前列腺特异性抗原等单独生物指标不能很好地诊断前列腺癌,故联合年龄、PSA、直肠指检、多参数MR等指标建立DT和Logistic回归模型,发现2种模型诊断前列腺癌的准确率均较好(AUC=0.72,0.80)。Nhung等[14]采用SVM模型预测前列腺癌的敏感度为95.1%、特异度为84.6%。上述研究[12-14]的目的均在于鉴别诊断前列腺癌与良性前列腺病变,而对高级别与非高级别前列腺癌的分类研究较为缺乏,且上述研究均未对各模型进行对比分析。Lee等[15]基于经直肠超声,联合临床相关指标,建立了诊断前列腺癌的Logistic回归、人工神经网络和SVM模型,发现SVM模型的AUC最大(AUC=0.847),且与其他2种模型比较差异有统计学意义。本研究结果与其不符,分析原因:①研究纳入的决策因素不同;②Lee等[15]的研究基于超声,而本研究是基于多参数MR分析建立的模型;③本研究样本量较小,SVM比人工神经网络更为适用。
本研究的不足:①为回顾性研究,前列腺大切片病理标本及穿刺点不能完全与影像学直接对照,结果可能存在偏倚;②样本量小,对于样本选择有一定局限性;③仅为3种机器学习模型的训练集和较少测试集分析,有待样本量扩大后进一步验证。
综上所述,基于PI-RADS v2评分的3种算法模型预测高级别前列腺癌的价值均较好,DT模型可作为预测前列腺高级别癌的较优模型。
