不同月经状态下正常子宫ADC值变化
2018-12-21陈基明颜秀芳李周丽张爱娟
朱 晴,陈基明,颜秀芳,邢 滔,李周丽,张爱娟
(皖南医学院弋矶山医院医学影像中心,安徽 芜湖 241001)
DWI反映组织内水分子扩散运动特征[1],诊断女性盆腔疾病、尤其是子宫疾病具有较大优势[2-3]。研究[4-5]表明,不同年龄女性及不同月经周期下,正常子宫的ADC值变化较大,因此,采用ADC值诊断及评估子宫病变、尤其是子宫内膜病变时,有必要考虑月经状态的影响。目前对绝经前女性正常子宫ADC值的研究较多,对绝经后正常子宫ADC值的研究则较少,而绝经后子宫形态和功能均与绝经前有明显差异[6-7]。本研究分析不同月经状态(月经期、卵泡期、黄体期、绝经后)正常子宫各层结构(内膜、结合带、肌层)的扩散特点,探讨不同月经状态对子宫各层结构ADC值的影响。
1 资料与方法
1.1一般资料 收集2016年6月—2017年12月因子宫以外的盆腔器官病变于我院接受MR检查的女性患者78例,其中绝经前58例,年龄24~52岁,中位年龄43岁,接受MR检查时处于月经期(月经来潮第1~6天)18例、卵泡期(月经来潮第7~14天)20例,黄体期(月经来潮第15天至下次月经期前)20例;绝经后20例,年龄51~65岁,中位年龄54岁。纳入标准:①年龄>18岁;②月经周期正常(21~35天);③超声或MR平扫均未发现明显子宫疾病;④无使用性激素类药物史;⑤无子宫手术史。排除标准:①妊娠期、哺乳期女性;②有妇科疾病史(如子宫肌瘤、子宫腺肌症等);③图像质量不佳影响测量结果。
1.2仪器与方法 采用GE Signa HDxt 3.0T MR成像系统,8通道相控阵体部线圈。T1WI,FSE序列,TR 560 ms,TE 6.27 ms;脂肪抑制T2WI,TR 3 460 ms,TE 85.56 ms。轴位扫描层厚5 mm,层间隔1 mm,FOV 38 cm×38 cm,矩阵256×384;矢状位、冠状位扫描层厚5 mm,层间隔1 mm,FOV 32 cm×32 cm~38 cm×38 cm,矩阵320×256。DWI,采用单次激发自旋回波-回波平面成像脂肪抑制序列,轴位采集,TR 4 000 ms,TE 60.3 ms,b值取0、700 s/mm2,NEX 12,层厚5 mm,层间隔1 mm,FOV 38 cm×38 cm,矩阵130×96。
1.3图像处理与分析 将原始图像传输至GE AW 4.4后处理工作站,采用Functool软件获得ADC伪彩图。由2名具有5年及以上工作经验的影像科医师分别独立观察分析图像,参照轴位脂肪抑制T2WI,在ADC伪彩图中选择子宫内膜、结合带、肌层均显示清晰、无变形伪影的层面,将相同大小的ROI放置于子宫内膜、结合带、肌层上,尽量避开宫腔积液、血管等结构,测量其ADC值,均测量3次,取平均值。计算子宫各层结构在月经期、卵泡期、黄体期和绝经后ADC值的变异系数(coefficient of variation, CV),以评价子宫各层结构在不同月经状态个体间ADC值的离散度,CV=均数/标准差×100%。
1.4统计学分析 采用SPSS 22.0统计分析软件。先对数据进行正态性及方差齐性检验,符合正态分布的计量资料以±s表示。采用组内相关系数(interclass correlation coefficients, ICC)评估2名医师测量结果的一致性,ICC为0~0.40为一致性较低,0.41~0.60为一致性中等,0.61~1.00为一致性高。采用单因素方差分析比较不同月经状态下子宫ADC值间的差异,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1测量结果的一致性 2名医师测量子宫各层结构在不同月经状态下ADC值的一致性较高,ICC均>0.70(P均<0.01,表1)。
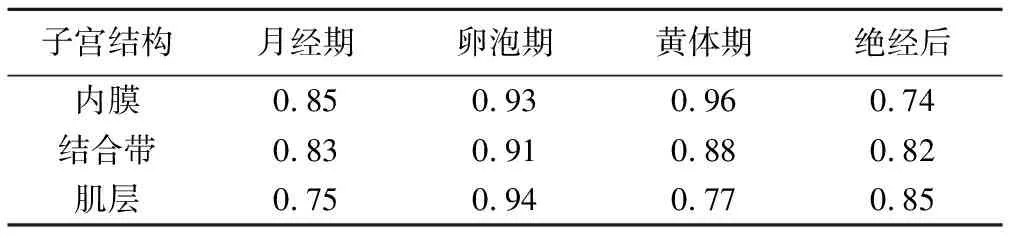
表1 2名医师测量正常子宫各层结构在不同月经状态下ADC值的一致性分析(ICC值)
2.2相同月经状态下子宫各层结构ADC值比较 相同月经状态下,子宫内膜、结合带、肌层间ADC值总体差异有统计学意义(P均<0.001),子宫肌层、内膜、结合带ADC值依次降低,两两比较差异均有统计学意义(P均<0.05,表2、图1、2)。
2.3子宫各层结构在不同月经状态ADC值比较 子宫内膜、结合带和肌层ADC值在月经期、卵泡期、黄体期和绝经后的总体差异有统计学意义(P均<0.05)。两两比较,子宫内膜ADC值于月经期、卵泡期与黄体期之间差异均有统计学意义(P均<0.05),绝经后与月经期、黄体期差异有统计学意义(P均<0.05),绝经后与卵泡期间差异无统计学意义(P>0.05)。结合带ADC值于月经期、卵泡期与黄体期间两两比较差异均有统计学意义(P均<0.05),绝经后与黄体期差异有统计学意义(P<0.05),绝经后与卵泡期、月经期差异无统计学意义(P均>0.05)。肌层ADC值于月经期、卵泡期与黄体期间两两比较差异无统计学意义(P均>0.05),绝经后与月经期、卵泡期和黄体期差异均有统计学意义(P均<0.05)。
2.4子宫各层结构在不同月经状态下的ADC值变异程度 在月经期、卵泡期、黄体期及绝经后4个时期中,子宫内膜ADC值的CV分别为14.95%、11.38%、9.77%和10.83%,月经期变异程度最大;结合带ADC值CV分别为15.05%、14.15 %、14.41%和9.90%,月经期变异程度最大;肌层ADC值CV分别为9.03%、11.11%、9.46%及5.76%,卵泡期变异程度最大(图3)。
3 讨论
DWI及ADC值可从分子水平反映人体组织的空间结构变化和病理生理条件下组织水分子的功能变化,有助于早期检测子宫病变,鉴别恶性子宫内膜组织与正常子宫内膜和良性子宫内膜病变。研究[8-9]表明,子宫内膜癌ADC值低于正常子宫内膜(P<0.01),二者无重叠,且恶性肿瘤ADC值与病理分级呈负相关[2-3]。ADC值能准确判断子宫内膜癌的分期、疗效及鉴别肿瘤复发等[10],但对于可高度提示恶性肿瘤的ADC阈值目前尚无统一标准[11]。
表2 正常子宫各层结构在不同月经状态下的ADC值(×10-3 mm2/s,±s)
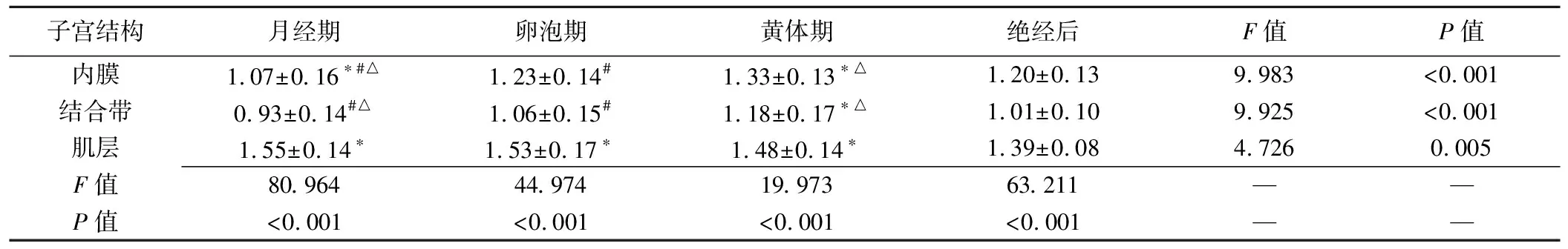
表2 正常子宫各层结构在不同月经状态下的ADC值(×10-3 mm2/s,±s)
子宫结构月经期卵泡期黄体期绝经后F值P值内膜1.07±0.16∗#△1.23±0.14#1.33±0.13∗△1.20±0.139.983<0.001结合带0.93±0.14#△1.06±0.15#1.18±0.17∗△1.01±0.109.925<0.001肌层1.55±0.14∗1.53±0.17∗1.48±0.14∗1.39±0.084.7260.005F值80.96444.97419.97363.211——P值<0.001<0.001<0.001<0.001——
注:*:同一结构中,与绝经后比较P<0.05;#:同一结构中,与黄体期比较P<0.05;△:同一结构中,与卵泡期比较P<0.05
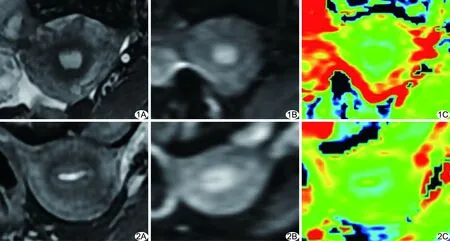
图1 受试者,44岁,黄体期,子宫各层结构显示清晰 A.轴位脂肪抑制T2WI; B.DWI; C.ADC伪彩图,内膜和肌层(绿色)ADC值高于结合带(蓝色) 图2 受试者,52岁,绝经后,子宫各层结构显示清晰,内膜明显变薄 A.轴位脂肪抑制T2WI; B.DWI; C.ADC伪彩图,内膜和肌层(绿色)ADC值高于结合带(蓝色)
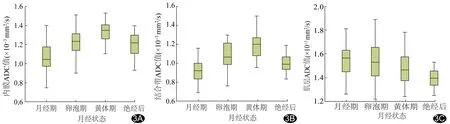
图3 子宫各层结构在不同月经状态下ADC值的箱式图 A.内膜,月经期ADC值变异程度最大; B.结合带,月经期ADC值变异程度最大; C.肌层,卵泡期ADC值变异程度最大
本研究结果显示,相同月经状态下,子宫各层结构ADC值差异均有统计学意义(P均<0.001),且子宫肌层ADC值最高,结合带最低,内膜居中,与Cao等[9,12]的研究结果相符。子宫壁各层间ADC值的差异系各层组织差异所致。结合带包括子宫黏膜下肌层及血管肌层,其细胞密集,质核比较低,含水量较低,肌纤维排列紧密[13],限制了水分子的扩散;肌层包括中间层和浆膜下层,其平滑肌束排列相对松散,且肌束间的纤维较多,细胞间隙大[14],水分子在细胞外的扩散自由度高,其ADC值最高;子宫内膜由黏膜上皮及其下方的固有层组成,有丰富的血管内皮细胞、间质细胞及腺细胞,同时内膜拥有特殊的微环境,细胞、间质黏附紧密[6],限制了水分子的扩散,其ADC值明显低于肌层。
本研究结果显示,月经状态对于子宫各层结构ADC值影响明显,月经期、卵泡期与黄体期之间子宫内膜、结合带ADC值差异均有统计学意义,而肌层无明显差异;子宫内膜绝经后与月经期、黄体期ADC值差异均有统计学意义,结合带绝经后与黄体期差异有统计学意义,肌层绝经后与月经期、卵泡期和黄体期均有统计学意义,与既往研究[4-5,12,15]报道不尽一致。子宫内膜不同月经状态下变化明显,与女性激素水平改变有关。在月经期,由于雌、孕激素撤离,子宫内膜功能层缺血坏死、脱落,期间ADC值降低可能与宫腔内血液的存在相关[6-7]。卵泡期雌激素水平逐渐升高,内膜上皮、腺体、间质和血管均呈增殖性变化,细胞外含水量较低,水分子扩散受限[6]。黄体期,在雌、孕激素作用下,内膜继续增厚,间质更加疏松、水肿,细胞数量相对减少,水分子扩散自由度高于卵泡期[6]。绝经后孕、雌激素分泌减少,子宫内膜变薄、萎缩,腺体无增生或分泌活性,同时黏膜间质纤维增生,使ADC值低于黄体期[6-7]。
结合带和内膜均起源于苗勒管,其雌激素、黄体激素受体的周期性表达与内膜相似[13],因此不同月经状态下ADC值的变化与内膜类似。肌层的类固醇激素受体并不随月经周期而发生变化[13],这可以解释其ADC值在不同月经周期无明显差异;而绝经后肌层萎缩、细胞间隙减小、含水量减少及纤维结缔组织增多[7],导致其ADC值低于绝经前。
本研究结果显示子宫各层结构在不同月经状态下ADC值的变异度均较大,子宫内膜和结合带ADC值在月经期CV最大,即变异程度最大,肌层在卵泡期变异程度最大。Tsili等[5,15]亦发现ADC值个体间差异较大,但肌层ADC值变异度在月经期最大,可能与各研究样本量不同有关。Kido等[15]的研究也表明子宫内膜ADC值周期性变化幅度与良恶性病变间ADC值的差异相当;Cao等[9]报道子宫内膜ADC值个体间差异高于正常内膜与子宫内膜癌的ADC差值(0.26×10-3mm2/s),因此,当以ADC值作为诊断肿瘤及鉴别肿瘤复发的指标时,有必要考虑不同月经状态造成的ADC值差异。
本研究的局限性:样本量较少;DWI仅采用单一b值;未观察不同月经状况ADC值变化与雌、孕激素水平的关系。
总之,本研究发现不同月经状态下正常子宫各层结构间ADC值有所差异,且个体间的变异度较大。采用ADC值评判子宫病变时,应充分考虑以上因素。
