发酵豆酱中ACE抑制肽的制备及分离纯化
2018-12-13李利军马英辉卢美欢
李利军,马英辉,卢美欢
(陕西省微生物研究所,西安 710043)
血管紧张素转化酶(angiotensin-converting enzyme, ACE)是血管内膜细胞的一种糖蛋白[1],相对分子质量为120~150 kDa[2],通过影响肾素-血管紧张素系统(renin angiotensin system, RAS)和激肽释放酶-激肽系统(kallikrein-kinin system, KKS)而引起血压升高[3]。
20世纪80年代日本就对ACE抑制肽进行了深入的研究。近年来,食源性的ACE抑制肽也成为我国研究的热点,其中大豆因蛋白质含量高,富含人体所需的8种必需氨基酸,成为制备ACE抑制肽的优选原料。利用戊糖片球菌发酵大豆,获得了低分子量的大豆多肽,对ACE的抑制率达65.1%左右[4]。Naoyoshi等[5]从豆浆提取物中发现了具有ACE抑制活性的多肽。刘文颖等[6]利用酶解法从大豆低聚肽中获得了抗氧化肽和ACE抑制肽,并对其进行了鉴定。
本实验室前期研究中,从细菌型豆豉中已经筛选到1株枯草芽孢杆菌BS90,能以大豆蛋白为底物,产生ACE抑制肽,相继研究了制备高抑制活性大豆ACE抑制肽的优化实验,在最佳条件下,培养40 h,大豆蛋白水解度达到89.1%,ACE抑制率达81.8%。在本实验中,通过微生物发酵大豆,制得中国传统黄豆酱。经过研磨、水溶,采用盐析、超滤、柱层析对发酵制备豆酱中的混合多肽进行分级分离,并分别测定ACE抑制活性,流程图见图1。
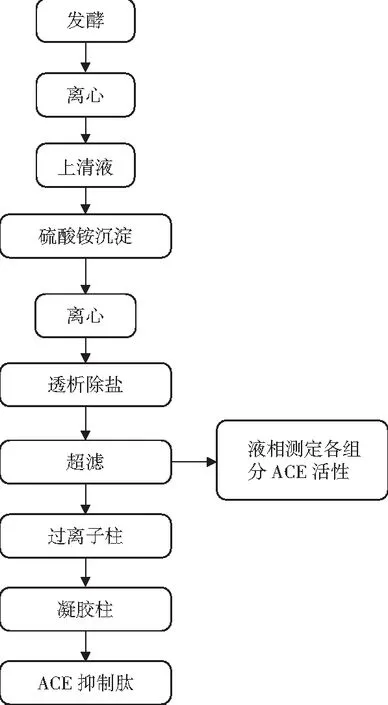
图1 ACE抑制肽纯化流程Fig.1 The purification process of ACE inhibitory peptide
1 材料与方法
1.1 材料与试剂
培养基:斜面培养基:LB;液体种子培养基:1%大豆分离蛋白,2%葡萄糖,0.5%氯化钠,定容于1000 mL,pH自然。
主要原料:黄豆,购于西安市紫燕食品有限公司。
主要试剂:血管紧张素转化酶(ACE)、马尿酸(标准品)、马尿酰-组胺-酰亮氨酸(HHL,标准品):美国Sigma公司;L-亮氨酸(分析纯);邻苯二甲醛(OPA,分析纯)、三氯乙酸(分析纯)、甲醇(分析纯)、乙腈(分析纯):天津市富宇精细化工有限公司。
1.2 仪器与设备
UV-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;安捷伦1260高效液相色谱仪(High Performance Liquid Chromatography, HPLC) 美国安捷伦公司;DHZ-D恒温摇床 江苏太仓仪器设备厂;DH-250A电热恒温培养箱 北京科伟仪器公司;Sigma3K15冷冻离心机 德国Sigma公司;HD-5紫外检测仪 上海沪西分析仪器厂有限公司;超滤仪 美国Milli Power 公司;Sephadex G-75凝胶柱(1.6 cm×75 cm);DEAE高流速琼脂糖微球a离子交换柱(2.6 cm×20 cm);C18柱(4.6 mm×250 mm)。
1.3 方法
1.3.1 黄豆酱制作
将保藏菌株BS90斜面活化24 h,接种于液体种子培养基中,温度35 ℃、150 r/min摇床培养18 h。
取黄豆1000 g,用自来水浸泡10 h,空去水分,入高压灭菌锅蒸煮:1.1~1.3 Pa灭菌20 min,自然冷却后接种上述培养的液体种子,搅拌均匀入恒温箱32 ℃培养42 h,检测其水分、蛋白酶活力。然后拌15%盐水,补足水分为62%,食盐为6%,置于40 ℃发酵15天,黄豆酱制作完成。
1.3.2 ACE抑制肽粗品制备
称取黄豆酱50 g,用500蒸馏水溶解、过滤,得到ACE抑制肽粗品。
1.3.3 ACE抑制肽的分离纯化
将ACE抑制肽粗品进行8000 r/min 离心5 min,取上清液,30 ℃磁力搅拌,缓缓加入50%硫酸铵,溶解后置于4 ℃进行蛋白沉淀过夜。10000 r/min离心10 min,弃上清液,沉淀用pH为7.4的缓冲液(Tris-HCl)溶解,置于4 ℃透析过夜。取出后进行8000 r/min离心5 min,对上清液进行超滤,超滤膜依次采用30,10,3,1 k,超滤后进行超滤管浓缩,高效液相色谱测定各个组分的活性,将活性最好的组分进行后期的色谱柱分离。
DEAE高流速琼脂糖微球a离子交换柱分离:平衡液为双蒸水,用NaCl(0.1~0.8 mol/L)、缓冲液进行线性梯度洗脱,洗脱速度为 1.0 mL/min,上样量为8 mL,在 280 nm 下收集各峰,检测活性,收集活性最高的组分备用。
Sephadex G-75 凝胶柱分离纯化:洗脱液为Tris-HCl,洗脱速度为 0.1 mL/min,上样量为20 mL,在280 nm下收集各峰,检测活性,收集活性最高的组分于冰箱冷冻保存。
1.3.4 检测方法
1.3.4.1 蛋白酶活力测定
按SB/T 10317—1999《蛋白酶活力测定法》执行。
1.3.4.2 水分测定
按GB/T 5009.3-2003执行。
1.3.4.3 氨基酸态氮、总酸、NaCl测定
按GB/T 5009.40—2000规定执行。
1.3.4.4 ACE活性检测方法[7]
发酵液中ACE抑制活性测定采用高效液相色谱法,其检测条件:C18色谱柱(4.6 mm×250 mm);检测波长228 nm;柱温20 ℃;流动相:水∶甲醇为40∶60(均含0.1%甲酸,V/V);流速0.8 mL/min;进样量10 μL。
马尿酸标准曲线的绘制:分别配制马尿酸浓度为0.05,0.1,0.2,0.3,0.4,0.5 mmol/L的标准溶液,过0.22 μm的滤膜后,采用高效液相色谱法检测马尿酸含量,以峰面积(y)为纵坐标,马尿酸浓度(x)为横坐标绘制马尿酸标准曲线。
样品中马尿酸的测定: 50 μL HHL溶液、20 μL发酵上清液、50 μL ACE溶液,于37 ℃恒温水浴中反应30 min,加入120 μL 乙腈终止反应,振荡10 s,离心10 min,取上清液10 μL过0.22 μm的滤膜,待测。以缓冲液替代反应体系中的发酵上清液为空白对照组。
2 结果与分析
2.1 中性蛋白酶活力测定结果
中性蛋白酶活力测定结果见表1。
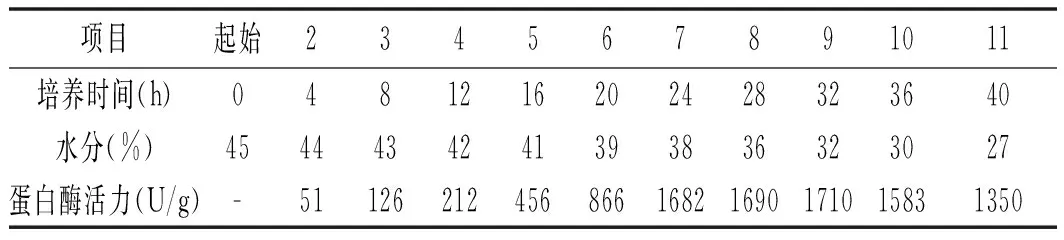
表1 中性蛋白酶活力测定结果Table 1 Determination of neutral protease activity
由表1 可知,曲料生长过程中,水分逐渐递减,蛋白酶活力前期随着菌丝生长,酶活力增加,在培养28~32 h时达到最高,之后水分递减,酶活力也随之下降。
2.2 黄豆酱理化指标测定
黄豆酱理化指标测定见表2。

表2 黄豆酱理化指标检测结果Table 2 Physical and chemical indexes test results of soybean paste
由表2可知,所制作豆酱符合国家标准GB/T 24399—2009。
2.3 ACE抑制肽液相测定标准曲线
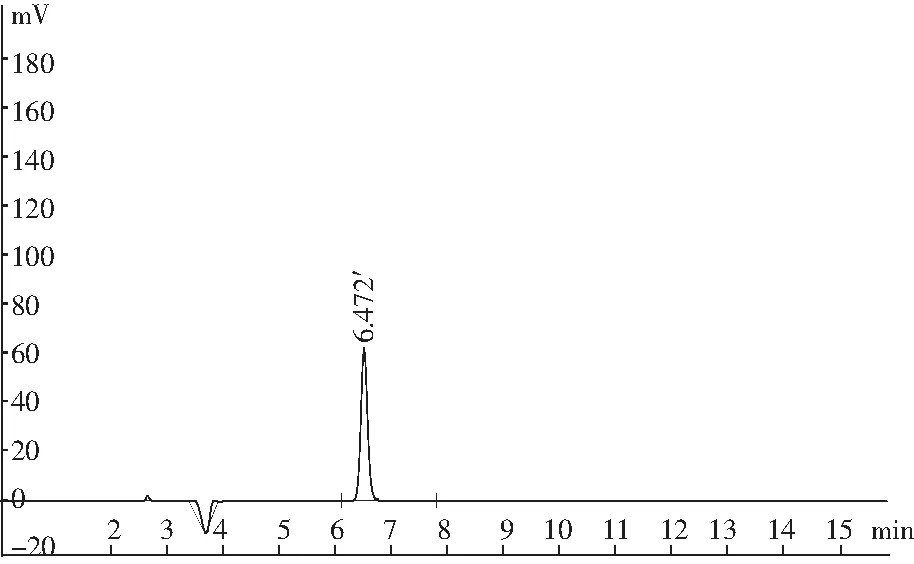

图2 马尿酸标品液相色谱图与标准曲线Fig.2 The HPLC and standard curve of hippuric acid
由图2可知,马尿酸的RT=6.472 min,峰面积与马尿酸浓度曲线拟合相关系数R2=1.0,说明该保留时间处的峰面积能够反映马尿酸的浓度大小。
2.4 超滤结果
将对硫酸铵沉淀、透析后的混合多肽进行超滤,依次分别使用30,10,3 k超滤膜进行超滤。超滤后,将混合多肽分子量分为4段:>30 k,30~10 k,10~3 k,<3 k。多肽含量和ACE抑制活性见图3。
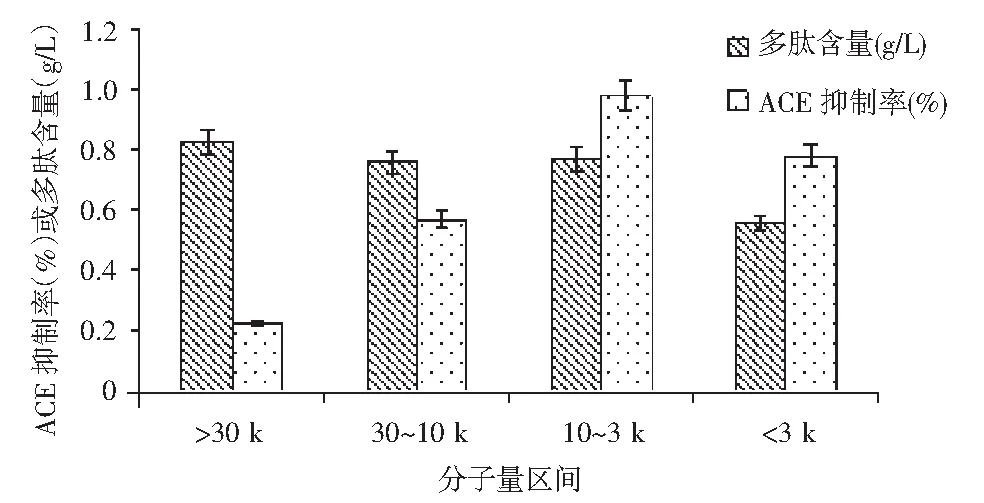
图3 不同分子量区间的多肽含量与ACE抑制率Fig.3 The polypeptide content and ACE inhibitory rates of different molecular weight intervals
由图3可知,10 k以上组分的多肽含量相对较多,但ACE抑制活性随着分子量的增大逐渐减小,各组分ACE抑制率分别为22.8%,57.2%,98.2%,78.88%。经超滤分级去除了部分没有 ACE抑制活性的长肽段,使 ACE 抑制肽主要富集在10 k以下分子量区间,3~10 k分子量的ACE抑制率最大,3 k以下组分的ACE抑制活性也在75%以上,从本结果来看,具有ACE抑制活性的多肽主要为短肽和中短肽,并非水解度越高,ACE抑制活性也越高。这与文献[8-11]报道的ACE抑制肽主要集中在3 k以下的组分有差别,这有待于进一步的研究。将收集的3~10 k分子量组分继续进行DEAE琼脂糖微球交换柱的分离。
2.5 DEAE高流速琼脂糖微球a离子交换柱

图4 3~10k组分的离子交换色谱图Fig.4 Ion exchange chromatogram of 3~10 k components
由图4可知,多肽3~10 k组分上样量20 mL后,分别使用0.1~0.8 mol/L的氯化钠进行洗脱,流速为1.0 mL/min, 1号峰为0.1 mol/L氯化钠洗脱,最大吸光值为0.25,是3~10 k混合多肽中的最大组分,ACE抑制率也是最高的(见图5)。组分IV采用0.5 mol/L的氯化钠洗脱后,组分的ACE活性也达到16.8%。但由于组分洗脱后未经过浓缩,所以ACE抑制率都相对较低。但可以确定,采用0.1 mol/L氯化钠洗脱组分I具有相对较高的ACE抑制活性,并对组分I进行下一步的凝胶柱分离。
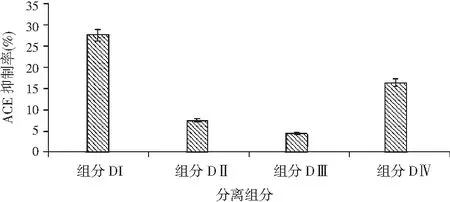
图5 离子交换柱洗脱组分的ACE抑制活性Fig.5 ACE inhibitory activity of ion exchange column elution components
2.6 Sephadex G-75 凝胶柱分离纯化

图6 组分DI的凝胶色谱图Fig.6 The gel chromatogram of DI components
由图6可知,组分DI经过G-75凝胶层析后,获得4个峰。对收集的各组分进行ACE抑制活性测定。见图7。组分DGIII的ACE抑制活性是最高的,抑制率为13.62%/40 μL。并对组分DGIII进行冻干浓缩后,ACE抑制活性为(98.3±1.24)%,IC50为0.08 mg/mL。

图7 凝胶色谱分离各组分的ACE抑制活性Fig.7 The ACE inhibitory activity of each component separated by gel chromatography
3 结论与展望
以大豆为底物,采用微生物发酵法制备中国传统黄豆酱,经过研磨、提取获得具有ACE抑制活性的多肽,通过超滤发现,分子量区间3~10 k的多肽ACE活性抑制率最高;并对其组分依次进行了DEAE琼脂糖微球a的柱层析和Sephadex G-75 凝胶柱分离,从而获得了组分DGIII为纯化后的ACE抑制肽,进行浓缩冻干后,测得ACE活性抑制率为(98.3±1.24)%,IC50为0.08 mg/mL,高于文献报道的ACE抑制率[12-14]。现有的文献都已证实ACE抑制肽为一类小分子量多肽,但繁琐的分离纯化步骤耗时耗力,成本较高。但如果能够直接食用,则比较简单。由此来看,开发具有降压作用的食品,黄豆酱无疑是最好的产品,需要注意的是黄豆酱中的食盐一般都比较高,也是为了保证产品质量,避免黄豆酱变质。因而开发具有降压作用的黄豆酱应降低食盐含量,既可以减少NaCl对生物活性物质的抑制作用,还可以方便群众增加摄食的需求。
