L-精氨酸对糖尿病大鼠勃起功能障碍的治疗作用
2018-11-12雷艳萍李晓媚杨文豪
黄 程,雷艳萍,李晓媚,杨文豪,熊 燕
(广州医科大学药学院,广州蛇毒研究所,广东 广州 511436)
糖尿病是严重危害人类健康的常见疾病,糖尿病患者易并发性功能障碍,在男性表现为阴茎勃起功能障碍(erectile dysfunction, ED),俗称阳痿,严重影响人们的身心健康和生活质量[1]。但有关糖尿病ED的机制并不清楚,临床也缺乏有效的防治药物,因此,阐明糖尿病ED发病机制,并研发有效的防治药物是医学和药学亟待解决的科学问题。
阴茎勃起是由神经调节的血管活动,依赖于海绵体神经和内皮细胞合成、释放一氧化氮(nitric oxide, NO),通过活化海绵体平滑肌细胞鸟苷酸环化酶,使cGMP增加,促使阴茎海绵体平滑肌舒张,使阴茎充血勃起。当性兴奋结束后,海绵体平滑肌细胞磷酸二酯酶5(phosphodiesterase 5, PDE5)活化,降解cGMP,使勃起终止。大量研究表明,NO-cGMP通路紊乱是导致ED的主要因素[2]。NO是由L-精氨酸在一氧化氮合酶(nitric oxide synthase, NOS)催化下转化而来。L-精氨酸同系物非对称性二甲基精氨酸(asymmetric dimethylarginine, ADMA)为NOS内源性抑制物,可抑制NOS并使之解偶联,一方面减少NO合成,另一方面增加超氧阴离子生成,导致氧化应激[3]。体内ADMA主要是由蛋白精氨酸甲基转移酶1(protein arginine methyltransferase 1, PRMT1)催化含精氨酸残基的蛋白质甲基化,再经蛋白水解作用释放而来,并主要由二甲基精氨酸二甲胺水解酶(dimethylarginine dimethylaminohydrolase, DDAH)代谢降解,因此,PRMT1-ADMA-DDAH是体内调节NO生成的重要信号通路。
近年研究发现,衰老大鼠海绵体对罂粟碱的舒张反应降低,并伴有海绵体内源性ADMA蓄积,NO与cGMP含量减少[4]。香烟尼古丁致ED兔海绵体ADMA含量也明显增加,并伴有DDAH活性降低[5]。2型糖尿病ED患者阴茎海绵体内皮型NOS(eNOS)和神经型NOS(nNOS)解偶联,氧化应激增加[3]。Meta分析显示,eNOS基因单核苷酸多态性与ED呈强相关[2]。这些研究提示,内源性ADMA蓄积导致NOS活性抑制和NO合成减少,不仅与吸烟所致ED和老龄ED密切相关,也可能参与糖尿病ED的病理生理过程。
临床上,PDE5抑制剂西地那非等被广泛用作各种ED治疗的首选药。越来越多的文献报道,西地那非可明显改善ED患者和动物勃起功能[6],但糖尿病ED患者对西地那非的疗效明显低于非糖尿病ED患者[7]。动物实验发现,西地那非并不能改善糖尿病大鼠海绵体eNOS、nNOS、PDE5基因和蛋白表达[8]。对以上不同的研究结果,巴西学者分别评估了糖尿病ED和非糖尿病ED患者对西地那非的反应性,结果发现,血中亚硝酸盐水平与糖尿病ED患者对西地那非的反应呈负相关,提示体内NO水平与ED患者对西地那非的疗效有关[9]。由此推测,糖尿病ED患者对西地那非疗效差的主要原因是由于海绵体NO减少,而不是PDE5过度活化所致。因此,阐明糖尿病ED海绵体NO缺乏的原因,研发促NO合成的药物,对糖尿病ED防治具有重要意义。
L-精氨酸作为NO合成前体,在ED形成及防治研究中也倍受关注。最近研究发现,严重ED和动脉性ED患者血清L-精氨酸水平明显低于轻度ED和非动脉性ED患者[10]。体外L-精氨酸孵育可改善老龄大鼠海绵体对乙酰胆碱(acetylcholine, ACh)或电刺激的舒张反应[11]。口服L-精氨酸可改善男性不育患者的精子质量和勃起功能[12]。但对于L-精氨酸能否改善糖尿病ED及其机制,尚未见国内外文献报道。因此,本研究拟在2型糖尿病大鼠中,探讨内源性ADMA在糖尿病ED形成中的重要作用,并观察L-精氨酸对糖尿病大鼠ED的治疗效果,同时在体外比较L-精氨酸与西地那非对糖尿病大鼠海绵体舒张功能障碍的改善作用及其机制。
1 材料与方法
1.1试剂苯肾上腺素(phenylephrin, PE)、ACh、ADMA、L-精氨酸、西地那非(sildenafil, SIL)、链脲佐菌素(streptozotocin, STZ)、二乙酰单肟、安替比林,均购自美国Sigma公司;抗PRMT1、DDAH1、DDAH2抗体,购自Abcam公司;抗PDE5、 NOS1-3、β-actin抗体,购自美国Santa Cruz公司;NO含量、NOS活性、超氧化物歧化酶(superoxide dismutase, SOD)活性、脂质过氧化产物丙二醛(malondialdehyde, MDA)含量、BCA蛋白浓度检测试剂盒、RIPA裂解液、ECL发光试剂盒,均购自碧云天生物技术有限公司;组织ADMA和cGMP ELISA检测试剂盒,购自上海研吉公司;其余常规试剂均为国产分析纯。
1.2动物模型的制备及分组SPF级健康♂Sprague-Dawley(SD)大鼠,体质量180~200 g,由广东省医学实验动物中心提供,合格证号:SYXK(粤)2010-0104。大鼠适应性喂养1周后,随机分为正常对照组、糖尿病组、糖尿病+L-精氨酸治疗组、L-精氨酸对照组,每组5只。2型糖尿病大鼠模型制备采用高脂饲养+小剂量STZ(30 mg·kg-1, i.p.)注射方法制备[13],并连续3 d检测尿糖为~者,再行连续2次隔日检测随机血糖≥16 mmol·L-1,则认为糖尿病大鼠模型成立,继续高脂饲养8周。正常对照组和L-精氨酸对照组用基础饲料饲养4周后,一次性腹腔注射等体积的柠檬酸缓冲液(pH 4.2),再继续用基础饲料饲养8周。
1.3方法
1.3.1 口服糖耐量的测定 糖尿病大鼠造模8周后,测定口服糖耐量以评价胰岛素敏感性。先将大鼠禁食12 h后,经尾静脉采血测定空腹血糖值(blood glucose,BG),然后一次性灌胃给予40%葡萄糖溶液(2 g·kg-1),分别在灌胃后30、60、90、120 min检测血糖值,绘制血糖-时间曲线,并采用梯形法计算曲线下面积[13]。
1.3.2 海绵体舒张功能测定 水合氯醛(300 mg·kg-1,i.p.)麻醉,颈动脉插管收集血标本后,快速摘取阴茎,按我室已建立的方法,检测大鼠离体海绵体对ACh的舒张反应,以反映阴茎勃起功能[13]。并记录各浓度点海绵体张力变化,并计算舒张百分率。在体外药物治疗实验中,记录第1次海绵体对ACh的舒张反应后,分别用L-精氨酸(3 mmol·L-1)和西地那非(3 μmol·L-1)孵育45 min,再检测海绵体对ACh的舒张百分率;并将药物孵育前后两次最大舒张百分率的比值,用以评价L-精氨酸和西地那非对糖尿病大鼠海绵体舒张功能障碍的体外治疗作用。
1.3.3 生化测定
1.3.3.1 血清和组织ADMA水平测定 采用高效液相色谱法测定大鼠血清ADMA浓度[13],通过比较样品和标准品的峰面积比值,以及标准品ADMA浓度,计算样品ADMA的浓度;采用大鼠ELISA试剂盒检测海绵体组织ADMA含量。
1.3.3.2 DDAH、NOS活性及NO含量测定 按我室已建立的方法测定海绵体组织DDAH活性。制备5%海绵体组织匀浆,取其上清50 μL与1 mmol·L-1ADMA反应,加入二乙酰单肟和安替比林共孵育100 min,用Epoch全波长酶标仪(美国BoiTek公司)在466 nm波长处读取吸光度值(A466)。计算L-胍氨酸生成量,以反映DDAH活性,其活性单位定义为每分钟催化生成1 μmol·L-1的L-胍氨酸所需要的DDAH量(U·g-1Pro)。分别用NOS和NO试剂盒,检测海绵体NOS活性及NO稳定代谢产物硝酸盐/亚硝酸盐含量,反映NO生成[13]。
1.3.3.3 氧化应激、cGMP和蛋白含量测定 用黄嘌呤氧化酶法测定海绵体SOD活性,硫代巴比妥酸法测定MDA含量,反映氧化应激[13]。采用大鼠cGMP ELISA试剂盒检测海绵体组织cGMP含量。采用双缩脲法测定组织蛋白含量,用以标化上述生化指标[14]。
1.3.4 蛋白表达检测 制备10%大鼠海绵体组织的RIPA裂解液,用Western blot法检测PRMT1、DDAH1、DDAH2、eNOS、nNOS、iNOS、PDE5等蛋白表达[13-14]。每孔上样30 μg蛋白,经电泳分离后,电转至PDVF膜上,室温封闭1 h后,加一抗(PRMT1、DDAH1、DDAH2 的浓度为1 ∶1 000,eNOS、nNOS、iNOS、PDE5的浓度为1 ∶500)4 ℃孵育过夜,再加二抗室温孵育2 h,用ECL化学发光试剂显色,凝胶成像系统(ChemiDocTMXRS+System,Bio-Rad公司)扫描,用Image Pro软件进行图像分析。

2 结果
2.1L-精氨酸体内治疗改善糖尿病大鼠的口服糖耐量如Fig 1所示,糖尿病大鼠空腹血糖明显高于正常对照组(P<0.01),葡萄糖负荷(2 g·kg-1, i.g.)后,糖尿病大鼠各时间点的血糖水平及血糖-时间曲线下面积均明显高于正常对照组(P<0.01),表明糖尿病大鼠糖耐量降低。经L-精氨酸(100 mg·kg-1·d-1, i.g.)体内治疗8周后,既可降低糖尿病大鼠的空腹血糖水平,也可降低糖负荷后2 h的血糖浓度(P<0.05),但不影响正常大鼠的空腹血糖和糖负荷后血糖水平,提示L-精氨酸治疗8周可改善糖尿病大鼠的糖耐量降低。
2.2L-精氨酸治疗改善糖尿病大鼠海绵体的舒张功能如Fig 2所示,与正常对照组比较,糖尿病大鼠海绵体对ACh诱导的最大舒张反应明显降低(P<0.01),提示糖尿病大鼠ED;L-精氨酸体内治疗明显增加糖尿病大鼠离体海绵体对ACh的最大舒张反应(P<0.05),但对正常对照组大鼠离体海绵体的最大舒张反应无明显影响。将糖尿病大鼠离体海绵体在体外用L-精氨酸(3 mmol·L-1)孵育45 min,也能增加其对ACh的最大舒张反应(P<0.05);然而,用PDE5抑制剂西地那非(3 μmol·L-1)体外孵育糖尿病大鼠离体海绵体,则不影响其对ACh的最大舒张反应。提示L-精氨酸无论是体内还是体外治疗,均能明显改善糖尿病大鼠海绵体的舒张功能损害。
2.3L-精氨酸对海绵体ADMA、NO、cGMP含量以及DDAH、NOS活性的影响如Tab 1所示,糖尿病大鼠血清中ADMA浓度明显高于正常对照组(P<0.01),海绵体内源性ADMA蓄积增加(P<0.05),DDAH及NOS活性降低(P<0.05),NO和cGMP含量均减少(P<0.01),提示糖尿病大鼠海绵体组织DDAH/ADMA/NOS/NO/cGMP通路紊乱。给予L-精氨酸体内治疗8周后,糖尿病大鼠血清ADMA浓度明显降低(P<0.01),海绵体内源性ADMA蓄积减少(P<0.05),DDAH及NOS活性增强(P<0.05),NO和cGMP含量增加(P<0.01),提示L-精氨酸治疗可逆转糖尿病大鼠海绵体DDAH/ADMA/NOS/NO/cGMP通路紊乱,但对正常大鼠海绵体DDAH/ADMA/NOS/NO/cGMP通路无明显影响。
2.4L-精氨酸对海绵体PRMT1/DDAH/NOS/PDE5通路蛋白表达影响如Fig 3所示,与正常对照组比较,糖尿病组大鼠海绵体PRMT1蛋白表达上调,而DDAH1和DDAH2蛋白表达下调(P<0.01),eNOS和nNOS的蛋白表达降低,而iNOS蛋白表达增加(P<0.01),此外,PDE5蛋白表达也上调(P<0.01)。
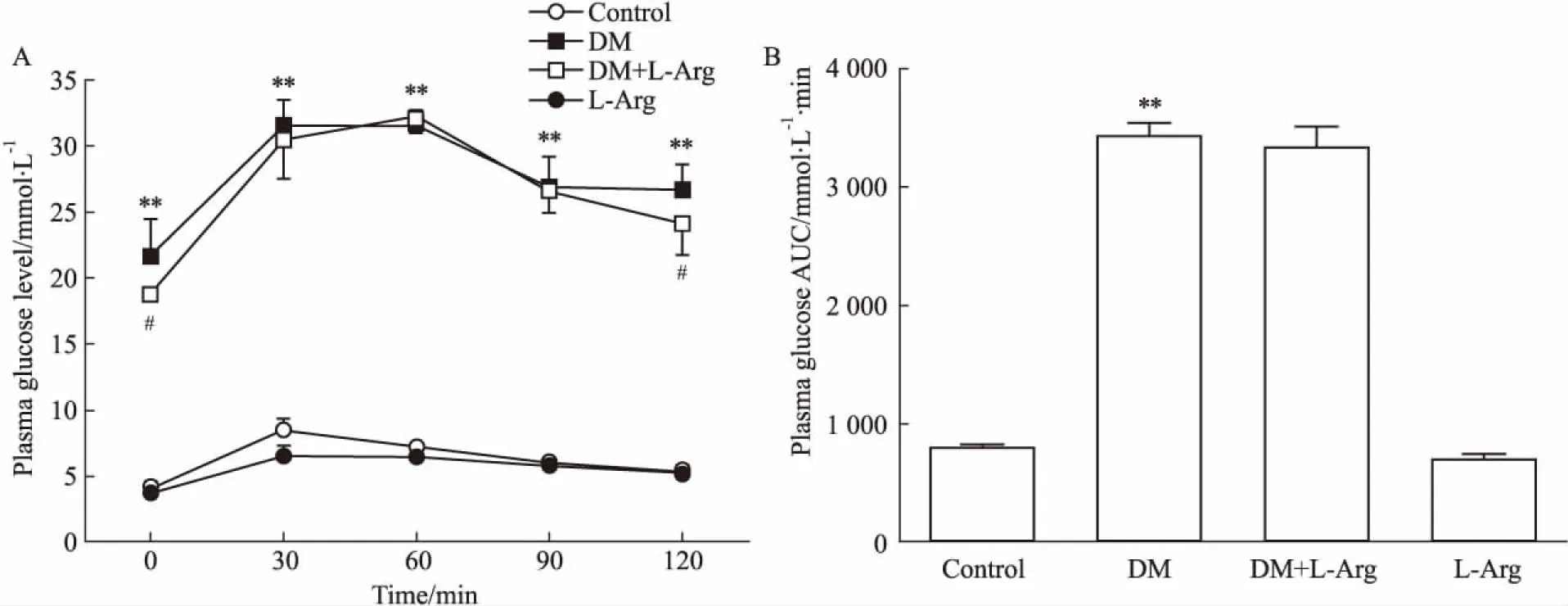
Fig 1 Treatment with L-arginine for 8 weeks improved the impairment of oral glucose tolerance in diabetic
A: Plasma glucose concentration-time curve; B: AUC of plasma glucose.**P<0.01vscontrol;#P<0.05vsDM.
Tab 1 L-arginine treatment in vivo reversed disorder of DDAH/ADMA/NOS/NO/cGMP pathway
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsDM
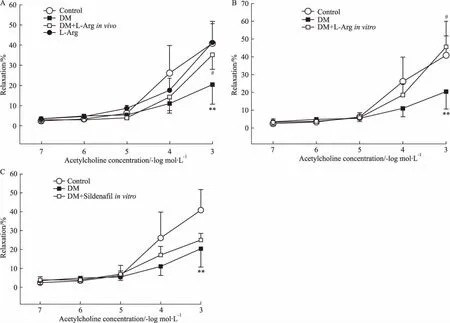
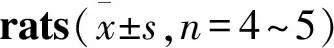
A: Effect of L-arginine treatmentinvivo; B: Effect of L-arginine treatmentinvitro; C: Effect of sildenafil treatmentinvitro.**P<0.01vscontrol;#P<0.05vsDM.
提示糖尿病大鼠海绵体组织PRMT1/DDAH/NOS/PDE5通路蛋白表达紊乱。经L-精氨酸体内治疗8周后,基本可逆转以上异常(P<0.05,P<0.01),但对正常大鼠海绵体PRMT1/DDAH/NOS/PDE5通路蛋白表达无明显影响。提示L-精氨酸体内治疗可改善PRMT1/DDAH/NOS/PDE5通路蛋白表达的异常。
2.5L-精氨酸降低糖尿病大鼠海绵体氧化应激如Fig 4所示,与正常对照组比较,糖尿病大鼠海绵体抗氧化酶SOD活性降低(P<0.01),脂质过氧化产物MDA含量有升高趋势,但差异无统计学意义,提示糖尿病大鼠海绵体氧化应激增加。用L-精氨酸体内治疗8周后,不仅能提高糖尿病大鼠海绵体SOD活性,还能降低MDA含量(P<0.01,P<0.05),提示L-精氨酸体内治疗可降低糖尿病大鼠海绵体氧化应激。
3 讨论
本研究发现,糖尿病大鼠海绵体舒张功能明显降低,并伴有内源性ADMA蓄积和海绵体PRMT1/ADMA/DDAH/NOS/PDE5通路紊乱;经L-精氨酸灌胃治疗8周,不仅改善糖尿病大鼠海绵体舒张功能障碍,还降低内源性ADMA蓄积,并纠正海绵体PRMT1/ADMA/DDAH/NOS/PDE5通路紊乱。为阐明糖尿病ED的发病机制及其治疗提供了新的实验数据。
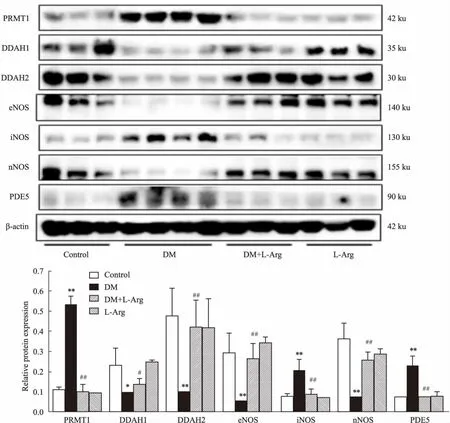
Fig 3 L-arginine treatment in vivo normalized abnormal protein expression of PRMT1/DDAH/NOS
*P<0.05,**P<0.01vscontrol;##P<0.01vsDM

Fig 4 L-arginine treatment in vivo suppressed oxidative stress in corpus cavernosum of diabetic
A:SOD activity; B: MDA content.**P<0.01vscontrol;#P<0.05,##P<0.01vsDM.
评价人类ED的严重性主要采用5项国际勃起功能指数(the International Index of Erectile Function, IIEF-5)评分[1, 6-7, 9-10]。评价动物ED,体内实验常采用阴茎海绵体内压(intracavernous pressure, ICP)及其与平均动脉压(mean arterial pressure, MAP)的比值来反映[4,8],体外实验常采用电刺激或药物如ACh等诱导离体海绵体的舒张反应来反映[5,15]。本研究通过检测离体海绵体对ACh的最大舒张反应来评估糖尿病大鼠勃起功能,证明了糖尿病大鼠ED与阴茎海绵体NO/cGMP信号损害有关。相似的实验结果也在老龄ED大鼠[4]、注射香烟抽提物致ED兔[5]和动脉粥样硬化ED大鼠等动物模型观察到。来自阴茎假体移植患者的离体海绵体研究发现,糖尿病ED患者海绵体内皮依赖性舒张功能和电刺激的舒张反应损害均比非糖尿病ED患者严重,海绵体cGMP含量也更低,并且对PDE5抑制剂诱导的舒张反应不明显[15]。临床分析发现,糖尿病ED患者血浆亚硝酸盐水平与其对PDE5抑制剂的治疗效果呈负相关[9]。这些研究结果均直接或间接支持我们关于糖尿病ED是由于海绵体NO/cGMP信号损害所致的实验结论。然而,导致糖尿病患者和动物海绵体NO/cGMP降低或损害的机制不完全清楚,深入研究对糖尿病ED的防治具有重要意义。
最近研究发现,海绵体内源性ADMA蓄积与衰老大鼠ED和香烟尼古丁所致兔ED有关[4-5]。因此,本研究检测糖尿病ED大鼠血清和海绵体ADMA水平。结果发现,糖尿病ED大鼠不仅血清ADMA浓度明显升高,海绵体内源性ADMA也明显蓄积,还伴有海绵体NOS活性抑制,eNOS和nNOS表达降低。依据这些结果,我们提出“海绵体内源性ADMA蓄积及其所致的NOS活性抑制、eNOS和nNOS表达下调,是导致糖尿病ED海绵体NO/cGMP信号降低的重要原因”的观点。已知ADMA抑制NOS,可使其解偶联,不仅减少NO生成,还增加氧自由基产生[3],因此,本研究检测了海绵体SOD活性及MDA含量以反映氧化应激。结果证明,糖尿病ED大鼠海绵体氧化应激的确增加。虽然已知DDAH和PRMT1与内源性ADMA生成与代谢有关,本研究揭示了糖尿病ED大鼠海绵体ADMA蓄积不仅是由于DDAH活性及表达降低所致,也与PRMT1表达增加有关。海绵体ADMA蓄积与DDAH和NOS活性降低的相似结果,也在老龄ED大鼠[4]、注射香烟抽提物所致ED兔[5]和动脉粥样硬化ED大鼠观察到,这些结果均间接支持了我们的观点。
为了进一步验证我们的观点,并寻找治疗糖尿病ED的更好药物,本研究观察了NO合成前体L-精氨酸体内治疗8周对糖尿病大鼠ED的疗效。结果发现,L-精氨酸体内治疗不仅能降低糖尿病大鼠内源性ADMA蓄积,还明显改善糖尿病ED,并可纠正糖尿病大鼠海绵体PRMT1/DDAH/ADMA/NOS/PDE5信号通路紊乱和氧化应激。不仅如此,L-精氨酸体外孵育糖尿病大鼠海绵体也能明显改善其舒张功能障碍,而用PDE5抑制剂西地那非体外孵育则不能。这些结果进一步证明,内源性ADMA蓄积导致NO缺乏是糖尿病大鼠ED的主要原因,而不是PDE5过度活化所致。基础和临床研究发现,糖尿病ED病人和动物对PDE5抑制剂治疗效果不佳[7-8],有研究推测这可能与糖尿病时血中NO水平降低,以及PDE5抑制剂不能改善海绵体NOS表达、活性与NO合成有关[8-9]。因为能增加NOS表达和保护NO不被灭活的白藜芦醇和抗氧化剂等药物,也能改善糖尿病病人和动物的ED,与PDE5抑制剂联合治疗可产生协同作用[8]。这些研究结果虽然来自各种ED病人和多种动物模型,都直接或间接地支持我们的实验结果和观点。
综上所述,本研究揭示海绵体内源性NOS抑制物ADMA蓄积是导致糖尿病大鼠ED的重要原因;NO合成前体L-精氨酸无论是体内治疗,还是体外孵育,对糖尿病大鼠离体海绵体舒张功能障碍均有明显的改善,其机制与上调海绵体DDAH和NOS活性与表达,增加NO合成,降低氧化应激有关。本研究为L-精氨酸用于临床防治糖尿病ED提供了重要的实验依据。
