GABAB受体激动剂巴氯芬对大鼠中脑导水管周围灰质兴奋性及抑制性突触的作用
2018-11-12邵采凤张雯玮胡朝婷王冉超赵昶昀
邵采凤,张雯玮,胡朝婷,王冉超,接 玉,赵昶昀,陈 茜,杨 鲲
(1. 江苏大学医学院解剖学教研室,江苏 镇江 212013; 2. 江苏大学附属人民医院麻醉科,江苏 镇江 212002; 3. 江苏大学医学院2015年级本科生,江苏 镇江 212013; 4. 江苏大学医学院2016年级本科生,江苏 镇江 212013)
中脑导水管周围灰质 (periaqueductal gray, PAG) 在伤害性信息的下行抑制系统中处于至关重要的位置[1]。PAG的腹外侧 (ventrolateral PAG, vlPAG) 亚区是参与伤害性信息调制的重要区域。PAG发出的纤维终止于脊髓背角,参与脊髓水平伤害性信息的调制,PAG的研究重点集中在其vlPAG亚区[1-2]。
γ-氨基丁酸 (γ-aminobutyric acid, GABA) 是PAG内重要的抑制性神经递质[2]。GABA能突触分泌的GABA与突触后GABA受体结合,后者包括GABAA受体和GABAB受体[1]。同时,谷氨酸是最重要的兴奋性神经递质。谷氨酸能突触分泌的谷氨酸与突触后谷氨酸受体结合,后者包括NMDA受体[3]和AMPA受体。由于GABAB受体既表达在谷氨酸能突触终末,也表达于GABA能突触终末上,因此,从理论上推断,GABAB受体激动剂可以激活这些受体,并抑制GABA能及谷氨酸能突触[4-6],继而抑制GABA和谷氨酸的释放。前期的实验结果也印证了这个推断[7-10]。
虽然GABAB受体被激活后,在神经系统内普遍引起“抑制效应”,但是研究人员很早就注意到,不同浓度的GABAB受体激动剂在PAG发挥的作用不同,继而通过影响下行抑制系统,产生“镇痛”与“致痛”作用[2,11]。这些结果提示不同浓度的GABAB受体激动剂可能在PAG内对兴奋性突触和抑制性突触有影响,继而打破动态平衡而影响PAG的输出,最终造成对脊髓水平的伤害性信息调制的不同作用[7]。本实验试图用“饱和浓度”及“非饱和浓度”的GABAB受体激动剂巴氯芬分别激活PAG内的谷氨酸能突触及GABA能突触,比较不同浓度的巴氯芬对上述两类突触的作用。根据已知的GABAB受体激动剂的药代动力学特征,本实验使用的“饱和浓度”和“非饱和浓度”的巴氯芬的浓度分别确定为5 μmol·L-1和 0.1 μmol·L-1[12]。最后,比较两种浓度对单个PAG细胞兴奋性的“净作用”(net effects),以探讨不同浓度GABAB受体激动剂引起不同作用的机制。
1 材料与方法
1.1试剂巴氯芬和EGTA购自美国Sigma公司;其他试剂均为国产分析纯,购自中国上海国药化学试剂公司。
溶液配制:① 人工脑脊液 (mmol·L-1,pH 7.2,渗透压约305 mOsm): NaCl 124、KCl 2.6、CaCl22.5、NaH2PO41.2、MgCl21.2、NaHCO325、葡萄糖 11。② 脑薄片切片液 (mmol·L-1,pH 7.2):蔗糖 212.7、KCl 4、CaCl20.5、NaH2PO41.23、MgCl210、NaHCO326、葡萄糖10。③ 记录电极内液1(pH 7.2,由CsOH调节, 渗透压约290 mOsm),记录抑制性突触后电流 (mmol·L-1): 甲基硫酸铯 85、CsCl 50、HEPES 10、MgCl22.5、Na2-ATP 4、Na3-GTP 0.4、Na-phosphocreatine 10、EGTA 0.6。④ 记录电极内液2(pH 7.2,由KOH调节, 渗透压约290 mOsm),记录兴奋性突触后电流 (mmol·L-1): K-gluconate 135、KCl 5、CaCl20.5、MgCl22、EGTA 5、HEPES 5、Mg-ATP 3.6。
1.2实验动物6~8周龄 ♂ Sprague-Dawley (SD) 大鼠,购自江苏大学实验动物中心,实验许可证号为SCXK (苏) 2013-0011。本实验有关使用动物的程序均经江苏大学实验动物伦理委员会批准,符合相关伦理规范。
1.3PAG脑片的制作PAG脑片的制作方法参见文献[7-9],异氟醚吸入将大鼠深度麻醉,于第2颈椎水平迅速断头;沿颅正中线剪开大鼠头部皮肤,暴露颅骨,以尖嘴骨剪从椎孔向上沿颅骨矢状缝向前剪开至双眼连线位置,小心剥开切除颅骨,暴露鼠脑,以专用刮刀剥离全脑(包括大脑、中脑、小脑和部分脑干)。浸入用混合气体(95% O2+5% CO2)充盈饱和的冰冷的人工脑脊液中;在解剖显微镜(江西上饶凤凰光学仪器公司)下,仔细修剪大脑,用手术刀修去多余部分,得到1个包含中脑的脑块;将脑块轻贴附于琼脂块上,用速干胶将琼脂块黏于7000smz-2 振动切片机(英国Campden Instruments公司)载物台上,横切薄片厚度设定为350 μm,振动频率为80 Hz,刀片前进速度为0.1 mm·s-1;将横切的包含PAG的中脑薄片放在约36 ℃的人工脑脊液中孵育30 min, 再转移到室温 22~24 ℃人工脑脊液中保存备用。全程液体均由上述混合气体充盈,以维持必要的酸碱度和氧气浓度。
1.4全细胞记录在室温条件下,将1枚切片移至记录槽中,维持人工脑脊液灌注,速率6~8 mL·min-1。低倍镜下选取PAG薄片的腹外侧部分,再将高倍镜置于该区域,使用BX51WI相差显微镜(日本Olympus公司)配合红外水浸镜头在明视野下采集图像,并连接至监视器,观察神经元,选取“健康饱满”的PAG细胞准备记录。
P-97微电极拉制仪(美国Sutter Instrument公司)将玻璃毛坯拉制成尖端约1 μm的记录电极,由电极后端充以电极内液。从电极后端给予适当大小正压,防止尖端堵塞。电极尖端进入液体后,电阻约为4~6 MΩ。使用微操纵器移动电极,使其尖端移动至选定的神经元细胞膜表面,并形成“酒窝”后,释放正压,改为适当负压吸引细胞,形成“巨欧姆”封接(电阻>1 GΩ),对电极内施加连续的短暂负压,使电极尖端吸住的细胞膜破裂,电极内液与细胞内部相接,建立“全细胞记录模式”[9,13]。
在电压钳模式下,设置钳制电压为-70 mV。当电极内充以Cs+内液(电极内液1),可记录到抑制性突触后电流(inhibitory postsynaptic currents, IPSCs);当电极内液为K+内液(电极内液2),可记录到兴奋性突触后电流 (excitatory postsynaptic currents, EPSCs) 。在电流钳模式下,使用电极内液2且钳制电流保持在0 pA时,可以记录到突触前同心圆电极刺激引起的突触后电位(postsynaptic potentials, PSPs)[13]。所有信号都通过Axopatch 200B微电极放大器放大,经由Axon Digidata 1550数模转换器(均购自美国Molecular Devices公司)转换信号,滤波频率为5 kHz,采样频率为10 kHz。通过在电脑上运行的pClamp 10.2记录软件(美国Molecular Devices公司)记录,或用此软件通过数模转换器的数字输出,再经隔离器(Stimulus Isolator A395, 美国WPI公司)给予突触前刺激。

2 结果
2.1 “非饱和浓度”的巴氯芬对GABA能突触和谷氨酸能突触的作用本部分所有实验均在室温下进行,因此,本实验结果反映的是室温下GABAB受体的反应。首先,我们观察了“非饱和浓度”的GABAB受体激动剂巴氯芬对GABA能突触和谷氨酸能突触的作用。0.1 μmol·L-1的非饱和巴氯芬灌流后,可将同心圆电极刺激引起的兴奋性突触后电流 (evoked EPSCs, eEPSCs) 的幅度由对照组的(106±10)pA降低到(89±11)pA (n=11,P<0.01)。同样浓度的巴氯芬将同心圆电极刺激引起的抑制性突触后电流 (evoked IPSCs, eIPSCs) 的幅度由对照组的(142.4±20)pA降低到(103±5)pA (n=10,P<0.01)。即0.1 μmol·L-1的巴氯芬对兴奋性突触后电流eEPSCs的抑制率为(14±3)%,而对抑制性突触后电流eIPSCs的抑制率为(26±4)%,两个抑制比率差异有统计学意义(P=0.038),见Fig 1A、1B。提示低浓度巴氯芬抑制更多的抑制性突触传递。
2.2 “饱和浓度”的巴氯芬对GABA能突触和谷氨酸能突触的作用其次,我们研究了5 μmol·L-1的“饱和浓度”巴氯芬的作用。将同心圆电极刺激引起的兴奋性突触后电流eEPSCs的幅度由对照组的(106±10)pA降低到(19±3)pA (n=11,P<0.01)。同样浓度的巴氯芬将同心圆电极刺激引起的抑制性突触后电流eIPSCs的幅度由对照组的(142±20)pA降低到(33±7)pA (n=10,P<0.01)。平均每个神经元的实验结果,5 μmol·L-1的巴氯芬对兴奋性突触后电流eEPSCs的抑制率为(80±3)%,对抑制性突触后电流eIPSCs的抑制率为(83±3)%,两个抑制比率差异无统计学意义(P>0.05) 。见Fig 1C。
2.3 “饱和浓度”及“非饱和浓度”的巴氯芬对单个PAG细胞兴奋性的“净作用” 上述实验表明,0.1 μmol·L-1的巴氯芬对兴奋性突触和抑制性突触有不同比例的抑制作用,结果提示,该浓度下的巴氯芬“净作用”可能有兴奋性增加或兴奋性降低两种。最后,为了阐明上述问题,我们研究了单个神经元的兴奋性。形成全细胞记录模式后,对单个PAG神经元进行电流钳制,通过记录电极使得电流始终保持为0,此时可以记录到刺激引起的突触后电位PSPs[7]。如Fig 2所示,突触前刺激电极给予适量的刺激强度可以记录到突触后电位PSPs,给予饱和浓度的巴氯芬(5 μmol·L-1)将动作PSPs的数值由(3.65±0.25)ms·mV降低到(1.53± 0.21)ms·mV (P<0.01),巴氯芬洗脱后频率恢复到对照组水平(3.53±0.32)ms·mV。而“非饱和浓度”的巴氯芬 (0.1 μmol·L-1) 将突触后电位PSPs提高到(15.30±2.51)ms·mV,在多数神经元还可能引起动作电位爆发 (Fig 2A4)。
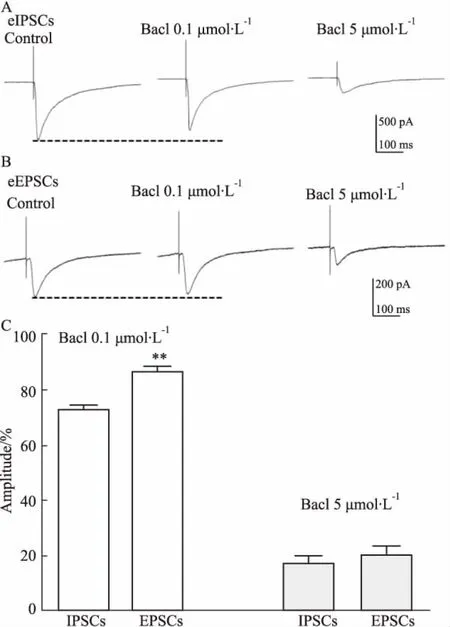
Fig 1 Non-saturated concentration and saturated concentration GABAB receptor agonist baclofen inhibited both eIPSCs and eEPSCs
Baclofen at 0.1 μmol·L-1depressed the amplitude of eIPSCs (A) and eEPSCs (B) and at the concentration of 5 μmol·L-1, the amplitudes were largely depressed. The dashed line indicated the peak amplitude of either eIPSCs or eEPSCs. The pooled data showed that at 5 μmol·L-1baclofen inhibited the amplitudes of eIPSCs and eEPSCs with the same ratio, while at 0.1 μmol·L-1, it depressed with different ratios (C).**P<0.01vseIPSCs.
净作用表示为突触后电位PSPs的AUC,AUC提高代表巴氯芬对突触的影响增加,AUC降低代表对突触的作用降低。以上结果提示,“非饱和浓度”的GABAB受体激动剂对PAG神经元的兴奋性具有提高作用 (Fig 2B)。
3 讨论
GABA是PAG内最重要的抑制性递质,GABAB受体也是重要的调节PAG在下行抑制系统功能的受体[1,5],因为GABAB受体既能抑制兴奋性突触,从而降低PAG神经元的兴奋性,又能抑制抑制性突触,从而增加神经元的兴奋性。因此,GABAB受体的作用十分复杂,而其对兴奋性突触和抑制性突触的“净作用”决定了GABAB受体对PAG输出的调节状态,即如果巴氯芬的净作用是降低了PAG神经元的兴奋性,则降低了下行抑制系统的输出;反之,如果其作用是增强了PAG神经元的兴奋性,则增强了下行抑制系统的输出[7]。
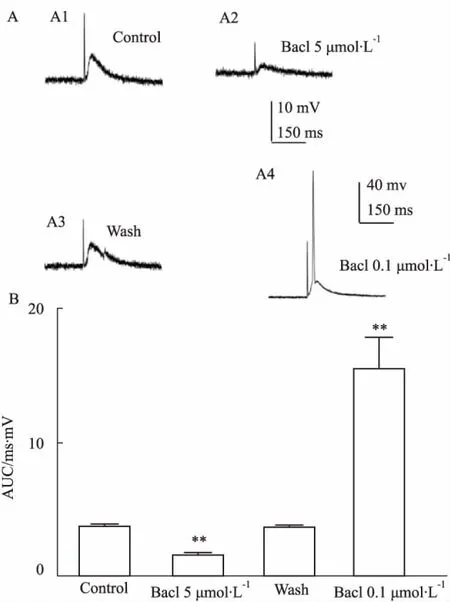
Fig 2 Saturated and non-saturated GABAB receptor agonist baclofen showed different actions on excitability of PAG neuron
A: Presynaptic stimulation-induced PSPs AUC was depressed by saturated concentration of baclofen (5 μmol·L-1), but the excitability was elevated by non-saturated baclofen (0.1 μmol·L-1). Baclofen at 0.1 μmol·L-1increased PSPs and even in some cases action potential occurred (A4). B: Pooled data showed that 5 μmol·L-1baclofen depressed AUC, but this depression was recovered after washout, while 0.1 μmol·L-1baclofen increased AUC. Wash: washout.**P<0.01vscontrol.
这两种结果都影响到自PAG起的下行抑制系统的环路[1-2]。因为PAG的投射有经中缝系统的延髓吻段腹侧部再向脊髓背角投射,也有直接终止于脊髓背角[1-2]。无论是PAG内巴氯芬微量注射[11],还是鞘内给予巴氯芬[14],都能影响实验动物的痛行为学反应,这些可能都是通过GABAB受体的抑制作用和脱抑制作用实现对痛反应的调节。本实验中,我们在突触水平获得的直接证据表明,低浓度的巴氯芬引起了神经元的兴奋作用,这个因素可能是PAG水平GABAB受体引起脊髓水平镇痛效应的基础之一。因为GABA受体在中枢神经系统有复杂的功能[4-5,15],但巴氯芬在PAG内的作用最终引起脊髓水平的伤害性信息调制结果的解释,还需进一步实验验证[7]。
值得强调的是,因为巴氯芬既能降低兴奋性谷氨酸的释放,降低突触后神经元的兴奋性,同时也能降低GABA的释放,继而通过“去抑制”的方式增加兴奋性,因此某浓度下的巴氯芬净作用可能有兴奋性增加或兴奋性降低两种。为了判断“净作用”是兴奋或抑制,我们在不加谷氨酸受体抑制剂或GABAB受体抑制剂的条件下,记录突触后综合电位PSPs。我们判断净作用的方式是以基线延长线为界,线上面积增加,表示兴奋性增加;线下面积增加,则表示抑制性作用增加。因为兴奋性和抑制性同一时间轴上可以相互抵消,且本实验中主要面积分布在基线延长线以上,因此主要巴氯芬的净作用是对兴奋性的作用。此方法为电生理常用计算方法之一[7]。
需要指出的是,GABAB受体激动剂与受体的结合,与其他受体类似,也有温度依赖性。本实验是在离体薄片室温进行,其实际药代动力学与体温可能存在差别。因此,为了探讨巴氯芬的作用,还需进一步验证其在生理温度(约36 ℃)的作用[16]。另外,GABAB受体及阿片μ受体都是下行抑制系统里的与胞内G蛋白偶联的受体,激活它们可能产生复杂的抑制及脱抑制作用[7,16]。我们当前的实验结果和前人的部分结果类似,其最终机制可能与受体激动剂的浓度等相关。
(致谢:本实验在江苏大学基础医学院解剖教研室实验室完成,感谢解剖教研室姜平教授、欧阳琦副教授的指导及杨鲲实验室同仁的帮助。)
