甜瓜种子相关性状遗传规律与QTL分析
2018-10-11张可鑫戴冬洋王浩男蔚明月盛云燕
张可鑫,戴冬洋,,王浩男,蔚明月,盛云燕,
(1.黑龙江八一农垦大学 农学院,黑龙江 大庆 163319;2.石河子大学 农学院,新疆 石河子 832003)
甜瓜(CucumismelonL.)是葫芦科重要的经济作物之一,目前世界范围内的年产量已达到2.9×107t。甜瓜具有较强的杂种优势,因此,甜瓜种子的生产培育具有巨大的经济价值[1]。甜瓜种子的大小对甜瓜产量和品质有直接影响,幼苗后期的生长发育也依赖于种子的质量[2-3]。种子的大小与幼苗竞争能力、种子休眠与萌发、种子发芽率存在相关性,同时与植株、幼苗与花器官大小,甚至植物寿命都具有一定相关性[4]。1936年,McKay首次对甜瓜种皮颜色开展相关研究[5],认为甜瓜白色种皮为质量性状,对黄色和棕褐色显性。2011年,王贤磊等[6]通过构建甜瓜遗传图谱,检测到3个QTLs:sl5.1、sw5.1和swt5.1,分别控制种子长度、宽度和千粒重。王敏等[7]对黄瓜种子性状进行遗传分析及QTL定位,发现黄瓜种子长度和宽度均符合C-0,即加性-显性-上位性多基因遗传模型,共检测到13个与种子性状相关的QTL。陈璐璐等[8]利用F2群体对黄瓜种子长度开展遗传分析及QTL检测,找到6个与种子长度有关系的QTL。不同研究者使用不同甜瓜遗传群体检测到的果实相关QTL中,有部分QTL在染色体上的分布具有明显重叠。目前,对甜瓜种子性状的研究报道较少,未见系统的深入研究。大部分研究报道是在甜瓜基因组信息公布之前,不能确定QTL位点在染色体和基因组上的准确信息[9]。本研究从分子角度探究甜瓜种子性状的遗传规律,利用亲本重测序技术挖掘酶切扩增多态性序列(cleaved amplified polymorphism sequences, CAPS)标记,对控制甜瓜种皮颜色、种子长度、种子宽度和百粒重的QTL进行检测和分析,旨在为甜瓜分子辅助育种提供依据,也为控制甜瓜种子性状相关基因的分离与克隆奠定基础。
1 材料与方法
1.1 材料
以美国农业部提供的厚皮甜瓜品系ms-5为母本(P1)、黑龙江省薄皮甜瓜HM1-1为父本(P2),配制杂交组合,获得F1代种子,F1分别与母本、父本回交获得回交群体BC1P1和BC1P2。F1单株自交后得到185个单株组成的F2群体。F2群体单株自交获得F2∶3家系。2016年将亲本厚皮甜瓜ms-5、亲本薄皮甜瓜HM1-1、F1各30株,F2群体及F2∶3家系(共153个家系,每个家系10株,3次重复)种植在黑龙江省八一农垦大学园艺实验站。单株授粉,待自然落果后,后熟7 d,剖瓜取籽,洗净,晾干。
1.2 测定指标
用游标卡尺测量甜瓜种子的长度(mm)和宽度(mm),用电子天平称量甜瓜种子的百粒重(g)。P1、P2、F1群体每次测量10株,3次重复;测量F2∶3家系的种子相关性状作为研究F2群体的试验数据。
1.3 DNA提取及分子标记
采用改良CTAB法提取甜瓜基因组DNA[10]。根据甜瓜基因组数据(https://melonomics.net/files/Genome/Melon_genome_v3.5.1/),利用SNP2CAPS软件分析亲本间差异位点,用7种限制性内切酶(EcoRⅠ、HindⅢ、PstI、BamHⅠ、XbaⅠ、XhoⅠ、HinfⅠ)对序列进行酶切位点分析,在酶切位点上下游 100~500 bp 设计CAPS引物,由上海生工生物技术服务有限公司合成。PCR扩增体系:DNA模板2 μL,上下游引物(10 μmol·L-1)各1 μL,Taq酶0.1 μL,dNTPs(10 mmol·L-1)0.15 μL,10 ×TaqBuffer 1 μL,加超纯水至10 μL。PCR扩增程序:94 ℃ 7 min;94 ℃ 1 min,60 ℃ 30 s,72 ℃ 90 s,30个循环,每个循环降0.5 ℃;4 ℃ 1 min,45 ℃ 30 s,72 ℃ 90 s;72 ℃ 7 min。酶切体系:1 μL限制性内切酶缓冲液,0.5 μL限制性内切酶(10 U·μL-1,THERMO),9 μL超纯水,PCR扩增产物5 μL,37 ℃水浴2 h。酶切产物用1%琼脂糖凝胶电泳检测。
1.4 遗传图谱构建
利用亲本筛选CAPS多态性引物,按照JoinMAP 4.0制图软件要求,与母本ms-5相同的条带记为“A”,与父本HM1-1相同的条带记为“B”,杂合条带记为“H”,缺失条带记为“-”,构建甜瓜F2群体遗传图谱。
1.5 甜瓜种子性状的遗传分析与QTL定位
利用Excel 2010软件进行数据统计分析,利用SPSS 19.0软件绘制F2群体分布柱状图。种皮颜色以F2∶3家系种皮颜色为表型数据,每个家系调查10个果实种皮颜色,全部为黄色的记为A,全部为白色的记为B,既有黄色又有白色的记为H,与遗传标记共同分析,对控制种皮白色的基因(WT)进行定位。采用盖钧镒等[11]主-多基因数量性状分离分析方法(IECM)对种子百粒重(100 seeds weight,SW)、种子长度(seed length,SL)和宽度(seed diameter,SD)进行分析,利用SPSS软件计算遗传力。根据AIC(赤池信息量准则)值最小准则和适合性检验[11]选择最优遗传模型。
利用WinQTL Cartographer 2.5的CIM(通用信息模型)方法进行QTL分析定位[12],采用排列组合1 000次重复检测的方法,运用Kosabi计算方法,确定LOD阈值(α=0.05)。以LOD>3.5为标准,利用复合区间作图法(CIM),每条染色体上每间隔5 cM进行扫描,找到可能存在QTL的图谱位置及与染色体紧密连锁的标记。标记名称命名:性状名称-染色体-QTL序号。如果QTL位点两端标记处于同一个scaffold(骨架)上,对该QTL所在区域进行softberry(http://www.softberry.com/)潜在基因预测,并通过NCBI(https://www.ncbi.nlm.nih.gov/)对潜在候选基因进行序列比对分析(blast)。
2 结果与分析
2.1 甜瓜种子表型
母本ms-5和父本HM1-1在种皮颜色、种子百粒重、种子长度和宽度性状上差异较明显,利用这2个亲本构建杂交群体,后代表型非常丰富(图1,表1)。母本ms-5为厚皮甜瓜,种皮颜色为黄色,种子较大,百粒重平均为2.82 g,种子长度为11.30 mm,宽度为4.70 mm;父本HM1-1为薄皮甜瓜,种皮颜色为白色,果实较小,种子百粒重平均为1.14 g,种子长度为5.90 mm,种子宽度为3.10 mm。F1种皮颜色为白色,F2种子种皮颜色有白色和黄色,分离比率为3∶1(P=0.64>0.05),母本回交群体BC1P1种皮颜色为白色和黄色比率为1∶1(P=0.87>0.05),父本回交群体BC1P2种皮颜色为白色。因此,可以判断出甜瓜种皮颜色为1对基因控制的质量性状,白色对黄色显性。
F1甜瓜种子百粒重为2.26 g,通过图2数据计算得出广义遗传力为52%;种子平均长为10.20 mm,通过图2数据计算得出广义遗传力为56%;种子平均宽度为4.80 mm,通过图2数据计算得出广义遗传力为51%。说明种子相关性状受遗传效应的影响较大,受到环境因素影响较小。F2群体种子百粒重平均值为1.85 g,分布范围为0.90~3.54 g;种子长度平均为8.70 mm,分布范围为7.00~11.50 mm;种子宽度平均值为4.10 mm,分布范围为3.40~5.20 mm。
2.2 甜瓜F2群体种子性状的遗传分析
2.2.1 甜瓜F2代种子性状特征
对甜瓜F2代群体种子性状进行相关性分析,结果(表2)显示:种子百粒重与种子长度呈显著正相关,相关系数为0.49;百粒重与种子宽度、种子长度与宽度相关性均不显著。
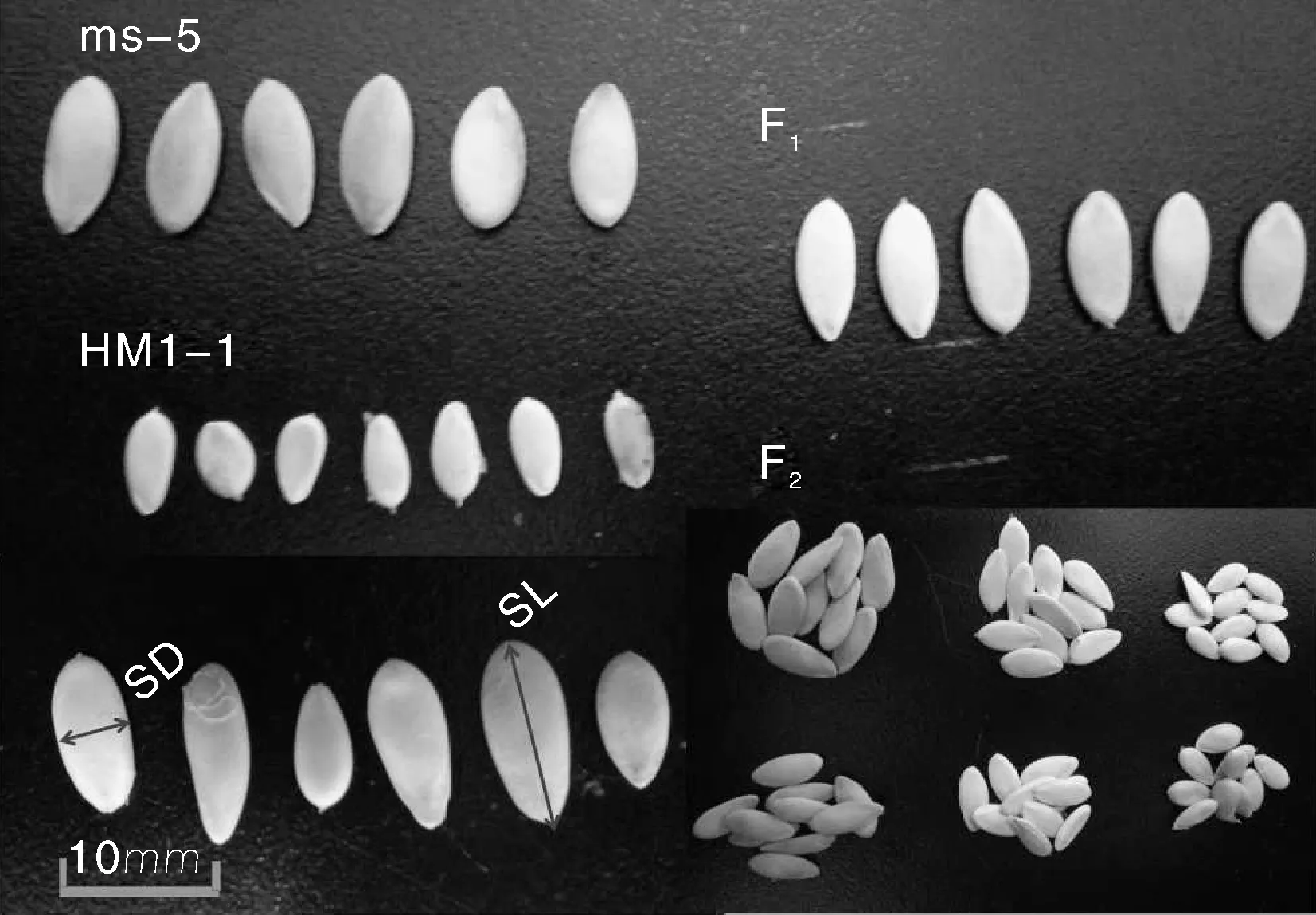
图1 甜瓜亲本、F1和F2代种子的表型Fig.1 Seed performance of parental lines, F1 and F2 generation in melon
表1甜瓜亲本及杂交后代群体种子相关性状表型
Table1Seeds traits of parental lines and hybrids in melon
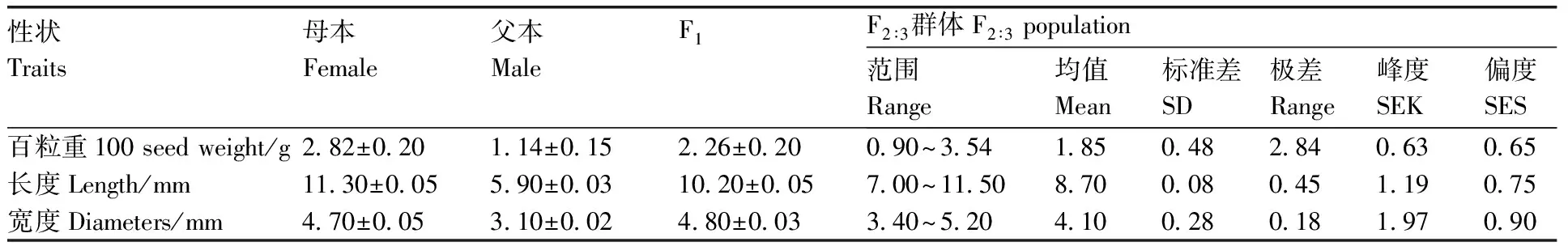
性状Traits母本Female父本MaleF1F2∶3群体F2∶3 population范围Range均值Mean标准差SD极差Range峰度SEK偏度SES百粒重100 seed weight/g2.82±0.201.14±0.152.26±0.200.90~3.541.850.482.840.630.65长度Length/mm11.30±0.055.90±0.0310.20±0.057.00~11.508.700.080.451.190.75宽度Diameters/mm4.70±0.053.10±0.024.80±0.033.40~5.204.100.280.181.970.90
SD,标准差;SEK,峰度;SES,偏度。
SD, Standard deviation; SEK, Kurtosis; SES, Skewness.
群体分布结果表明,甜瓜F2代种子百粒重、长度及宽度呈单峰正态分布(图2),甜瓜种子在这3个性状上连续变异,变异幅度较大。
2.2.2 最优遗传模型
使用主-多基因数量性状遗传分析软件对甜瓜F2群体种子百粒重、长度及宽度进行遗传模型分析,结果表明,与甜瓜种子长度相关的遗传模型11个,其中1对主基因(A)模型5个,2对主基因(B)模型6个。与甜瓜种子宽度相关的遗传模型1个,为1对主基因遗传模型;与种子百粒重相关的遗传模型11个,其中,A模型5个,B模型6个。
表2甜瓜F2代种子性状相关性
Table2Correlation of seed traits in F2generation of melon
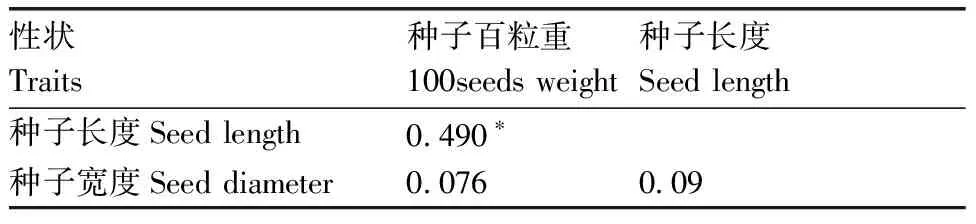
性状Traits种子百粒重100seeds weight种子长度Seed length种子长度Seed length0.490∗种子宽度Seed diameter0.0760.09
*表示显著相关(P<0.05)。
* meant significant correlated at 0.05 level.
对甜瓜种子相关的遗传模型进行分析,根据AIC值最小准则,选取AIC值最小及与最小AIC值比较接近的遗传模型作为备选最适模型。与甜瓜种子长度相关的11个遗传模型中,B-1模型的AIC值最小,为-268.74,A-0、A-2、B-6模型作为备选模型。与种子百粒重相关的11个遗传模型中,A-1模型的AIC值最小,为271.30,A-0、A-4、B-6模型作为备选模型。选出最适模型后进行适合性检验,选择达到显著水平较少的统计量模型为最优模型。
甜瓜种子百粒重的模型适合性检验结果(表3)表明,达到显著水平的统计量A-1模型为2个,A-4模型为2个,B-6模型为3个。因此,选择A-1模型为甜瓜种子百粒重最优模型,表明甜瓜种子百粒重为1对基因控制的数量遗传性状,且控制基因为加性-显性模型。甜瓜种子长度的模型适应性检验结果(表3)表明,B-1、A-0、B-6、A-2模型显著水平的统计量均为3个,但B-1模型的AIC值最小。因此,选择B-1模型为甜瓜种子长度最优模型,表明甜瓜种子长度的性状为2个基因位点,受加性-显性多基因模型控制。甜瓜种子宽度的模型适应性检验结果(表3)表明,A-1模型达到显著水平的统计量为1个,表明甜瓜种子宽度受1对主基因控制,为加性-显性遗传模型。
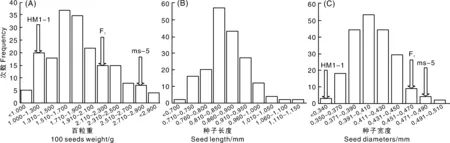
图2 甜瓜百粒重、种子长度及种子宽度F2群体分布图Fig.2 Frequency distribution in F2 population for 100-seed weight, seed length and seed diameter
2.2.3 遗传参数分析
根据已经确定的最优模型和IECM的估算方法,对甜瓜种子F2群体性状进行遗传参数测定。甜瓜种子F2群体平均百粒重为1.02 g,主基因加性-显性效应da(d)=1.02,主基因的遗传率为22.83%,说明甜瓜百粒重受到1对加性-显性多基因模型控制。甜瓜种子F2群体平均长度为m=1.20 mm,主基因加性-显性效应da(d)=0.34,主基因遗传率为78.87%;甜瓜种子F2群体平均宽度m=1.17 mm,主基因加性-显性效应da(d)=0.84,主基因遗传率为80.23%。
2.3 甜瓜种子性状的基因定位及QTL分析
在甜瓜亲本重测序的基础上,共开发出4 934个CAPS标记,经筛选获得159个多态性标记。利用F2群体构建了1个含有153个CAPS标记的遗传连锁图谱,该连锁图谱覆盖总长度为1 104.2 cM,标记间平均遗传距离为7.2 cM(图3)。对甜瓜种皮颜色开展初步定位,将白色基因(WT)定位在第5连锁群上,两端连锁标记为HD0520和HD0519。白色基因(WT)与连锁标记的遗传距离分别为13.3 cM和7.0 cM。连锁标记较远,但是两端标记处在同一个cM3.5_scaffold00003。WT基因候选区域长度786 kb,含有128个候选基因。
对种子百粒重、长度和宽度进行QTL分析,根据贡献率>10%、LOD值>2.8的标准,共检测到6个QTL,分布在第6、7、11和12连锁群上(表4)。其中,检测到2个种子百粒重QTL位点sw6.1和sw11.1,位于第6和第11连锁群,LOD分别为8.38和6.13,主基因贡献率均大于14.00%,加性效应分别为0.25和0.26。sw6.1位于标记E0615和E0618之间,sw11.1位于标记E1113和P1117之间。
检测到3个甜瓜种子长度QTL位点sl7.1、sl11.1和sl11.2。sl7.1分布在第7连锁群上,位于标记HD0713和E0716之间,LOD值为3.60,主基因贡献率为13.80%;sl11.1和sl11.2分布在第11连锁群上,分别位于标记E1110、E1112和XB1114、E1113之间,LOD值分别为40.30和32.60,主基因贡献率分别为17.49%和11.90%,加性效应相反,分别为0.25和-0.21。sl11.1位于cM3.5_scaffold00020上17.5 kb区域,该区域存在有18个候选基因;sl11.2位于 cM3.5_scaffold00039框架2035510至3638929 bp,有374个候选基因。
检测到1个控制甜瓜种子宽度的QTL位点,位于第2连锁群,LOD值为18.40,主基因贡献率为18.11%,加性效应值为-1.51,说明该基因起到负减效功能。sd2.1位于标记XB0207和E0219之间,处于cM3.5_scaffold 00004上,候选区域含有507个候选基因。
表3甜瓜F2群体种子质量、长度和宽度的适合性检验
Table3Suitability test for seed quality, length and width of melon F2population
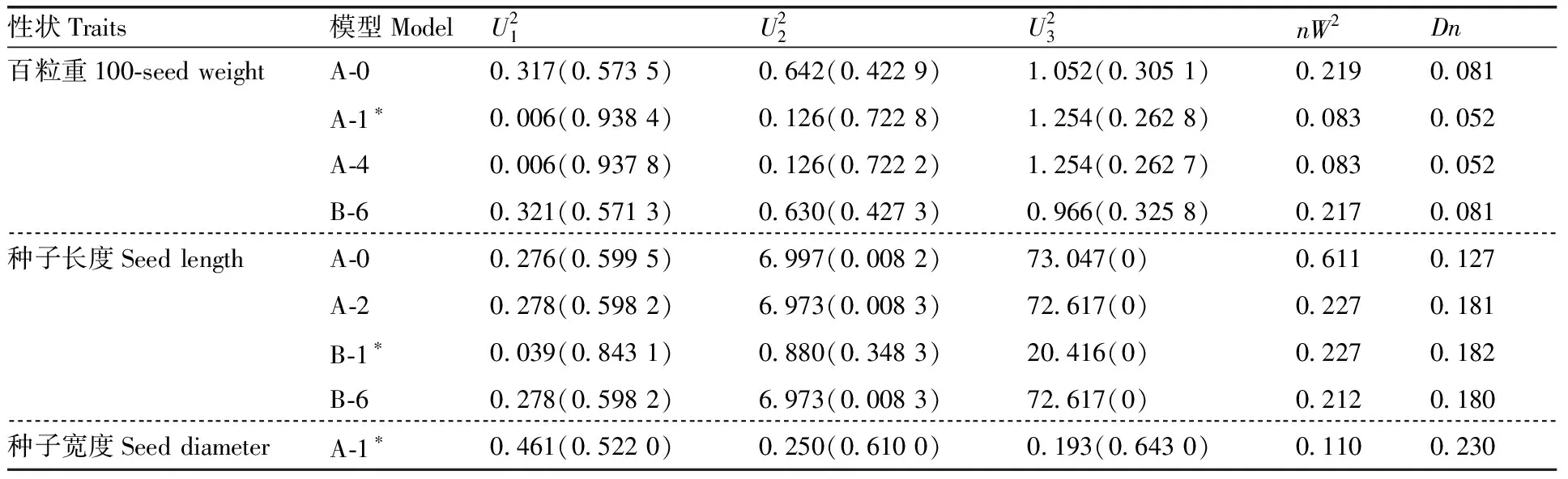
性状Traits模型ModelU21U22U23nW2Dn百粒重100-seed weightA-00.317(0.573 5)0.642(0.422 9)1.052(0.305 1)0.2190.081A-1∗0.006(0.938 4)0.126(0.722 8)1.254(0.262 8)0.0830.052A-40.006(0.937 8)0.126(0.722 2)1.254(0.262 7)0.0830.052B-60.321(0.571 3)0.630(0.427 3)0.966(0.325 8)0.2170.081种子长度Seed lengthA-00.276(0.599 5)6.997(0.008 2)73.047(0)0.6110.127A-20.278(0.598 2)6.973(0.008 3)72.617(0)0.2270.181B-1∗0.039(0.843 1)0.880(0.348 3)20.416(0)0.2270.182B-60.278(0.598 2)6.973(0.008 3)72.617(0)0.2120.180种子宽度Seed diameterA-1∗0.461(0.522 0)0.250(0.610 0)0.193(0.643 0)0.1100.230
*表示最优模型。
*meant the best fitted model.
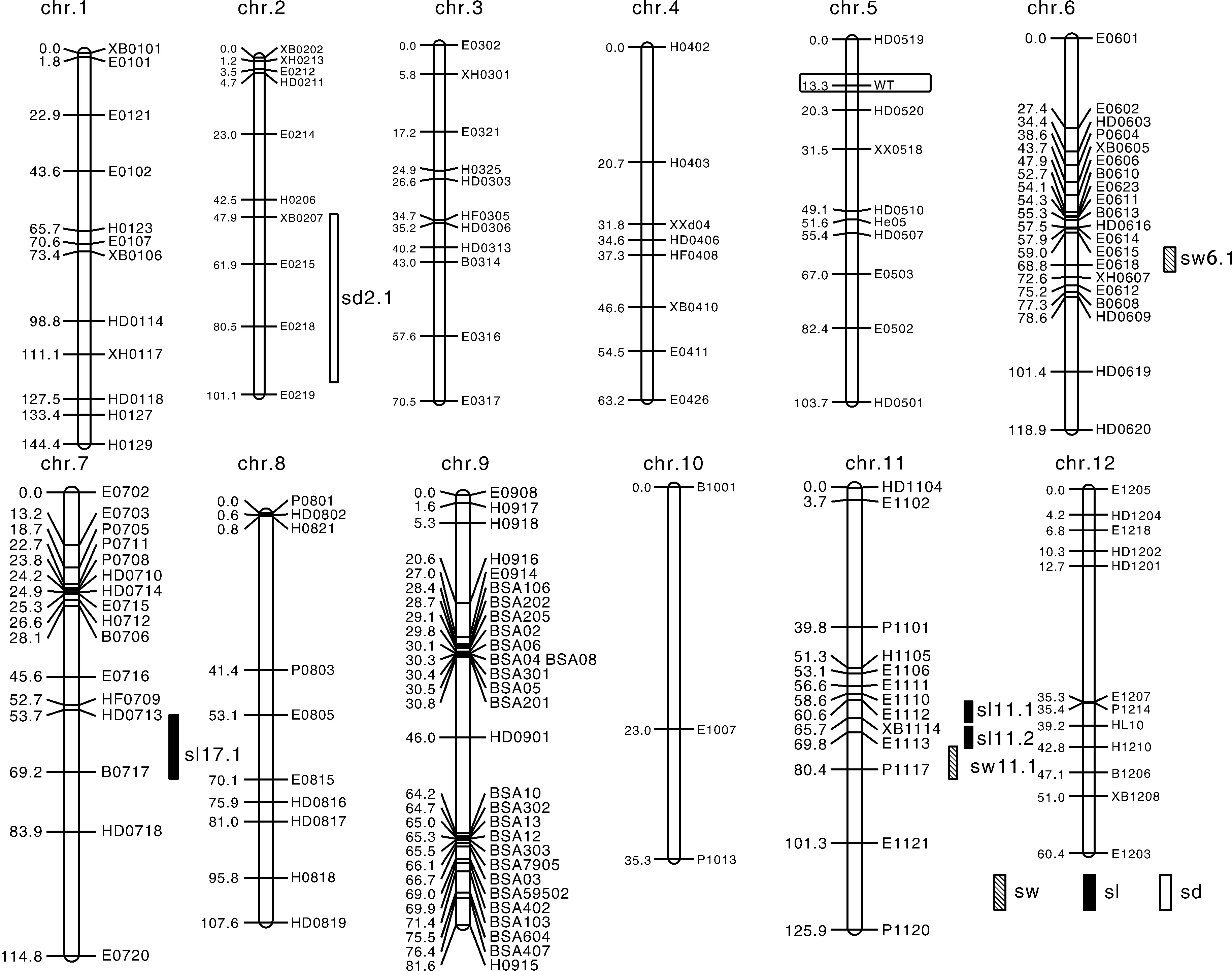
图3 甜瓜F2群体连锁图谱及种子性状QTL定位Fig.3 Genetic map construction and QTL mapping of seed related traits of F2 generation in melon
表4甜瓜F2群体种子性状QTL定位
Table4QTL analysis of melon seed traits in F2population
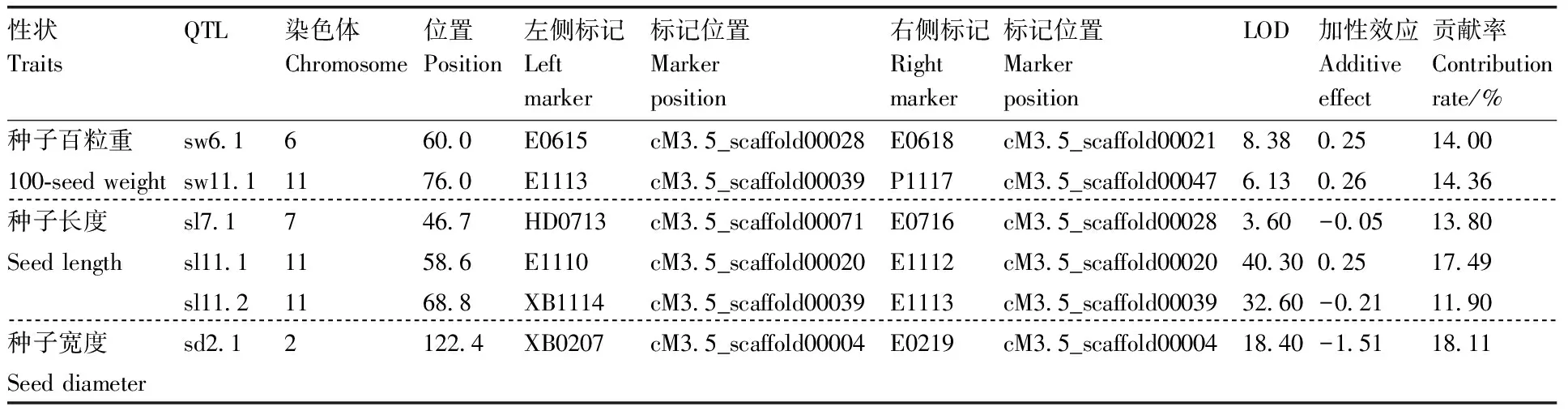
性状TraitsQTL染色体Chromosome位置Position左侧标记Leftmarker标记位置Markerposition右侧标记Rightmarker标记位置MarkerpositionLOD加性效应Additiveeffect贡献率Contributionrate/%种子百粒重sw6.1660.0E0615cM3.5_scaffold00028E0618cM3.5_scaffold000218.380.2514.00100-seed weightsw11.11176.0E1113cM3.5_scaffold00039P1117cM3.5_scaffold000476.130.2614.36种子长度sl7.1746.7HD0713cM3.5_scaffold00071E0716cM3.5_scaffold000283.60-0.0513.80Seed lengthsl11.11158.6E1110cM3.5_scaffold00020E1112cM3.5_scaffold0002040.300.2517.49sl11.21168.8XB1114cM3.5_scaffold00039E1113cM3.5_scaffold0003932.60-0.2111.90种子宽度sd2.12122.4XB0207cM3.5_scaffold00004E0219cM3.5_scaffold0000418.40-1.5118.11Seed diameter
3 结论与讨论
本研究利用F2∶3群体构建了一个含有153个CAPS标记的遗传连锁图谱,该连锁图谱覆盖总长度为1 104.2 cM,标记间平均遗传距离为7.2 cM。对甜瓜种皮颜色开展初步定位,将控制甜瓜种皮颜色的白色基因(WT)定位在第5连锁群上。对种子百粒重、种子长度及宽度进行了QTL分析,共检测到6个QTL;甜瓜种子百粒重QTL位点位于第6和第11连锁群,甜瓜种子长度QTL分布在第7和第11连锁群上;甜瓜种子宽度QTL位点位于第2连锁群。3个性状贡献率为11.90%~18.11%。本研究结果为甜瓜种子相关性状的精细定位与候选基因分离鉴定提供了理论依据。
其他作物种皮颜色的研究较甜瓜深入。尚建立等[13]最早对西瓜种皮颜色进行了研究,认为种皮颜色主要由3个基因控制。迟莹莹等[14]对西瓜种皮颜色相关的QTL位点进行分析,结果显示SCC8.3、SCC8.4贡献率均大于60%,位于第8染色体上。Miao等[15]利用六世代群体检测到4个与芝麻种皮颜色相关的QTL位点,表明芝麻种皮颜色由多个主效基因控制。本研究认为甜瓜种子种皮颜色为质量性状,由1对基因控制,白色对黄色呈显性,这与刘文革[16]编译的甜瓜基因目录中指出的控制白色种皮基因(WT)的研究结果一致。
前人研究结果表明,种子大小性状属于由多基因控制的质量性状,但将QTL定位到与之相对应的染色体上的报道相对较少[17-18]。种子百粒重是衡量种子饱满程度的重要标志之一,其对植株的形态建成、苗期发育具有重要意义[19-21]。周慧文等[3]利用CAPS标记在F2代群体中进行QTL分析,结果表明,西瓜种子大小性状相关的候选基因在6号染色体。迟莹莹等[14]检测到西瓜种子百粒重相关QTL位点2个,分别位于6、9号染色体。前人研究认为,瓜类种子形态如种子长度、宽度或大小一般受多基因控制,为数量性状[7-8]。王贤磊等[6]研究表明,控制甜瓜种子相关性状的QTL主要集中在C5连锁群标记NCA-N73C,sl5.1、sw5.1和swt5.1分别控制甜瓜的种子长度、宽度和千粒重,分别可解释表型变异的17%、19%和23%。本研究结果与此相似,但是无法整合2个研究结果,推测甜瓜种子长度在F2群体中由多基因作用控制,加性效应强于显性效应[22]。本研究结合基因组重测序,将控制甜瓜种子相关性状的QTL定位到染色体,并找到了其候选区域所在的染色体骨架及分布区域。
