燕麦镰孢菌环介导等温扩增(LAMP)检测方法的建立与应用
2018-09-19漆永红曹素芳李雪萍李敏权
漆永红, 曹素芳, 李雪萍, 李敏权*
(1.甘肃省农业科学院植物保护研究所, 甘肃 兰州 730070; 2.甘肃省农业科学院林果花卉研究所, 甘肃 兰州 730070;3.甘肃农业大学草业学院, 甘肃 兰州 730070)
青稞(Hordeumvulgare‘nudum’)茎基腐病是青稞苗期和成株期生长中的一种主要病害之一。苗期田间地上症状主要表现为,有明显的发病中心、植株长势弱、不同程度发黄或萎蔫,严重时会出现缺埂断垄、秃斑和整株死亡,根及茎基部变褐缢缩或腐烂等;成株期植株感染茎基腐病后表现为穗白、粒瘪、茎杆发褐或黑红、根及茎基部缢缩发干或腐烂等[1]。该病害病原菌主要有燕麦镰孢菌(Fusariumavenaceum)、木贼镰孢菌(Fusariumequiseti)、锐顶镰孢菌(Fusariumacuminatum)、柔毛镰孢菌(Fusariumflocciferum)和Fusariumlangsethiae等,其中燕麦镰孢菌为优势病原菌[1]。青稞茎基腐病田间症状表现多样,其症状常因环境条件、发病阶段、寄主与品种及生育时期的不同而呈现较大变化。当田间症状不典型或诊断者经验不足时,仅依据田间病害症状有时不易准确判别。因此,建立快速、准确检测青稞茎基腐病菌的方法对及时有效的控制该病害有重要的意义。
环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)是Mori等[2]研发的一种新型核酸扩增方法,针对靶基因的6个区域设计4条特异引物,在链置换DNA酶(Bst DNA polymerase)作用下,60~65℃恒温扩增,30~80 min能够将少量拷贝数的目的基因扩增至109个[3]。LAMP反应产物不仅可以通过浊度仪、real-time PCR仪以及凝胶电泳仪进行检测,还可以通过SYBR Green I、钙黄绿素和羟基萘酚蓝等[4-5]染色后用肉眼观察颜色变化来判断。LAMP检测具有操作简单、特异性强、灵敏度高、产物易检测等特点,广泛应用于真菌、细菌、病毒、线虫等病原微生物的检测[6-12],已成功建立了假禾谷镰孢菌[13]、大丽轮枝菌[14]、番石榴焦腐病[15]等检测技术,关于青稞茎基腐病燕麦镰孢菌LAMP检测方法未见报道。因此,本试验以燕麦镰孢菌为目标菌,建立以荧光染料SYBR Green I为指示剂的LAMP检测技术用于青稞茎基腐病菌的快速检测,为燕麦镰孢菌的检测及其青稞茎基腐病的诊断提供一种新的技术。
1 材料与方法
1.1 供试材料
青稞茎基腐病病株(图1)采自甘肃省甘南州临潭县,同时采集发病根际周围土样,室内分离病原菌,保存于本研究室。

图1 青稞茎基腐病Fig.1 Naked barley crown rot disease
主要试剂:Bst2.0 DNA聚合酶、荧光染料SYBR Green I、MgSO4、dNTP等,购自天根生物科技有限公司。
1.2 菌株培养和基因组DNA提取
菌株用常规的马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,25℃培养。基因组DNA提取采用E. Z. N. ATM. HP Fungal DNA Kit试剂盒(OMEGA Bio-tek)的具体步骤进行。
1.3 病原菌ITS序列的扩增及LAMP引物的设计
对青稞茎基腐病菌ITS序列进行扩增(94℃预变性5 min,94℃变性30 s,58℃退火45 s,72℃延伸80 s,35个循环;72℃延伸7 min,4℃保存)、PCR产物用AxyPrep DNA凝胶回收试剂盒回收、测序(北京天一辉远生物科技有限公司),获得其病菌燕麦镰孢菌的ITS序列。应用LAMP设计软件primer software PrimerExplorer V4(http://primerexplorer.jp/elamp4.0.0/index.Html;Eiken Chemical Co.,Japan)进行引物设计,包括2条外引物F3和B3,2条内引物FIP、BIP(表1)。
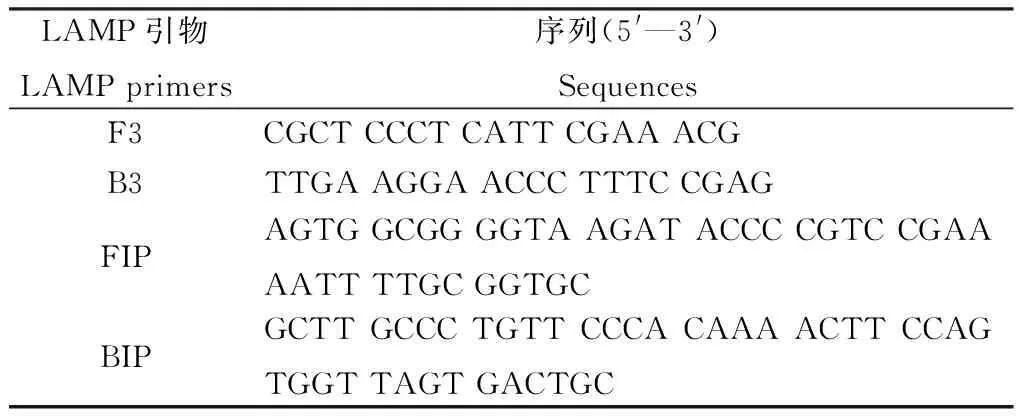
表1 设计的LAMP引物序列Table 1 Necleotide sequences of LAMP primers
1.4 LAMP反应体系的建立
在60~65℃范围内对反应温度进行梯度实验,反应时间1 h,以确定LAMP引物的最佳反应温度。优化LAMP反应体系:10×Isothermal Amplification Buffe (1~3 μL),100 m M MgSO4(0.5~2) μL,FIP Primer (0.5~1.5) μL,BIP Primer (0.5~1.5) μL,F3 Primer (0.5~1.5) μL,B3 Primer (0.5~1.5) μL,10 mM dNTP (2.0~4.0) μL,模板DNA (2.0~4.0) μL,8 000 U·mL-1的Bst2.0 DNA聚合酶(0.5~1.5) μL,加ddH2O (8.0~11.0) μL至总25 μL体系。试验重复3次。
1.5 扩增结果判断方法
反应结束后取3 μL产物,用2%琼脂糖凝胶电泳检测扩增产物,若出现连续阶梯状条带,则判定为阳性;未出现条带,则判定为阴性。同时加入0.5 μL荧光染料SYBR Green I,通过肉眼观察LAMP反应液是否发生颜色变化来判断结果,阳性反应为黄绿色,阴性反应为橘色。
1.6 燕麦镰孢菌LAMP检测体系的特异性验证
选择7个不同地区来源(表2)的燕麦镰孢菌菌株DNA作为模板,同时以ddH2O替代目标菌的DNA模板为阴性对照,以燕麦镰孢菌相近种尖孢镰孢菌(Fusariumoxysporium)和其他3个非镰孢菌(Phytophthorainfestans、Botrytiscinerea、Rhizoctoniasolani)的基因组DNA为模板作为对照,进行LAMP反应,观察反应管颜色变化和2%琼脂糖凝胶电泳是否出现阶梯状条带来判定结果,试验重复3次。

表2 青稞茎基腐病燕麦镰孢菌菌株及其来源Table 2 Fusarium avenaceum causing naked barley crown rot disease and their locality
1.7 燕麦镰孢菌LAMP检测体系的灵敏度验证
采用10倍浓度系列稀释法将提取的青稞茎基腐病燕麦镰孢菌DNA进行梯度稀释,使其质量浓度梯度依次为100 ng·μL-1、10 ng·μL-1、1 ng·μL-1、100 pg·μL-1、10 pg·μL-1,分别取2 μL作为模板进行LAMP反应,反应结束后观察反应管颜色变化和2%琼脂糖凝胶电泳是否出现阶梯状条带来判定结果。试验重复3次。
1.8 田间发病组织中燕麦镰孢菌的检测
供试24份青稞茎基腐病疑似病害样本采自甘肃省甘南州卓尼县和临潭县,每份样品取200 mg病组织,按照E. Z. N. ATM. HP Fungal DNA Kit试剂盒说明书提取发病组织DNA,将其作为模板进行LAMP扩增,以燕麦镰孢菌纯DNA作为阳性对照,灭菌水作为阴性对照。
1.9 土壤中燕麦镰孢菌检测的灵敏度
在燕麦镰孢菌平板中加5 mL无菌水,轻轻刮下镰孢菌的孢子,制备孢子悬浮液。取每份不含燕麦镰孢菌的土样(该土样经燕麦镰孢菌LAMP检测呈阴性) 1 g,放入2 mL的EP管中,分别添加不同数量的孢子(40 000、4 000、400、40、4个)。按照E. Z. N. ATM. HP Fungal DNA Kit提取试剂盒说明书提取土壤样品总DNA,将其作为模板进行LAMP扩增,并以燕麦镰孢菌纯DNA作为阳性对照,灭菌水作为阴性对照。
2 结果与分析
2.1 LAMP反应体系的建立
优化后用于检测青稞茎基腐病燕麦镰孢菌的LAMP最佳反应体系25 μL:10×Isothermal Amplification Buffe 2.5 μL,100 mM MgSO41.5 μL,FIP Primer 1 μL,BIP Primer 1 μL,F3 Primer 1 μL,B3 Primer 1 μL,10 mM dNTP 3.5 μL,模板DNA 2.5 μL,8 000 U·mL-1的Bst2.0 DNA聚合酶1 μL,ddH2O 10 μL。通过反应温度进行优化,确定LAMP引物最佳反应温度为65℃。反应程序为:65℃ 1 h,80℃ 20 min。肉眼观察燕麦镰孢菌LAMP反应液阳性为黄绿色,而对照产物为橘色,呈阴性(图2A)。2%琼脂糖凝胶电泳显示,阳性出现连续阶梯状条带,而阴性未出现条带(图2B)。

图2 燕麦镰孢菌LAMP反应体系的建立Fig.2 The detection of F. avenaceum by LAMP注:(A)LAMP反应体系颜色变化;(B)2%琼脂糖凝胶电泳(1:燕麦镰孢菌;2:阴性对照)Note:(A) The specificity of LAMP for F. avenaceum was detected by SYBR Green I;(B) 2.0% agarose gel electrophoresis. Lane M:DL 2 000 DNA marker;Lane 1:F. avenaceum;Lane 2:Negative control.
2.2 特异性检测
7个不同地理来源的青稞茎基腐病燕麦镰孢菌LAMP检测均显示黄绿色,而阴性对照(CK)和其它 4个病原菌LAMP检测均显示橘色(图3A)。用2%琼脂糖凝胶电泳检测扩增产物,阳性均出现梯度条带,阴性对照和其它4个病原菌则没有出现任何条带(图3B)。以上结果表明,该LAMP引物能够特异性的检测不同地理来源的青稞茎基腐病燕麦镰孢菌。
图3 燕麦镰孢菌LAMP特异性检测Fig.3 Specificity of LAMP detection for different F. avenaceum strains
2.3 灵敏度验证
以10 pg为模板时,反应产物仍然可显示黄绿色(图4A),说明该LAMP反应体系可以检测到10 pg的燕麦镰孢菌DNA。2.0%琼脂糖凝胶电泳检测结果显示,100 ng~10 pg模板DNA均可出现梯度条带,而对照ddH2O模板未出现条带(图4B)。
图4 燕麦镰孢菌LAMP灵敏度检测Fig.4 Sensitivity of LAMP assay to detect serially diluted genomic DNA from 100 ng to 10 pg with F. avenaceum
2.4 田间发病组织中燕麦镰孢菌的检测
20份甘肃省甘南州卓尼县和临潭县青稞茎基腐病疑似病害样本提取的DNA检测发现,13份为阳性,其中卓尼县5份(图5),临潭县8份(图6)。同时对阳性的样本进行组织分离,分离获得的菌株经形态学观察和ITS测序鉴定为燕麦镰孢菌。以上结果表明,该技术能够排除寄主植物及其他非目标菌的干扰,快速、准确地从青稞发病组织中检测出燕麦镰孢菌。LAMP检测技术用于燕麦镰孢菌的检测和青稞茎基腐病的快速诊断。

图5 甘肃省甘南州卓尼县青稞茎基腐病LAMP检测Fig.5 LAMP assay for diseased naked barley from Zhuoni county注:1~10:发病样品;11:阳性对照;12:阴性对照,下同Note:Tuber 1-10:Diseased naked barley samples;Tuber 11:Positive control;Tuber 12:Negative control,the same as below

图6 甘肃省甘南州临潭县青稞茎基腐病LAMP检测Fig.6 LAMP assay for diseased naked barley from Lintan county
2.5 土壤中燕麦镰孢菌的检测灵敏度
图7表明,1号阳性对照,2~5号燕麦镰孢菌40 000、4 000、400、40个孢子悬浮液LAMP检测均呈黄绿色的阳性反应,表明LAMP技术在每克土壤中检测的灵敏度为40个燕麦镰孢菌孢子。5号燕麦镰孢菌4个孢子悬浮液LAMP检测呈橘色的阴性反应,表明LAMP检测对土壤中4个燕麦镰孢菌孢子悬浮液未检测到,6号阴性对照呈现橘色。本方法可用于土壤中携带燕麦镰孢菌的高灵敏度检测。

图7 土壤中燕麦镰孢菌的检测Fig.7 Sensitivity of the LAMP assay in soil containing different number of spores注:1号:阳性对照;2~6号:40 000、4 000、400、40、4个孢子悬浮液;7号:阴性对照Note:Tuber 1:Positive control;Tuber 2-6:Soil with different amount of spores 40 000,4 000,400,40 and 4,respectively;Tuber7:Negative control
3 讨论
随着分子生物学技术的不断发展,以ITS为靶标的普通PCR分子检测[16]、RAPD-PCR方法[17]、巢式PCR技术[18,19]、实时定量RT-PCR技术[20-21]、IGS-PCR[22]等用于不同病原菌的检测,但这些检测方法需要的检测时间较长,准确性和灵敏度偏低。本试验以荧光染料SYBR Green I为指示剂,首次建立了青稞茎基腐病燕麦镰孢菌LAMP快速检测方法,本方法的建立与应用为燕麦镰孢菌的检测及其青稞茎基腐病的诊断提供一种新的技术。
LAMP技术已成功用于尖孢镰孢菌[23]、木贼镰孢菌和禾谷镰孢菌[24]等多种植物病原菌的检测。纪睿等[25]利用LAMP技术检测雪松疫霉根腐病菌(Phytophthoralateralis),在灵敏度检测中,最低检测限为 100 pg·μL-1。张吉红等[26]采用LAMP建立了烟草环斑病毒检测法,60℃扩增60 min,整个检测过程约1.5 h。本试验首次利用LAMP技术进行了燕麦镰孢菌的检测。与PCR技术相比,本试验中LAMP检测技术具有以下优点:(1)引物特异性强。在LAMP体系中,4条引物特异性识别靶标基因的6个区域,而在PCR体系中只有2条引物识别2个区域。本试验应用LAMP设计软件设计4条引物,包括2条外引物F3、B3和2条内引物FIP、BIP,7个不同地理来源的青稞茎基腐病燕麦镰孢菌LAMP检测均呈黄绿色(阳性),2%琼脂糖凝胶电泳检测均出现梯度条带,而对照和其他病原菌均呈橘色(阴性),电泳检测没有条带。(2)检测灵敏度高。LAMP技术检测灵敏度比普通PCR技术高10~1000倍。本试验灵敏度验证结果表明,LAMP反应液检测灵敏度在DNA水平达到10 pg,2.0%琼脂糖凝胶电泳检测显示,100 ng~10 pg的模板DNA均出现梯度条带。(3)反应速度快。PCR一般需要3~6 h,本试验优化的LAMP反应体系最佳反应程序为65℃ 1 h,80℃ 20 min。(4)直接用肉眼观察结果。本试验LAMP技术在反应完成后加入荧光染料SYBR Green I,通过肉眼观察LAMP反应液是否发生颜色变化来判断结果,阳性反应为黄绿色,阴性反应为橘色。(5)准确性高。本试验中,扩增产物的阴阳性,加入荧光染料SYBR Green I颜色变化检测的结果和凝胶电泳是否出现梯度条带完全吻合。(6)不易污染。荧光染料SYBR Green I可以在LAMP反应前加入到反应液中,可以有效避免反应后开盖加入荧光染料造成的污染问题。
本试验LAMP技术对疑似病害样本提取的DNA进行检测,只需要提取青稞发病部位的总DNA就可以检测到燕麦镰孢菌的有无,该技术能够检测出青稞发病组织中的燕麦镰孢菌,排除了病害样本上含有多种微生物,手工不易分离纯化到目标菌的人为因素影响。另外,本试验LAMP技术在土壤中检测的灵敏度为每克土壤40个燕麦镰孢菌孢子,土壤检测灵敏度很高。与普通PCR相比,本试验在燕麦镰孢菌ITS特异序列基础上建立了青稞茎基腐病菌LAMP简便、灵敏、快速和准确的方法,为生产上青稞茎基腐病诊断和防治提供重要的实用价值。
本试验仅对引起青稞茎基腐病的优势病原菌燕麦镰孢菌进行了LAMP快速检测,然而在实际生产中,引起青稞茎基腐病的病原菌种类很多,为了全面、系统、准确检测青稞茎基腐病的病原菌,在今后的研究中应该建立多重病原菌LAMP快速分子检测技术。
4 结论
首次建立了青稞茎基腐病燕麦镰孢菌LAMP快速检测技术,最佳反应温度为65℃,LAMP反应液检测灵敏度在DNA水平达到10 pg·μL-1,土壤灵敏度检测为每克土壤40个燕麦镰孢菌孢子。本方法的建立与应用为燕麦镰孢菌的检测及其青稞茎基腐病的诊断提供了一种新技术。
