碱性电解水耦合酶提取茶渣蛋白工艺优化
2018-09-13谭晓妍孙君社宁慧娟裴海生曾文慧张秀清
谭晓妍,孙君社,宁慧娟,裴海生,曾文慧,胡 静,张秀清,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.北京农业部规划设计研究院,北京 100125)
中国拥有世界上最丰富的茶叶资源和庞大的茶叶消费市场,并且随着我国茶叶消费量的逐年增加以及茶叶产业初、深加工技术的不断发展,不可避免地产生大量茶渣[1-2],不仅造成资源的巨大浪费,也会对环境造成极大的污染,茶渣的处理成了一个急需解决的问题[3]。研究表明,茶渣中的蛋白质不仅具有营养保健作用,还具有清除体内超氧阴离子、降血脂、抗突变、预防心血管疾病和癌症的功效[4-6]。但茶渣蛋白基本为水不溶性蛋白,其结构复杂、提取较为困难。因此通过有效途径提取茶渣蛋白,提高茶渣蛋白提取率,从而提高茶叶的经济附加值以及实现茶渣副产物资源的综合利用具有重要意义[7]。
目前,茶渣蛋白提取方法多采用NaOH浸提法,同时辅以超声、微波及蛋白酶等复合提取[8-10]。但NaOH具有强腐蚀性,且该法存在提取率低、所得蛋白水溶性不强等缺点[11]。碱性电解水是电解水制备过程中阴极生成的含有NaOH等物质的碱性水,一直被作为电解水制备过程中的副产物,目前的相关研究较少。与传统的NaOH水溶液相比,强碱性电解水在制备过程中氧化还原电位(ORP)值可达-1000 mV以下,具有强还原性,可以防止铁水管中产生赤铁锈,使水的表面张力降低,从而提高水的洗涤能力。且其含有的活性成分性质不稳定,易逐渐恢复为普通水,因而不易对环境造成污染,较NaOH使用安全可靠。同时,电解水制取装置结构比较简单,仅需一个有隔膜的电解槽,在制取过程中无需大量的化学原料以及复杂的单元操作,与生产传统化学试剂相比成本低廉,有利于其在食品加工等各项事业中推广应用[12-14]。
本研究选用碱性电解水用于茶渣蛋白的提取,利用单因素实验对碱性电解水pH、提取温度、液固比、提取时间四个因素进行优化,确定各因素最佳水平,进行正交实验优化碱性电解水提取茶渣蛋白的最佳工艺。研究进一步添加碱性蛋白酶进行复合提取,有效提高蛋白质提取率,并优化了蛋白酶水解条件。
1 材料与方法
1.1 材料与仪器
龙井绿茶茶渣(粉碎过60目筛) 天津天士力公司;碱性电解水 实验室自制;碱性蛋白酶(1.0×105U/mL) 上海楷洋生物技术有限公司;总抗氧化能力(T-AOC)测定试剂盒 南京建成生物工程研究所;其他试剂 均为国产分析纯。
电解槽 为常规双槽隔膜式电解槽(自制),隔膜采用阳离子交换膜(异相膜,上海化工厂),极板为纯钛板(北京中北钛业有限公司),极板距离为14 cm;SPD50半自动凯氏定氮仪及SPT20红外高温消解炉 北京三品科创仪器有限公司;PB-10酸度计 德国Startorious公司;SHB-Ⅲ循环水式多样真空泵 郑州长城科工贸有限公司;BS200S电子天平 德国Startorious公司;Agilent1200高效液相色谱仪 美国Agilent公司;HH-S数显温控油浴锅 江苏金坛荣华仪器制造有限公司。
1.2 实验方法
1.2.1 茶渣组分分析
1.2.1.1 茶渣中蛋白含量的测定 采用国家标准方法,凯氏定氮法,GB5009.5-2010。
1.2.1.2 茶渣中木质素、纤维素、半纤维素含量测定 采用美国可再生能源实验室的两步酸性电解水水解法进行分析[15]。第一步:准确称取干燥后的茶渣样品0.300 g放入15 mL试管中,加入3.0 mL 72%的硫酸,漩涡混合,将试管放入30 ℃水浴锅中保持60 min,期间每隔15 min漩涡混合一次。第二步:将试管从水浴锅中取出,准确加入去离子水84 mL,将浓硫酸的浓度由72%稀释至4%,放入高压灭菌锅中120 ℃保持1 h。反应结束后,待液体冷却至室温,将液体在砂芯漏斗上抽真空进行过滤,滤渣烘干称重即为酸不溶性木质素含量,酸溶性木质素含量由两步酸水解的滤液在320 nm下的吸光度测得。将两步酸水解的滤液过0.22 μm滤膜,HPLC法测定其中木糖与葡萄糖含量,由此计算样品中纤维素、半纤维素含量。
1.2.1.3 茶渣中水分及干物质含量的测定 采用国家标准方法,105 ℃恒重法,GB5009.3-2010。
1.2.1.4 茶渣中灰分含量的测定 采用国家标准方法,GB5009.4-2010。
1.2.2 碱性电解水的制备 电解电压:25~35 V;电解电流:0.6 A(定时监测,手动调节变压器电压使其稳定在此值);电解质浓度:阳极0.1%(NaCl,w/v),阴极1%(NaCl,w/v);定时测定阴极室中碱性电解水的pH,达到所需pH时即可停止电解,收集电解水,密封保存在4 ℃冰箱备用。
1.2.3 碱性电解水提取茶渣蛋白单因素实验
1.2.3.1 碱性电解水pH对茶渣蛋白提取率的影响 取2 g茶渣于管式反应器中,量取40 mL(液固比20∶1 mL/g)pH分别为10、10.5、11、11.5、12、12.5的碱性电解水至管中,振荡混匀,封上管盖,放入温度为120 ℃的油浴锅中反应20 min,检测不同条件下茶渣蛋白的提取率。
1.2.3.2 提取温度对茶渣蛋白提取率的影响 称取2 g干燥茶渣于管式反应器中,量取40 mL(液固比为20∶1 mL/g)pH为12.5的碱性电解水加入管式反应器,振荡混匀,封上管盖,放入油浴锅中,处理温度为90、100、110、120、130 ℃,提取时间为20 min,检测不同条件下茶渣蛋白的提取率。
1.2.3.3 液固比对茶渣蛋白提取率的影响 称取2 g干燥茶渣于管式反应器中,按液固比分别为10∶1、15∶1、20∶1、25∶1、30∶1、35∶1、40∶1 mL/g的添加量,加入pH为12.5的碱性电解水至管式反应器中,振荡摇匀,封上管盖,提取温度和时间分别为120 ℃、20 min,检测不同条件下茶渣蛋白的提取率。
1.2.3.4 提取时间对茶渣蛋白提取率的影响 取2 g干燥茶渣于管式反应器中,量取80 mL(液固比为40∶1 mL/g)pH12.5的碱性电解水至反应器中,振荡混匀,封上管盖,放入温度为120 ℃的油浴锅中,提取时间分别为10、20、30、40、50、60 min,检测不同条件下茶渣蛋白的提取率。
1.2.4 正交实验确定最佳碱性电解水提取工艺 在单因素优化结果的基础上,选取合适因素及水平进行L9(34)正交实验,如表1,以茶渣蛋白提取率为指标,优化预处理工艺条件,得到最优参数组合。
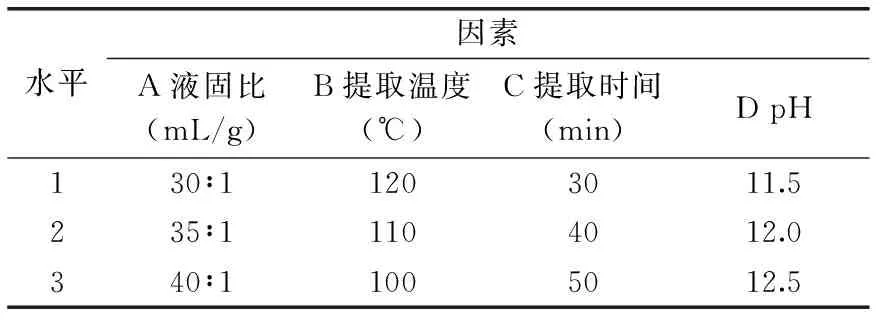
表1 正交实验因素与水平表
1.2.5 茶渣蛋白初提液蛋白酶酶解条件优化 经碱性电解水优化工艺提取后的茶渣初提液,加入碱性蛋白酶进一步提取茶渣蛋白。采用单因素实验优化碱性蛋白酶对茶渣初提液蛋白提取率的影响。
1.2.5.1 酶解pH对茶渣蛋白提取率的影响 鉴于碱性蛋白酶酶活力只在碱性条件下较高,选定不同的酶解pH为7.0、7.5、8、8.5、9、9.5、10(用0.1 mol/L HCl或0.1 mol/L NaOH调节pH)。其他参数水平保持一致:酶解温度50 ℃,酶添加量1000 IU/g茶渣,酶解时间4 h。酶解反应在恒温水浴摇床中进行。酶解反应结束时,在100 ℃水浴锅中保持10 min达到灭酶的目的。
1.2.5.2 酶解时间对茶渣蛋白提取率的影响 设定不同酶解时间分别为2、4、16、32、64 h。其他参数水平保持一致:酶解温度50 ℃,酶解pH9,酶添加量1000 IU/g茶渣。酶解反应在恒温水浴摇床中进行。酶解反应结束时,在100 ℃水浴锅中保持10 min达到灭酶的目的。
1.2.5.3 酶添加量对茶渣蛋白提取率的影响 设定不同的酶添加量:500、1000、1500、2000、2500、3000 IU/g茶渣。其他参数水平保持一致:酶解温度50 ℃,酶解pH9.0,酶解时间32 h。酶解反应在恒温水浴摇床中进行。酶解反应结束时,在100 ℃水浴锅中保持10 min达到灭酶的目的。
1.2.5.4 酶解液总抗氧化能力测定 按照总抗氧化能力(T-AOC)测定试剂盒说明书检测。总抗氧化能力计算公式如下:
总抗氧化能力(单位/OD样品)=(测定OD值-对照OD值/0.01)+30×(反应液总量/取样量)×样品测试前稀释倍数
1.2.6 蛋白质提取率 蛋白质含量计算公式如下:
式中,V是处理液总体积,mL;C是盐酸标准滴定液的浓度,mol/L;6.25是氮换算为蛋白质的系数,一般食物为6.25;20是量取的处理液体积,mL;0.014是1.0 mL盐酸[c(HCl)=1.000 mol/L]标准滴定液相当的氮的质量,g;m是称取的茶渣质量,g;0.27是茶渣中蛋白质含量保留两位小数时的数值。
2 结果与分析
2.1 茶渣组分分析
首先对茶渣主要成分进行分析,结果如表2所示:蛋白质含量为27.78%,与其它研究报道相近,如张晓晖等[16]所报道的茶叶蛋白含量为25.1%;李娟等[17]报道了浙江安吉茶厂提供的茶叶加工废末中蛋白质含量为23.21%。由表2可知,茶渣中半纤维素、纤维素和木质素含量总和为49.05%,木质素含量较高,达到了30.72%。在植物细胞壁中,木质纤维素包裹着蛋白质,木质纤维素的存在限制了蛋白质的溶出,如何去除木质纤维素是提高茶渣蛋白提取率的有效方法之一[18-19]。已有研究报道表明,碱性电解水可有效去除生物质材料中的木质纤维素成分,能提高秸秆的酶解效率[20]。鉴于此,本研究选择碱性电解水提取茶渣蛋白,以期提高茶渣中碱溶性蛋白的提取率。

表2 茶渣的基本组成成分
2.2 碱性电解水提取茶渣蛋白工艺条件优化
2.2.1 电解水pH对茶渣蛋白提取率的影响 不同电解水pH下蛋白质提取率如图1。当pH在10~11.5之间时,蛋白质提取率无明显变化,均在20%左右;当pH>11.5时,随着pH的增加,茶渣蛋白提取率不断提高,在pH为12.5时,茶渣蛋白的提取率最高达到38%。而pH12.5是目前实验室制备的碱性电解水的极限。可见,茶渣蛋白在强碱性条件下更易被提取。原因可能是在强碱性电解水中(pH>11.5),木质纤维素更易被降解,从而有效提高了茶渣蛋白的溶出率[22]。同时,增强电解水强度也更利于破坏蛋白质分子的次级键(特别是氢键),使部分极性基团发生解离,进而增加茶渣蛋白的溶解性[7]。因此随着碱性电解水的pH升高,茶渣蛋白提取率逐渐升高,但由于pH12.5以上的碱性电解水制备比较困难,综合考虑,最佳的碱性电解水pH确定为12.5。
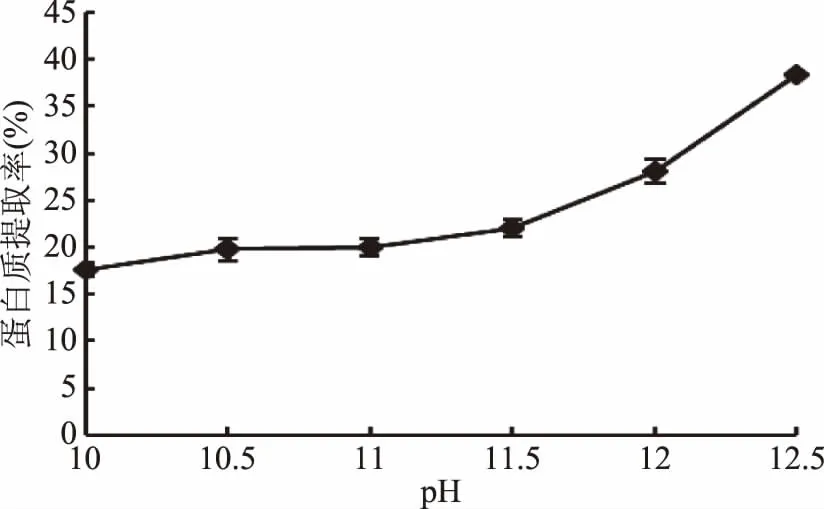
图1 提取pH对蛋白提取率的影响
2.2.2 提取温度对茶渣蛋白提取率的影响 不同提取温度下蛋白质提取率如图2。随着温度的升高,茶渣蛋白提取率逐渐提高,其原因可能是不同的提取温度对茶渣细胞壁的生物质分子结构破坏力不同,随着温度的升高,越来越多的半纤维素、纤维素以及木质素结构被破坏以致水解,细胞壁破裂,使得包裹其中的或细胞内的蛋白质等功能性成分被释放[21],蛋白质溶出量增加,从而起到提高茶渣蛋白提取率的作用。由图2可见,90~120 ℃之间处理时茶渣蛋白提取率的增长率高于120~130 ℃,同时考虑到过高温度需要更多能耗,且木质纤维素等糖类更易与蛋白发生美拉德反应而产生有毒有害物质(醛、酮等)[6],综合考虑后选择120 ℃为最佳提取温度。
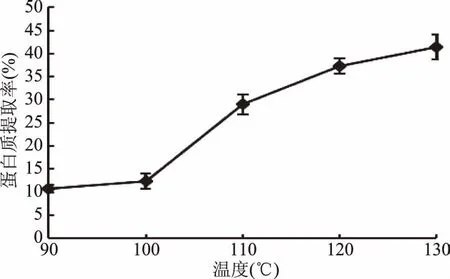
图2 提取温度对蛋白提取率的影响
2.2.3 液固比对茶渣蛋白提取率的影响 不同液固比下蛋白质提取率如图3。随着液固比的增大,茶渣蛋白提取率不断增大,在液固比为40∶1 mL/g时,茶渣蛋白的提取率达到33%。液固比是影响蛋白质提取率的一个重要因素,碱性电解水的添加量不仅直接影响其与蛋白质相互作用的几率,还影响互相作用的传质及传热速度,液固比较低时,虽利于蛋白质和碱性电解水的相互接触,但却增大了溶液的粘度,影响反应过程传质和传热,导致茶渣蛋白提取率降低;液固比较高时,可降低反应体系的粘度,加快传质传热,利于茶渣蛋白浸出[2]。但液固比过高又会降低蛋白样品浓度,增加提取难度,造成水资源和能源的浪费,综合考虑,最佳预处理液固比为40∶1 mL/g。
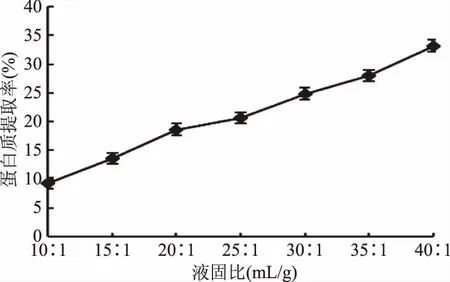
图3 液固比对蛋白提取率的影响
2.2.4 提取时间对茶渣蛋白提取率的影响 不同提取时间下蛋白质提取率如图4。随着反应时间的延长,茶渣蛋白质提取率逐渐升高。从10~30 min时,蛋白质提取率增长较快,30 min后继续反应蛋白质提取率缓慢增长,当提取时间为40 min时,茶渣蛋白提取率可达46%。茶渣中含有的粗蛋白80%以上均为谷蛋白[7],反应初期这些颗粒外层表面的谷蛋白和醇溶谷蛋白比较容易溶出,提取相对简单。但之后要溶出更多的蛋白质,溶剂必须进入颗粒内部,这样增加了提取的难度,所以时间的延长对蛋白质提取率的影响不大[2]。由于40 min后蛋白质提取率几乎不再增长,而且考虑到时间的延长直接影响着生产周期,会造成能耗增加。因此初步确定提取时间为40 min。
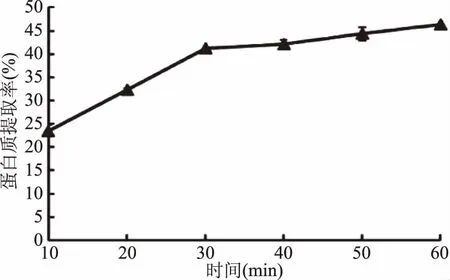
图4 提取时间对蛋白提取率的影响
2.2.5 正交优化碱性电解水处理工艺 由单因素实验可知,碱性电解水的pH、提取温度、液固比、提取时间四个因素对茶渣蛋白提取率有明显影响,在此基础上,对影响茶渣蛋白提取率的四个因素选择合适的水平,进行L9(34)的正交实验对提取条件进一步优化,以蛋白提取率为指标进行极差分析,正交实验结果及极差分析见表3,方差分析见表4。
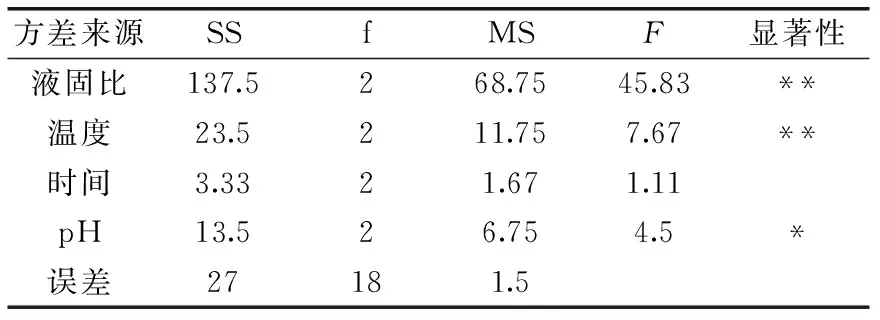
表4 方差分析表
由表4可知,提取温度、液固比对茶渣蛋白提取率有极显著作用(p<0.01),碱性电解水的pH对茶渣蛋白提取率有显著作用(p<0.05);采用直观分析法,比较极差分析表3中四因素的极差R值,液固比的极差R值为9.5、提取温度为3.84、提取时间为1.33、碱性电解水pH为2.87,由此可知液固比是影响蛋白质提取率的最主要因素,影响茶渣蛋白提取率的主次因素从大到小顺序依次为:液固比>提取温度>碱性电解水的pH>提取时间。根据极差分析结果,四因素的最优水平组合为A3B1C2D3,结合方差分析结果即采用碱性电解水pH为12.5,提取温度为120 ℃,液固比为40∶1 mL/g,提取时间为40 min。验证实验结果表明,在该最佳提取工艺条件下,得到茶渣蛋白提取率为48.3%。
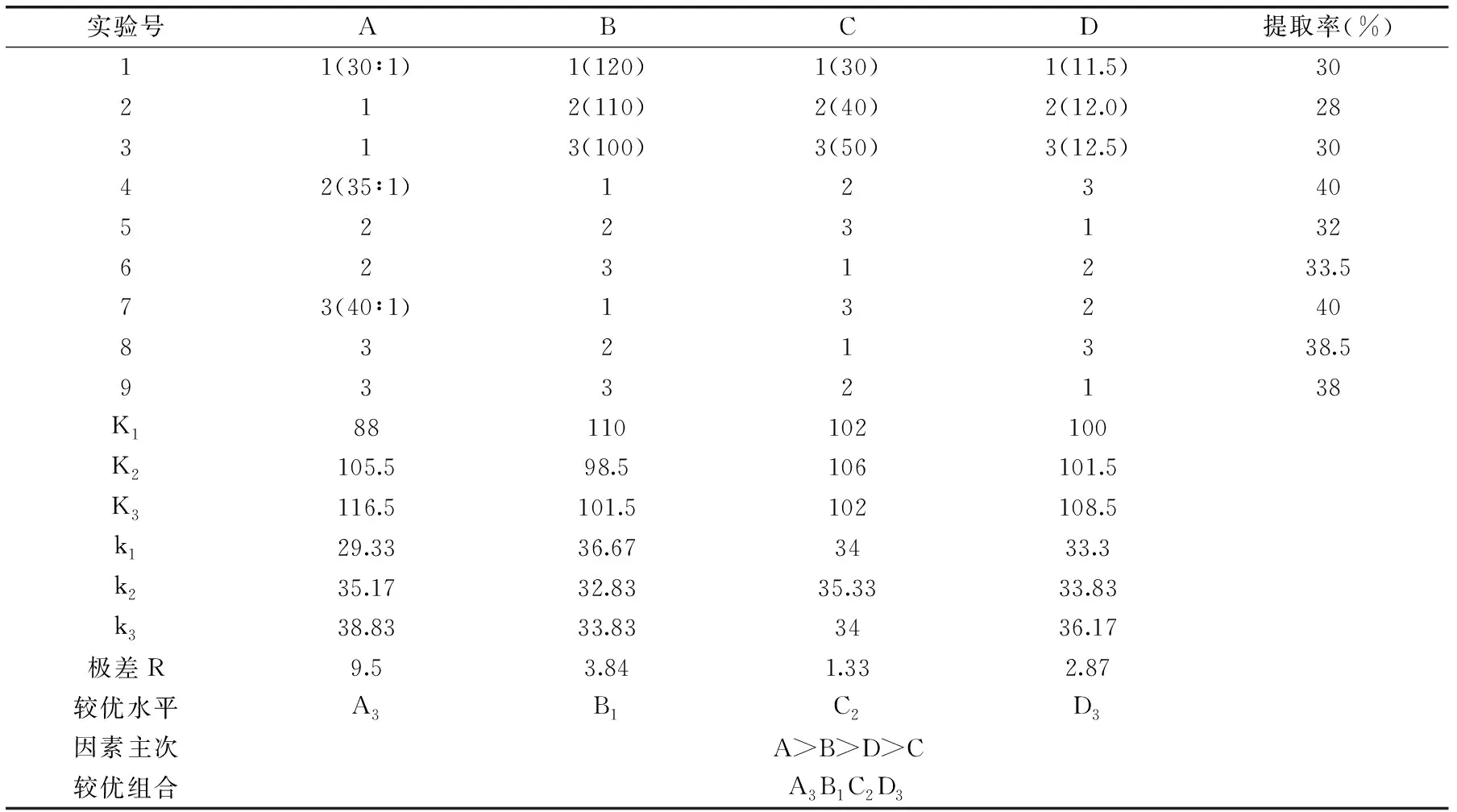
表3 正交实验结果和极差分析表
本研究直接利用碱性电解水提取茶渣蛋白,替代了传统的碱法提取。碱性电解水提取条件优化后,茶渣蛋白提取率最高达48%,略低于传统碱法提取的蛋白得率[7,16-17],但也高于部分报道中的蛋白提取率,如蔡志宁等[23]优化了茶渣蛋白碱法提取的工艺条件,优化后蛋白提取率为36.8%。经过电解的碱性还原水为6个或7个(H2O)的小分子水(自来水为14~16个),由于分子团小,体积小,渗透力强,所以容易进入细胞与细胞之间,导致碱性电解水的渗透力增强。自然界中的大分子团水被迫解离成小分子团水,由于不是自然产生,小分子团水必须还原成大分子团水,此时水分子与水分子在结合过程中快速运动,形成高溶解力,所以导致碱性电解水具有较高的溶解力[14]。而传统碱提是利用细胞在碱液中会吸水溶胀以致破裂,使细胞中的活性物质释放出来的原理提高提取率,若碱液浓度过高则会破坏物质结构。因此,碱性电解水提取法较传统碱提法温和、破坏力小,且碱性电解水提取可有效减少碱法提取引起的污染性问题,同时碱性电解水作为功能性电解水制备过程中的副产物,它的利用也增加了电解水的附加值。
2.3 茶渣蛋白初提液蛋白酶酶解条件优化
茶渣蛋白的酶法提取是近年来的热点,酶法提取不仅可以有效提高蛋白质的提取率,同时还能改善蛋白质的营养学特性[24]。本研究为进一步提高茶渣蛋白的提取率,尝试了在碱性电解水的初提液中继续添加碱性蛋白酶酶解的复合提取法,同时测定了酶解液的总抗氧化能力,以保证提取出的蛋白质为活性蛋白。
2.3.1 酶解pH对茶渣蛋白提取率和总抗氧化能力的影响 不同酶解pH下蛋白质提取率和总抗氧化能力如图5。结果表明,pH为7.0~9.0时,随着pH的增大,茶渣蛋白的提取率逐渐增高;当酶解pH达到9时,蛋白提取率最大(提取率为62%),此结果与邹小明[11]、李圆圆等[24]的研究结果相同;继续提高pH时,蛋白提取率略微降低,说明当pH为9时,碱性蛋白酶的酶活最高,酶对底物作用效果明显,这与碱性蛋白酶的最适pH相符(最适pH在9~11范围内),pH过高过低都会对蛋白酶活造成影响。因此,选定碱性蛋白酶酶解pH为9.0。此外,总抗氧化能力变化趋势与蛋白提取率一致,均在pH9时达到最高。
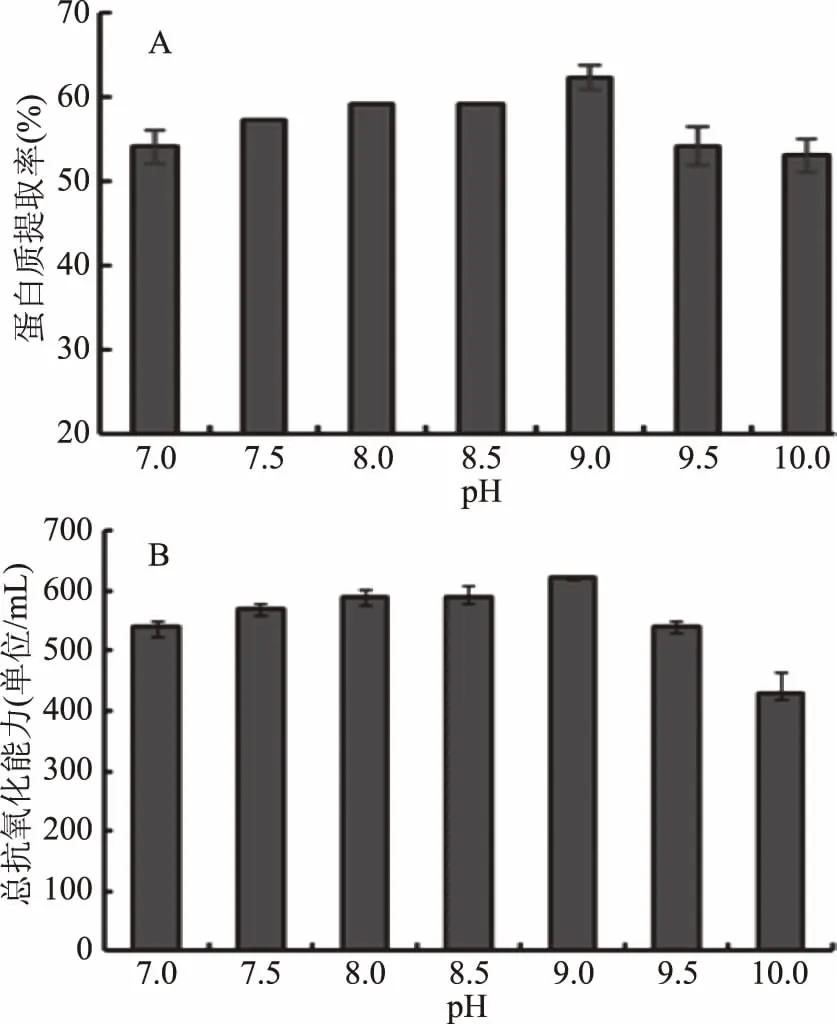
图5 酶解pH对蛋白提取率(A)和总抗氧化能力(B)的影响
2.3.2 酶解时间对茶渣蛋白提取率和总抗氧化能力的影响 不同酶解时间下蛋白质提取率和总抗氧化能力如图6。随着反应时间的延长,蛋白提取率逐渐提高,酶解时间达到32 h时,提取率最高(提取率为73%),但当酶解时间继续延长时,蛋白提取率变化趋于平缓。这是因为随着时间的延长,底物不断减少,酶解充分,因此确定最适酶解时间为32 h,且32 h后酶解液总抗氧化能力不再提高。
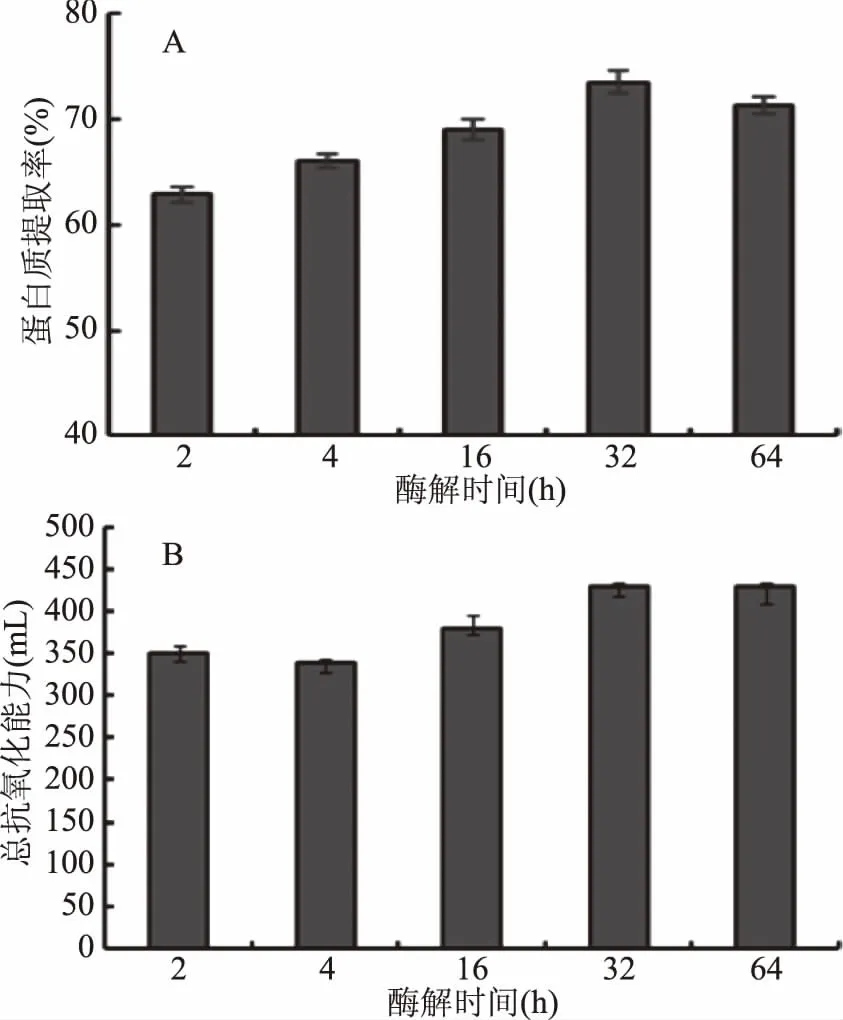
图6 酶解时间对蛋白提取率(A)和总抗氧化能力(B)的影响
2.3.3 酶添加量对茶渣蛋白提取率和总抗氧化能力的影响 不同酶添加量下蛋白质提取率和总抗氧化能力如图7。结果表明,随酶添加量的增长,蛋白质提取率逐渐提高,加酶量至2500 IU/g茶渣后提取率最高(蛋白提取率为83%),之后再增加酶使用量提取率增长缓慢。一般而言,当底物浓度一定,增加的酶量未使底物浓度饱和时,则酶/底物值越大,反应速度越大,蛋白质的水解率越大。但酶/底物值过大,可能导致酶自身相互水解,酶活力降低,水解度降低[25]。酶的过量使用还会大幅度增加生产成本,综合考虑后确定酶添加量为2500 IU/g茶渣,该添加量显著低于赵立娜等[25]水解茶渣蛋白时添加的蛋白酶量(6000 U/g茶渣)。同时,该加酶量下蛋白质的抗氧化活性较高,达到668单位/mL。
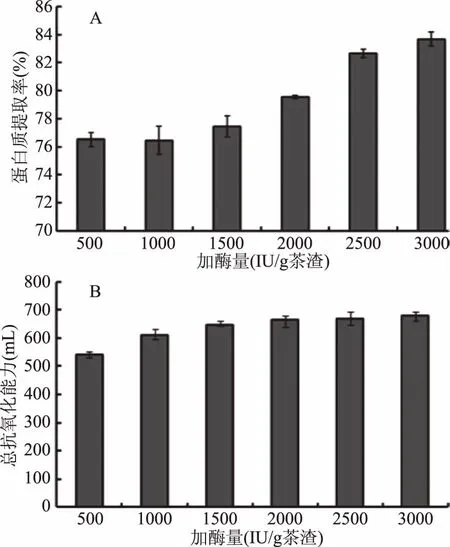
图7 加酶量对蛋白提取率(A)和总抗氧化能力(B)的影响
茶渣蛋白经过碱性电解水及酶两步提取后,蛋白提取率高达83%,较单一碱性电解水提取提高了34.7%,高于绝大多数已报导的研究结果[7,17,26]。邹小明等[11]同样采用复合法提取茶梗中的蛋白,用碱溶液初提后再添加蛋白酶进行提取,提取率达到81.83%,提取水平与本研究相当。同时,该工艺条件下提取出的蛋白质仍具有较高的总抗氧化能力,表明方法可行。基于本研究的结果,可进一步考虑结合其他处理技术,如超声辅助和微波辅助法,以期更加高效地提取茶渣蛋白。如陆晨等[8]采用超声波技术辅助碱法提取蛋白,提取条件优化后蛋白得率增高至86.5%;文静等[14]采用微波辅助碱法提取茶渣蛋白,最高提取率可达89.01%。但传统的氢氧化钠碱提法存在一定弊端,如设备腐蚀、环境污染和安全隐患,选择一种安全高效的新型处理方法具有重要意义。因此,碱性电解水以其易制备、无污染、安全性高的特点,在茶渣蛋白提取中具有显著优势。
3 结论
碱性电解水提取后再添加碱性蛋白酶提取茶渣蛋白的方法效果较好,优化后最佳工艺条件为:碱性电解水pH为12.5,提取温度120 ℃,液固比为40∶1 (mL/g),提取时间40 min,碱性蛋白酶酶解pH9.0,酶解时间32 h,酶添加量2500 IU/g茶渣。在该条件下,蛋白质提取率为83%,总抗氧化能力为668单位/mL。该复合提取法提取率高,且充分利用作为功能水制备过程中副产物的碱性电解水,为扩大再生产提供了良好的理论依据。
