桥本脑病的磁共振成像表现及其病理机制
2018-09-06王小宜廖伟华肖海清周高峰彭娴婧
杨 帅,王小宜,廖伟华,肖海清,周高峰,胡 平,彭娴婧
1中南大学 湘雅医院放射科,长沙 4100082长沙市第三医院放射科,长沙 410000
桥本脑病(Hashimoto’s encephalopathy,HE) 又称甲状腺毒性脑病,是一种十分罕见的与甲状腺疾病相关的自身免疫性脑病。1966 年由Brain等[1]首次进行报道,其发病率约为2.1/100000,以中年女性多见。目前HE的发病机制尚不清楚,其临床表现变化多样,发展至危重期可危及生命,Tang等[2]在研究中国桥本脑病病例后发现越早获得激素治疗,HE越有可能治愈。然而HE临床少见,表现多样且无特异性,病程可呈急性、亚急性、慢性及复发-缓解性,所以早期确诊率低,误诊率高,易误诊为脑梗死、病毒性脑炎、急性播散性脱髓鞘脑病等。虽然常规磁共振成像(magnetic resonance imaging,MRI)现已成为颅脑疾病诊断及鉴别诊断的重要方式,但文献报道中HE的常规MRI表现多无特异性,且早期诊断价值有限;HE的功能MRI表现报道较少,其对HE的诊断价值尚不明确,但以往的部分研究表明功能MRI能提示HE不同病理机制下的不同表现,且能发现一部分常规MRI中不能发现的早期改变,从而为诊断、鉴别诊断提供更全面、更早期的信息[3- 9]。本研究对中南大学湘雅医院7年来30例临床诊断为HE患者的颅脑磁共振成像表现及临床资料进行回顾性分析,总结HE患者的常规和功能MR的主要表现,旨在提高对HE的MR诊断及鉴别诊断水平。
对象和方法
对象回顾性收集中南大学湘雅医院2010年1月至2017年4月经临床诊断为HE患者共 30 例。所有病例均符合Graus等[10]2016 年提出的HE诊断标准:(1)表现为癫痫、肌阵挛、幻觉或卒中样发作的脑病;(2)亚临床或轻度的甲状腺疾病(通常为甲状腺功能低下);(3)头颅MRI正常或无特异性改变;(4)血清甲状腺抗体(甲状腺过氧化物酶抗体、甲状腺球蛋白抗体)阳性;(5)血清和脑脊液中无特异性神经元抗体;(6)排除其他可能的病因。所有患者均行常规MRI检查,包括T1加权成像(T1-weighed imaging,T1WI)、T2加权成像(T2-weighed imaging,T2WI)、液体衰减反转恢复序列(fluid-attenuated inversion recovery,FLAIR)(T2)。其中 15例患者另行增强,16例行弥散加权成像(diffusion-weighed imaging,DWI),8例行磁共振血管成像(magnetic resonance angiography,MRA),2例行氢质子波谱成像(1H magnetic resonance spectroscopy,1H MRS),1例同时行动脉自旋标记(arterial spin labeling,ASL)和弥散张量成像(diffusion tensor imaging,DTI)检查,7例进行随访复查、有连续的临床及影像资料。本回顾性研究获得中南大学湘雅医院伦理委员会批准。
影像检查方法采用美国GE公司3.0 T超导型磁共振扫描仪(Signa HDX;General Electric Healthcare,Milwaukee,WI,USA),8 通道头颈联合线圈。增强检查使用高压注射器经肘前静脉团注对比剂二乙烯五胺乙酸钆(钆喷酸葡胺,广州康臣药业有限公司),剂量 0.2 mmol/kg,注射速度 2 ml/s,对比剂团注结束后再注入等体积生理盐水冲洗导管。扫描前充分匀场,准确定位。所有受检者均无MRI检査禁忌证。患者平躺于检查床上,双耳佩戴耳罩降低噪音,海绵垫充分固定头部,使其保持静止。常规MRI检查包括横断位T1WI、T2WI、FLAIR(T2)和矢状位T1WI,其他MRI检查包括增强T1WI、MRA,功能成像包括DWI、1H MRS、ASL、DTI。横断位T1WI、T2WI、FLAIR(T2)、增强T1WI、DWI平行于前、后联合连线,从颅底扫描至颅顶;ASL和DTI平行于水平线,从颅底扫描至颅顶,矢状位T1WI平行于正中矢状位左右 15 层。DWI序列b=1000 s/mm2;MRA序列 层块数=3 次,层块层数=46 层,层块重叠层数=16 层。1H MRS 感兴趣容积为 20 mm×20 mm×20 mm。ASL序列分辨率=512,螺旋臂=8,标记后延迟时间=1.5 s。DTI序列共 35 个方向,其中前3个方向为b=0,后32个方向为扩张敏感梯度方向,b=0,b=1000 s/mm2,每个梯度方向连续扫描 50 个层面。常规及功能MRI序列其他主要参数见表1。
图像分析MRA原始图像行最大强度投影后进行评估。1H MRS感兴趣区均选取病灶区域,取对侧正常脑组织作为对比,获得谱线图及氮-乙酰天门冬氨酸/肌酸(N-acetylaspartate/creatine,NAA/Cr)、胆碱/肌酸(choline/creatine,Cho/Cr)值。经GE后处理工作站ADW 4.4 functool软件包处理,ASL获得脑血流图,DTI获得表观弥散系数(apparent diffusion coefficient,ADC)图及各项异性分数(fraction anisotropy,FA)图。DTI、ASL感兴趣区均选取病灶区域,取对侧正常脑组织作为对比,根据病变大小手工选取感兴趣区 3次,取测量值均值。30 例HE病灶评价均由两位神经影像学中级以上医生采取双盲法阅片,意见不一致时经过讨论并取得一致结论,观察病灶的分布、信号及功能影像表现。
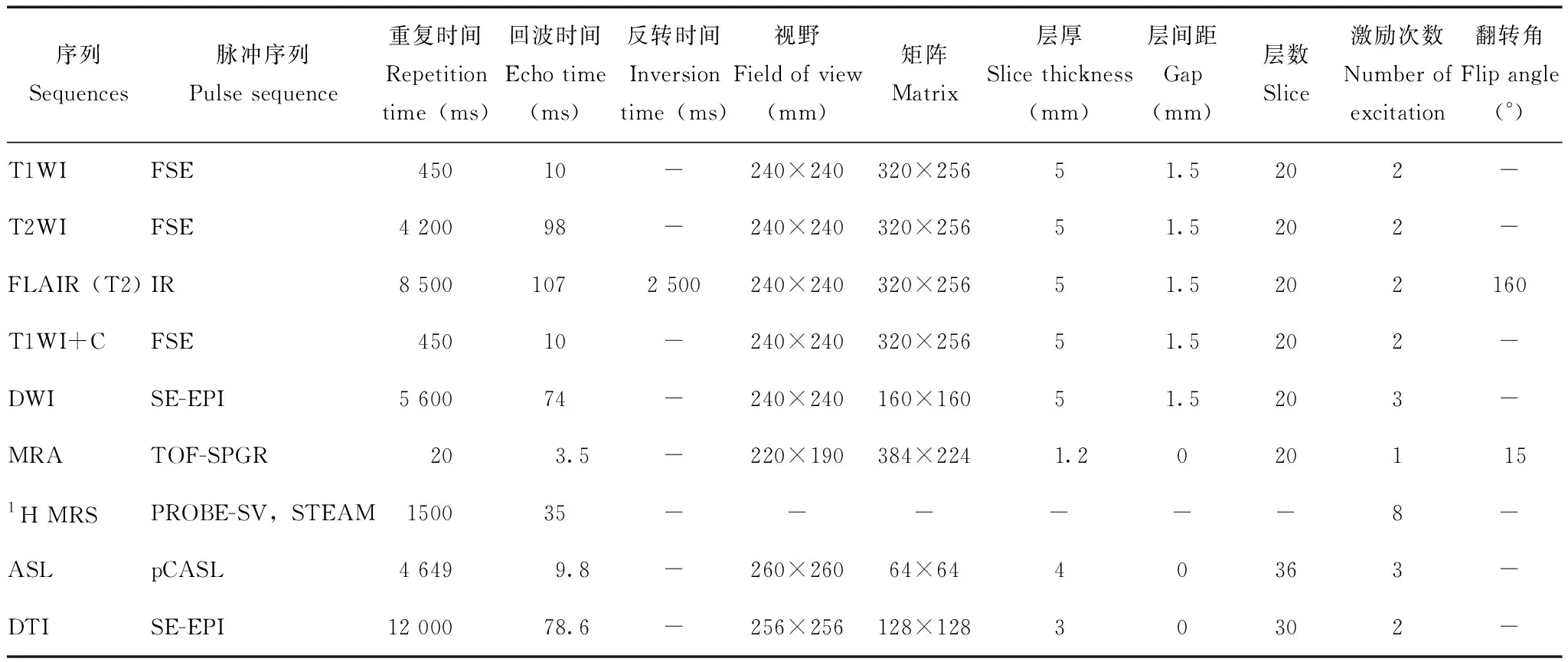
表 1 常规及功能MRI序列参数Table 1 Parameters of the routine and functional MRI sequences
MRI:磁共振成像;T1WI:T1加权成像;T2WI: T2加权成像;FLAIR(T2):液体衰减反转恢复序列(T2);T1WI+C:增强T1加权成像;DWI:弥散加权成像;MRA:磁共振血管成像;1H MRS:氢质子波谱成像;ASL:动脉自旋标记灌注成像;DTI:弥散张量成像;FSE:快速自旋回波;IR:反转恢复;SE-EPI:自旋-平面回波成像;TOF-SPGR:时间飞跃-扰相梯度回波;PROBE-SV:单体素氢质子波谱脑检查;STEAM:激励回波采集模式;pCASL:准连续动脉自旋标记;-:表示“无”
MRI: magnetic resonance imaging;T1WI:T1-weighed imaging;T2WI: T2-weighed imaging;FLAIR(T2):fluid-attenuated inversion recovery(T2);T1WI+C:contrast enhanced T1-weighed imaging;DWI:diffusion weighed imaging;MRA:magnetic resonance angiograph;1H MRS:1H magnetic resonance spectroscopy;ASL:arterial spin labeled perfusion imaging;DTI:diffusion tensor imaging;FSE:fast spin echo;IR:inversion recovery;SE-EPI:spin echo echo planar imaging;TOF-SPGR:time of flight-spoiled gradient recalled echo;PROBE-SV:proton brain exam-single voxel;STEAM:stimulated echo acquisition mode;pCASL:pseudo-continuous arterial spin labeling;-:means none
结 果
一般情况共纳入30 例患者,女性21例、男性9例,其中儿童(≤12 岁)6例,年龄2岁10个月至12岁,平均(8±3)岁,成人24例,年龄26~78岁,平均(56±8)岁。临床亚型:弥漫进展型13例,卒中样发作的血管炎类型17例。其中27例行促甲状腺激素(thyroid stimulating hormone,TSH)检查,TSH升高9例、减低4例、正常14例。30例患者均行甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)和甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb),TGAb升高27例、正常3例;TPOAb升高28例、正常2例。TGAb和TPOAb均异常(串联)25例(83.33%),TGAb和TPOAb其中一个异常(并联)30例(100%)。22例行甲状腺彩超,异常14例、正常8例。
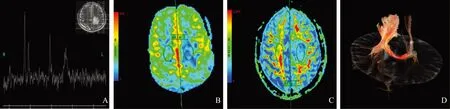
MR表现颅脑MRI检查正常者8 例(8/30)、异常者22 例(22/30);异常病例中,表现为脑小血管病样改变9 例(9/22),主要是多发腔隙灶、室旁及深部白质高信号、血管周围间隙扩大及脑萎缩改变;其他非特异性改变13 例(13/22),以大脑半球白质区(12/13)多发(11/13)病灶为主,仅1例(1/13)累及皮质,仅2例(2/13)单发。病灶为斑点状或小片状、局灶性或融合性的稍长或等T1信号,T2WI及FLAIR(T2)呈高信号,2例合并脑萎缩。15 例增强患者中1 例轻度强化、2 例脑膜强化、12 例病灶强化不明显。16 例行DWI的患者中,7 例异常,其中3 例急性发病,DWI呈高信号,ADC值减低,另外4 例亚急性或慢性发病,DWI呈高信号,ADC值轻度升高或升高。8例行MRA的患者中,5例正常、3例颅内动脉局限性狭窄。2例MRS,病变区NAA峰较对侧无病变区明显降低,Cho峰升高,出现乳酸峰或脂质峰(图1A、2F)。1 例同时行ASL和DTI的患者结果显示,病变区的脑血流量(cerebral blood flow,CBF)值较对侧无病变区减低;病变区各项异性分数FA值相对对侧无病变区下降,ADC值相对对侧无病变区升高,皮质脊髓束可见不同程度的缺损(图1B~1D)。
HE:桥本脑病
HE:Hashimoto’s encephalopathy
A.1H MRS示病灶区氮-乙酰天门冬氨酸峰明显降低,胆碱峰升高,出现乳酸峰或脂质峰;B. ASL获得脑血流量图(左侧圈表示病灶感兴趣区,右侧圈表示病灶感兴趣区镜像位置正常脑组织),病灶区脑血流量减低;C. DTI获得各项异性分数图(左侧圈表示病灶感兴趣区,右侧圈表示病灶感兴趣区镜像位置正常脑组织),病灶区异性分数值减低;D. DTI示病灶区皮质脊髓束不同程度的缺损
A.1H MRS shows N-acetylaspartate peak decreases,choline peak increases,lactate peak or lipid peak appears;B. ASL perfusion imaging gains cerebral blood flow(left circle shows the region of interest of the lesion,while right circle shows the mirroring region of interest of the normal brain parenchyma),the cerebral blood flow of the lesion decreases;C. DTI gains fraction anisotropy map(left circle shows the region of interest of the lesion,while right circle shows the mirroring region of interest of the normal brain parenchyma),the fraction anisotropy of the lesion decreases;D. DTI shows the interruption or impairment of corticospinal tract in the lesion
图148岁HE男性患者,病变累及左侧额顶叶白质
Fig1In a 48-year-old male HE patient,the lesions involved the white matter of fronto-parietal lobes
随访复查追踪复查7 例,其中3 例前后变化不大,4 例前后出现变化,其中1 例复查患者在首次发病期间,病变区域出现长T1长T2信号的病灶,DWI和FLAIR序列信号增高。随着治疗的进行,病情得到有效控制并且好转,但影像学资料显示病灶范围有扩大,局部软化,出现脑萎缩(图2)。另1 例在治疗过程中出现病情反复,呈缓解-复发性,首次就诊行MRI于左侧顶枕叶见累及皮层为主的异常信号,DWI高信号,ADC呈稍低-等信号,增强后无明显强化,经激素治疗后MRI复查,病灶范围明显缩小、好转,几近正常;但半年后患者以癫痫发作再次就诊,复查MRI原病灶部位再次出现异常信号,范围、形态、信号与首发病灶相似,DWI呈高信号,ADC低值,经激素治疗后病灶好转,DWI高信号减低,ADC值升高。4年后随访复查原部位再次出现异常信号,但范围较前缩小,DWI高信号,ADC呈低信号(图3)。1 例累及小脑的病灶经治疗范围缩小并出现软化、小脑萎缩。1 例首次MRI无明显病灶,后出现快速进展的脑萎缩。
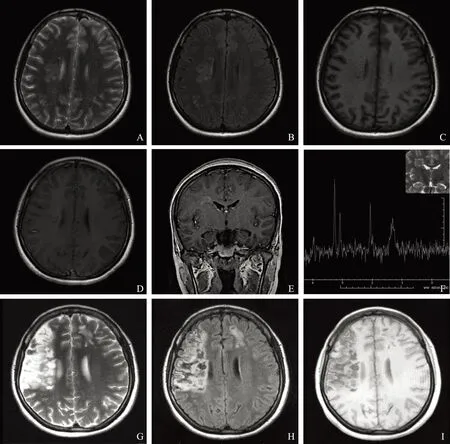
A. T2WI示右侧侧脑室旁半卵圆中心病变区域呈长T2信号;B. FLAIR(T2)示病灶呈高信号;C. T1WI示病灶呈低信号;D.增强横轴位T1WI示病灶轻-中度强化;E. 增强冠状位T1WI示病灶轻-中度强化;F.1H MRS示病灶区氮-乙酰天门冬氨酸峰减低,胆碱峰升高,出现乳酸峰或脂质峰;G~I.分别为T2WI(G)、FLAIR(T2)(H)、T1WI(I)序列,同一患者治疗后2个月复查,病灶范围扩大,大部分软化,出现脑萎缩
A. the lesion in the right periventricular area and the centrum semiovale shows hyper-intensity on T2WI;B. the lesion shows hyper-intensity on FLAIR(T2);C. the lesion shows hypo-intensity on T1WI;D. enhanced axial T1WI shows the mid-to-moderate enhanced lesion;E.enhanced coronal T1WI shows the mid-to-moderate enhanced lesion;F.1H MRS shows the decreased N-acetylaspartate peak,the increased choline peak,the lactate peak,or the lipid peak;G-I. the following-up MRI T2WI(G),FLAIR(T2)(H),and T1WI(I) of the same patient shows the enlarged but mostly softened lesion,complicated with cerebral atrophy after two months of treatment
图226岁女性HE患者,首次以“左上肢麻木、无力3周,左下肢无力1周”就诊,发现右侧侧脑室旁一半卵圆中心病变
Fig2A 26-year-old female HE patient initially admitted to the hospital with numbness and weakness on the left upper extremity for 3 weeks and weakness on the left low extremity for 1 week,the lesion in the right periventricular area and the centrum semiovale was found
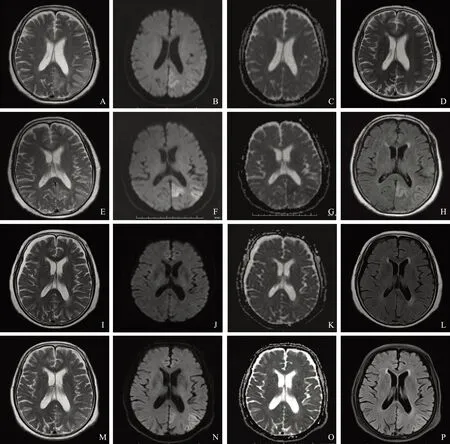
ADC:表观弥散系数
ADC:apparent diffusion coefficient
A~C.首诊MRI;A. T2WI序列示左侧顶枕叶累及皮层为主的长T2信号灶;B.DWI示病灶呈高信号;C.ADC图示病灶呈稍低-等信号;D.激素治疗后T2WI序列示病灶明显吸收、好转,接近正常;E~H. 半年后癫痫发作,再次就诊MRI;E. T2WI示原左侧顶枕叶病灶区再次出现长T2信号,范围、形态、信号与首发病灶相似;F. DWI示病灶呈高信号;G. ADC图病灶呈低值;H. FLAIR(T2)序列病灶呈高信号;I~L.再次激素治疗后MRI;I. T2WI示原病灶基本消失;J. DWI高信号减低;K. ADC值升高;L. FLAIR(T2)示原病灶基本消失;M~P. 患者4年后复查;M. T2WI示原部位再次出现病灶;N. DWI示病灶呈高信号;O. ADC图病灶呈低值;P. FLAIR(T2)序列病灶呈高信号
A-C. the initial MRI;A. T2WI shows the lesions mainly involve the grey matter of parietal-occipital area with hyper-intensity on T2WI;B. the lesions show hyper-intensity on DWI;C. the lesions show hypo-or iso-intensity on ADC map;D. the lesions disappeared rapidly with almost normal MRI manifestation T2WI after the hormone treatment showed;E-H. the second MRI after 6 months with the onset of seizure;E. T2WI shows the similar lesions in the similar area with the similar shape and signals to the first MRI;F. the lesions show hyper-intensity on DWI;G. the lesions show hypo-intensity on ADC map;H. the lesions show hyper-intensity on FLAIR(T2);I-L. MRI after the hormone treatment;I. the lesions almost disappeared on T2WI;J. the lesions showed decreased hyper-intensity on DWI images;K. the lesions showed increased hypo-intensity on ADC map;L. the lesions almost disappeared on FLAIR(T2);M-P. the follow-up MRI after 4 years;M. the reversible lesions show hyper-intensity in the similar area on T2WI;N. the lesions show hyper-intensity on DWI;O. the lesions show hypo-intensity on ADC map;P. the lesions show hyper-intensity on FLAIR(T2)
图371岁女性HE患者,以“头痛、胡言乱语6 d”首次就诊
Fig3A 71-year-old female HE patient initially admitted to the hospital with headache and babbling for 6 days
讨 论
HE是一种少见的伴有抗甲状腺过氧化物酶抗体和/或抗甲状腺球蛋白抗体增高,以急性、亚急性起病,呈缓解、复发或逐步进展性神经和精神功能异常为主要表现的疾病[11]。以往认为HE的主要特点是伴有自身免疫性甲状腺疾病、抗甲状腺抗体阳性、对激素敏感,但随着研究进展,HE已逐渐成为一种排他性诊断。关于抗体的检测,阴性相对来说作为排除诊断的价值更大,但阳性不能作为确诊的指标;而激素治疗据统计只有50%有效,治疗无效不能作为排除诊断的指标。因此,虽然Castillo等[12]提出的HE标准认可度相对最高,但其第7条标准“激素治疗有效”同时也是Graus等[10]在2016 年剔除的HE诊断标准,目前已经不适用于临床确诊HE,而Castillo等[12]研究组和Graus等[10]研究组两者提出的HE其余诊断标准大致相同,故本研究采用Graus等[10]提出的标准诊断HE。
HE的病程多样,可急性、亚急性、慢性发病,也可持续性进展或呈复发-缓解进程,导致早期诊断困难。目前根据临床及影像(主要是MRI)有无异常表现,HE大致分为两类临床亚型[13- 14],一类是弥漫进展型,表现为起病隐匿,且逐渐进展的认知功能障碍或精神行为异常,后期出现意识水平逐渐下降,头颅MRI可无异常表现;二类是表现为卒中样发作的血管炎类型,表现为认知障碍及癫痫发作甚至意识障碍,MRI可提示白质多病灶异常信号。本研究弥漫进展型13例,MRI无明显异常表现者11例,2例表现异常;另卒中样发作的血管炎类型17例,MRI均出现异常。
本研究HE病例常规MRI表现各异,但主要表现为非特异性的多发(11/13)局灶性或融合性白质病变,呈稍长或等T1、长T2信号,边界欠清,FLAIR(T2)序列呈高信号,多位于大脑半球,但也可位于脑干、小脑,可合并脑萎缩。文献报道HE影像表现以缺血性改变、脱髓鞘性病灶、血管源性水肿以及脑萎缩[3,15- 17]为主,本研究与之相符。以上病理改变主要由免疫介导的微血管病变、淋巴细胞性血管病变及不同的直接抗脑部抗原的抗体反应引起[7,12,18- 20]。本研究HE病灶增强后大多无明显强化,另1例病灶有轻中度强化,2例有脑膜强化,该种强化表现在既往文献中有类似报道,文献认为HE可同时累及脑实质和脑膜,脑脊液生化可有炎性表现,尸检也可发现血管周围淋巴细胞浸润[12,18,21- 22]。另外,本研究9例患者出现脑小血管病样改变,符合Pantoni[23]于2010年提出的脑小血管病病理分型中的炎症或免疫介导型小血管病变。
DWI能发现常规序列未发现的HE早期病灶。本研究急性期出现DWI高信号、ADC低信号3例,呈弥散受限改变,支持部分急性发作的HE病灶在早期病理生理过程为细胞毒性水肿[4,17]。而本研究DWI高信号、ADC值升高的病例,与另1例行DTI检查的病例(FA值减低、ADC值升高),均为亚急性及慢性发作的患者,DWI与DTI表现提示血管源性水肿、脱髓鞘改变及星形胶质细胞增生。此两类病例从横断面研究上说明HE的不同阶段MRI表现不同,病理机制亦不同。本研究经过追踪复查、前后发生变化的4例患者中,2例出现软化,1 例出现复发缓解表现,1 例首次MRI阴性、随后出现快速进展的脑萎缩,则从纵向研究上提示HE多样的病程、预后及病理机制。综合以往文献报道及本研究,HE患者的MRI病灶的随访复查表现主要可以分为3 种:(1)缓解-复发。在既往的研究中,HE部分病灶可逆,尤其是DWI上弥散受限的病灶,在经过激素及时治疗后,ADC值升高,且其临床症状亦随之改善[4,12,24- 25]。这种可逆的特征可能是由于一过性的缺血导致的可逆性细胞毒性水肿[4]。但是本研究1例患者在首发病灶呈弥散受限表现、经激素治疗后病灶消失,半年后再次于原部位出现类似病灶,且经过激素再次治疗后病灶消失,但间隔4年后随访复查原部位再次出现病灶,MRI表现呈缓解-复发性,这在文献中报道较少,其病理机制尚不清楚,笔者推测,多发性硬化可呈缓解-复发的病程,HE的缓解-复发病程可能部分与其脱髓鞘的病理改变相关,而DWI高信号、ADC值减低被认为是细胞毒性水肿,一定程度上提示HE多种病理机制共同作用导致病程呈缓解-复发性,未来可收集更多的随访复查病例及可能获得的病理活检进一步观察分析。(2)软化坏死。本研究2例软化坏死的病灶在首次发病时,其中1 例病灶内出现强化,另1例邻近脑膜出现强化,均为亚急性起病,其病理机制可能为缺血导致细胞毒性水肿使得毛细血管继发坏死、内皮细胞受损,血脑屏障消失,水肿略消退后侧支循环开放,病灶区因血脑屏障消失,即可见强化,而这些侧支循环大都附着软脑膜,故病灶呈脑回样强化或邻近软脑膜强化,病灶经长时间缺血后,坏死过程不可逆,形成软化灶。(3)首次MRI阴性,随访后出现脑萎缩。脑萎缩可能是HE最终阶段的反应,是一种不可逆的损坏,其可能为免疫介导的脱髓鞘、慢性持续的炎症反应、HE继发癫痫引起的结构性损害。
HE患者1H MRS显示NAA减低,Cho峰轻度升高,出现Lac峰和/或Lip峰,分别提示神经元和轴突损伤、良性胶质增生和脱髓鞘病变、缺氧和糖酵解过程加强及脑内破坏性过程,呈非肿瘤性谱图表现,符合文献报道的HE的1H MRS表现及神经元变性、反应性星形胶质细胞增生、血管周围淋巴细胞浸润的活检病理特点[5- 6]。
HE患者病灶区CBF降低,可能与疾病初期免疫反应引起缺血、缺氧导致细胞毒性水肿,从而造成HE患者病灶内低灌注有关[7]。另有报道部分HE患者双侧额叶及颞叶可出现低灌注改变,同时这部分患者均出现精神行为异常或认知功能障碍[26- 28]。而本研究此例患者ASL并无此征象,原因可能为该患者卒中样发作起病,属于卒中样发作的血管炎类型而非弥漫性进展型。个案报道中额颞叶的这种低灌注改变,是否与HE的不同病理机制导致不同临床亚型有关,尚需进一步扩大样本量进行研究。
HE患者可出现颅内动脉局限性狭窄,以往国内外已有关于HE并发颅内外血管病变的报道[8- 9],与体液免疫介导的免疫复合物沉积导致免疫性脑血管炎有关[29],该类患者多表现缺血样改变、卒中样发作,脑血管检查阳性率较高。本研究3例出现MRA阳性的患者均出现卒中样发作,可能与免疫性脑血管炎这一发病机制相关。
HE的临床症状和MRI表现均无特异性,早期诊断及鉴别诊断困难。常规MRI发现T2WI或FLAIR(T2)白质高信号改变,且无明显强化,而功能成像DWI于发病初期发现非血管供血区分布的弥散受限的病灶,随访复查发现病灶可逆,均需考虑到HE的可能,应尽可能完善甲状腺相关抗体的检测,以实现诊断及鉴别诊断,并尽可能早期激素治疗。功能成像如1H MRS、ASL等可提供更多鉴别诊断信息。近年关于HE的异常MRI表现的报道越来越多,这可能与对该病认识增加以及检查技术水平提高有关。目前HE的诊断仍主要依赖于临床,但常规MRI结合MRI功能成像已成为诊断HE的重要辅助手段,能从不同的角度反映HE以急、慢性期的缺血性改变以及继发的脱髓鞘病变为主的影像特征,为HE的准确诊断及深入评价提供重要信息,并可能成为活体研究HE病理机制的有效方法,值得长期的大样本的更进一步的研究。
