人巨细胞病毒感染致颈动脉粥样硬化机制的探讨
2018-09-03脱厚珍王佳伟赵伟秦王得新
李 丹,脱厚珍,王佳伟,李 博,赵伟秦,王得新
(1. 北京市和平里医院,北京 100013;2. 首都医科大学附属北京友谊医院,北京 100050;3. 首都医科大学附属北京同仁医院,北京 100730)
根据动脉粥样硬化(AS)炎性假说机制,粥样硬化病变最初源于炎性损害导致的内皮细胞功能紊乱,而后发生单核巨噬细胞和T细胞浸润[1]。根据缺血性卒中(TOAST)分型,无论大或小血管病变在其发病机制中均具重要地位,因此阐明导致动脉粥样硬化的潜在原因或影响因素尤为重要。本研究拟通过检测颈动脉粥样硬化斑块中人巨细胞病毒(HCMV)核酸、血凝素样氧化低密度脂蛋白受体-1(LOX-1)、基质金属蛋白酶(MMP)-2和MMP -9的表达情况,探讨上述炎性因子与动脉粥样硬化间的关系及HCMV感染导致动脉粥样硬化的可能途径。
1 临床资料
1.1纳入标准 ①症状性颈动脉狭窄(既往短暂性脑缺血发作或非致残性卒中史)且数字减影血管造影显示狭窄程度>70%;②症状性颈动脉狭窄程度>50%、局部粥样硬化斑块为不稳定型斑块(表面有溃疡或血栓形成);③无症状性颈动脉狭窄程度>60%、粥样硬化斑块呈不稳定型或伴对侧颈动脉狭窄或闭塞。
1.2排除标准 存在严重心肝肾功能衰竭者;处于明显的免疫抑制状态(如血液病、器官移植患者等)者;入院前4周曾有发热或任何感染史(包括呼吸道、泌尿系、消化系统等)者;入院前4周曾服用过抗生素或免疫抑制剂者;年龄>75岁者;长期服避孕药者。
1.3标本来源 选择1999年1月—2008年5月在首都医科大学附属北京友谊医院和北京大学第一医院血管外科住院行颈动脉内膜切除术的31例颈动脉狭窄患者标本(均于手术后12 h内取材并经病理检查证实为≥Ⅳ级颈动脉粥样硬化)作为颈动脉粥样硬化组,其中男26例,女5例;年龄52~67(60.35±1.83)岁;统计传统致动脉粥样硬化危险因素包括高血压19例,糖尿病6例,高三酰甘油(TG)血症13例,血清低密度脂蛋白(LDL)>2.6 mmol/L 12例,吸烟14例,饮酒10例,有心脑血管疾病阳性家族史10例。选择首都医科大学附属北京友谊医院神经内科脑库提供的28例意外死亡者之正常颈内动脉组织标本(均于死亡后12 h内行尸体解剖并取材,均经患者家属同意)作为对照组,其中男24例,女4例;年龄55~70(63.59±1.08)岁;经询问家属排除心血管疾病、免疫功能低下或免疫抑制状态,并死亡前4周无发热或感染病史。
1.4试剂与药品 原位杂交试剂HCMV地高辛标记探针来自美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)GenBank,选择其HCMV AD169株UL75基因中的一段基因序列(5’-CGCTGAGGTCCAGGTAGTTGAAGTCCAGTGCGGCGTCGAGAAAGTCCGAGTCTTTGAGAT-3’,工作浓度20 mg/L)。原位杂交试剂盒[含地高辛标记探针、AP检测系统及蛋白酶K(1∶10)、蛋白封闭缓冲液(1∶20)、预杂交液、杂交液、封闭液、兔抗地高辛-BSA(1∶100)和AP-羊抗兔IgG(1∶100)多克隆抗体、NBT/BCIP显色系统]购自北京鼎国生物技术有限责任公司,(3-氨基丙基)三乙氧基硅烷(APES)购自北京中杉金桥技术有限公司,TritonX-100购自北京赛百盛生物工程公司。30%过氧化氢(H2O2)购自北京化工厂。免疫组织化学染色试剂中Ⅰ抗[含兔抗人MMP-9、兔抗人MMP-2和兔抗人MMP组织抑制因子-1(TIMP-1)多克隆抗体(1∶100)、鼠抗人LOX-1单克隆抗体(1∶100)]、PV-9000二步法免疫组织化学检测试剂盒[含3% H2O2、即用型增强剂(Polymer Helper)、多过氧化物酶羊抗兔/小鼠IgGⅡ抗]以及DAB显色试剂盒分别由北京中杉金桥技术有限公司和美国R&D公司提供。
1.5仪器与设备 DK-8D型恒温水浴箱购自上海医疗器械七厂,DGF3006型烘箱(标准温度35~150 ℃)购自重庆四达实验仪器有限公司。
1.6研究方法 检测2组中HCMV DNA、LOX-1、MMP-2、MMP-9阳性表达情况;统计颈动脉粥样硬化组伴及不伴危险因素者HCMV DNA阳性细胞计数,HCMV DNA阳性与阴性表达者、血脂水平正常与异常者LOX-1、MMP-2、MMP-9阳性细胞计数。
1.6.1标本制备 将颈动脉管壁组织标本(长0.50~1.50 cm)置4%中性甲醛溶液固定、石蜡包埋,制备层厚约5 μm连续组织切片。颈动脉粥样硬化组标本经HE染色符合≥Ⅳ级动脉粥样硬化改变,对照组血管未见异常病理改变。
1.6.2HCMV表达检测 采用原位杂交技术检测。①检测方法:组织切片经常规脱蜡、新鲜配制的0.5% H2O2甲醇溶液室温下处理30 min,灭活内源性过氧化物酶,滴加50 μL经稀释的1×蛋白酶K,37 ℃孵育10 min,体积比为1%多聚甲醛溶液固定20 min,滴加50 μL预杂交液,42 ℃保育2 h,去多余液体、湿盒保湿;滴加50 μL探针/杂交工作液,覆盖Parafilm膜切片置95 ℃恒温水浴箱变性8 min、冰浴1 min,湿盒中42 ℃烤箱杂交过夜,洗脱盖玻片滴加封闭液、37 ℃烘箱保育30 min;依次滴加兔抗地高辛-BSA(1∶100)和AP-羊抗兔IgG(1∶100),37 ℃烤箱反应60 min,滴加NBT/BCIP显色液并于37 ℃湿盒中显色,核固红复染、乙醇脱水、二甲苯透明、中性树胶封片。②结果分析与判定:HCMV DNA阳性染色细胞胞核显示蓝紫色颗粒,主要见于平滑肌细胞、单核/巨噬细胞,泡沫细胞少见,随机观察5个高倍视野(×400)并计算阳性细胞数目。阳性对照为经HE染色证实存在HCMV包涵体的小肠黏膜组织,阴性对照以磷酸盐缓冲液(PBS)代替探针。
1.6.3炎性因子表达检测 采用免疫组织化学染色法检测。①检测方法:组织切片经常规脱蜡、抗原修复后,逐次滴加Ⅰ抗(兔抗人MMP-2和MMP-9多克隆抗体和鼠抗人LOX-1单克隆抗体,37 ℃烤箱孵育2 h)、增强剂(37 ℃烤箱孵育20 min)和辣根过氧化物酶标记的羊抗兔/小鼠IgG多聚体(37 ℃烤箱孵育30 min),DAB显色液显色,Harris苏木精染色液复染5 min,盐酸-乙醇分化液分化1~2 s,乙醇脱水、二甲苯透明、中性树胶封片。②结果分析与判定:阳性染色细胞胞核内呈棕黄色颗粒,主要见于平滑肌细胞、泡沫细胞、单核/巨噬细胞;随机观察5个高倍视野(×400),计算平均每一高倍视野内阳性细胞数目,利用IPP计算免疫组化阳性区域占总面积的比例(即阳性面积)及阳性区域的光密度(OD值)。阳性对照分别为乳腺癌组织MMP-2、肝脏组织MMP-9、肺组织LOX-1,阴性对照以磷酸盐缓冲液代替Ⅰ抗。
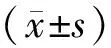
2 结 果
2.1HCMV DNA表达情况 颈动脉粥样硬化组HCMV DNA阳性表达率为41.94%(13/31),对照组为14.29%(4/28),2组比较差异有统计学意义(2=5.393,P=0.020);光镜下HCMV DNA阳性表达表现为颈动脉管壁平滑肌细胞和单核/巨噬细胞胞核可见大量呈蓝紫色颗粒的免疫沉积物,泡沫细胞偶见,未发现呈阳性染色的脂质核及钙化斑块,见图1。颈动脉粥样硬化组中高TG血症、血清LDL水平>2.60 mmol/L和既往吸烟者HCMV DNA阳性细胞计数高于相应不伴危险因素者(P均<0.05),见表1;进一步分析,HCMV DNA阳性者血清LDL-C和TG水平分别为(3.27±1.12)mmol/L和(3.63±0.52)mmol/L,HCMV DNA阴性者分别为(3.01±1.17)mmol/L和(1.23±0.25)mmol/L,HCMV DNA阳性者血清LDL-C水平明显高于HCMV DNA阴性者(P=0.032)。


图1 光镜下颈动脉标本中HCMV DNA阳性染色表现

危险因素nHCMV DNA阳性细胞计数/(个/高倍视野)uP性别男女2650.00(2.25) 1.80(2.40)57.0000.631高血压伴不伴19122.00(2.8)2.00(1.75)91.0000.298糖尿病伴不伴6250.00(2.8)0.00(2.2)71.0000.824高TG血症伴不伴13182.00(3.10)0.00(0.40)50.5000.003LDL正常>2.60mmol/L19120.00(3.15)2.20(1.60)55.0000.008吸烟史无有17140.00(1.70) 2.00(3.05)71.5000.035饮酒史无有21100.00(2.00)0.09(3.55)83.0000.300心脑血管病家族史无有21100.00(2.10)0.90(2.85)90.0000.480
注:表中数据为中位数(四分间距)。
2.2炎性因子表达情况
2.2.1LOX-1、MMP-2、MMP-9阳性表达率动脉粥样硬化组中LOX-1、MMP-2、MMP-9阳性表达率分别为54.80%,100%,100%,对照组分别为21.40%,67.90%,75.00%,动脉粥样硬化组LOX-1、MMP-2、MMP-9阳性表达率明显高于对照组(P均<0.05)。
2.2.2LOX-1、MMP-2、MMP-9阳性染色表现LOX-1阳性染色显示平滑肌细胞、泡沫细胞、单核/巨噬细胞胞核可见大量呈棕黄色颗粒的免疫沉积物(见图2),而细胞外基质、脂质核及粥样硬化斑块未发现同类阳性物质。MMP-2和MMP-9阳性染色显示平滑肌细胞、泡沫细胞、单核/巨噬细胞内及细胞外基质可见深染的棕黄色颗粒(见图3和图4),以细胞内为主,细胞外基质少见,而脂质核及粥样硬化斑块未见染色阳性的颗粒物质。


图2 光镜下颈动脉标本中LOX-1阳性染色表现


图3 光镜下颈动脉标本中MMP-2阳性染色表现


图4 光镜下颈动脉标本中MMP-9阳性染色表现
2.2.3LOX-1、MMP-2、MMP-9免疫沉积物表达情况 颈动脉粥样硬化组LOX-1、MMP-2和MMP-9免疫沉积物表达阳性面积百分比、OD值均明显高于对照组(P均<0.05)。见表2。
2.2.4颈动脉粥样硬化组HCMV DNA阳性与阴性表达者炎性因子表达情况 HCMV DNA阳性表达者LOX-1阳性细胞计数明显高于HCMV DNA阴性表达者(P<0.05),而HCMV DNA阳性表达者与阴性表达者MMP-2和MMP-9阳性细胞计数比较差异均无统计学意义(P均>0.05)。见表3。
2.2.5颈动脉粥样硬化组血脂水平正常与异常者炎性因子表达情况 TG正常与升高者LOX-1、MMP-2和MMP-9阳性细胞数比较差异均无统计学意义(P均>0.05);LDL>2.6 mmol/L者LOX-1阳性细胞数明显高于LDL正常者(P<0.05)。见表4。

表2 颈动脉粥样硬化组与对照组颈动脉管壁LOX-1、MMP-2、MMP-9免疫沉积物表达情况
注:表中数据为中位数(四分间距)。

表3 颈动脉粥样硬化组HCMV DNA阳性与阴性表达者炎性因子阳性细胞数比较 个/高倍视野
注:表中数据为中位数(四分间距)。

表4 颈动脉粥样硬化组血脂水平正常与异常者炎性因子阳性细胞数比较 个/高倍视野
注:表中数据为中位数(四分间距)。
3 讨 论
目前研究证实,多种微生物或病毒均可促进动脉粥样硬化形成,其中以单核细胞等浸润血管壁内皮细胞为关键因素,这种单核细胞可运送潜伏的HCMV到血管损伤的局部,同时HCMV被激活,随后病毒通过激活免疫和炎症反应,进一步推动管壁的动脉粥样硬化进程[2]。Fujishiro等[3]证实脑卒中患者血清HCMV-IgG、HCMV-IgM抗体和HCMV DNA检出率均明显高于正常志愿者,在排除了性别、年龄、体质量指数、高血压、吸烟等影响后,此种差异仍然存在。本研究亦发现,动脉粥样硬化组HCMV DNA检出率明显高于对照组,提示其与颈动脉粥样硬化有关;且动脉粥样硬化组中高TG血症、血清LDL水平>2.60 mmol/L和既往吸烟者HCMV DNA阳性细胞计数高于相应不伴危险因素者,提示TG、LDL水平升高和吸烟可加重HCMV感染,其机制尚有待进一步研究。但由于本研究中31份粥样硬化斑块标本均有不同程度的表面破损,加之手术切开和术中镊子夹持损伤,以及标本处理过程中组织皱缩和包埋的随意性,无法观察到完整的纤维帽形态及斑块肩部,因此未能对HCMV在粥样斑块中的完整分布情况进行定位分析。
HCMV感染机体后,可导致肝脂酶(HL)和卵磷脂胆固醇酰基转移酶(LCAT)的含量或活性明显下降,从而导致体内脂代谢异常[4-5]。其中LDL-C是动脉粥样斑块形成和进展的致病因素,且与LDL-C水平相关[6]。LDL-C可被进一步氧化为氧化型-LDL(ox-LDL),其与LOX-1特异性结合后,可被血管壁细胞吞噬和代谢,促进泡沫细胞的合成,诱导血管壁炎症反应,参与动脉粥样硬化的发生发展[7-8],而很多疾病状态如动脉粥样硬化、高血脂症、高血压、糖尿病等可上调LOX-1基因表达[9]。本研究发现,颈动脉粥样硬化组中HCMV DNA阳性者LDL-C水平和LOX-1阳性细胞数均明显高于阴性者,且颈动脉粥样硬化组LOX-1阳性检出率、阳性面积百分比和OD值均明显高于对照组,提示HCMV感染机体后可能通过影响血LDL-C的代谢,并进一步上调LOX-1基因表达而促进动脉粥样硬化的发生、发展。虽然本研究颈动脉粥样硬化组中高TG血症者HCMV DNA阳性细胞数多,但HCMV阳性者及阴性者血TG水平差异无统计学意义,未得出HCMV参与动脉粥样硬化的过程与TG有关,但由于本研究所收集病例数不够多,故有待进一步证实。
本研究还显示,颈动脉粥样硬化组中MMP-2、MMP-9阳性检出率、阳性面积百分比和OD值均明显高于对照组,提示MMP-2、MMP-9参与动脉粥样硬化的发生发展过程。但颈动脉粥样硬化组HCMV DNA阳性及阴性者MMP-2、MMP-9阳性细胞数比较差异均无统计学意义,提示HCMV感染机体后参与动脉粥样硬化的过程可能不是通过影响MMP-2、MMP-9来实现的。
综上所述,HCMV感染是动脉粥样硬化危险因素之一,伴HCMV感染者血清LDL-C水平和动脉中LOX-1阳性细胞数均明显高于无感染者,推测HCMV感染机体后可能是通过影响血LDL-C的代谢,并进一步上调LOX-1基因表达从而促进动脉粥样硬化的发生、发展的。但由于本研究所收集病例数较少,仍需大样本数进一步证实。
