降解亚硝酸盐和生物胺乳杆菌筛选及其改善鱼肉香肠品质效果
2018-08-21李田田贾瑞娟王如福
许 女,李田田,贾瑞娟,张 浩,王如福
(山西农业大学食品科学与工程学院,太谷030801)
0 引 言
肉制品中的亚硝酸盐残留、亚硝胺和生物胺的产生成为重要的食品安全问题。目前对二者控制的方法主要有[1-2]:物理方法:超高压、辐照和气调控制(抑制生物胺产生菌的生长和氨基酸脱羧酶的活性);化学方法:植物提取物(姜、蒜、芦荟、茶多酚等)、抑菌剂(山梨酸钾、抗坏血酸、延胡索酸酯、葡萄糖酸内酯等);生物方法:亚硝酸盐和生物胺降解菌发酵剂(植物乳杆菌、干酪乳杆菌、短乳杆菌、嗜酸乳杆菌、长膜明串珠菌、木糖葡萄球菌、解淀粉芽孢杆菌等)。相比物理和化学方法,降解菌发酵剂具有丰富协调产品风味、提升产品生理功能、延长产品保质期、有利于产品标准化等无可比拟的优势。
肉制品中的亚硝酸盐残基与胺生成致癌物质亚硝胺。乳酸菌发酵碳水化合物生成乳酸降低pH值,pH值的降低有利于降解亚硝酸盐和抑制亚硝胺的生成[3]。另外,也有报道[4]称乳酸菌具有亚硝酸盐还原酶等一系列酶降解亚硝酸盐。Chen等[5]将清酒乳杆菌、植物乳杆菌等混合菌种应用于中国发酵干香肠中,产品在成熟期间亚硝酸盐的残留量和挥发性盐基氮的含量均有明显降低。Sun等[6]采用戊糖乳杆菌、弯曲乳杆菌和清酒乳杆菌混合接种于中国哈尔滨红肠发酵中,与对照组相比,发酵成熟9天后亚硝胺的含量显著降低。关于生物胺,Bovercid等[7]采用包含清酒乳杆菌、木糖葡萄球菌和肉葡萄球菌的混合发酵剂显著降低了干发酵香肠中酪胺、尸胺和腐胺的含量。Tosukhowong等[8]报道植物乳杆菌可以显著降低泰国发酵香肠中尸胺、腐胺、酪胺和组胺的含量。曾雪峰[9]发现接种了混合菌发酵剂的酸鱼在发酵过程中酪胺、尸胺、腐胺的积累受到显著抑制。
综上所述,以往的研究存在以下问题:1)只是对降解能力表型进行了简单筛选,缺乏对相关降解基因分布的研究,另外,筛选出的优良目的菌株必须不含生物胺生成等相关潜在基因;2)亚硝胺和生物胺是发酵肉制品的重要食品安全问题,以往的报道中,只是进行单一的研究,并没有筛选出对二者同时具有降解作用,并且降解率高、降解种类多的优良菌株,并将其成功地应用在发酵肉制品的试验中。
本文主要考察了不同来源植物乳杆菌的亚硝酸盐和生物胺的降解活性及相关基因的分布情况,从中筛选出1株同时具有高效降解亚硝酸盐和生物胺活性的优良菌株,并将其应用在鱼肉发酵香肠中。为乳酸菌亚硝酸盐和生物胺的降解机理、基因工程育种进行初步的研究基础工作,对发酵肉制品的质量安全控制、营养功能提升都具有重要意义。
1 材料与方法
1.1 主要材料与试剂
清酒乳杆菌L.saki M4(实验室前期研究筛选的优良肉品发酵剂菌株,具有较强的NaCl耐受性,产蛋白酶和细菌素的能力),植物乳杆菌,山西农业大学食品学院生物工程实验室保存。
细菌提基因组试剂盒,购自北京博迈德科技发展有限公司;Taq DNA聚合酶、dNTP、10×聚合酶链式反应(polymerase chain reaction,PCR)反应缓冲液、10×Loading Buffer,购自大连宝生物工程有限公司。二乙基亚硝胺(NDEA),二甲基亚硝胺(NDMA),甲基乙基亚硝胺(NMEA),N-亚硝基吗啉(NMOR)标准品,美国 Accustandard公司;各种生物胺标准品,美国 Sigma公司。
1.2 主要仪器与设备
Veriti PCR 扩增仪(温度精度为±0.25 ℃),美国ABI 公司;电泳成套设备,美国 Bio-rad公司;凝胶成像系统,美国Alpha Innotech公司;台式高速冷冻离心机,美国Sigam公司;GENESYSTM5型分光光度计(波长精度为±0.5 nm),日本Spectronic公司;Trace1300气相色谱-TraceISQ质谱连用仪、戴安U3000液相色谱仪(波长精度为±0.1 nm),赛默飞世尔科技有限公司。
1.3 试验方法
1.3.1菌株降解亚硝酸盐能力的测定
参考文献[10-11]中乳酸菌降解亚硝酸盐的测定方法,并进行改良。将不同来源的植物乳杆菌菌株,于乳酸细菌培养基(deMan rogosa sharpe,MRS)中活化后,按3%接种量接种于100 mL含 0.1 mg/mL NaNO2的MRS液体培养基中,37℃培养,每隔24 h取样,采用盐酸萘乙二胺光度法于波长540 nm下测定培养液中亚硝酸盐的含量,不接菌的空白培养基吸光度为 A0,样品吸光度为AS,亚硝酸盐降解率如式 (1):
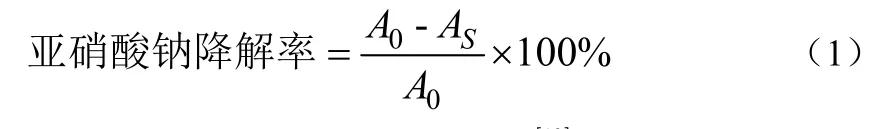
1.3.2 菌株产亚硝酸盐还原酶的测定[12]
按照 GENMED公司细菌亚硝酸盐还原酶总活性比色法定量检测试剂盒说明进行。即通过底物亚硝酸盐被催化产生氨或一氧化氮的同时,人工电子供体还原型甲基紫精氧化后呈现吸光峰值的变化,采用比色法来测定样品中亚硝酸盐还原酶总活性。
1.3.3 菌株降解生物胺能力的测定[13]
将不同来源的植物乳杆菌菌株,于MRS培养基中活化后,按3%接种量接种于200 mL MRS液体培养基中,37℃静置培养24 h,4℃、8 000 r/min离心10 min收集菌体,磷酸盐缓冲液洗涤2次后,将菌体重悬到含8种生物胺各100 mg/L的0.05 mol/L pH7.0磷酸盐缓冲液中,调整菌浓度为OD600=0.8,37℃静置培养24 h,以不接菌的生物胺磷酸盐缓冲液作为空白对照组。8 000 r/min离心10 min收集上清液,采用Dns-Cl柱前衍生HPLC-FLD法测定上清液中各生物胺含量,计算降解率。
1.3.4 亚硝酸盐和生物胺降解及生成相关基因的聚合酶链式反应(polymerase chain reaction,PCR)扩增
参考文献[12,14-15]等发表的引物序列,采用 PCR方法对亚硝酸盐还原酶疑似基因(HP、GR、ORD),生物胺生成相关基因(hdc-组氨酸脱羧酶,tdc-酪氨酸脱羧酶,odc-鸟氨酸脱羧酶)和生物胺降解基因suf I进行检测。
1.3.5 植物乳杆菌在鱼肉发酵香肠的应用
1)发酵剂制备
将L. plantarum CP3和 L.saki M4按3%接种量接种于200 mL MRS液体培养基中,37℃培养24 h,8 000 r/min离心10 min收集菌体,生理盐水洗涤后重悬,使菌体浓度达到1010cfu/mL。
2)鱼肉发酵香肠制备
参考文献[16]中的鱼肉发酵香肠制备工艺,并进行改良。取新鲜青鱼去骨取肉后匀浆,制成鱼肉糜,向鱼肉糜中加入2%盐、3%白砂糖、1%葱姜料酒、8%玉米淀粉及10%的水,搅拌均匀,接入1%的发酵剂,与鱼肉糜混合均匀后灌入肠衣中结扎成型,置于30℃恒温培养箱中,相对湿度为90%,发酵24 h,每隔12 h取样测定亚硝胺、生物胺及微生物的变化。
3)理化及微生物指标测定
①微生物的测定[17]
总菌数、乳酸菌、假单胞菌、肠杆菌和酵母菌分别采用平板计数琼脂(plate count agar,PCA)、乳酸菌培养基(deMan Rogosa Sharpe,MRS)、谷氨酸盐淀粉酚红琼脂(glutamate starch phenol red agar,GSP)、肠杆菌计数琼脂(violet red bile dextrose agar,VRBD)和马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)。
②亚硝胺的测定[6]
样品处理:取1 g绞碎样品,加入9 mL饱和食盐水,充分混匀后,在400 r/min、50 ℃条件下用固微相萃取仪(蓝色平头PDMS/DVB65 µm萃取头)萃取30 min,上机检测。
色谱条件:使用安捷伦气相7890A和气质5975C联用仪进行测定。选用不分流模式,色谱柱为 DB-WAX 122-7032(30 m×0.25 mm),柱温 250℃,流速 1.2 mL/min。
③生物胺的测定[17]
样品处理:称取5 g待测样品加入20 mL 0.4 mol/L的高氯酸进行研磨,4℃、8 000 r/min条件下离心10 min,取上清液用0.4 mol/L的高氯酸定容到50 mL。采用1.3.3中的Dns-Cl柱前衍生HPLC-FLD法测定上清液中各生物胺含量。
pH值,硫代巴比妥酸(thiobarbituric acid,TBA),挥发性盐基氮(total volatile basic nitrogen,TVB-N),非蛋白氮(non-protein nitrogen,NPN)及游离氨基酸(free amino acids,FAA)等其他理化指标的测定
按照文献[18]中报道的方法对发酵鱼肉香肠中pH值,TBA,TVB-N,NPN及FAA等指标进行测定。
2 结果与分析
2.1 降解亚硝酸盐菌株的筛选
按照1.3.1中的方法,考察了分离自醋醅(CP-cupei)、泡菜(SK-sauerkraut)、乳制品(MP-milkproduct)和青贮饲料(EL-ensilage)中的19株植物乳杆菌降解亚硝酸盐的能力。如表 1所示,所有菌株均具有一定的亚硝酸盐降解能力,并且与降解时间呈正相关关系。但各株菌的降解能力有很大差异,L. plantarum CP3和MP1的亚硝盐酸降解能力最强,72 h的降解率分别达到95%和97%。
关于植物乳杆菌亚硝酸盐还原酶的酶活对于研究乳酸菌发酵香肠中的乳酸菌的作用具有重大意义。研究报道[4]证实,植物乳杆菌在亚硝酸盐的诱导下,能够产生亚硝酸盐还原酶。以往关于亚硝酸盐还原酶的研究大都集中在泛养硫球菌(Thiosphaera pantotropha),脱氮副球菌(Paracoccus denitrificans),荚膜红细菌(Rhodobacter capsulatus),施氏假单胞菌(Pseudomonas stutzeri), 绿脓假单胞菌(Pseudomonas aeruginosa)等反硝化菌中,这些菌能够将硝酸盐或者亚硝酸盐降解生成一氧化二氮(nitrous oxide,N2O),一氧化氮(nitric oxide,NO)和氮气(nitrogen,N2),这个过程中的关键酶就是亚硝酸盐还原酶[12]。近年来,随着发酵泡菜、香肠亚硝酸盐的安全性问题的关注,才激起对传统发酵食品菌株的亚硝酸盐还原酶的研究热点。Gøtterup等[19]从发酵香肠、烟熏烤肠和腌肉中,筛选出9种可以发酵产生亚硝酸盐还原酶的Staphylococcus,在 30℃、pH值为7.0、转速为 150 r/min的条件下进行厌氧发酵,其最终亚硝酸还原酶酶活在 6~42 U。Neubauer等[20]也研究了发酵香肠中分离的Staphylococcus carnosus 中亚硝酸还原系统的分子特性,表明厌氧和亚硝酸盐是亚硝酸还原酶产生的诱导因素。但是,关于乳酸菌亚硝酸盐还原酶的研究比较少。表 1中列出了19株植物乳杆菌亚硝酸盐还原酶的测定结果,除菌株CP5,CP6,SK3,EL2和EL3外,其他菌株都呈现出亚硝酸盐还原酶阳性,这同时印证了CP5,CP6,EL2和EL3这4株菌亚硝酸盐降解率偏低的结果,但令人感兴趣的是SK3菌株虽然显示亚硝酸盐还原酶阴性,但是其亚硝酸盐的降解率却高达 80%。相似地,Dodds等[21]也证实,清酒乳杆菌(L.sake)虽然具有降解亚硝酸盐的能力,但检测不到酸盐还原酶的活性,推测菌株产生的其他化学组分(如次生代谢产物、小分子物质等)也可能造成亚硝酸盐的降解;并且Dodds等[21]还证明乳酸菌对亚硝酸盐的降解主要分为酶降解和酸降解 2个阶段,在发酵初期以酶降解为主,在发酵的后期以酸降解为主。
有研究表明[12],乳酸菌的HP(hypothetical protein)基因编码的一个未知蛋白具有显著降解亚硝酸盐的能力,同时,GR基因(编码谷胱甘肽还原酶,glutathione reductase)和 ORD基因(编码一氧化还原酶,oxidoreductase)编码的蛋白也呈现出一定的亚硝酸盐还原酶活性,但活性远远低于HP。为了明确植物乳杆菌亚硝酸盐还原酶的类型,初步揭示其降解机理,为将来育种工作的展开奠定研究基础,本文初步考察了亚硝酸盐还原酶疑似编码基因在植物乳杆菌菌株中的分布情况。表1结果显示所有菌株中均含有HP基因,GR和ORD基因的检出率经表 1结果计算分别达到 47.36%和42.10%。关于乳酸菌的亚硝酸盐还原酶类型及基因编码序列鲜有研究,今后需对这 3个基因编码蛋白的亚硝酸盐还原酶活性,与其他反硝化酶之间的基因表达调控,及寻找新的编码亚硝酸盐还原酶的功能基因等方面作进一步的深入研究。
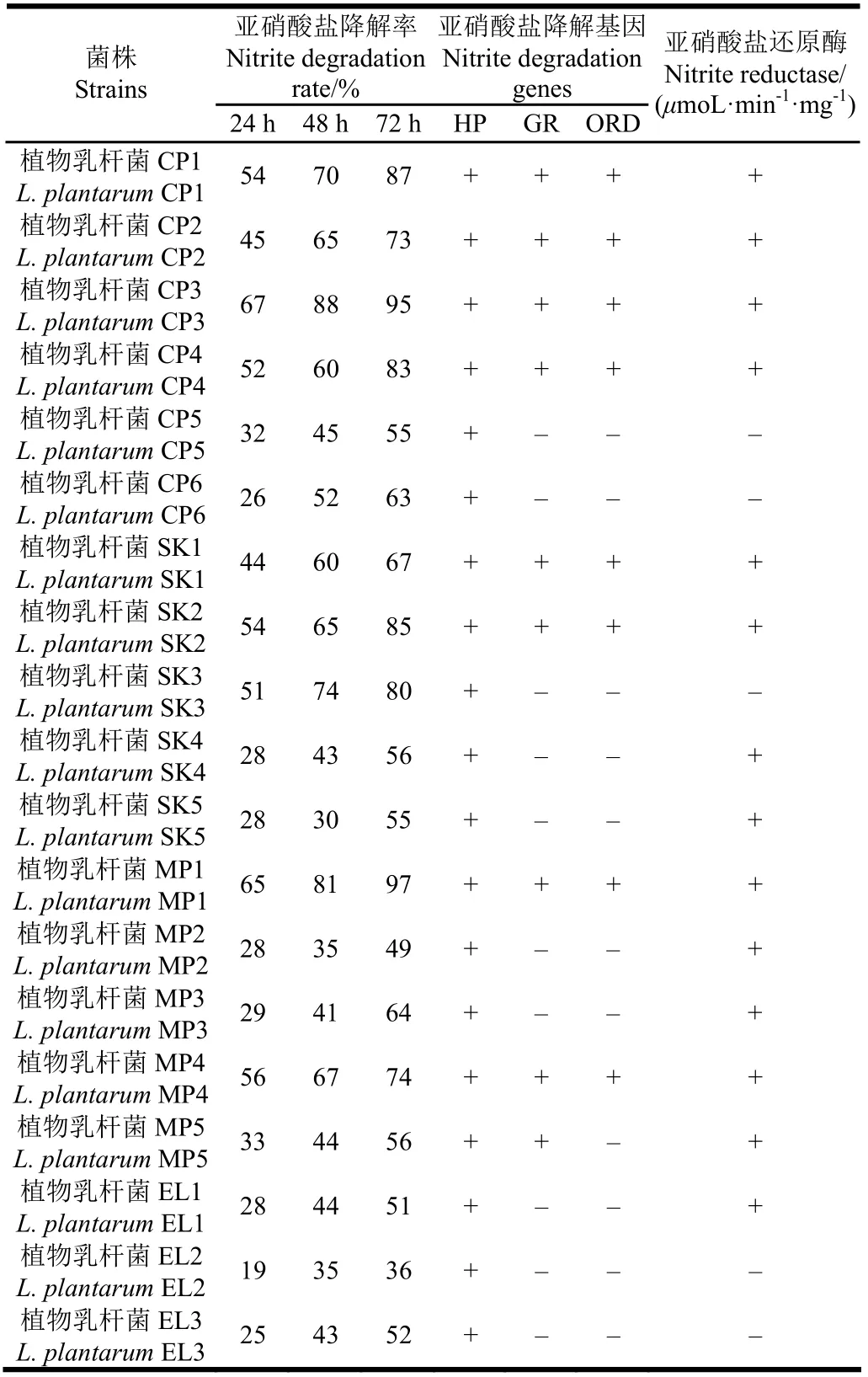
表1 不同植物乳杆菌菌株降解亚硝酸盐能力及相关基因和酶的检测Table 1 Detection of nitrite degradation rate, related genes and enzyme in different Lactobacillus plantarum strains
2.2 降解生物胺菌株的筛选
生物胺普遍存在于食品尤其是发酵食品中,在发酵肉制品、发酵海产品、发酵乳制品和发酵蔬菜等发酵食品中均有生物胺产生的报道。食品中生物胺的形成主要是由微生物所产生的氨基酸脱羧酶对游离氨基酸进行脱羧作用产生的。微生物主要通过转运蛋白将游离氨基酸送入胞内,经酶作用生成相应的生物胺后再送出胞外,不同的生物胺涉及的转运蛋白和氨基酸脱羧酶具有特异性,且二胺和多胺的形成相对复杂,需要多种酶的连续作用[22]。目前已报道的食品中的生物胺产生菌包括:分离自奶酪的酪胺产生菌属于肠球菌属(Enterococcus)和乳球菌属(Lactococcus)[23],Victor等[24]通过实时定量聚合酶链式反应(RT-q PCR)检测到产组胺细菌;分离到组胺产生菌普通变形杆菌(Proteus vulgaris)[25],弗氏柠檬酸杆菌(Citrobacter freundii)[26]和嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia)[27]等;腐胺产生菌有戊糖片球菌(Pediococcus pentosaceus)[28]和月形单胞菌(Selenomonas ruminatium)[29]等。
目前食品中生物胺最好的控制方法是接种特定微生物能够降解生物胺。已报道的生物胺降解菌有干酪乳杆菌 Lactobacillus casei IFI-CA52[30],植物乳杆菌Lactobacillus plantarum 2142,副干酪乳杆菌Lactobacillus casei subsp. casei 2763,弯曲乳杆菌Lactobacillus curvatus 2771[31],酒葡萄球菌Staphylococcus cerevisiae JM19[17],解淀粉芽孢杆菌 Bacillus amyloliquefaciens FS05 和肉葡萄球菌 Staphylococcus carnosus FS19[32]。但已发现的生物胺降解菌存在生物胺降解种类少,降解率低且降解机制不明确等问题。筛选优良乳酸菌作为生物胺降解菌,可作为发酵剂应用于多种发酵食品中,并且乳酸菌在机体内会产生多种益生功能。
本文按照1.3.3中的方法考察了不同来源的植物乳杆菌对8种生物胺的降解能力。19株植物乳杆菌表现出不同的生物胺降解活性,总生物胺降解率从20%到77%不等,其中,L. plantarum CP3和MP1的总生物胺的降解能力最强,分别达到77%和71%。共有6株菌对测试的8种生物胺都具有降解活性。分别有10株(降解色胺)、2株(降解腐胺)、7株(降解组胺)和3株(分别降解酪胺、精胺、亚精胺)的降解率超过50%。
目前认为,微生物的生物胺降解活性主要是产生了生物胺氧化酶,菌株降解生物胺的种类与其产生的生物胺氧化酶的种类多少有关[15]。一些学者已经从节杆菌(Arthrobacter crystallopoietes), 甲基营养酵母(Candida boidinii),产气克雷白(氏)杆菌(Klebsiella aerogenes), 藤黄八叠球菌(Sarcina. lutea)和红串红球菌(Rhodococcus erythropolis)中分离出了多种生物胺氧化酶[15]。但是关于乳酸菌生物胺氧化酶的报道比较少。Callejón等[15]首次从L. plantarum J16和P. acidilactici分离纯化出具有降解生物胺活性的酶,经测序比对证明其为生物胺氧化酶类-多铜氧化酶(multicopper oxidase,MCOS),并由sufⅠ基因编码,初步探讨了植物乳杆菌的生物胺降解机理;并且证明短乳杆菌(Lactobacillus. brevis),德氏乳杆菌保加利亚亚种(Lactobacillus. delbrueckii subsp. bulgaricus), 副干酪乳杆菌(Lactobacillus. paracasei)和戊糖片球菌(Pediococcus. pentosaceus)中也含有此类酶。本文采用PCR技术检测了19株植物乳杆菌的胺氧化酶基因suf I的分布情况,结果如表2所示。
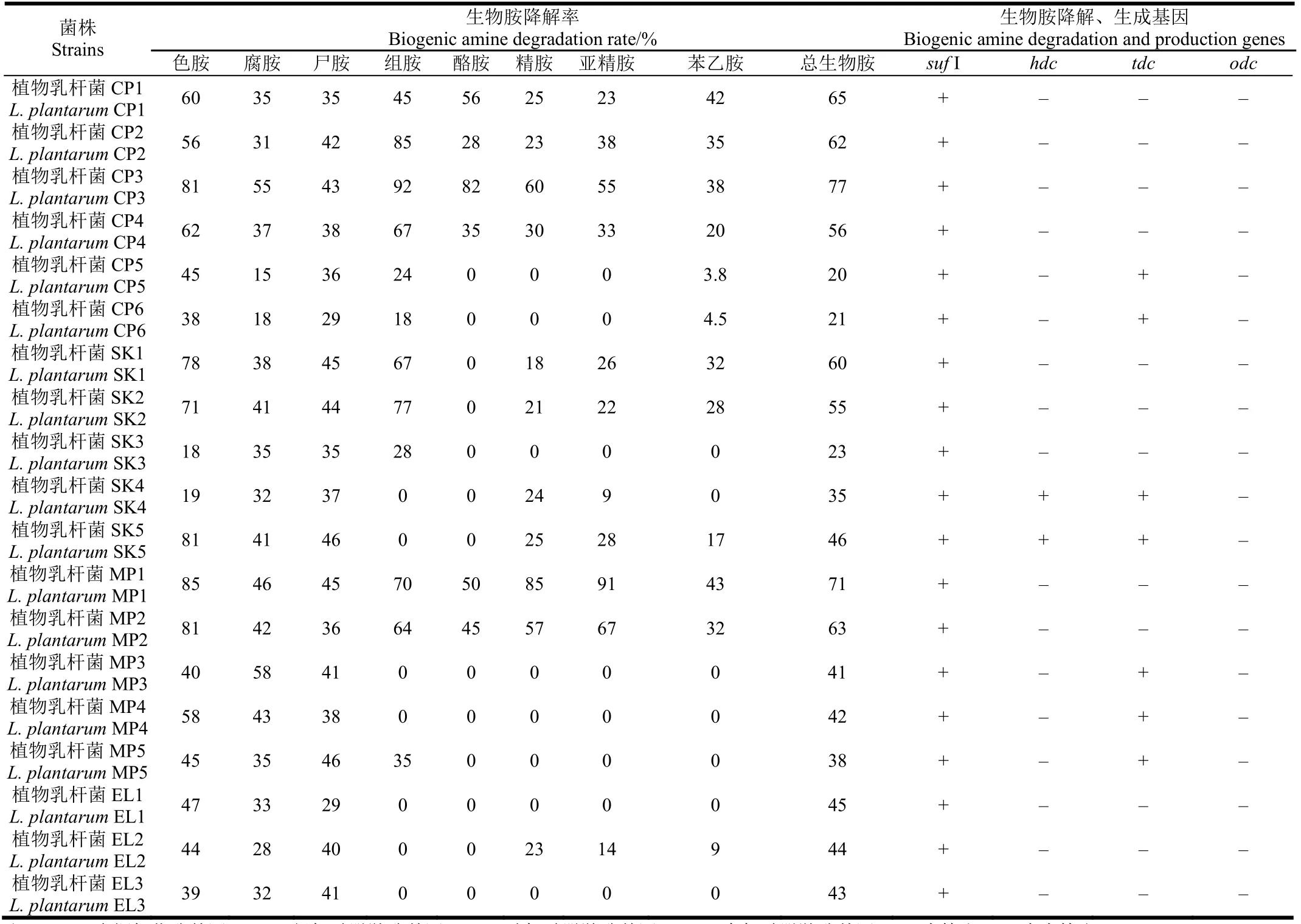
表2 不同植物乳杆菌菌株降解生物胺能力及相关基因的检测Table 2 Detection of biogenic amine degradation rate and related genes in different Lactobacillus plantarum strains
19株植物乳杆菌中均含有suf I基因,但表1 中的表型结果却显示19株植物乳杆菌对生物胺的降解作用不尽相同,原因可能是不同植物乳杆菌的 suf I基因上有差异,导致表达产物有所不同,也可能存在其他的生物胺降解基因,佟婷婷等[33]也发现了一株具有降解生物胺能力的布氏乳杆菌t1不含suf I基因,说明还存在其他间接降解生物胺的机制。
一株优良的生物胺降解菌株,不仅具有降解种类和降解率高的特性,还必须不含产生物胺的潜在基因,关于氨基酸脱羧酶基因的研究,目前主要集中在组氨酸脱羧酶(histidine decarboxylase gene,hdc),酪氨酸脱酸酶(tyrosine decarboxylase gene,tdc)和鸟氨酸脱羧酶(ornithine decarboxylase genehdc,odc)中。本文对19株生物胺降解菌中这 3个基因的携带情况进行了研究。从表2可知,19株植物乳杆菌中都不含有odc基因,分离自泡菜中的2株菌SK4和SK5中同时含有hdc和tdc基因,还有2株醋醅源植物乳杆菌CP5,CP6和3株乳制品源植物乳杆菌MP3,MP4,MP5中只含有tdc基因。由此可知,有些菌株中同时含有生物胺降解和生成基因,这些潜在的生物胺生成基因,可能会在某种环境诱导下表达生成氨基酸脱羧酶,从而催化氨基酸底物生成生物胺,因此,对于生物胺降解优良菌株的筛选,必须确保其不含生物胺生成相关基因。
2.3 亚硝酸盐和生物胺降解菌在鱼肉发酵香肠中的应用
2.3.1 降解菌对鱼肉发酵香肠中微生物的影响
图 1为乳酸菌对鱼肉香肠发酵过程各种微生物数量变化的影响。如图1所示,在整个48 h的鱼肉香肠发酵过程中,总菌数呈上升趋势,添加了乳酸菌发酵剂处理组香肠中的总菌数显著高于对照组(P<0.05)。乳酸菌在发酵过程中大量繁殖,成为优势菌,发酵48 h后接种发酵剂处理组中的乳酸菌数高出对照组 1个数量级,达到10.56 lg cfu/g,但接种单菌(L. plantarum CP3)和混菌发酵(L. plantarum CP3+L.saki M4,活菌数比为1:1)没有显著差异(P>0.05)。肠杆菌和假单胞菌作为发酵香肠的腐败指示菌,从发酵开始就开始繁殖,与对照组相比,接种乳酸菌发酵剂后,显著抑制了肠杆菌和假单胞菌的生长(P<0.05),并且混菌的抑菌效果显著强于单菌(P<0.05),这是因为 L.saki M4具有高产细菌素的能力。Zhang等[34]也在发酵香肠中报道了类似的结果,证明接种乳酸菌发酵剂或添加乳酸菌素等抑菌物质可以抑制病原菌和腐败菌的生长,保证产品的卫生,降低食品安全隐患。另外,研究结果显示,接种乳酸菌发酵剂的鱼肉香肠中,发酵24 h后,与对照组相比,其中的酵母菌显著降低。而酵母菌对于发酵香肠的风味和质地等具有重要的品质贡献作用[35-36],曾雪峰[9]发现酵母菌联合乳酸菌和葡萄球菌共发酵酸鱼,不仅使最终产品中不饱和脂肪酸、香气物质的含量、质构和感官等得到了显著提升,并且发现酵母菌联合乳酸菌发酵协助增强了对酸鱼发酵过程中生物胺产生的抑制作用。本文中接种的乳酸菌在抑制腐败菌的同时,对其中的有益菌-酵母产生了一定的抑制作用,为了消除这一不利影响,因此在今后的鱼肉香肠发酵工艺研究中,需要进行乳酸菌和优良酵母菌联合发酵,细化接种比例,接种条件,充分考虑二者之间的互作协同机制。

图1 乳酸菌对鱼肉香肠发酵过程各种微生物数量变化的影响Fig.1 Effect of inoculated Lactobacillus on microbial populations evolution in fish sausages during fermentation process
2.3.2 降解菌对鱼肉发酵香肠中亚硝胺的影响
在酸性条件下,发酵香肠中的亚硝酸盐转变为亚硝酸,不稳定的亚硝酸分解为亚硝酐(nitrosan anhydride,N2O3),亚硝酐是活化亚硝化合物,可以与胺类物质发生亚硝基化反应生成致癌物质N-亚硝胺[6]。
1978年国际癌症研究机构(IARC)大会上对亚硝胺类化合物的致癌性进行了评定,认为二甲基亚硝胺(N-nitrosodimethylamine,NDMA)和二乙基亚硝胺(N-nitrosodiethylamine,NDEA)是(2A组)致癌性强的物质,而把亚硝基吗啉(N-nitrosomorpholine,NMOR),甲基乙基亚硝胺(N-nitrosomethylamine,NMEA),N-亚硝基吡咯烷(N-nitrosopyrrolidine,NPYR),N-亚硝基哌啶(N-nitrosopiperidine,NPIP)和 N-二丁基亚硝胺(N-dibutylnitrosamine,NDBA)等列为2B 类致癌物质(2B,对人体可能致癌,即在动物试验中发现的致癌性证据尚不充分,对人体的致癌性证据有限)。中国在 GB 9677-1998食品中亚硝胺限量卫生标准中规定,肉制品中NDMA不得高于3 µg/kg,NDEA不得高于5 µg/kg。
按照1.3.5中的方法,采用气质联用技术对鱼肉发酵香肠发酵过程中各种亚硝胺的变化进行了测定,结果见图2。图2表明:除NDMA外,其余亚硝胺的质量分数在整个鱼肉香肠发酵过程中都呈现上升趋势,NDMA的含量在发酵24 h后,呈下降趋势。接种乳酸菌发酵剂处理组的香肠,发酵12 h后各种亚硝胺的质量分数显著下降(P<0.05),并且混种接种优于单菌,与对照组相比,发酵48 h后NDEA,NDMA,NMOR的质量分数分别极显著下降了47.2%(P<0.01),50%(P<0.01)和81.89%(P<0.01)。尤其是 NMEA,在处理组发酵香肠中没有被检测出(P<0.01),而对照组中NMEA的质量分数却高达 2.2 µg/kg(48 h)。最终,接种了 L. plantarum CP3+L.saki M4的混菌发酵香肠中总亚硝胺的质量分数比对照组极显著降低了62.76%(P<0.01)。

图2 乳酸菌对鱼肉香肠发酵过程各种亚硝胺含量变化的影响Fig.2 Effect of inoculated Lactobacillus on N-nitrosoamine changes in fish sausages during fermentation process
对照组发酵香肠中NDEA的质量分数(6.25 µg/kg)超出国标中的规定限量,而接入乳酸菌发酵剂后,降为3.3 µg/kg(P<0.01)。而对照组中NDMA的质量分数仅为0.8 µg/kg,远低于国标中的限量,说明NDMA不是此类发酵香肠的主要安全隐患。另外,试验结果显示接种乳酸菌的发酵鱼肉香肠中NMOR的质量分数分别为1.56µg/kg(L. plantarum CP3)(P<0.01)和 1.03 µg/kg(L.plantarum CP3+L.saki M4)(P<0.01),而未接乳酸菌的对照组香肠中NMOR的质量分数高达5.69 µg/kg。NPYR,NPIP和NDBA在本试验中未被检测出。Nie等[17]报道乳酸菌之所以可以降解发酵肉制品中的亚硝胺,除了胺氧化酶等一系列酶的作用外,乳酸菌在发酵过程中产生的乳酸使pH值降低,也会导致亚硝酸盐、亚硝酸盐残基和亚硝胺的减少。
2.3.3 降解菌对鱼肉发酵香肠中生物胺的影响
图 3为乳酸菌对鱼肉香肠发酵过程各种生物胺含量变化的影响。

图3 乳酸菌对鱼肉香肠发酵过程各种生物胺含量变化的影响Fig.3 Effect of inoculated Lactobacillus on biogenic amine changes in fish sausages during fermentation process
图 3结果显示,接种乳酸菌发酵剂的鱼肉发酵香肠中各种生物胺的含量显著低于对照组(P<0.05),发酵48 h后腐胺、尸胺和酪胺的含量分别降低了 76.83%,93.33%和 88%。腐胺和尸胺是鱼肉发酵香肠中最主要的生物胺,发酵48 h后,L. plantarum CP3组发酵香肠中腐胺和尸胺的质量分数比对照组极显著下降了 63.87%(P<0.01)和80.61%(P<0.01)。Bovercid等[7]也得到了相似的结论,证明传统自然发酵香肠中检测出的腐胺和尸胺的含量显著高于其他种类的生物胺,并且采用乳酸菌发酵剂接种发酵后,腐胺和尸胺的含量显著降低。肠杆菌中的脱羧酶活性很强,被认为是腐胺和尸胺最主要的产生者,本文中联合接种L.saki M4后,协同提高了生物胺的降解率(P<0.01),这是由于L.saki M4具有产细菌素活性,加强抑制了发酵鱼肉香肠中肠杆菌的生长。
酪胺也是发酵香肠中主要的生物胺[37]。由图3可知,添加了乳酸菌发酵剂的鱼肉香肠中酪胺的含量下降极显著(P<0.01),降低了将近88%左右,但接种单菌和混菌的降解效果没有显著差异。相似地,Liu等[38]采用酿酒酵母发酵草鱼香肠的研究试验中,酪胺的含量也显著降低。但 Nie[17]和 Zhang等[34]报道在采用植物乳杆菌和酿酒酵母发酵的鲢鱼香肠和采用汉逊德巴利酵母和解脂耶罗维亚酵母发酵的干香肠中酪胺的含量反而高于对照组。生物胺的降解机理复杂,与所使用菌种、添加量、发酵基质中的其他成分如香辛料等及pH值、渗透压等有关,需进一步研究。
组胺是毒性最强的生物胺,对机体会产生很多健康问题[17]。图3结果显示,发酵48 h后,对照组发酵鱼肉香肠中组胺的质量分数为 23.45 mg/kg,而接种 L.plantarum CP3+L.saki M4的处理组香肠中组胺的质量分数下降极显著(P<0.01),为4.56 mg/kg。鱼肉发酵产品中较低的组胺含量也被Liu[38],Mah等[39]证明,认为只要在原料采购和加工过程中严格卫生标准、操作程序,发酵终产品中组胺的含量是可以被控制的。
精胺在本试验中未被检测出。对照组中亚精胺的质量分数低于20 mg/kg,接种乳酸菌发酵后下降极显著(P<0.01),为6.22 mg/kg。这与Nie等[17]报道的结果相似,即精胺和亚精胺的含量在发酵鱼肉制品中非常少,推测此类多胺不是有微生物的脱羧作用形成的,而是原料肉中的生理微组分。
2.3.4 降解菌对鱼肉发酵香肠其他理化指标的影响
表 3为鱼肉发酵香肠其他理化指标的测定结果。由表3可知,添加乳酸菌发酵剂菌种的发酵香肠pH值(P<0.05)、硫代巴比妥酸(TBA)(P<0.01)和挥发性盐基氮(TVB-N)(P<0.01)的含量显著低于对照组,单菌和混菌发酵差异不显著(P>0.05)。添加了乳酸菌发酵剂的鱼肉香肠的pH值显著降低,低pH值有利于腐败菌的抑制和亚硝酸盐和亚硝胺降解。
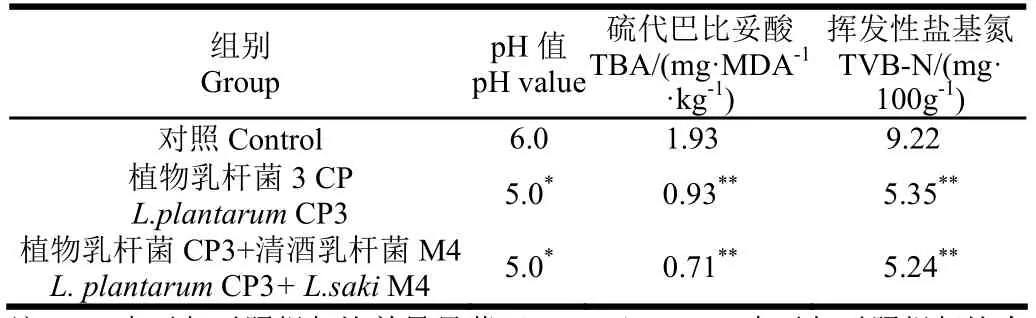
表3 乳酸菌对鱼肉发酵香肠其他理化指标的影响(48 h)Table 3 Effect of inoculated Lactobacillus on other physico-chemical indexes of fish sausages
另外,乳酸菌产生的各种有机酸,及最终生成的酯类物质等,对发酵鱼肉香肠的风味具有重要的贡献作用。TVB-N和TBA值反应肉以及肉制品蛋白质分解成胺和脂肪氧化程度,是判断肉制品品质的重要指标。
3 结 论
1)L. plantarum CP3对亚硝酸盐和生物胺的降解能力最强,分别达到95%和77%,PCR结果显示此菌株中含有亚硝酸盐降解酶(HP、GR、ORD)和生物胺降解的相关基因(suf I),且不含生物胺生成相关基因(hdc,tdc,odc)。
2)L. plantarum CP3对发酵香肠中4种亚硝胺-二乙基亚硝胺(NDEA),二甲基亚硝胺(NDMA),亚硝基吗啉(NMOR)和甲基乙基亚硝胺(NMEA)的生成都具有显著的抑制作用,联合接种L.saki M4可以协同提高亚硝胺的降解能力。与对照组相比,接种 L. plantarum CP3+L.saki M4的鱼肉香肠,发酵48 h后腐胺、尸胺和酪胺的含量分别降低了76.83%,93.33%和88%。接种乳酸菌处理组香肠中的肠杆菌、假单胞菌等腐败菌及pH值、硫代巴比妥酸(TBA)和挥发性盐基氮(TVB-N)的含量显著低于对照组。
3)综上所述,L. plantarum CP3可以显著抑制鱼肉香肠发酵过程中亚硝胺和生物胺的积累,提升了发酵香肠的营养质量和安全性保证,体现了其良好的开发应用前景。
