Lasiodiplodia theobromae激活芒果防御酶基因差异表达的研究
2018-08-16苏初连梅志栋杨石有刘晓妹蒲金基
康 浩,苏初连,梅志栋,杨石有,刘晓妹,蒲金基,张 贺*
(1.海南大学热带农林学院,海南 海口 570228;2.中国热带农业科学院环境与植物保护研究所,海南 海口 571101;3.澄迈县农业局,海南 澄迈 571900)
Lasiodiplodiatheobromae是发生在热带和亚热带地区常见的一种病原真菌[1]。芒果蒂腐病是芒果采后的主要病害,也是世界芒果主产区的主要病害之一。可可球二孢蒂腐菌(Lasiodiplodiatheobromae)在幼果期侵入并潜伏于果实中,潜伏期长,扩展迅速,常温下3~5 d即可导致整个果实腐烂[2],储藏期病果率一般为10 %~40 %,发病严重时可达100 %[3],在我国芒果主产区内普遍发生。【研究意义】寄主植物被病原菌侵染时能够激活自身抗病防御酶基因高效表达,从而抵抗病原菌的侵染,提高其抗病性,有助于病害的有效管理。【前人研究进展】采后热处理对芒果蒂腐病的控制效果不太稳定[4],异菌脲、咪鲜胺等化学药剂处理对该病有一定控制效果,但易产生农药残留、药害和抗药性等问题,该病成为影响芒果经济效益的重要因素之一[2]。有关于抗性产生的生理生化机理的研究也很多,如苯丙氨酸解氨酶PAL参与木质素和植保素的合成,降低真菌、细菌侵入时分泌的果胶酶、β-1,3葡聚糖酶的活性,增加植物细胞壁厚度,增加植物自身的抗病性[5];Sticher[6]认为过氧化物酶POD和多酚氧化酶PPO活性的提高可以作为抗性产生的生理生化标志[7]。超氧化物歧化酶SOD主要通过清除植物体内由于各种胁迫或伤害引起的过多自由基,减轻活性氧对寄主细胞膜脂的损伤及对细胞的破坏作用。因此,这些酶活性增强对植物的抗病反应有着十分重要的作用[8]。本实验室中国热带农业科学院环境与植物保护研究所热带果树病害研究组前期研究发现诱抗剂BTH处理芒果叶片后可以明显提高各类酶的活性。【本研究切入点】本文选用芒果蒂腐菌的分生孢子分别接种芒果叶片和果实,定时取样,通过实时荧光定量PCR(Quantitative Real-Time PCR,qRT-PCR)技术分析了7个防御酶相关基因的表达,再结合热度图综合评价了病原菌侵染所诱导的防御酶基因的表达情况。【拟解决的关键问题】本研究通过抗病相关防御酶基因的差异性表达以期增强寄主植物对病原菌的抵抗能力,减缓病原菌在寄主植物内的扩展,并为了解病原菌与寄主之间的相互作用奠定基础。
1 材料与方法
1.1 材料
供试材料:贵妃芒的嫩叶和成熟果采自中国热带农业科学院热带作物品种资源研究所国家芒果种质资源圃内。
试剂:RNAprep Pure多糖多酚植物总RNA提取试剂盒和RevertAid First Strand cDNA Synthesis Kit购自天根生化科技有限公司;DNA Marker DL 5000为大连宝生物工程有限公司产品,荧光定量试剂盒UltraSYBR Mixture (Low Roe)购自康为试剂公司;其它常用试剂均为常规分析纯试剂。
1.2 方法
1.2.1 芒果组织总RNA的提取和cDNA第一链的反转录 供试材料为胶孢炭疽菌分生孢子(浓度为1.0 ×106个/mL)侵染贵妃芒嫩叶和果皮的组织,于不同时间点(0,12,24,36,48,72 hpi)取样,提取不同时间点组织的总RNA并反转录成cDNA第一链,将反转录后的cDNA稀释10倍,备用。
贵妃芒果实和叶片总RNA的提取参照天根生化科技公司的RNAprep Pure多糖多酚植物总RNA提取试剂盒中的方法。提取各组织的总RNA后,用超微量紫外分光光度计(Nanodrop 2000C型)并结合2 %的琼脂糖凝胶电泳,测定提取RNA的OD,估算RNA浓度,-80 ℃保存作为后续研究。第一链cDNA的合成是按照天根公司的FastQuant RT Kit(with gDNase)试剂盒的方法,供试各个样品反转录的总RNA的量统一为0.5 μg。
1.2.2 实时荧光定量PCR 以芒果超氧化物歧化酶 (MiSOD) 、多酚氧化酶(MiPPO) 、过氧化物酶(MiPOD)、几丁质酶(MiCHI)、病程相关蛋白1(MiPR1)、苯丙氨酸解氨酶 (MiPAL)、生长素反应因子(MiARF)等抗病防御酶基因为对象,内参基因为芒果18 S(Mi18S),通过实时荧光定量PCR(Quantitative Real-time PCR)分析抗病防御酶基因在Lasiodiplodiatheobromae分生孢子侵染贵妃芒嫩叶、果实时的表达量。所用基因引物序列均由北京华大基因合成,PAGE纯化。
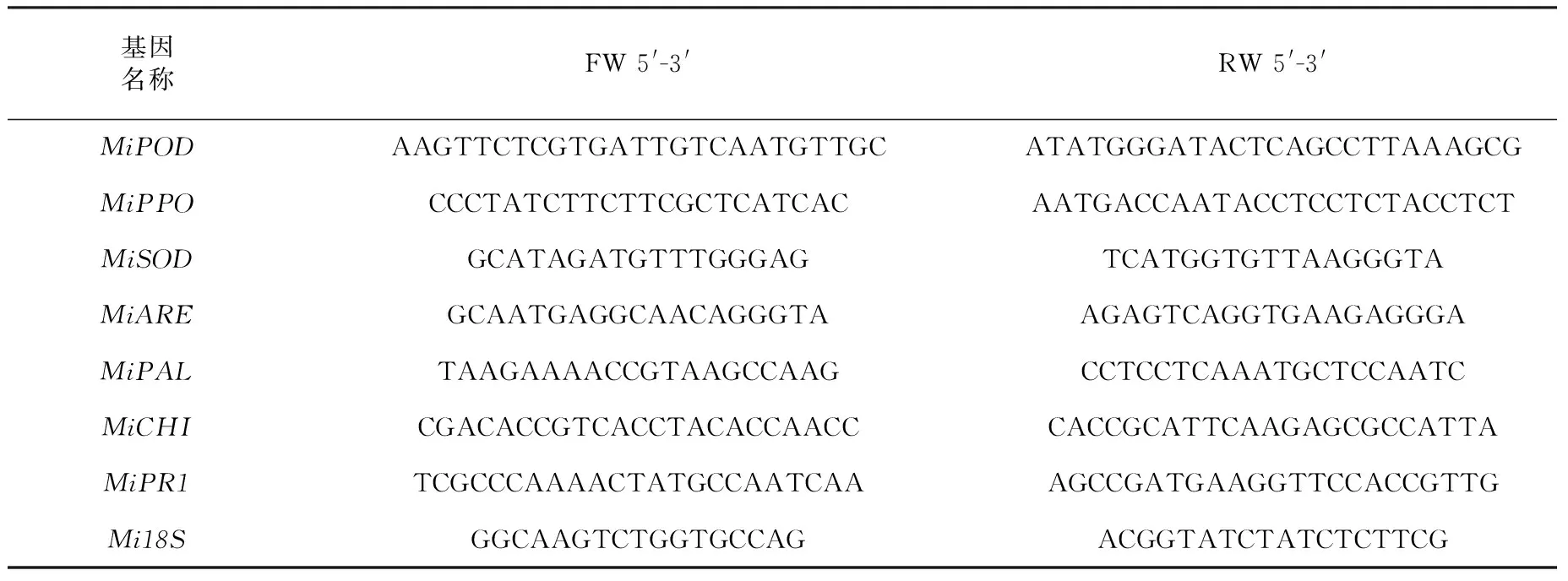
表1 供试引物序列
采用Quant Studio 6 Flex实时荧光定量PCR检测系统,每个PCR反应体系为20 μl:2× Mix 10 μl,cDNA 1 μl,上下游引物各0.5 μl,ddH2O 8 μl,每个样本重复4次。
PCR反应程序为:95 ℃预变性10 min;95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸30 s,40个循环;50 ℃保存,在72 ℃时收集荧光信号。
1.2.3 数据分析 通过实时荧光定量PCR仪自带软件(QuantStudioTM6 Flex Real-Time PCR System Software)获得各个样品的Ct值,以0 h的表达量为对照,运用2-△△Ct法进行数据统计,并对数据采用邓肯新复极差法进行方差分析[9]。
参照Deng[10]等人的方法,运用HemI 1.0.3.3软件绘制热度图,综合分析各防御酶相关基因在不同时间点、不同组织内的表达差异。
2 结果与分析
2.1 Lasiodiplodia theobromae侵染芒果果实时防御酶相关基因表达量分析
通过qRT-PCR分析抗病防御酶基因在Lasiodiplodiatheobromae分生孢子侵染贵妃芒果实时的表达量,果实中7个芒果防御酶基因中活性氧相关基因(MiPOD、MiPPO)的表达量在各个时间段均差异显著,活性氧相关的3个防御酶基因(MiPOD、MiPPO、MiSOD)表达量在36 h达到最大值,但MiPOD、MiPPO在6、12、24、48、72 h的表达量均低于0 h,MiPPO、MiSOD在6、12、24 h这3个时间点表达量的变化趋势没有MiPOD的变化趋势快(图1);抗病相关的4个基因(MiCHI,MiARF,MiPR1和MiPAL)表达量的变化趋势与活性氧相关的基因较为相似,也在36 h时表达量达到最大值(图2),但MiPR1整体呈先上升后下降的趋势,36 h后的表达量显著低于0 h的表达量,MiCHI,MiPAL在6和12 h时的表达量与0 h无显著差异。
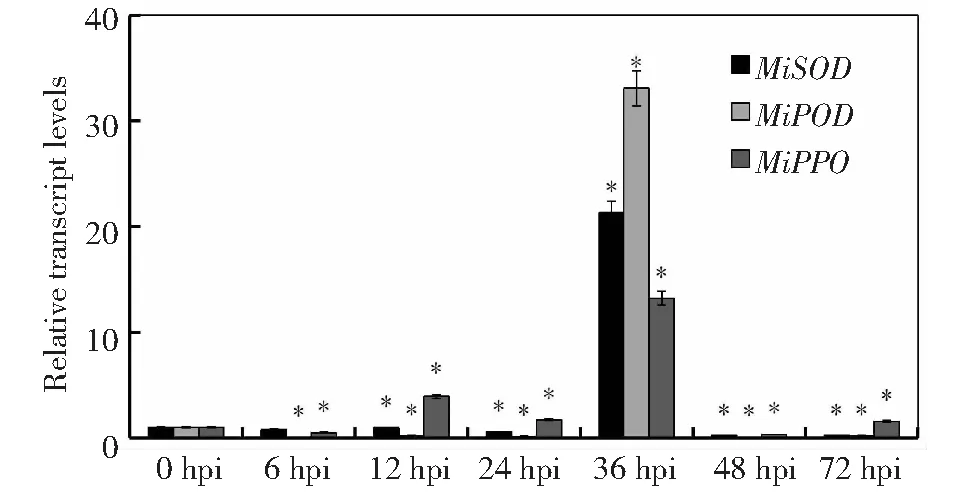
图1 芒果果实3个活性氧相关基因在不同时间点的表达Fig.1 Expression of 3 active oxygen related genes in mango fruits at different time points
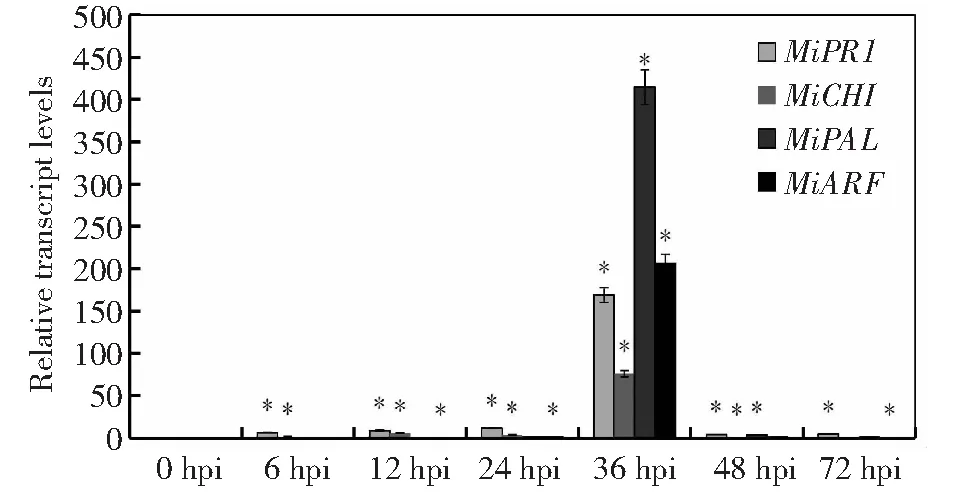
图2 芒果果实4个抗性相关基因在不同时间点的表达分析Fig.2 Expression analysis of 4 resistance-related genes in mango fruits at different time points
通过HemI 1.0.3.3软件绘制热度图3显示,Lasiodiplodiatheobromae分生孢子在侵染芒果果皮时能够明显激活7个防御酶相关基因的表达,部分基因在一些时间点高表达;接种36 h 时,7个基因均高效表达,明显高于后续的时间点。MiPR1基因在整个侵染过程中均持续性地高表达,36 h时仍为最高表达量,而MiPOD基因除在36 h时表达量较0 h时高,其他时间点的表达量均较0 h时偏低。
2.2 Lasiodiplodia theobromae侵染芒果叶片时防御酶相关基因表达量分析
叶片中,7个芒果防御酶基因中活性氧相关基因(MiPOD、MiPPO)的表达量在各个时间点差异显著,活性氧相关的3个基因(MiPOD、MiPPO、MiSOD)表达量在24 h达到最大值,其中MiPOD、MiPPO在各个时间点的表达量均较0 h的高,MiSOD除12、24 h表达量较0 h显著增高,其他时间点表达量不显著;抗病相关的4个基因(MiCHI,MiARF,MiPR1和MiPAL)表达量差异显著,且变化趋势较活性氧相关基因大。4个基因中除MiARF外其他3个均为正调控表达,MiARF表达量呈逐渐下降趋势,MiPR1基因的表达量72 h时最大,MiCHI基因的表达量48 h最大(图4~5)。

图3 芒果果实7个防御相关基因在不同时间点的表达图谱分析Fig.3 Expression patterns of 7 defense-related genes in mango fruits at different time points
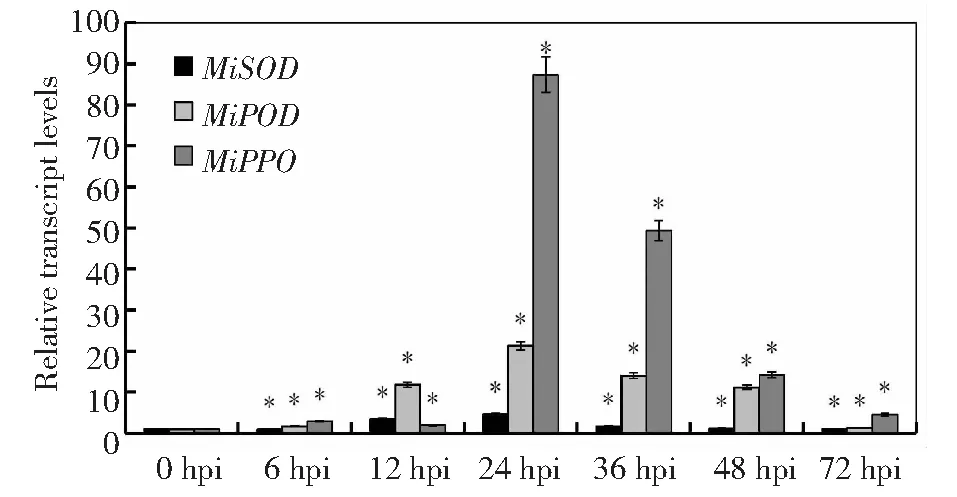
图4 芒果叶片3种活性氧相关基因在不同时间表达分析Fig.4 Expression of 3 active oxygen related genes in mango leaves at different time points
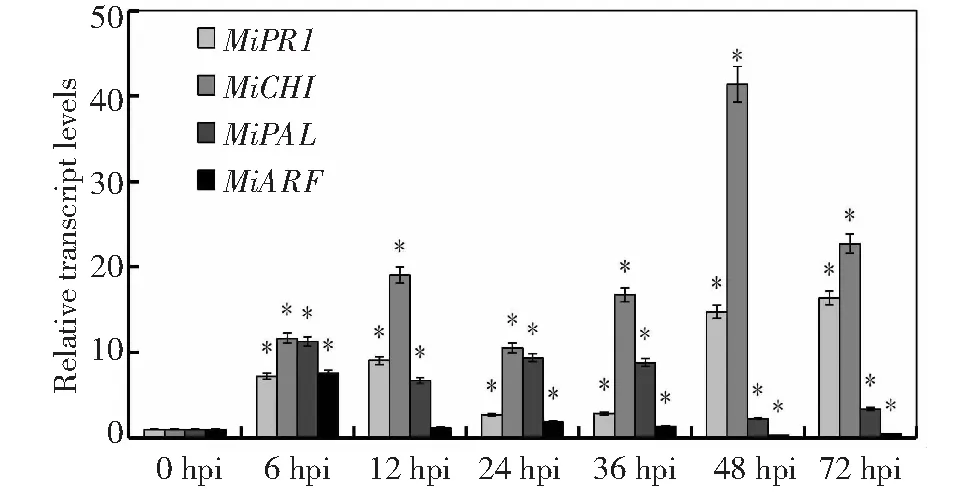
图5 芒果叶片4种抗性相关基因在不同时间表达分析Fig.5 Expression analysis of 4 resistance-related genes in mango leaves at different time points
通过HemI 1.0.3.3软件绘制热度图6显示,Lasiodiplodiatheobromae分生孢子在侵染芒果果皮时能够明显激活7个防御酶相关基因的表达,部分基因在一些时间点高表达;除基因MiSOD在6 h、MiARF在48、72 h时出现负调控表达其他基因在整个时间段均为正调控表达。基因MiPOD和MiPPO的表达量呈先上升后下降趋势,基因MiCHI持续高表达,MiPR1在接种72 h时出现最高表达量。
3 讨 论
寻找抗病相关基因对于了解病原菌与寄主之间的相互作用机制有重要意义,有助于病害的有效管理。为抵御各种病原微生物的侵入,寄主植物自身有发达的防御机制,包括利用物理屏障,限制病原体的传播和产生抗菌化合物抑制病原菌的定殖、生长。此外,细胞壁中某些蛋白能识别病原体引起下游防御反应[11]。
中国热带农业科学院环境与植物保护研究所热带果树病害研究组前期王芳[12]等人研究发现200 μg/mL BTH处理芒果叶片后MiPAL、MiPPO、MiCAT、MiSOD、MiPOD等5种抗病相关基因的酶活性均显著提高。王媛[8]等研究发现病原菌侵染寄主组织后,寄主组织被侵染部位酶的活性增加,感病后酶活性增加越快,植物的抗病性就强,反之则减弱。

图6 芒果叶片7个防御相关基因在不同时间的的表达图谱分析Fig.6 Expression patterns of 7 defense-related genes in mango leaves at different time points
植物的抗病性与POD酶有关,POD酶的高活性是植物抗病的生化机制之一[8]。病原菌侵染后会引起寄主组织中CAT活性下降[13],而POD和APX的活性会增加[14]。超氧化物歧化酶SOD能够清除植物体内过多自由基,减轻活性氧对寄主细胞及细胞脂膜的损伤和破坏作用;H2O2能够在细胞间稳定传输,高浓度的H2O2可以引起植物病变部位的过敏性反应直接杀死入侵病原菌,启动膜脂过氧化,引起细胞死亡,在抗病中起作用[15]。
4 结 论
Lasiodiplodiatheobromae分生孢子侵染芒果嫩叶和成熟果实,能够不同程度地诱导MiPOD、MiPPO、MiCHI、MiPR1等7个防御酶基因的表达,激发寄主植物对病原菌的抵抗能力,起到延缓病原菌在寄主组织内的迅速扩展的作用。
