见微知著水的电离
2018-08-15李萍
李 萍
(山东省枣庄八中 277000)
水是一种极弱的电解质.25℃ 1 L纯水中只有1.0×10-7mol的水分子电离,水的离子积常数Kw约为1.0×10-14mol2·L-2.水的电离程度非常小,但其具有重要意义.
一、水电离应用
1.用水的电离平衡认识化学反应的本质
(1)活泼金属与水的反应

(2)盐的水解反应
在溶液中盐电离出的离子与水电离的H+或OH-结合生成弱电解质,破坏水电离平衡,促进水电离,使c(H+)≠c(OH-),盐溶液呈现酸碱性.
以上反应都是以水的电离为前提,反应过程中伴随水的电离平衡移动.
2.水的电离是工业电解水制氢的基础
电解制氢的原理是水电离出的H+被还原生成H2,水电离出的OH-被氧化生成O2.可以说没有水电离,就无法实现水电解.此外在惰性电极电解电解质的水溶液时,也可能是水电离的H+或OH-参加反应.如工业电解饱和食盐水制氢气、氯气和NaOH时,反应的H+就来自水电离.电解过程伴随水电离平衡移动,在阴极区生成H2和NaOH.
3.判断水溶液中粒子浓度关系离不开水的电离
比较溶液粒子浓度大小,如稀醋酸溶液同时存在醋酸和水电离,弱电解质电离是微弱的,但水电离能力远远小于弱酸,溶液粒子浓度由大到小顺序:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-).
稀醋酸钠溶液中,盐电离的弱酸根离子和弱碱阳离子水解是微弱的,但水电离程度远远小于盐水解,溶液粒子浓度由大到小的顺序:c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+).

例1 下列溶液粒子浓度关系正确的是( ).
A.硫化钠溶液c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.草酸钠溶液c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
D.醋酸钠和氯化钙混合溶液c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
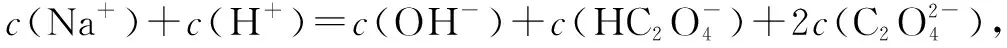
二、水电离常见考点
1.外界条件对水电离平衡影响
影响水电离平衡的因素有温度、酸、碱、能水解的盐和活泼金属等,水的电离平衡移动符合勒夏特列原理.

A.向水中加入稀盐酸,平衡逆向移动,c(H+)降低
B.向水中加入少量固体醋酸钠,c(OH-)增大,水的离子积常数不变
C.向水中加人少量固体NaOH,平衡正向移动,c(H+)降低
D.将水加热,水的离子积常数增大,pH不变
答案:B
2.水电离出的c(H+)和c(OH-)的计算(25 ℃时)
中性溶液,c(OH-)=c(H+)=1×10-7mol·L-1
溶质为酸的溶液,酸溶液中H+来源于酸的电离和水的电离,而OH-只来源于水的电离,即酸溶液计算水的电离需求OH-的浓度.如pH=2的盐酸,溶液中的c(OH-)=1×10-12mol·L-1,即水电离出的c(H+)=c(OH-)=1×10-12mol·L-1;溶质为碱的溶液,碱溶液中OH-来源于碱的电离和水的电离,而H+只来源于水的电离.即碱溶液计算水的电离需求H+的浓度.如pH=12的NaOH溶液,溶液中c(H+)=1×10-12mol·L-1,即由水电离出的c(H+)=c(OH-)=1×10-12mol·L-1.

3.水电离图像
把水的离子积以图像形式呈现出来,既能考查对图像的分析能力,也考查对水的离子积的理解和应用能力.解此类问题时应牢牢把握离子积也属于平衡常数只与温度有关.曲线上的点都代表平衡点,其c(H+)·c(OH-)=Kw.改变温度,c(H+)和c(OH-)一定不在曲线上.温度不变改变其他条件,c(H+)和c(OH-)可能会改变,但Kw不变,表示的点还在曲线上.
例3 一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( ).

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入氯化铁可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
答案:A.
