mRuby2在原核细胞中的表达及纯化
2018-07-05刘志云鲁秀敏
余 瑛,刘志云,余 磊,鲁秀敏
(重庆理工大学 药学与生物工程学院, 重庆 400054)
蛋白质是现代分子生物学中最重要的研究对象之一。蛋白质研究过程中通常需要通过紫外分析、同位素标记、酶标记等方法进行跟踪检测,过程繁琐。荧光蛋白由于检测方便且不影响蛋白质生物学活性,在分子生物学领域得到越来越广泛的应用,如在基因功能鉴定中用于基因定位[1-2]、基因调节[3-4]、蛋白质相互作用[5]研究等,在医药研发中用于肿瘤检测[6-8]、药物筛选[9-10]等。荧光蛋白通常需要特定波长的光源激发才能发出荧光,检测过程仍需要依赖昂贵的仪器。
mRuby2由斯坦福大学的Lin等[11]设计,是最明亮的单体红色荧光蛋白之一。在双荧光报告系统中利用Clover 和mRuby2替换CFP和YFP,可显著提高检测的灵敏性[11-12]。mRuby2作为荧光标记还用于观察真核活细胞迁移过程以及蛋白质在细胞中的分布、转移等现象[13]。
最近研究发现,荧光蛋白mRuby2能在原核系统中高效表达,产生穿透力极强的红色荧光。这种荧光蛋白在活细胞中的表达及体外纯化过程都能在日光下直观地呈现,方便随时对目的蛋白进行跟踪检测。本研究构建了mRuby2的原核表达菌株,观察了该基因在大肠杆菌中随诱导时间表达水平发生变化的过程,采用Ni亲和层析对mRuby2编码的重组红色荧光蛋白进行了纯化。mRuby2编码的红色荧光蛋白在表达及纯化过程中均呈现出极好的可视性和指示性,特别适合作为生化、分子生物学实验教学和蛋白标记的候选基因。
1 材料与方法
1.1 材料
1.1.1 供试菌株及质粒
菌株DH5α、BL21(DE3),质粒pET30a(+)、pcDNA3-mRuby2由本实验室保存。
1.1.2 主要试剂
限制性内切酶BamHI、EcoRI,T4 DNA 连接酶、LA Taq DNA聚合酶、DNA 分子量marker 100 bp Ladder、DL2000购自TaKaRa 公司;蛋白质分子量标准购自碧云天生物技术有限公司;DNA片段琼脂糖凝胶回收试剂盒、质粒提取试剂盒、PCR 产物纯化试剂盒、IPTG 等购自 Omega生物技术有限公司。Ni亲和层析预装柱购自上海生工生物工程有限公司。
1.1.3 主要溶液
① LB液体培养基:NaCl 5 g/L,酵母提取物5 g/L,胰蛋白胨 10 g/L,灭菌备用。
② LB固体培养基:LB液体培养基中加入1.5%琼脂,灭菌备用。
③ 卡拉霉素溶液:30 mg/mL,0.22 μm微孔滤膜过滤除菌。
④ 细胞裂解液:50 mmol/L Tris-HCl (pH值为8.0),0.1mol/L NaCl,0.1 mmol/L PMSF。
⑤ 平衡溶液:50 mmol/L Tris-HCl (pH值为8.0),0.1 mol/L NaCl。
⑥ 50 mmol/L咪唑溶液:50 mmol/L Tris-HCl (pH值为8.0),0.1 mol/L NaCl,50 mmol/L咪唑。
⑦ 200 mmol/L咪唑溶液:50 mmol/L Tris-HCl (pH值为8.0),0.1 mol/L NaCl,200 mmol/L咪唑。
1.1.4 主要设备
PCR仪、电泳仪、蛋白纯化仪。
1.2 方法
1.2.1大肠杆菌DH5α,BL21(DE3)感受态细胞的制备
采用CaCl2法[14]制备DH5α,BL21(DE3)感受态细胞。
1.2.2pET30a(+)-mRuby2原核表达载体的构建
1) 引物设计和合成
根据载体pcDNA3-mRuby2序列和pET30a(+)多克隆位点信息,利用Primer5.0设计了一对特异引物F1、R1,两条引物上下游分别带有BamHI或EcoRI识别的酶切位点,引物序列见表1。

表1 PCR引物
2) mRuby2基因片段的获得
mRuby2基因片段采用PCR方法获得,扩增反应体系如下:引物F1(10 μmol/L) 2 μL,R1(10 μmol/L) 2 μL,LA DNA polymerase 1u,10×LA Reaction Buffer 5 μL,dNTP(2.5 μmol/L)2 μL,pcDNA3-mRuby2(2 ng/μL)1 μL,加超纯水至50 μL。反应条件:94 ℃ 5 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min。反应结束后,进行琼脂糖凝胶电泳,用胶回收试剂盒纯化目的基因片段。
3) pET30a(+)与 mRuby2的酶切处理
质粒pET30a(+)及回收后的mRuby2分别用BamHI和EcoRI进行双酶切处理,然后回收纯化。酶切体系为:pET30a(+) 4 μg (或全部回收后的mRuby2),EcoRI(15 U/μL)0.5 μL,BamHI(15 U/μL)0.5 μL,10×H buffer 2 μL,加超纯水至20 μL。37 ℃,1 h孵育后,在1.5%琼脂糖凝胶中进行电泳,用胶回收试剂盒回收酶切片段。
4) 连接与转化
经酶切、回收处理后的pET30a(+)、mRuby2按以下体系进行连接:pET30a(+)(60 ng/μL) 1μL,mRuby2 (20 ng/μL) 1 μL,T4DNA ligase (350 u/μL) 1 μL,10×T4DNA ligase buffer 1 μL,加超纯水至10 μL。16 ℃连接1 h,然后用CaCl2法转化DH5α感受态细胞,转化液涂布含有卡拉霉素的LB平板,37 ℃倒置培养。
1.2.3 pET30a(+)-mRuby2重组子的鉴定
1) 菌落PCR鉴定
从转化平板上挑取转化子,制成菌悬液作为PCR反应模板。按本文1.2.2节PCR反应条件进行扩增。扩增完成后,进行电泳检测。
2) 酶切鉴定
取PCR结果呈阳性的克隆接种于含有卡拉霉素的LB液体培养基,200 r/min,37 ℃过夜培养。提取质粒,进行酶切。酶切体系为:质粒DNA 2 μg,EcoRI(15 U/μL)0.5 μL,BamHI(15 U/μL)0.5 μL,10×H buffer 2 μL,加超纯水至20 μL。37℃,1 h孵育,电泳,观察酶切结果。
1.2.4 mRuby2蛋白的诱导表达
取PCR及酶切验证均为阳性的质粒测序。测序正确的pET30a(+)-mRuby2质粒以CaCl2法转化BL21(DE3)感受态细胞。次日,挑取转化子接种含有卡拉霉素的LB液体培养基,培养至OD600=0.8时加入终浓度为1 mmol/L的IPTG进行表达诱导,间隔1 h收集菌液,比较观察不同诱导时间菌液颜色的变化。并于荧光显微镜下观测mRuby2荧光蛋白表达情况。用SDS-PAGE电泳[14]分析不同诱导时间目的蛋白表达的情况。
1.2.5 镍螯合亲和层析法纯化mRuby2蛋白
1) 细胞裂解液的制备
将1 L诱导后的菌液离心,收集菌体。按细菌湿重∶细胞裂解液(g/g)=1∶5加入裂解液,重悬细胞。用超声法破碎细胞,条件为:功率400 W,超声3 s,间隔2 s,重复180次;4 ℃,16 000 r/min, 15 min离心收集裂解上清;裂解上清用微孔滤膜过滤,冰上放置。
2) Ni亲和层析纯化目的蛋白
用5倍介质体积的平衡溶液平衡层析柱上样,使细胞裂解液随流动相进入层析柱;用5倍介质体积的平衡溶液平衡层析柱,洗去未与介质结合的杂质;用5倍介质体积的50 mmol/L咪唑溶液洗柱去除非特异结合的杂蛋白;用10倍介质体积的200 mmol/L咪唑洗脱目标蛋白,按每管 1 mL收集所有流出液,保存备用。纯化过程流速为15 mL/h。用SDS-PAGE检测mRuby2蛋白纯化情况。
2 结果与分析
2.1 pET30a(+)-mRuby2重组质粒的构建
采用PCR方法以pcDNA3-mRuby2质粒为模板成功扩增出了mRuby2基因片段(见图1),其相对分子质量大小为730 bp。分别将mRuby2与pET30a(+)用BamHI和EcoRI进行酶切,然后连接、转化,在转化平板上挑取5个转化子进行菌落PCR鉴定,1#、2#、5#克隆呈阳性(图2(a),选取1#、2#克隆培养提取质粒进行酶切,产物中均含有大小为730 bp的目的条带(图2(b)),结果显示1#、2#均呈阳性。
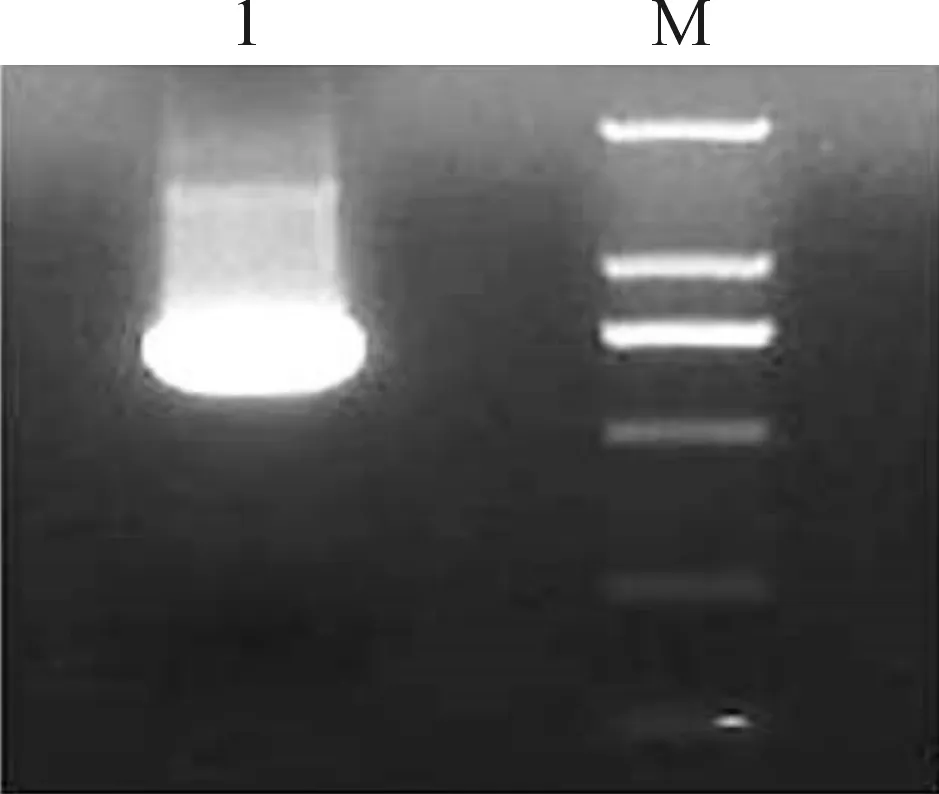
1.PCR扩增的mRuby2片段; M.DL2000
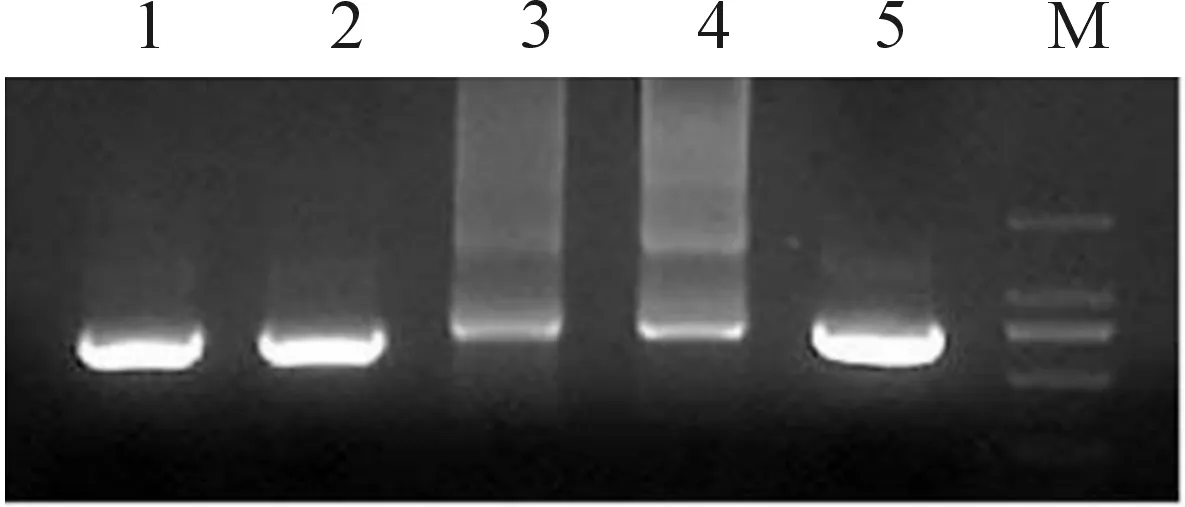
1~5.转化子的PCR扩增产物; M.DL2000(a) 菌落PCR鉴定结果
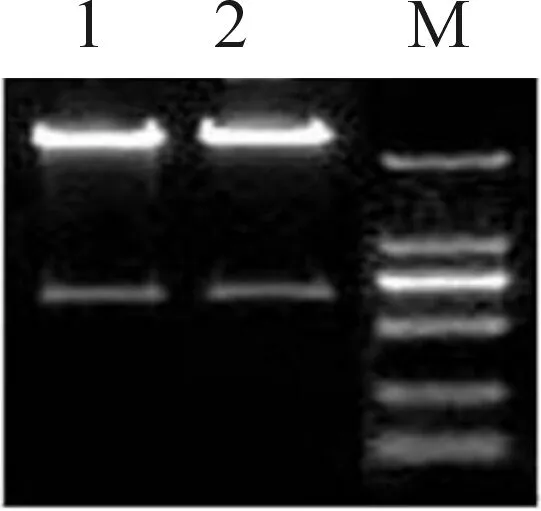
1~2.BamHI、EcoRI双酶切处理重组质粒; M.DL2000(b) pET30a(+)-mRuby2重组质粒的酶切
2.2 pET30a(+)-mRuby2/BL21DE3的培养与mRuby2蛋白的表达
用1#克隆的质粒转化BL21DE3,获得pET30a(+)-mRuby2/BL21DE3菌株。培养pET30a(+)-mRuby2/BL21DE3至OD600达到0.8时加入IPTG诱导目的蛋白表达,间隔1 h收集菌液。观察发现随着诱导时间的增加,发酵液的颜色逐渐转红、加深(图3(a))。诱导后的菌液离心获得的菌体呈较深的粉红色(图3(b)),在荧光显微镜下观察可见菌体整体出现极强的红色荧光(图3(c)),提示mRuby2基因在BL21DE3中得到成功表达。
取不同诱导时间发酵菌液的裂解上清进行SDS-PAGE电泳,结果提示目的蛋白浓度随诱导时间延长表达量增加,诱导4~6 h表达水平达到峰值,与发酵液的颜色变化一致(见图4)。
2.3 mRuby2蛋白的纯化
将1 L诱导6 h的发酵液进行离心,收集mRuby2/BL21DE3菌体,经超声裂解、离心、微孔过滤获得裂解上清。因mRuby2插入pET30a(+)后带有his-tag,可以用Ni亲和层析方法纯化目的蛋白。目的蛋白吸附到Ni亲和柱上使介质由蓝绿色(图4(a1))转变为紫红色(图4(a2)),随着咪唑溶液对目的蛋白洗脱,含有目的蛋白的红色洗脱液流出,亲和柱中的介质又重新恢复呈蓝绿色。
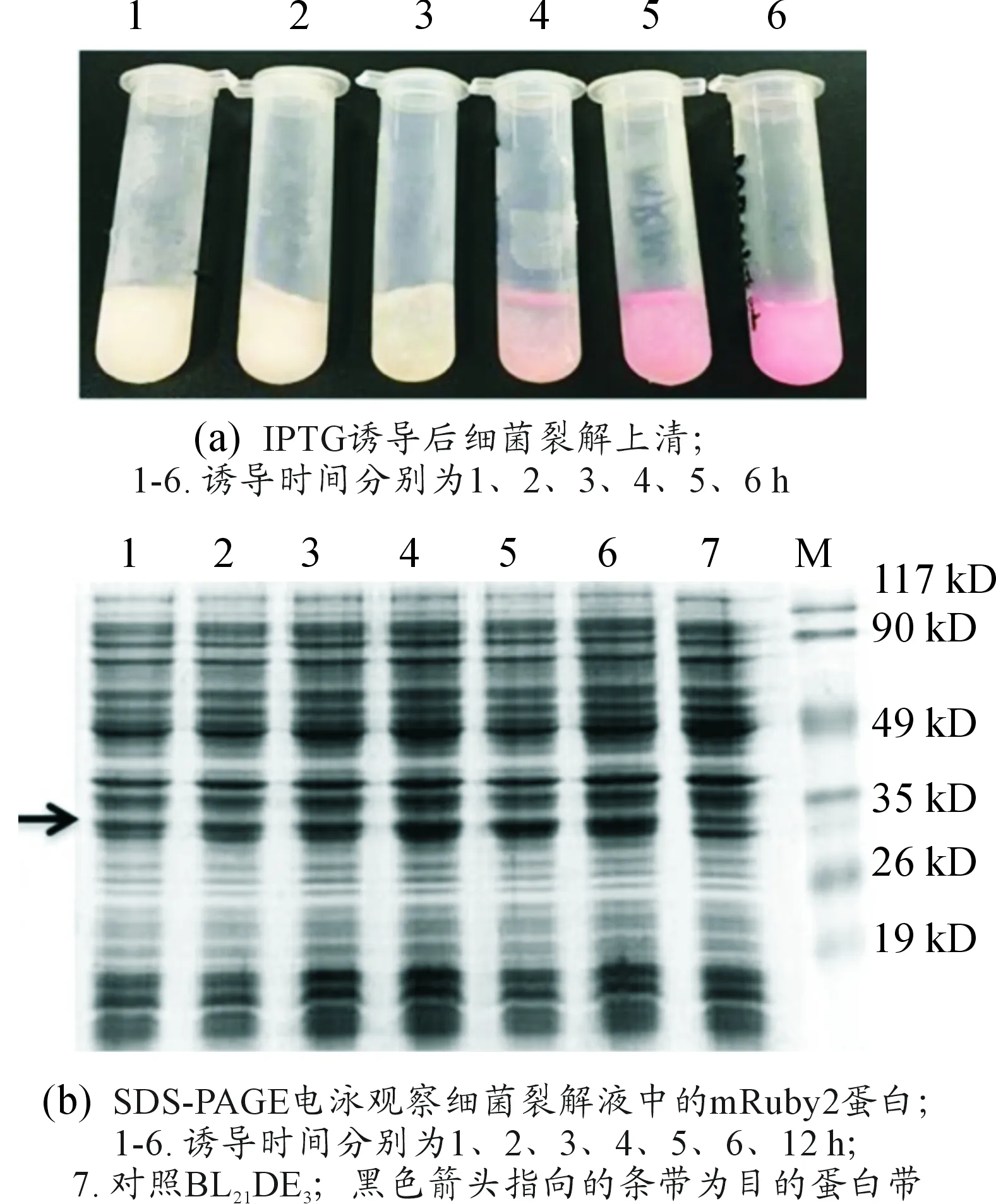
图4 不同诱导时间mRuby2蛋白表达情况的检测
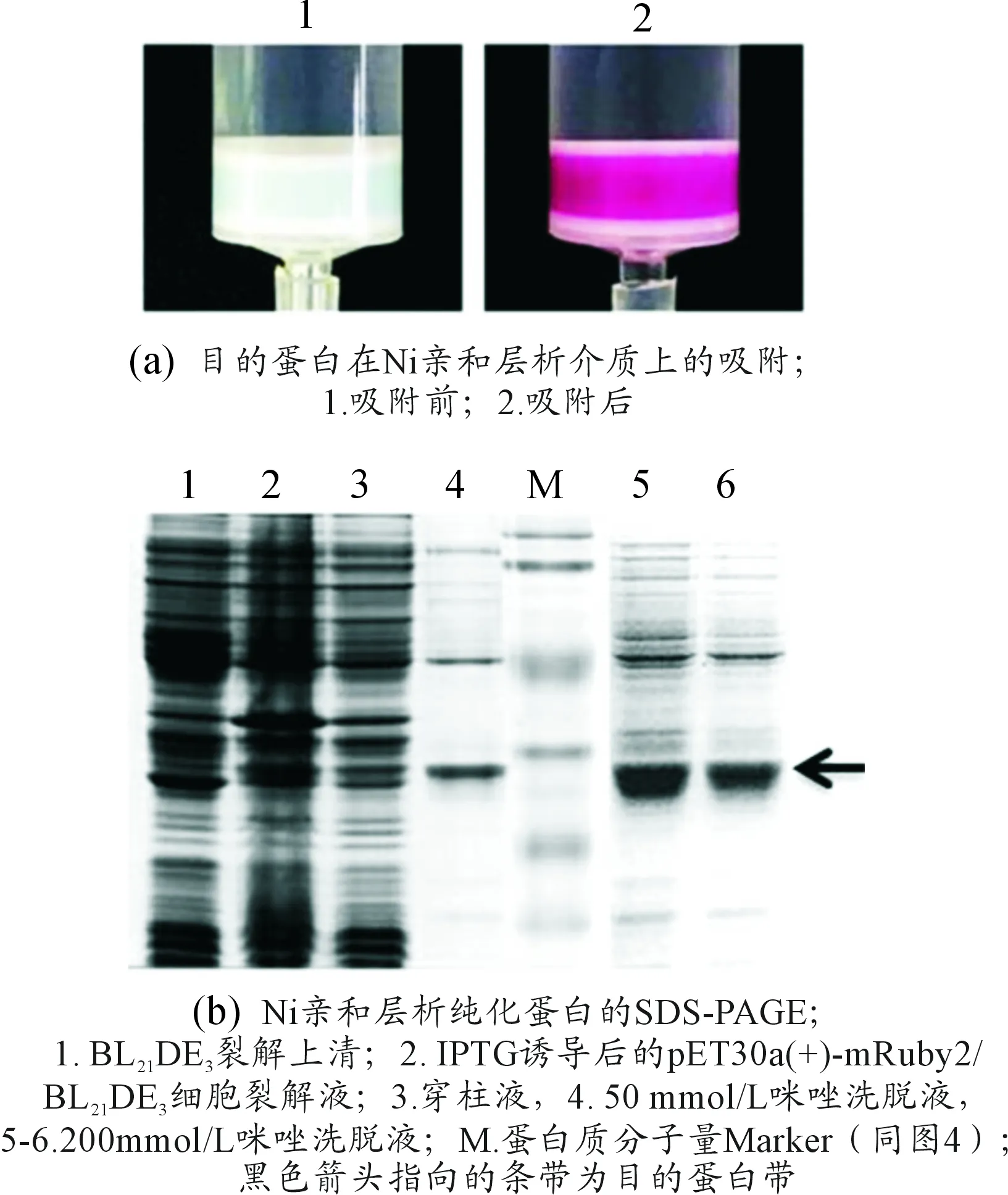
图5 Ni螯合亲和层析纯化目的蛋白
在进行镍螯合亲和层析纯化目的蛋白的过程中,用50 mmol/L咪唑洗脱时,收集到的溶液为浅红色,用200 mmol/L咪唑洗脱时,初期流出液颜色呈较深的枚红色,然后颜色逐渐变浅,最后至无色。SDS-PAGE电泳结果(图4(b))显示50 mmol/L咪唑洗脱的流出液中目的蛋白较少,200 mmol/L咪唑洗脱液中含有大量的目的蛋白,纯度在80%以上。结果表明:纯化过程中流出液颜色的变化与目的蛋白浓度变化一致,说明mRuby2编码的荧光蛋白其颜色艳丽、可视,对纯化过程具有很好的指示作用。
3 讨论
在高校生物化学、分子生物学的实验教学中,基因的克隆、重组表达载体构建、目的蛋白在宿主细胞中的表达及纯化常常作为经典的实验项目开设。在有限的课时内,要达到较好的教学效果,就要求实验过程要易于操作、省时且结果直观。
mRuby2是目前已知的发光强度最大的红色荧光蛋白之一。在LB液体培养基中,接种大肠杆菌BL21(DE3)/pET30a(+)-mRuby2,37 ℃诱导培养后,发酵菌液呈橙红色,离心沉淀的菌体在日光下就可以显现为明显的红色,与转入空载质粒的BL21(DE3)/pET30a(+)比较有明显差异。
在Ni亲和层析实验中,超声破碎、离心后得到的含有重组mRuby2蛋白的裂解液上清为粉红色。当带有His-tag的重组mRuby2蛋白随流动相进入固相时,能清晰地观察到mRuby2重组蛋白吸附在固相上,使层析柱中的Ni亲和介质逐渐由蓝绿色变为玫红色,这一过程中流出的穿柱液颜色几乎无色。随着咪唑溶液的加入,流出液的颜色变为红色,目的蛋白得到洗脱。将收集的裂解液上清、穿柱液、洗脱液进行SDS-PAGE电泳,凝胶染色,观察目的蛋白条带的含量。结果提示层析过程中流动相、固相颜色的变化规律与SDS-PAGE检测的结果一致。因此,mRuby2蛋白不仅可以作为理想的原核表达报告基因,而且在实验教学中能明确、直观地显示目的基因表达的情况。在课时有限时,可以直接根据发酵液或裂解液上清的颜色,判断目的蛋白的存在,也可与菌落PCR鉴定,SDS-PAGE等常规方法配合使用,相互印证。
本文所建立的实验方案包括了完整的mRuby2基因克隆,重组子鉴定,目的蛋白表达、纯化等过程,涉及PCR、酶切、连接、转化、微生物培养、显微观察、超声破碎、SDS-PAGE、亲和层析等实验操作,目测颜色变化可以与常规实验方法相互结合,使学生能直观地观察实验结果,便于对实验方法、原理进行正确理解和掌握。本文建立的研究内容和方法为生物化学实验、分子生物学实验等实践教学提供了一个很好的教学参考方案。
[1] JAMES E R,DAVID M C.A PAL1 Gene Promoter-Green Fluorescent Protein Reporter System to Analyse Defence Responses in Live Cells of Arabidopsis thaliana[J].European Journal of Plant Pathology,2003,109(1):83-94.
[2] GRIMALDI B,DE RAAF M A,FILETICI P.Agrobacterium-mediated gene transfer and enhanced green fluorescent protein visualization in the mycorrhizal ascomycete Tuber borchii:a first step towards truffle genetics[J].Current Genetics.2005,48(1):69-74.
[3] VAN R P,BRAND A H.Imaging into the future:visualizing gene expression and protein interactions with fluorescent proteins[J].Nature Cell Biology.2002,4 (1):E15-20.
[4] CHO J H,EOM S H,AHNN J.Analysis of calsequestrin gene expression using green fluorescent protein in Caenorhabditis elegans[J].Molecules And Cells,1999,9 (2):230-234.
[5] DUNN A R,FRY B A,LEE T Y,et al.Transformation of Phytophthora capsici with genes for green and red fluorescent protein for use in visualizing plant-pathogen interactions[J].Australasian Plant Pathology,2013,42(5):583-593.
[6] KAN Zuxing,LIU Tajen.Video microscopy of tumor metastasis:using the green fluorescent protein (GFP) gene as a cancer-cell-labeling system[J].Clinical & Experimental Metastasis.1999,17(1):59-66.
[7] HOFFMAN R M.Use of fluorescent proteins and color-coded imaging to visualize cancer cells with different genetic properties[J].Cancer and Metastasis Reviews,2016,35(1):5-19.
[8] YAMAMOTO N,TSUCHIYA H.Tumor imaging with multicolor fluorescent protein expression[J].International Journal of Clinical Oncology,2011,16(2):84-91.
[9] LYU Fengting,LIU Libing,WANG Shu.Logic-signal output of fluorescent proteins for screening antibiotic combinations[J].Science China Chemistry,2014,57(12):1696-1702.
[10] CHEN Feng,TU Jiaojiao,LIANG Caishuang,et al.Fluorescent drug screening based on aggregation of DNA-templated silver nanoclusters,and its application to iridium (III) derived anticancer drugs[J].Microchimica Acta,2016,183(5):1571-1577.
[11] LAM A J,ST-PIERRE F,GONG Y,et al.Improving FRET dynamic range with bright green and red fluorescent proteins[J].Nat Methods, 2012,9(10):1005-1012.
[12] BAJAR B T,WANG E S,LAM A J,et al.Improving brightness and photostability of green and red fluorescent proteins for live cell imaging and FRET reporting[J].Sci Rep,2016(6):20889.
[13] KER D F E,SHARMA R,WANG E T H,et al.Development of mRuby2-Transfected C3H10T1/2 Fibroblasts for Musculoskeletal Tissue Engineering[J].PLoS One, 2015,10(9):e0139054.
[14] 奥斯伯.精编分子生物学实验指南[M].北京:科学出版社,2008.
