玉米幼苗叶片响应热胁迫的蛋白质组学分析
2018-07-02朱月清楼旭平余建忠阮松林陈文岳
石 江,赵 琳,朱月清,楼旭平,余建忠,阮松林,陈文岳,*
(1.杭州市农业科学研究院,浙江 杭州 310024;2.杭州市临安区林业局(农业局),浙江 杭州 311300;3.杭州市萧山区农业科学技术研究所,浙江 杭州 311202;4.杭州市淳安县农业局,浙江 杭州 311700)
玉米幼苗叶片响应热胁迫的蛋白质组学分析
石 江1,赵 琳1,朱月清2,楼旭平3,余建忠4,阮松林1,陈文岳1,*
(1.杭州市农业科学研究院,浙江 杭州 310024;2.杭州市临安区林业局(农业局),浙江 杭州 311300;3.杭州市萧山区农业科学技术研究所,浙江 杭州 311202;4.杭州市淳安县农业局,浙江 杭州 311700)
摘 要:玉米是喜温作物,但在生长发育过程中对高温天气敏感,易造成产量下降。以耐热玉米品种先甜5号幼苗为实验材料,在42℃下处理0、0.5和3.0h,提取相应处理的叶片蛋白,进行差异蛋白的筛选,随后对其进行GO分类和KEGG途径分析。结果显示,共筛选到181个差异蛋白,其中上调蛋白95个(定量比值>1.20且P<0.05),下调蛋白86个(定量比值<0.83且P<0.05)。与对照相比,随着热处理时间延长,上调蛋白数明显增加,而下调蛋白数有所下降。GO分类结果显示,2个差异上调蛋白被富集并指定分布在2个细胞组分中,18个差异上调蛋白被富集并指定具有8种分子功能,15个差异上调蛋白被富集并参与17种生物过程。而2个差异下调蛋白被富集并指定分布在8个细胞组分中,29个差异下调蛋白被富集并指定具有11种分子功能,45个差异下调蛋白参与18种生物过程。KEGG分析结果显示,有16个差异上调蛋白被富集并指定参与6个途径,而有14个差异下调蛋白被富集并指定参与8个途径。Domain分析表明,有27个差异上调蛋白被富集并指定含有22个不同结构域,而有34个差异下调蛋白被富集并指定含有21个不同结构域。根据NCBI数据库中信息对上述相关蛋白进行搜索,结果发现假定Dna J分子伴侣蛋白家族、热休克蛋白、硫氧还蛋白H型、脱氢酶和泛素结合酶5类蛋白与耐热关系密切。总之,上述热胁迫响应相关的蛋白质的分析鉴定,可为进一步揭示玉米响应热胁迫的分子机制提供新的思路。
关键词:玉米;热响应;蛋白质组学;GO分类;KEGG路径分析
玉米起源于热带,对温度的适应性较好。但是近年来,随着气温不断变暖,我国玉米产区的异常高温天气出现的频率越来越高,尤其在玉米抽雄到吐丝受精阶段,是夏季中最炎热的时候,而此时也是玉米对温度最为敏感的时期,高温的出现对玉米开花、授粉及籽粒生长可造成严重的影响,甚至会使玉米绝产。因此,研究玉米对高温的耐性机理、寻找耐热相关的蛋白及候选基因对选育耐热玉米品种具有重要作用。Karim等[1]研究发现,生长在高温下的玉米幼苗外形会比较瘦弱,叶片颜色由绿转黄,很快出现早衰,叶片的生长速度变慢,地上部分的生物量减少,CO2的同化速度降低。谷胱甘肽还原酶(GR)是抗氧化酶系统中重要的一员,郭丽红等[2]研究表明,在热胁迫过程中,热激处理过的玉米幼苗的GR活性高于未处理的幼苗,这说明热激处理能使幼苗在逆境中保持较高的GR活性。
热激蛋白家族(HSPs)在正常生长条件下为高水平的组成性表达,但是当细胞处于胁迫条件如热激或改变最适温度,其表达水平会显著地增加[3]。Gulli等[4]发现,玉米中存在与Hvhsp17同源的基因序列,该序列在热胁迫下会被诱导。Jorgensen等[5]从Mo17中分离出了低分子量的HSP cDNA(Zmhsp17.2),并发现在自然高温过程中,Zmhsp17.2转录积累,暗示了它对玉米具有热保护作用。Adrian等[6]研究表明,在高温胁迫条件(42℃,4h)下,两种22ku的HSP22蛋白含量呈现明显增加趋势,持续高温下HSP22一直持续高表达,解除胁迫4h后HSP22蛋白表达量减半,24h后已检测不到。克隆测序后发现HSP22的表达可能有效地影响植物线粒体对热的反应。Qin等[7]利用Microarray分析发现,将玉米基因ZmDREB2A转入拟南芥后,可有4个与热胁迫相关的基因上调了7倍,说明ZmDREB2A基因在热激中起调节其他相关基因表达的作用。热激蛋白基因表达主要通过热激转录因子(Hsf)进行调控[8-10],该调控是通过热激转录因子与热激蛋白基因启动子区的热激元件(heat shock elements,HSE)结合来实现的[11-13],因此Hsf在传递逆境信号以及提高植物抗逆性方面起重要作用[14-15]。李慧聪等[16]利用同源基因克隆的方法,从42℃热胁迫1h的玉米幼叶中克隆了玉米热激转录因子基因ZmHsf06,并对其在不同器官中的表达水平及亚细胞定位进行了分析。结果显示,42℃热胁迫、外源脱落酸(ABA)和盐胁迫处理均使ZmHsf06基因的表达上调。正常条件下ZmHsf06定位在细胞核,37℃热激后也只在细胞核中观察到GFP荧光,推测玉米ZmHsf06可能在转录水平上介导玉米花粉发育,并参与对多种逆境胁迫的调控过程,所有功能的行使均在细胞核内进行。
经过长期的进化,植物已形成一系列用于调控自身生长发育、抵御生物和非生物胁迫逆境的机制,而转录因子(DREB、NAC、WRKY、MYB等)在这些调控中扮演重要的角色[17]。研究表明ZmWRKY44基因的表达受到盐害、高温、H2O2等非生物条件以及ABA激素的抑制,认为ZmWRKY44可能作为负调控因子参与植物的盐害、高温等非生物胁迫及ABA信号转导途径[18]。
近年来,蛋白质组学研究为系统而深入地认识植物高温胁迫应答的分子机制提供了重要信息,已在拟南芥、大豆、水稻和小麦等植物应答高温胁迫过程中研究蛋白质组变化特征。共鉴定到838种响应高温胁迫的蛋白质,其中534种蛋白质表达受到高温诱导,304种蛋白质表达受到抑制[19]。目前在玉米上鲜有关于其响应热胁迫的蛋白质组变化的报道。本研究选取耐热玉米品种先甜5号,对在不同处理时间条件下幼苗叶片响应热胁迫的蛋白组变化进行分析,试图寻找与玉米热响应胁迫相关的蛋白质,为揭示玉米响应热胁迫的分子机制奠定基础。
1 材料与方法
1.1 实验材料
选取耐热玉米品种先甜5号,该品种是由瑞士先正达培育的甜玉米单交种,已通过广东省农作物新品种审定。
1.2 实验方法
1.2.1 玉米幼苗培养及高温处理
将50粒玉米种子播于装有基质的盆钵中,3次重复,播种后放入智能人工气候培养箱中培养,培养温度25℃,湿度为70%,24h光照。待玉米幼苗生长到12~17cm左右,叶片5~7片时进行高温处理,处理温度为42℃,选取0、0.5、3.0h这3个时间点,以0h为未处理的对照,每个时间点选取株高和叶片数基本一致的3株玉米剪取叶片,装入离心管,置于超低温冰箱贮存备用。
1.2.2 玉米叶片总蛋白的提取
称取新鲜玉米叶片0.5g,用液氮研磨成粉末,装入10mL离心管中,迅速加入5mL预冷的蛋白提取液Ⅰ(含10%三氯乙酸的丙酮溶液)进行沉淀粗蛋白(-20℃,1h)提取,期间晃匀5~6次,4℃下13000r·min-1离心20min。取沉淀物,加入10mL预冷的蛋白提取液Ⅱ(含0.07% β-巯基乙醇的丙酮溶液)(-20℃,1h)清洗,4℃下13000r·min-1离心20min。再重复清洗2次。取沉淀,真空抽干得粗蛋白干粉。用裂解液UTC(7mol·L-1尿素,10mmol·L-1DTT,2mmol·L-1EDTA,1mmol·L-1PMSF)溶解沉淀,室温放置1h(涡旋5~6次)。取上清液得蛋白样品,用改良型Bradford法测定试剂盒(酶标法)测定蛋白浓度。
1.2.3 还原烷基化和蛋白酶解
取150μg蛋白样品于1.5mL EP管并加入100mmol·L-1NH4HCO3至100μL,加入11μL 100mmol·L-1的二硫苏糖醇(DTT)使其终浓度为10mmol·L-1,适度涡旋,放于37℃的金属浴上反应1h。加入12μL 500mmol·L-1的IAA使其终浓度为50mmol·L-1左右,避光室温反应30min。将上述反应液转移至超滤管中,4℃ 12000r·min-1离心15min。弃收集管中废液,再向超滤管中加入150μL 100mmol·L-1NH4HCO3于4℃ 12000r·min-1离心15min。重复清洗1次。更换新的收集管,超滤管中加入100mmol·L-1NH4HCO3至总体积为100μL,按照蛋白质量∶Trypsin =25∶1的比例加入Trypsin(1μg·μL-1),于37℃金属浴上过夜(12~16h)。然后于4℃ 12000r·min-1离心15min,再向超滤管中加入100μL 100mmol·L-1NH4HCO3重复离心一次即得肽段溶液。
1.2.4 除盐
在上述肽段溶液中加入5%三氟乙酸(TFA)至其终浓度为0.1%~1%,使肽段酸化。将C18 tip 紧密固定在100μL移液器上,吸取100mL 50%乙腈(ACN)后打出,重复1次以润湿C18填料。吸取吹打0.1%TFA 2次以平衡C18 tip。吸取吹打肽段样品50次以达到最佳吸附效果。吸取吹打0.1% TFA/5% ACN 10次以清洗肽段样品。依次缓慢吸取50μL 含0.1% TFA的50%、60%、70%、80% ACN以洗脱肽段,并将洗脱液收集到新的1.5mL EP管中。得到终体积200μL的样本,真空旋转抽干。加入80μL 0.1% TFA适当涡旋溶解,转移至样品瓶中上机检测。
1.2.5 质谱数据采集
利用Easy-nano LC 1000液相仪和Q Exactive质谱仪(ThermoScientific)进行质谱分析。保护柱,Acclaim PepMap100(75μm内径×2cm长,3μm颗粒C18);分析柱,Acclaim PepMap RSLC(50μm内径×15cm长,3μm颗粒C18)。液相梯度,0~4min,4%~7% B;4~66min,7%~14% B;66~88min,14%~19% B;88~104min,19%~34% B;104~120min,34%~84% B(A,0.1%FA溶于H2O;B,0.1%FA溶于ACN)。喷针电压2.0 kV。毛细管温度,320℃;S-lens,55%;碰撞能量,27% HCD;分辨率设置,一级70000@m/z200,二级17500@m/z200;母离子扫描范围,m/z300-2000;子离子扫描范围,start from m/z100。以DDA模式(Data-dependent)采集前20(TOP20)的肽段。
1.2.6 差异蛋白筛选
利用Perseus软件(版本1.6.0.2)分析差异蛋白质。有效值过滤条件:最小有效值为3。采用2个样品测验:Welch test:S0=2 both side;Permutation based FDR=0.01 report q-value;Number of randomizations=250;-log10(Pvalue)。数据筛选标准:-Log Welch’s T-testP-value>1.3(即Pvalue<0.05);Welch’s T-test Difference>0.585(即fold change>1.5);或Welch’s T-test Difference<-0.585(即fold change<2/3)。
1.2.7 GO分类和KEGG途径分析
GO注释的蛋白来源于UniProt-GOA数据库(http://www.ebi.ac.uk/GOA/)。首先,将鉴定出的蛋白ID转化成UniProt ID,然后绘制成GO IDs,如果某些表达蛋白不能通过UniProt-GOA数据库被注释,那么我们可以利用依赖蛋白序列比对方法的InterProScan软件来进行分析,最后这些蛋白将通过GO注释分为3类:生物过程、细胞组分和分子功能。GO分类的检验方法是费舍尔检验,P<0.05。
KEGG数据库用来注释蛋白通道。首先,利用KEGG在线服务工具(KAAS)来注释蛋白质的KEGG数据库,注释结果用KEGG在线工具(KEGG mapper)形成途径,KEGG检验标准是FDR卡值,P<0.01。
2 结果与分析
2.1 差异表达蛋白质数量分析
通过对不同处理时间下的玉米叶片进行蛋白质组分析,共鉴定出1 996个蛋白,其中1 365个被定量分析,筛选出181个蛋白为差异显著表达,包括95个上调蛋白和86个下调蛋白。与对照相比,随着热处理时间延长,上调蛋白数明显增加,而下调蛋白数有所下降。此外,热处理3.0h(XT3.0)的差异上调蛋白数也明显高于热处理0.5h(XT0.5),而下调蛋白数两者没有明显差异(表1)。
2.2 差异表达蛋白质GO分类
2.2.1 差异上调表达蛋白质GO分析

表1 不同处理与对照中差异表达蛋白数量
XT表示先甜5号,XT0,XT0.5,XT3.0分别表示热处理0、0.5和3.0h。上调蛋白的定量比值>1.2,且P<0.05,下调蛋白的定量比值<0.83,且P<0.05。
XT represents Xiantian No.5.XT0,XT0.5 and XT3.0 represent three time points of heat treatment,0,0.5 and 3.0h,respectively.The quantitative ratio of the up-regulated protein was>1.2 andP<0.05.The quantitative ratio of down regulated protein was less than 0.83 andP<0.05.
接下来,我们对95个差异上调蛋白进行细胞组分、分子功能及生物过程等方面的GO分类,结果发现XT3.0/XT0处理条件下,2个差异蛋白被富集并指定分布在2个细胞组分中,包括质子转运v型ATP酶,V1结构域(GO:0033180)和质子转运v型ATP酶复合物(GO:0033176)。XT0.5/XT0处理条件下,7个差异蛋白被富集并指定具有3种分子功能,包括L-苹果酸脱氢酶活性(GO:0030060)、苹果酸脱氢酶的活性(GO:0016615)和蛋白结合(GO:0005515);XT3.0/XT0处理的6个差异蛋白被富集并指定具有3种分子功能,包括核苷三磷酸酶调节活性(GO:0060589)、转运活性(GO:0005215)和跨膜转运蛋白活性(GO:0022857);XT3.0/XT0.5处理条件下,6个差异蛋白被富集并指定具有2种分子功能,包括未折叠蛋白结合(GO:0051082)和锌离子结合(GO:0008270)。XT0.5/XT0处理条件下,2个差异蛋白被富集并参与2种生物过程,包括苹果酸代谢过程(GO:0006108)和二元酸代谢过程(GO:0043648);XT3.0/XT0处理条件下,10个差异蛋白被富集并参与12种生物过程,包括定位(GO:0051234)、运输(GO:0006810)、定位(GO:0051179)、ATP水解偶联跨膜转运(GO:0090662)、能量耦合质子跨膜转运与电化学梯度(GO:0015988)、ATP水解偶联阳离子跨膜转运(GO:0099132)、ATP水解耦合离子跨膜转运(GO:0099131)、ATP水解耦合质子转运(GO:0015991)、应激反应(GO:0050896)、跨膜运输(GO:0055085)、抗逆反应(GO:0006950)和离子传输(GO:0006811);XT3.0/XT0.5处理条件下,5个差异蛋白被富集并参与4种生物过程,包括耐热反应(GO:0009408)、对温度刺激的反应(GO:0009266)、对非生物刺激的反应(GO:0009628)和抗逆反应(GO:0006950)(表2)。
表2差异上调蛋白GO分类
Table2GO classification of differentially up-regulated proteins

基因分类项GO term基因分类项描述GO terms description相关蛋白Related proteins-log10(P value)细胞组分CellularcomponentXT3.0/XT0质子转运v型ATP酶,V1结构域Proton-transporting V-type ATPase, V1 domain(GO:0033180)NP_001152665.1,XP_008645297.12.56质子转运v型ATP酶复合物Proton-transporting V-type ATPase complex(GO:0033176)NP_001152665.1,XP_008645297.12.35分子功能MolecularfunctionXT0.5/XT0L-苹果酸脱氢酶活性L-malate dehydrogenase activity(GO:0030060)NP_001142100.1,NP_001141337.12.50苹果酸脱氢酶的活性Malate dehydrogenase activity(GO:0016615)NP_001142100.1,NP_001141337.12.18蛋白结合Protein binding(GO:0005515)Q9FR39.1,XP_008670625.1,ACG37608.1,NP_001130694.1,NP_001152033.11.69XT3.0/XT0核苷三磷酸酶调节活性Nucleoside-triphosphatase regulator activity(GO:0060589)NP_001183437.1,NP_001152033.12.26转运活性Transporter activity(GO:0005215)NP_001152665.1,Q84RL7.2,XP_008645297.1,NP_001104949.11.94跨膜转运蛋白活性Transmembrane transporter activity(GO:0022857)NP_001152665.1,XP_008645297.1,NP_001104949.11.50XT3.0/XT0.5未折叠蛋白结合Unfolded protein binding(GO:0051082)AFW67420.1,XP_008670278.1,NP_001135416.31.52锌离子结合Zinc ion binding(GO:0008270)NP_001132009.1,XP_008677172.1,NP_001292782.11.44生物过程BiologicalprocessXT0.5/XT0苹果酸代谢过程Malate metabolic process(GO:0006108)NP_001142100.1,NP_001141337.12.30二元酸代谢过程Dicarboxylic acid metabolic process(GO:0043648)NP_001142100.1,NP_001141337.11.85XT3/XT0定位Establishment of localization(GO:0051234)NP_001152665.1,Q84RL7.2,NP_001183437.1,XP_008645297.1,ACG41076.1,NP_001104949.12.69

续表2
XT表示先甜5号,XT0、XT0.5、XT3.0分别表示热处理0、0.5和3.0h。所有GO项的P值小于0.05,相反,所有GO项的-log10P值均大于1.301 0,即-log10P值越大,则越显著。下同。
XT represents Xiantian No.5.XT0,XT0.5 and XT3.0 represent three time points of heat treatment,0,0.5 and 3.0h,respectively.Pvalues of all GO terms are lower than 0.05.Conversely,-log10(Pvalue) values of all GO terms are greater than 1.301 0,that is,the greater -log10(Pvalue) value,the better significance.The same as below.
2.2.2 差异下调表达蛋白质GO分析
同样,我们对86个差异下调表达蛋白进行细胞组分、分子功能及生物过程等方面的GO分类,结果发现XT0.5/XT0处理条件下,2个差异蛋白被富集并指定分布在8个细胞组分中,包括细胞器内膜(GO:0019866)、线粒体内膜(GO:0005743)、线粒体膜(GO:0031966)、线粒体外膜(GO:0005740)、线粒体部分(GO:0044429)、细胞器膜(GO:0031090)、外膜(GO:0031975)和细胞器外膜(GO:0031967)。XT0.5/XT0处理条件下,11个差异蛋白被富集并指定具有9种分子功能,包括铁离子结合(GO:0005506)、通过合并或降低分子氧来作用于配对的供体的氧化还原酶活性(GO:0016705)、肽基脯氨酰顺反异构酶活性(GO:0003755)、顺反异构酶活性(GO:0016859)、血红素结合(GO:0020037)、四吡咯结合(GO:0046906)、异构酶活性(GO:0016853)和氧化还原酶活性(GO:0016491);XT3.0/XT0处理条件下,11个差异蛋白被富集并指定具有8种分子功能,包括过氧化物酶活性(GO:0004601)、以过氧化氢作为受体的氧化还原酶活性(GO:0016684)、抗氧化活性(GO:0016209)、血红素结合(GO:0020037)、四吡咯结合(GO:0046906)、氧化还原酶活性(GO:0016491)、肽基脯氨酰顺反异构酶活性(GO:0003755)和顺反异构酶活性(GO:0016859)。XT3.0/XT0.5处理条件下,15个差异蛋白被富集并指定具有8种分子功能,包括苹果酸脱氢酶的活性(GO:0016615)、氧化还原酶活性(GO:0016491)、以铜蛋白为受体,作用于二元酚和有关物质为供体的氧化还原酶活性(GO:0052880)、Plastoquinol-质体蓝素还原酶活性(GO:0009496)、L-苹果酸脱氢酶活性(GO:0030060)、氧化还原酶活性,NAD或NADP作为受体,作用于供体的CH-OH组(GO:0016616)、氧化还原酶活性,作用于供体的CH-OH组(GO:0016614) 和糖原(淀粉)合成酶活性(GO:0004373)。XT0.5/XT0处理条件下,13个差异蛋白参与10种生物过程,包括肽氨基酸修饰(GO:0018193)、细胞蛋白修饰过程(GO:0006464)、高分子变性(GO:0043412)、蛋白变性过程(GO:0036211)、光合作用,光反应(GO:0019684)、肽基脯氨酸修(GO:0018208)、蛋白肽基脯氨酰异构化(GO:0000413)、前体代谢产物和能量的产生(GO:0006091)、氧化还原过程(GO:0055114)和电子传递链(GO:0022900)。XT3.0/XT0处理条件下,18个差异蛋白参与14种生物过程,包括氧化应激反应(GO:0006979)、耐压反应(GO:0006950)、肽氨基酸修饰(GO:0018193)、应激反应(GO:0050896)、氧化还原过程(GO:0055114)、细胞蛋白修饰过程(GO:0006464)、蛋白修饰过程(GO:0036211)、高分子变性(GO:0043412)、肽基脯氨酸修饰(GO:0018208)、蛋白肽基脯氨酰异构化(GO:0000413)、单体代谢过程(GO:0044710)、柠檬酸循环(GO:0006099)、柠檬酸代谢过程(GO:0006101)和有氧呼吸(GO:0009060)。XT3.0/XT0.5处理条件下,18个差异蛋白参与8种生物过程,包括氧化还原过程(GO:0055114)、二元酸代谢过程(GO:0043648)、苹果酸代谢过程(GO:0006108)、单体代谢过程(GO:0044710)、单一的生物过程(GO:0044699)、蛋白肽基脯氨酰异构化(GO:0000413)、肽基脯氨酸修饰(GO:0018208)和肽氨基酸修饰(GO:0018193)(表3)。
2.3 差异表达蛋白质的KEGG分析
2.3.1 差异上调表达蛋白质的KEGG分析
为了明确95个差异上调蛋白的功能,我们对其进行KEGG分析,结果发现,XT0.5/XT0处理条件下,有3个差异蛋白被富集并指定参与3个途径,包括在生物光合作用中的碳固定-大豆gmx00710基因、半胱氨酸和蛋氨酸代谢-大豆gmx00270基因和柠檬酸循环(TCA循环)-大豆gmx00020基因;XT3/XT0处理条件下,有6个差异蛋白被富集并指定参与2个途径,包括内质网上的蛋白加工-大豆gmx04141基因和吞噬体-大豆gmx04145基因;XT3/XT0.5处理条件下,有10个差异蛋白被富集并指定参与2个途径,包括内质网上的蛋白加工-大豆gmx04141基因和泛素介导的蛋白水解-大豆gmx04120基因(表4)。
2.3.2 差异下调表达蛋白质的KEGG分析
表3差异下调蛋白的GO分类
Table3GO classification of differentially down-regulated proteins

基因分类项GO term基因分类项描述GO terms description相关蛋白Related proteins-log10(P value)细胞组分Cellular componentXT0.5/XT0细胞器内膜Organelle inner membrane(GO:0019866)CAA26600.1, NP_001151372.12.65线粒体内膜Mitochondrial inner membrane(GO:0005743)CAA26600.1, NP_001151372.12.65线粒体膜Mitochondrial membrane(GO:0031966)CAA26600.1, NP_001151372.12.29线粒体外膜Mitochondrial envelop(GO:0005740)CAA26600.1, NP_001151372.12.18线粒体部分Mitochondrial part(GO:0044429)CAA26600.1, NP_001151372.12.13细胞器膜Organelle membrane(GO:0031090)CAA26600.1, NP_001151372.12.13外膜Envelope(GO:0031975)CAA26600.1, NP_001151372.12.08细胞器外膜Organelle envelope(GO:0031967)CAA26600.1,NP_001151372.12.08分子功能Molecular functionXT0.5/XT0铁离子结合Iron ion binding(GO:0005506)NP_001105244.1, NP_001105255.12.44通过合并或降低分子氧来作用于配对的供体的氧化还原酶活性Oxidoreductase activity, acting on paired donors, with incorpora-tionor reduction of molecular oxygen(GO:0016705)NP_001105244.1, NP_001105255.12.44肽基脯氨酰顺反异构酶活性Peptidyl-prolyl cis-trans isomerase activity(GO:0003755)XP_008645736.1, NP_001149265.12.08顺反异构酶活性Cis-trans isomerase activity(GO:0016859)XP_008645736.1, NP_001149265.12.08血红素结合Heme binding(GO:0020037)NP_001105244.1, ACG48334.1,NP_001105255.12.00四吡咯结合Tetrapyrrole binding(GO:0046906)NP_001105244.1, ACG48334.1,NP_001105255.11.88异构酶活性Isomerase activity(GO:0016853)XP_008645736.1, NP_001168977.1,NP_001149265.11.75氧化还原酶活性Oxidoreductase activity(GO:0016491)P05643.2, NP_001105244.1,NP_001157807.1, NP_001105255.1,CBD26786.1, AFW83444.1,NP_001151372.11.63XT3.0/XT0过氧化物酶活性Peroxidase activity(GO:0004601)NP_001241719.1, NP_001132505.1,XP_008667271.1, NP_001151992.2,NP_001131430.13.97以过氧化氢作为受体的氧化还原酶活性Oxidoreductase activity, acting on peroxide as acceptor(GO:0016684)NP_001241719.1, NP_001132505.1,XP_008667271.1, NP_001151992.2,NP_001131430.13.84抗氧化活性Antioxidant activity(GO:0016209)NP_001241719.1, NP_001132505.1,XP_008667271.1, NP_001151992.2,NP_001131430.13.29血红素结合Heme binding(GO:0020037)NP_001241719.1, NP_001132505.1,XP_008667271.1, NP_001131430.12.52四吡咯结合Tetrapyrrole binding(GO:0046906)NP_001241719.1, NP_001132505.1,XP_008667271.1, NP_001131430.12.37氧化还原酶活性Oxidoreductase activity(GO:0016491)NP_001132505.1, XP_008667271.1,DAA59498.1, CBD26786.1,NP_001131430.1, NP_001241719.1,DAA48574.1, DAA48359.1,NP_001151992.21.82肽基脯氨酰顺反异构酶活性Peptidyl-prolyl cis-trans isomerase activity(GO:0003755)CBD32860.1, NP_001149265.11.82顺反异构酶活性Cis-trans isomerase activity(GO:0016859)CBD32860.1, NP_001149265.11.82XT3.0/XT0.5苹果酸脱氢酶的活性Malate dehydrogenase activity(GO:0016615)NP_001142100.1, NP_001152396.1,DAA63735.1, NP_001141337.14.38

续表3

续表3
表4差异上调蛋白KEGG途径分析
Table4KEGG pathway analysis of differentially up-regulated proteins

处理名称Treatment name代谢途径KEGG-pathway相关蛋白Related protein-log10(P value)XT0.5/XT0在生物光合作用中的碳固定-大豆gmx00710 基因gmx00710 Carbon fixation in photosynthetic organisms-Glycine max(soy-bean)XP_008677788.1,NP_001142100.1,NP_001141337.12.26半胱氨酸和蛋氨酸代谢-大豆gmx00270基因gmx00270 Cysteine and methionine metabolism-Glycine max(soybean)NP_001142100.1,NP_001141337.11.81柠檬酸循环(TCA循环)-大豆gmx00020基因gmx00020 Citrate cycle(TCA cycle)-Glycine max(soybean)NP_001142100.1,NP_001141337.11.43XT3/XT0内质网上的蛋白加工-大豆gmx04141基因gmx04141 Protein processing in endoplasmic reticulum-Glycine max(soy-bean)XP_008670278.1,NP_001183165.1,P24067.3,DAA44894.11.95吞噬体-大豆gmx04145 基因gmx04145 Phagosome-Glycine max(soybean)NP_001152665.1,XP_008645297.11.42XT3/XT0.5内质网上的蛋白加工-大豆gmx04141基因gmx04141 Protein processing in endoplasmic reticulum-Glycine max(soy-bean)ACG35158.1,NP_001183165.1,NP_001105583.1,NP_001130454.1,XP_008670278.1,AFW67420.1,NP_001135416.3,CBM38941.1,P24067.34.51泛素介导的蛋白水解-大豆gmx04120基因gmx04120 Ubiquitin mediated proteolysis-Glycine max(soybean)ACG35158.1,NP_001148188.12.02
同样,我们对86个差异表达蛋白进行KEGG分析,结果发现XT0.5/XT0处理条件下,有6个差异蛋白被富集并指定参与2个途径,包括α-亚麻酸代谢-大豆gmx00592基因和光合作用-天线蛋白-大豆gmx00196基因;XT3.0/XT0处理条件下,有3个差异蛋白被富集并指定参与2个途径,包括谷胱甘肽代谢-大豆gmx00480基因和抗坏血酸和aldarate代谢-大豆gmx00053基因;XT3.0/XT0.5处理条件下,有5个差异蛋白被富集并指定参与4个途径,包括半胱氨酸和蛋氨酸代谢-大豆gmx00270基因、乙醛酸盐代谢-大豆gmx00630基因、丙酮酸代谢-大豆gmx00620基因和在生物光合作用中的碳固定-大豆gmx00710基因(表5)。
2.4 差异表达蛋白质的结构域(Domain)分析
2.4.1 差异上调表达蛋白质的结构域分析
为了明确95个差异上调蛋白在结构上是否存在共同点,我们对其进行Domain分析,结果发现XT0.5/XT0处理条件下,有4个差异蛋白被富集并指定含有4个不同结构域,包括乳酸脱氢酶/糖苷水解酶,家族4,C-末端、乳酸/苹果酸脱氢酶,N-末端、乳酸/苹果酸脱氢酶,C-末端和NAD(P)结合结构域;XT3.0/XT0处理条件下,有9个差异蛋白被富集并指定含有9个不同结构域,包括ATP酶-F1/V1/A1复合物-α/β亚基-N末端结构域、ATP酶-F1/V1/A1复合物-α/β亚基-核苷酸结合结构域、三四氨基酸重复结构域、类似螺旋结构域、含三磷酸核苷水解酶的结合环、翻译延伸因子EF1A/起始因子IF2γ-C末端、热激蛋白70ku-C端结构域、热激蛋白70ku-肽结合结构域和类似翻译延伸因子EFTu-2结构域;XT3.0/XT0.5处理条件下,有19个差异蛋白被富集并指定含有13个不同结构域,包括α晶状体蛋白/HSP20结构域、水孔蛋白、HSP20同类伴侣、泛素结合酶E2、热激蛋白70ku-C端结构域、热激蛋白70ku-肽结合结构域、类似组氨酸激酶的ATP酶-C末端结构域、热激蛋白HSP90-N末端、泛素结合酶/类似RWD、CCHC类型锌指结构、三四氨基酸重复结构域、硫氧还蛋白结构域和类似螺旋结构域(表6)。
2.4.2 差异下调表达蛋白质的结构域分析
表5差异下调蛋白途径分析
Table5Pathway analysis of differentially down-regulated proteins
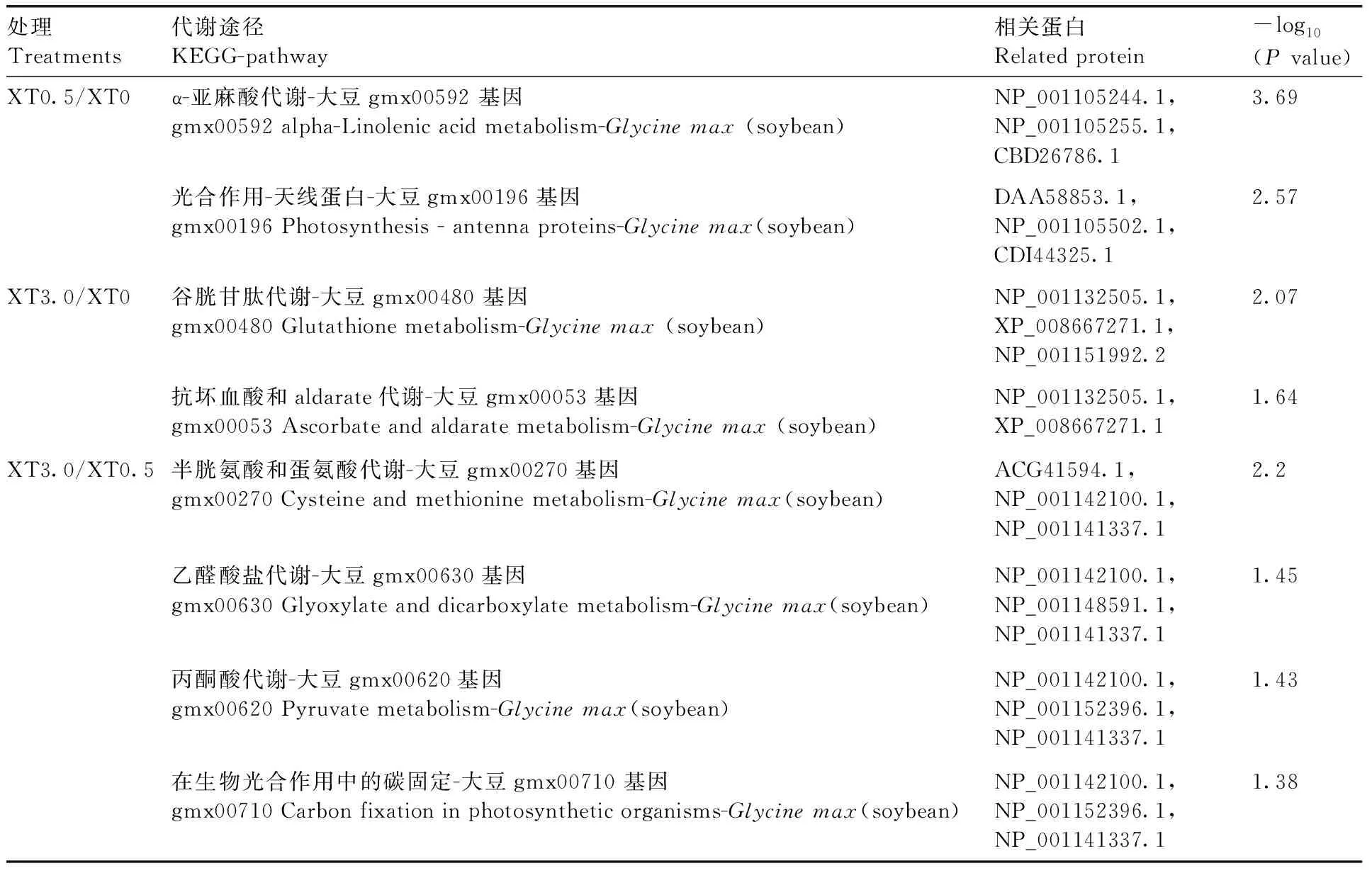
处理Treatments代谢途径KEGG-pathway相关蛋白Related protein-log10(P value)XT0.5/XT0α-亚麻酸代谢-大豆gmx00592 基因gmx00592 alpha-Linolenic acid metabolism-Glycine max(soybean)NP_001105244.1,NP_001105255.1,CBD26786.13.69光合作用-天线蛋白-大豆gmx00196基因gmx00196 Photosynthesis - antenna proteins-Glycine max(soybean)DAA58853.1,NP_001105502.1,CDI44325.12.57XT3.0/XT0谷胱甘肽代谢-大豆gmx00480 基因gmx00480 Glutathione metabolism-Glycine max(soybean)NP_001132505.1,XP_008667271.1,NP_001151992.22.07抗坏血酸和aldarate代谢-大豆gmx00053基因gmx00053 Ascorbate and aldarate metabolism-Glycine max(soybean)NP_001132505.1,XP_008667271.11.64XT3.0/XT0.5半胱氨酸和蛋氨酸代谢-大豆gmx00270基因gmx00270 Cysteine and methionine metabolism-Glycine max(soybean)ACG41594.1,NP_001142100.1,NP_001141337.12.2乙醛酸盐代谢-大豆gmx00630基因gmx00630 Glyoxylate and dicarboxylate metabolism-Glycine max(soybean)NP_001142100.1,NP_001148591.1,NP_001141337.11.45丙酮酸代谢-大豆gmx00620基因gmx00620 Pyruvate metabolism-Glycine max(soybean)NP_001142100.1,NP_001152396.1,NP_001141337.11.43在生物光合作用中的碳固定-大豆gmx00710 基因gmx00710 Carbon fixation in photosynthetic organisms-Glycine max(soybean)NP_001142100.1,NP_001152396.1,NP_001141337.11.38
表6差异上调表达蛋白的Domain分析
Table6Domain analysis of differentially up-regulated proteins

处理Treatments结构域描述Domain description相关蛋白Related protein-log10(P value)XT0.5/XT0乳酸脱氢酶/糖苷水解酶,家族4,C-末端Lactate dehydrogenase/glycoside hydrolase, family 4, C-terminalNP_001142100.1,NP_001141337.12.53乳酸/苹果酸脱氢酶,N-末端Lactate/malate dehydrogenase, N-terminalNP_001142100.1,NP_001141337.12.53乳酸/苹果酸脱氢酶,C-末端Lactate/malate dehydrogenase, C-terminalNP_001142100.1,NP_001141337.12.53NAD(P)结合结构域NAD(P)-binding domainXP_008677788.1,NP_001142100.1,NP_001150639.1,NP_001141337.12.00XT3.0/XT0ATP酶,F1/V1/A1复合物,α/β亚基,N-末端结构域ATPase, F1/V1/A1 complex, alpha/beta subunit, N-terminal domainNP_001152665.1,XP_008645297.12.02ATP酶,F1/V1/A1复合物,α/β亚基,核苷酸结合结构域ATPase, F1/V1/A1 complex, alpha/beta subunit, nucleotide-binding domainNP_001152665.1,XP_008645297.11.93三四氨基酸重复结构域Tetratricopeptide repeat-containing domainNP_001151932.1,NP_001149790.1,1.93类似螺旋结构域Tetratricopeptide-like helical domainNP_001151932.1,NP_001149790.1,1.77含三磷酸核苷水解酶的结合环P-loop containing nucleoside triphosphate hydrolaseNP_001152665.1,CBM38382.1,XP_008645297.1,NP_001136994.1,NP_001149568.21.70

续表6
同样,我们对86个差异表达蛋白进行结构域分析,结果发现XT0.5/XT0处理条件下,有9个差异蛋白被富集并指定含有5个不同结构域,包括叶绿素a/b结合蛋白结构域、亲环蛋白类似结构域、亲环素类肽基脯氨酰顺反异构酶结构域、硫氧还蛋白折叠和谷胱甘肽S-转移酶-N末端;XT3.0/XT0处理条件下,有9个差异蛋白被富集并指定含有5个不同结构域,包括血红素过氧化物酶,植物/真菌/细菌、亲环素类肽基脯氨酰顺反异构酶结构域、亲环蛋白类似结构域、分泌过氧化物酶和RNA识别结构域;XT3.0/XT0.5处理条件下,有19个差异蛋白被富集并指定含有13个不同结构域,包括α晶状体蛋白/HSP20结构域、水孔蛋白、HSP20同类伴侣、泛素结合酶E2、热激蛋白70ku-C端结构域、热激蛋白70ku-肽结合结构域、组氨酸激酶样ATP酶-C末端结构域、热激蛋白HSP90-N末端、泛素结合酶/类似RWD、CCHC类型锌指结构、三四氨基酸重复结构域、硫氧还蛋白结构域和类似螺旋结构域(表7)。
表7差异下调表达蛋白的结构域分析
Table7Domain analysis of differentially down-regulated proteins

处理Treatments域描述Domain description相关蛋白Related protein-log10(P value)XT0.5/XT0叶绿素a/b结合蛋白结构域Chlorophyll a/b binding protein domainDAA58853.1,NP_001105502.1,CDI44325.12.44亲环蛋白类似结构域Cyclophilin-like domainXP_008645736.1,NP_001149265.11.90亲环素类肽基脯氨酰顺反异构酶结构域Cyclophilin-type peptidyl-prolyl cis-trans isomerase domainXP_008645736.1,NP_001149265.1,1.90硫氧还蛋白折叠Thioredoxin-like foldNP_001151414.1,NP_001104979.2,ACG35158.1,ACG45880.11.82谷胱甘肽S-转移酶,N-末端Glutathione S-transferase, N-terminalNP_001151414.1,NP_001104979.21.32XT3/XT0血红素过氧化物酶,植物/真菌/细菌Haem peroxidase, plant/fungal/bacterialNP_001241719.1,NP_001132505.1,XP_008667271.1,NP_001131430.13.15亲环素类肽基脯氨酰顺反异构酶结构域Cyclophilin-type peptidyl-prolyl cis-trans isomerase domainCBD32860.1,NP_001149265.11.80亲环蛋白类似结构域Cyclophilin-like domainCBD32860.1,NP_001149265.11.80分泌过氧化物酶Secretory peroxidaseNP_001241719.1,NP_001131430.11.46RNA识别结构域RNA recognition motif domainXP_008676441.1,ACN29319.1,ACN25391.11.39XT3/XT0.5α晶状体蛋白/HSP20结构域Alpha crystallin/Hsp20 domainNP_001146967.1,CBM38941.1,NP_001105583.1,NP_001130454.12.51水孔蛋白Aquaporin-likeQ84RL7.2,Q9ATM6.12.40HSP20同类伴侣HSP20-like chaperoneNP_001146967.1,CBM38941.1,NP_001105583.1,NP_001130454.12.26泛素结合酶E2Ubiquitin-conjugating enzyme E2ACG35158.1,NP_001148188.12.19热激蛋白70 ku,C端结构域Heat shock protein 70 ku, C-terminal domainNP_001183165.1,XP_008654914.1,P24067.32.12热激蛋白70 ku,肽结合结构域Heat shock protein 70 ku, peptide-binding domainNP_001183165.1,XP_008654914.1,P24067.32.04组氨酸激酶样ATP酶,C-末端结构域Histidine kinase-like ATPase, C-terminal domainXP_008670278.1,NP_001135416.32.02热激蛋白HSP90,N-末端Heat shock protein Hsp90, N-terminalXP_008670278.1,NP_001135416.32.02泛素结合酶/类似RWD Ubiquitin-conjugating enzyme/RWD-likeACG35158.1,NP_001148188.12.02CCHC类型锌指结构Zinc finger, CCHC-typeNP_001132009.1,XP_008677172.11.76三四氨基酸重复结构域Tetratricopeptide repeat-containing domainNP_001151932.1NP_001149790.11.57硫氧还蛋白结构域Thioredoxin domainACG35158.1,CBM39951.1,ACG45880.11.49类似螺旋结构域Tetratricopeptide-like helical domainNP_001151932.1,NP_001149790.11.42
3 讨论
本研究发现,差异上调蛋白和差异下调蛋白中均无共同细胞组分,但两者均具有苹果酸脱氢酶和L-苹果酸脱氢酶活性的分子功能,也具有共同参与苹果酸代谢过程(GO:0006108)、应激反应(GO:0050896)、二元酸代谢过程(GO:0043648)和抗逆反应(GO:0006950)生物过程,尤其是上调表达蛋白中AFW67420.1和CBM38382.1蛋白,它们是与耐热反应(GO:0009408)和对温度刺激的反应(GO:0009266)相关的蛋白。
KEGG分析发现,差异上调蛋白和差异下调蛋白均参与生物光合作用中的碳固定-大豆gmx00710与半胱氨酸和蛋氨酸代谢-大豆gmx00270基因的代谢途径,与之相关的蛋白有XP_008677788.1、NP_001142100.1、NP_001141337.1、ACG41594.1和NP_001152396.1,而NP_001142100.1和NP_001141337.1蛋白在上调蛋白和下调蛋白相同代谢途径中均发挥作用,说明在玉米响应热胁迫中需要这些途径中的不同蛋白表达上调与下调保持平衡,可能与玉米更好地维持生长与热胁迫响应的平衡有关。除了上述途径之外,内质网上的蛋白加工和泛素介导的蛋白降解途径也参与玉米响应热胁迫过程,这与以往植物通过蛋白质合成与周转途径变化来应对高温胁迫的机制[19]基本一致。
Domain分析发现,差异上调蛋白与差异下调蛋白有很多相同的结构域,包括α晶状体蛋白/HSP20结构域、水孔蛋白、HSP20同类伴侣、泛素结合酶E2、热激蛋白70ku-C端和肽结合结构域、热激蛋白HSP90-N末端、泛素结合酶/类似RWD、三四氨基酸重复结构域、类似螺旋结构域、CCHC类型锌指结构域和硫氧还蛋白结构域,其中许多含有与热激蛋白相类似的结构域,且与这些功能相关的蛋白有19个,包括:NP_001146967.1、CBM38941.1、NP_001105583.1等。根据NCBI数据库(https://www.ncbi.nlm.nih.gov/)中信息对上述相关蛋白进行搜索,结果发现这些蛋白可大致分为5类,分别为假定Dna J分子伴侣蛋白家族、热休克蛋白、硫氧还蛋白H型、脱氢酶和泛素结合酶类,其中热休克蛋白有HSP1、16.9ku Ⅰ型HSP 1、Ⅰ型HSP3、HSP82、HSP81-1、HSP26等,而以往并未对这些热休克蛋白有研究报道,今后可深入对其进行研究。
:
[1] KARIM M A,FRACHEBOUD Y.STAMP P.Effect of high temperature on seedling growth and photosynthesis of tropical maize genotypes[J].JournalofAgronomy&CropScience,2000,184(4):217-223.
[2] 郭丽红,陈善铘,王德斌,等.热激和热胁迫过程中玉米幼苗谷胱甘肽还原酶活性和同工酶的变化[J].云南大学学报(自然科学版),2006,28(3):262-266.
GUO L H,CHEN S Y,WANG D B,et al.Changes of glutathione reductase activity and isozymes in maize seedlings during heat shock and heat stress[J].JournalofYunnanUniversity(NaturalScienceEdition),2006,28(3):262-266.(in Chinese with English abstract)
[3] 杨泉女,甄畅迪,王蕴波,等.玉米耐热性研究进展[J].佛山科学技术学院学报(自然科学版),2008,26(4):61-66.
YANG Q N,ZHEN C D,WANG Y B,et al.Progress in research on heat tolerance in maize[J].JournalofFoshanUniversity(NaturalScienceEdition),2008,26(4):61-66.(in Chinese with English abstract)
[4] GULLI M,RAMPINO P,LUPOTTO E,et al.The effect of heat stress and cadmium ions on the expression of a small hsp gene in barley and maize[J].JournalofCerealScience,2005,42(1):25-31.
[5] JORGENSEN J A,NGUYEN H T.Isolation,sequence and expression of a cDNA encoding a Class Ⅰ heat shock protein(HSPl7.2)in maize plant[J].PlantScience,1994,97(2):167-175.
[6] ADRIAN A L,PAUL H B,DINAKAR B,et al.Heat-stress response of maize mitochondria[J].PlantPhysiology,1998,116(3):1097-1110.
[7] QIN F,KAKIMOTO M,SAKUMA Y,et al.Regulation and functional analysis ofZmDREB2Ain response to drought and heat stresses inZeamaysL.[J].PlantJournal,2007,50(1):54-69.
[8] AGASHE V R,HARTL F U.Roles of molecular chaperones in cytoplasmic protein folding[J].SeminarsinCell&DevelopmentalBiology,2000,11(1):15-25.
[9] ELLIS R J.Chaperone substrates inside the cell[J].TrendsinBiochemicalScience,2000,25(5):210-212.
[10] JOLLY C,MORIMOTO R I.Role of the heat shock response and molecular chaperones in oncogenesis and cell death[J].JournaloftheNationalCancerInstitute,2000,92(19):1564-1572.
[11] NOVER L,SCHARF K D,GAGLIARDI D,et al.The Hsf world: classification and properties of plant heat stress transcription factors[J].CellStressChaperones,1996,1(4):215-223.
[12] NOVER L,BHARTI K,DÖRING P,et a1.Arabidopsis and the heat stress transcription factor world:how many heat stress transcription factors do we need[J].CellStressChaperones,2001,6(3):177-189.
[13] LEE J H,HFIBEL A,SCHSFFI F.Derepression of the activity of genetically engineered heat shock factor causes constitutive synthesis of heat shock proteins and increased thermo-tolerance in transgenic Arabidopsis[J].PlantJournal,1995,8(4):603-612.
[14] MISHRA S K,TRIPP J,WINKELHAUS S,et al.In the complex family of heat stress transcription factors,HsfAl has a unique role as master regulator of thermotolerance in tomato[J].Genes&Development,2002,16(12):1555-1567.
[15] NISHIZAWA A,YABUM Y,YOSHIDA E,et al.Arabidopsis heat shock transcription factor A2 as a key regulator in response to several types of environmental stress[J].PlantJournal,2006,48(4):535-547.
[16] 李慧聪,李国良,郭秀林.玉米热激转录因子基因(ZmHsf06)的克隆、表达和定位分析[J].农业生物技术学报,2015,23(1):41-51.
LI H C,LI G L,GUO X L.Cloning,expression and localization analysis of heat shock factor gene(ZmHsf06) in maize[J].JournalofAgriculturalBiotechnology,2015,23(1):41-51.(in Chinese with English abstract)
[17] 于延冲,乔梦,刘振华,等.WRKY转录因子功能的多样化[J].生命科学,2010,22(4):345-351.
YU Y C,QIAO M,LIU Z H,et al.WRKY transcriptional factor function diversification[J].LifeScience,2010,22(4):345-351.(in Chinese with English abstract)
[18] 王娜.玉米ZmWRKY44和ZmWRKY50基因与非生物胁迫相关的功能初探[D].成都:四川农业大学,2013.
WANG N.The function ofZmWRKY44 andZmWRKY50 genes associated with abiotic stress in maize [D].Chengdu:Sichuan Agricultural University,2013.(in Chinese with English abstract)
[19] 刘军铭,赵琪,尹赜鹏,等.利用蛋白质组学技术揭示的植物高温胁迫响应机制[J].应用生态学报,2015,26(8):2561-2570.
LIU J M,ZHAO Q,YIN Z P,et al.Heat-responsive mechanisms in plants revealed by proteomic analysis:a review[J].ChineseJournalofAppliedEcology,2015,26(8):2561-2570.(in Chinese with English abstract)
Proteomicanalysisofmaizeseedlingleavesinresponsetoheatstress
SHI Jiang1,ZHAO Lin1,ZHU Yueqing2,LOU Xuping3,YU Jianzhong4,RUAN Songlin1,CHEN Wenyue1,*
(1.HangzhouAcademyofAgriculturalSciences,Hangzhou310024,China;2.Lin’anDistrictForestryBureau(AgriculturalBureau)ofHangzhou,Hangzhou311300,China;3.AgriculturalScienceandTechnologyInstituteofXiaoshanDistrictofHangzhouCity,Hangzhou311202,China;4.AgriculturalBureauofChun’anCountyofHangzhouCity,Hangzhou311700,China)
Abstract:Maize is a warm-tempered crop,but it is sensitive to high temperature weather during its growth and development,which is easy to cause the decline of yield.In this study,seedlings of a heat-resistant maize variety Xiantian No.5 as experimental materials were treated for 0,0.5,3.0h at 42℃,and leaf proteins from all treatments was extracted to carry out screening of differential proteins,and then the GO classification and KEGG pathway were analyzed.The results showed that 181 proteins including 95 up-regulated proteins(quantitative ratio>1.20 andP<0.05) and 86 down-regulated proteins(quantitative ratio<0.83 andP<0.05) were identified.Compared with the control,the number of up-regulated proteins increased with the increase of heat treatment time,while the number of down-regulated proteins decreased.GO classification indicated that in these differentially up-regulation proteins,there were 2 proteins enriched and designated to 2 cell components,18 proteins enriched and designated to 8 molecular functions and 15 proteins enriched and involved in 17 biological processes.Similarly,in differentially down regulated proteins,there were 2 proteins enriched and distributed in 8 cell components,29 proteins were enriched and designated to 11 molecular functions.45 proteins involved in 18 biological processes.KEGG pathway analysis revealed that 16 differentially up-regulated proteins were enriched and designated to participate in 6 pathways,while 14 differentially down-regulated proteins were enriched and designated to participate in 8 pathways.Domain analysis revealed that 27 differentially up-regulated proteins were enriched and designated to 22 various domains,while 34 differentially down-regulated proteins were enriched and designated to 21 different domains.According to the searching information in NCBI database,we found that 5 proteins of Dna J molecular chaperone family including heat shock protein,thioredoxin H type,dehydrogenase and ubiquitin binding enzyme were likely to be closely related to heat resistance.In conclusion,identification of proteins related to heat stress response can provide an insight to further revealing the underlying molecular mechanism of maize response to heat stress.
Key words:maize;heat response;proteomics;GO classification;KEGG pathway analysis
中图分类号:S513
A
文章编号:1004-1524(2018)06-0893-16
收稿日期:2018-02-15
作者简介:石江(1969—),男,浙江绍兴人,副研究员,主要从事旱粮作物育种与栽培研究。E-mail:569546851@qq.com
,陈文岳,E-mail:21572608@qq.com
10.3969/j.issn.1004-1524.2018.06.03
(责任编辑张 韵)
