泛素特异性肽酶22对肝癌细胞凋亡的影响及机制研究
2018-06-27,,,
,,,
1.大连市友谊医院消化内科,辽宁 大连 116000; 2.中山大学附属第一医院老年病科; 3.上海交通大学医学院附属仁济医院重症医学科
【Abstract】ObjectiveTo investigate the effect of ubiquitin specific peptidase 22 (USP22) on apoptosis of hepatocellular carcinoma cells and its possible molecular mechanism.MethodsRT-PCR and Western blotting were used to detect the expression of USP22 mRNA and protein in human normal Chang liver cells and human hepatoma HepG2 cells. The USP22 gene was silenced by transfection of USP22-siRNA with liposome, and the silencing effect was detected by RT-PCR and Western blotting. The effects of USP22 gene silencing on HepG2 cell cycle and apoptosis were investigated by flow cytometry, and Western blotting was used to detect the effect of USP22 gene silencing on the expressions of Cleaved caspase-3, Cleaved caspase-9, Cyclin D1 and CDK2 proteins.ResultsThe expression of USP22 gene in human hepatocellular carcinoma HepG2 cells was significantly higher than that in human normal Chang liver cells (P<0.05). After siRNA interference with HepG2 cells, the expressions of USP22 mRNA and protein in the intervention group were significantly lower than those in the control group (P<0.05), but there was no significant difference in the negative group (P>0.05). After the siRNA interfered with HepG2 cells, compared with the control group, the expressions of USP22 mRNA and protein in the intervention group were significantly decreased (P<0.05), but the difference in the negative group was not significant (P>0.05). After silence of the USP22 gene, compared with the control group, the proportion of G0/G1phase cells was significantly increased, the proportions of S phase and G2/M phase cells were decreased significantly, and the rate of apoptosis was increased significantly, whose differences were statistically significant (P<0.05); but there was no significant difference in the percentage of G0/G1phase, phase S and phase G2/M cells and apoptosis rate between the negative group and the control group (P>0.05). Compared with the control group, the relative expressions of Cleaved caspase-3, Cleaved caspase-9, Cyclin D1 and CDK2 proteins in the intervention group were significantly reduced (P<0.05), and the difference between the negative group and the control
group was not significant (P>0.05).ConclusionThe gene silencing of USP22 can induce apoptosis of HepG2 cells in hepatocellular carcinoma, and its mechanism may be related to the decline in expression of cell cycle correlated proteins Cyclin D1, CDK2, and apoptotic proteins Cleaved caspase-3 and Cleaved caspase-9.
【Keywords】 Hepatocellular carcinoma; USP22; Apoptosis; Cell cycle
肝癌是一种常见的发生在肝脏的恶性肿瘤,是人类疾病死亡致死的第二大因素。2015年的统计数据[1-2]显示,2012年世界上新增肝癌患者约78万,中国约占其发病率和死亡率的50%。近年来,我国肝癌的发病率和死亡率有明显上升的趋势,严重影响着人们的健康和生活。研究表明,肝癌的发生与饮水污染、酒精、肝炎病毒、性激素和肝硬化等多种因素密切相关,但肝癌具体的发病机制并不明确,在肝癌的预防和治疗方面,我国面临着很大的挑战。肝癌的发生、发展是一个十分复杂的过程,研究肝癌细胞的分子机制对肝癌的治疗和预防具有重要意义。随着肝癌研究的不断深入,寻找抑制细胞生长和细胞凋亡的有效靶点一直是学者们研究的热点。
泛素特异性肽酶22(ubiquitin specific peptidase 22,USP22)是一种泛素特异性肽酶,在细胞周期、细胞凋亡和信号传导等生化反应中发挥着重要作用,与多种疾病的发生、发展密切相关。细胞凋亡是一个多阶段、多步骤和多基因参与的复杂过程,在肝癌的发生、发展过程中具有重要的负调控作用,研究USP22在肝癌细胞凋亡中分子机制,为肝癌的靶向分子治疗提供了新方向。研究[5-7]发现,USP22在甲状腺癌、肺癌和胃癌等多种肿瘤细胞中呈高表达,与肿瘤的发生发展、恶性程度和预后密切相关。有研究[8]发现,USP22在肝癌中高表达,但其对肝癌的作用机制并不明确。目前,关于USP22对肝癌细胞凋亡的影响及其机制的研究较少,因此,本研究通过脂质体转染法干扰肝癌细胞系HepG2细胞中USP22表达,观察其对肝癌细胞凋亡的影响,并探讨其可能的分子机制。
1 材料与方法
1.1材料人正常肝Chang liver细胞和人肝癌HepG2细胞购自中国科学院上海细胞库。USP22-siRNA和Control-siRNA、USP22引物和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物均由北京华大基因有限公司合成,其中USP22-siRNA片段正义链序列为5′-GAAGCAUAUUCACGAGCAUTT-3′,反义链序列为3′-TTCUUCGUAUAAGUGCUCGUA-5′。Control-siRNA片段正义链序列为5′-GAGAAGACUACUCAAGCATT-3′,反义链序列为3′-TTCUCUUCUGAUGAGUUCGUA-5′。胎牛血清购自杭州四季青有限公司,胰蛋白酶、RPMI 1640培养基、Lipofectamine 2000、Trizol试剂均购自美国Invitrogen公司。二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒、细胞周期检测试剂盒和膜联蛋白-V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒均购自美国BD公司。RT-PCR试剂盒、细胞蛋白提取试剂盒、反转录试剂盒和ECL发光试剂盒均购自大连TaKaRa公司。兔抗人USP22、GAPDH、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved cysteinyl aspartate specific proteinase 3,Cleaved caspase-3)、Cleaved caspase-9、细胞周期素D1(Cyclin D1)、细胞周期蛋白依赖性激酶2(recombinant Cyclin dependent kinase 2,CDK2)抗体和HRP辣根酶标记山羊抗兔IgG(IgG-HRP)二抗均购自武汉博士德公司。
1.2 方法
1.2.1 细胞培养、转染及分组:将人正常肝Chang liver细胞和人肝癌HepG2细胞于37 ℃水浴解冻复苏后,以1×106个/ml的细胞浓度接种至含有质量浓度为100 g/L的胎牛血清的RPMI 1640培养基上,置于温度为37 ℃、体积分数为5%的CO2、湿度为95%的培养箱中常规培养,待细胞融合度为70%~80%时,加质量浓度为2.5 g/L的胰蛋白酶消化,以1∶3传代培养。
取对数生长期HepG2细胞,以1×104个/ml的细胞浓度接种至6孔细胞板上,置于体积分数为5%的CO2、饱和湿度和37 ℃培养箱中培养至融合度为70%以上时,按照脂质体转染说明书的操作步骤转染干预组和阴性组的细胞。以转染USP22-siRNA片段序列的细胞为干预组,以转染Control-siRNA片段序列的细胞为阴性组,以不做任何处理的细胞为对照组。转染后在常规条件下培养48 h后收集对数生长期细胞进行实验。
1.2.2 RT-PCR检测USP22 mRNA的表达:收集对数生长期的Chang liver细胞和HepG2细胞,采用Trizol法提取两组细胞的总RNA。根据逆转录试剂盒的操作步骤合成cDNA。以cDNA为模板RT-PCR试剂盒扩增目的基因。总反应体系为20 μl,其中,cDNA模板为2 μl,USP22引物或GAPDH引物各1 μl,PCR master Mix 10 μl、ddH2O 6 μl。PCR反应条件:95 ℃预变性5 min(1个循环),95 ℃变性30 s(35个循环),60 ℃退火30 s(35个循环),72 ℃ 延伸30 s(35个循环),72 ℃总延伸4 min(1个循环)。以GAPDH为内参,采用2-△△Ct法计算USP22 mRNA的相对表达水平。扩增USP22引物上游序列为5′-GGCGGAAGATCACCACGTAT-3′,下游序列为5′-TTGTTGAGACTGTCCGTGGG-3′,GAPDH引物上游序列5′-CGGAGTCAACGGATTTGGTCGTAT-3′,下游序列为5′-AGCCTTCTCCATGGTGGTGAAGAC-3′。根据上述方法检测转染48 h后的干预组、阴性组和对照组细胞中USP22 mRNA的表达水平。其中,所有实验过程中,每组实验设5个复孔,实验重复3次,最后取均值。
1.2.3 Western blotting检测USP22蛋白的表达:收集对数生长期的Chang liver细胞和HepG2细胞,培养48 h后,根据细胞蛋白提取试剂盒提取两组细胞的总蛋白,并根据BCA蛋白检测试剂盒的操作步骤检测提取总蛋白的浓度和纯度。将总蛋白与上样缓冲液按等比例混匀后,沸煮5 min,以每孔50 μl蛋白样品上样,于质量浓度为100 g/L的十二烷基硫酸钠聚丙烯酰胺凝胶中进行电泳分离,取出蛋白凝胶,在400 mA恒流条件下转至聚偏二氟乙烯膜上,放入含有质量浓度为50 g/L脱脂奶粉的TBST溶液中封闭2 h,加入特异性一抗USP22抗体(600倍稀释)和GAPDH抗体(1 000倍稀释),在4 ℃环境中孵育过夜,再与稀释1 000倍的二抗(IgG-HRP)37 ℃反应2 h,以ECL发光试剂盒处理,显影曝光,以GAPDH为内参,分析USP22蛋白的表达水平。采用同样的方法检测转染48 h后的干预组、阴性组和对照组细胞中USP22蛋白的表达水平。
1.2.4 流式细胞仪检测细胞周期和细胞凋亡情况:收集转染48 h的干预组、阴性组和对照组细胞,弃细胞培养液,用胰酶消化细胞,以2 000 r/min离心(离心半径r=12.4 cm)10 min,弃酶消化液,加入冰预冷的磷酸盐缓冲液,调整细胞浓度为3×105个/ml。根据细胞周期检测试剂盒和Annexin V-FITC/PI细胞凋亡试剂盒说明书进行操作,流式细胞仪检测各组细胞的周期分布和细胞凋亡情况。
1.2.5 Western blotting检测细胞Cleaved caspase-3、Cleaved caspase-9、Cyclin D1和CDK2蛋白的表达:取对照组、阴性组和干预组对数生长期细胞,培养48 h后,提取细胞总蛋白,根据1.2.3中的实验方法检测三组细胞中Cleaved caspase-3、Cleaved caspase-9、Cyclin D1和CDK2蛋白的表达情况。
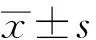
2 结果
2.1USP22在肝癌HepG2细胞中高表达RT-PCR和Western blotting检测结果显示,与人正常肝Chang liver细胞相比,HepG2细胞中USP22 mRNA和蛋白的相对表达量均显著升高,差异有统计学意义(P<0.05)(见图1、表1)。
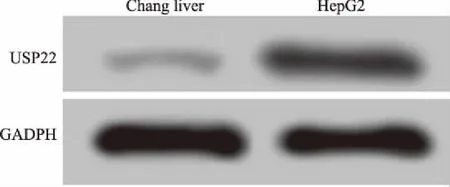
图1 Western blotting检测Chang liver细胞和HepG2细胞中USP22蛋白的表达结果Fig 1 The expressions of USP22 protein in Chang liver cells and HepG2 cells detected by Western blotting

注:与Chang liver细胞相比,aP<0.05。
2.2USP22siRNA对肝癌HepG2细胞中USP22基因表达的影响转染48 h后,RT-PCR和Western blotting检测结果显示,与对照组相比,干预组中USP22 mRNA和蛋白的表达均显著降低,差异有统计学意义(P<0.05),而阴性组差异无统计学意义(P>0.05)(见图2、表2)。
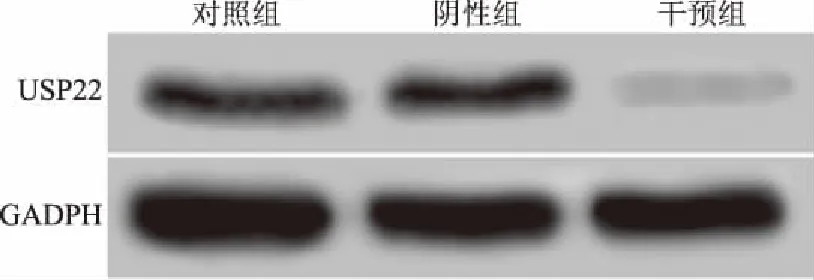
图2 转染48 h后Western blotting检测各组细胞中USP22蛋白的表达结果Fig 2 The expression of USP22 protein after 48 hours of transfection detected by Western blotting
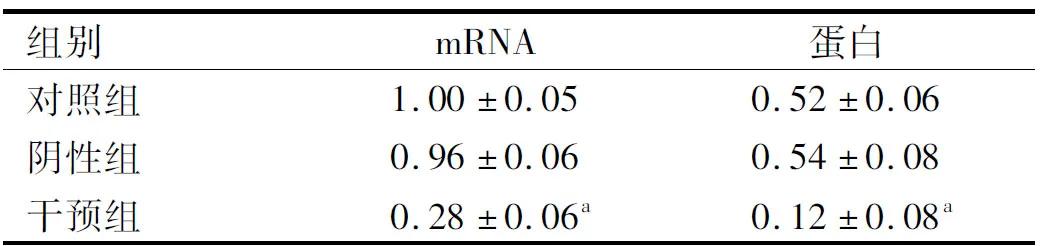
注:与对照组相比,aP<0.05。
2.3USP22基因沉默对肝癌HepG2细胞周期和细胞凋亡的影响转染48 h后,流式细胞仪检测各组HepG2细胞中的细胞周期分布情况,结果显示,与对照组相比,干预组中G0/G1期细胞所占比例显著升高,S期和G2/M期细胞所占比例显著下降,差异均有统计学意义(P<0.05)(见表3)。阴性组和对照组间G0/G1期、S期和G2/M期细胞所占比例差异无统计学意义(P>0.05)。流式细胞仪检测各组细胞的凋亡情况,结果显示,对照组、阴性组和干预组细胞的凋亡率分别为(6.86±1.26)%、(7.35±1.65)%和(27.58±5.22)%。与对照组相比,阴性组细胞凋亡率差异无统计学意义(P>0.05),干预组细胞凋亡率显著升高(P<0.05)(见图3~4)。
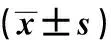
表3 USP22 siRNA对HepG2细胞周期的影响 Tab 3 The effect of USP22 siRNA on the cell cycle of
注:与对照组相比,aP<0.05。
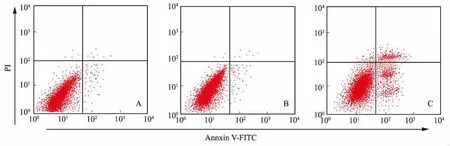
图3 USP22基因沉默对肝癌HepG2细胞凋亡的影响
A:对照组;B:阴性组;C:干预组
Fig3TheapoptosisofHepG2cellsineachgroupdetectedbyflowcytometry
A: control group; B: negative group;
C: intervention group
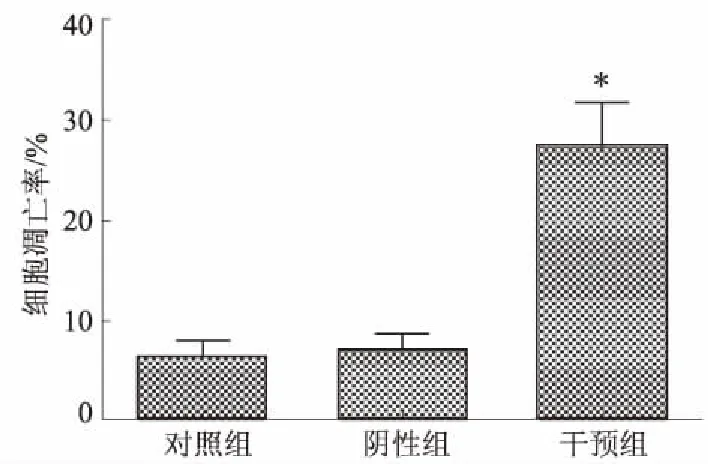
注:与对照组相比,*P<0.05。
图4各组HepG2细胞的凋亡率
Fig4TheapoptosisrateofHepG2cellsineachgroup
2.4USP22基因沉默对肝癌细胞中Cleavedcaspase-3、Cleavedcaspase-9、CyclinD1和CDK2蛋白表达的影响转染48 h后,Western blotting检测各组HepG2细胞中Cleaved caspase-3、Cleaved caspase-9、Cyclin D1和CDK2蛋白表达,结果显示,与对照组相比,干预组中Cleaved caspase-3、Cleaved caspase-9、CyclinD1和CDK2
蛋白的相对表达量均显著降低,差异均有统计学意义(P<0.05);阴性组中Cleaved caspase-3、Cleaved caspase-9、Cyclin D1和CDK2蛋白的相对表达量与对照组相比,差异无统计学意义(P>0.05)(见图5、表4)。
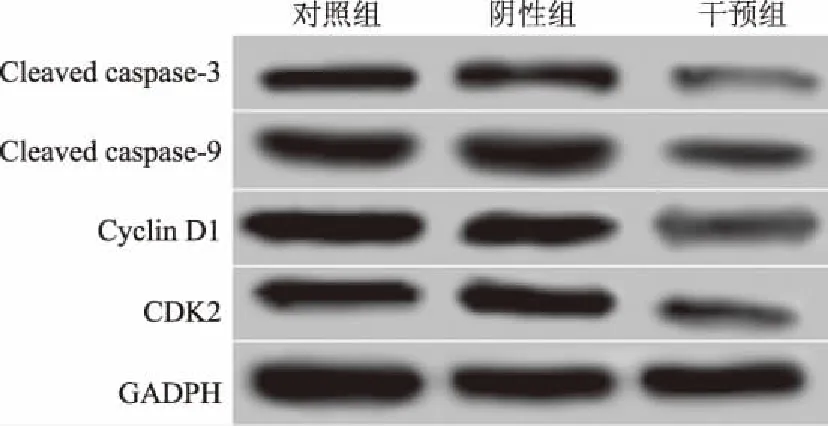
图5 Western blotting检测转染48 h后各组细胞中Cleaved caspase-3、Cleaved caspase-9、Cyclin D1和CDK2蛋白的表达Fig 5 The expressions of Cleaved caspase-3, Cleaved caspase-9, Cyclin D1 and CDK2 proteins in each group after transfection for 48 hours detected by Western blotting

组别Cleaved caspase-3Cleaved caspase-9Cyclin D1CDK2对照组0.45±0.050.53±0.080.96±0.120.48±0.08阴性组0.42±0.060.50±0.100.87±0.250.46±0.12干预组0.15±0.08a0.26±0.15a0.32±0.18a0.21±0.10a
注:与对照组相比,aP<0.05。
3 讨论
USP22基因是去泛素化酶家族的重要成员,位于17p11.2染色体上,可编码525个氨基酸。它通过形成复合体后在细胞增殖、细胞周期和细胞凋亡等生理过程中发挥作用。大量研究[5-7,9]发现,USP22在多种肿瘤器官或组织中呈高表达,抑制或沉默其表达可抑制细胞生长,促进细胞凋亡。ZHOU等[10]研究发现,下调USP22可通过抑制TERT/P53途径促进视网膜母细胞瘤细胞凋亡。JI等[11]研究发现,抑制USP22表达后,卵巢癌细胞的增殖明显受到抑制,其作用机制可能与致癌转化因子TGFβ1诱导细胞周期G1期阻滞有关。有研究[12]发现,USP22在肝癌组织中高表达,且与肝癌患者预后差密切相关。因此,研究USP22基因在肝癌细胞中的作用对肝癌的诊断和治疗具有重要意义。细胞的无限增殖与细胞凋亡受阻密切相关,研究肝癌的细胞凋亡机制对抗肝癌的研究具有重要影响。目前,关于USP22基因对肝癌细胞凋亡的研究较少,其具体的作用机制尚不明确,本研究通过脂质体转染法干扰肝癌HepG2细胞中USP22表达,观察其对肝癌细胞凋亡的影响,结果发现,HepG2细胞凋亡率较对照组明显升高。进一步观察HepG2细胞周期发现,与对照组相比,干预组中G0/G1期细胞所占比例显著升高,S期和G2/M期细胞所占比例显著下降。结果提示,沉默USP22基因可能通过将细胞周期阻滞G0/G1期,抑制细胞增殖,进而诱导HepG2细胞凋亡。
细胞周期是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,是细胞生命活动的基本过程。越来越多的研究[13-15]认为,细胞周期的失调是肿瘤形成的原因,细胞周期在多种肿瘤的发生和发展中具有重要作用。细胞周期蛋白(Cyclins)和细胞周期蛋白依赖性激酶(cyclin dependent kinases,CDKs)在整个细胞周期的推进进程中发挥着重要调控作用[12]。Cyclin D1是Cyclins家族的重要成员,被认为是细胞周期的正调控因子,在细胞周期G1/S期的转换过程中发挥关键作用。CDK2蛋白作为CDKs蛋白家族中的一员,在细胞周期各时相间的相互转换过程中起着重要作用。研究[16-18]发现,Cyclin D1和CDK2在乳腺癌、肝癌和非小细胞肺癌等多种肿瘤细胞中异常表达,在多种肿瘤的诊断和治疗方面具有重要作用。USP22基因对Cyclin D1和CDK2蛋白的表达有一定的影响。如LI等[19]通过RNA干扰介导USP22基因沉默后,发现有效抑制人脑胶质瘤细胞增殖,促进了细胞凋亡,同时细胞周期阻滞在G2/M期,周期相关蛋白CDK1、CDK2和Cyclin B1表达显著减少。ZHUANG等[20]在慢病毒介导USP22基因沉默抑制鼻咽癌细胞生长及对Akt信号通路影响的研究中发现,在鼻咽癌CNE-1和CNE-2细胞中沉默USP22基因后,可通过下调p-Akt、p-gsk-3β和Cyclin D1表达抑制细胞增殖生长和影响细胞G0/G1期。为了探讨USP22基因沉默对肝癌细胞周期作用的分子机制,本研究通过Western blotting检测转染48 h后的HepG2细胞,结果发现,干预组中Cyclin D1和CDK2蛋白的表达与对照组相比均显著下降。结果提示,USP22基因沉默可能通过下调Cyclin D1和CDK2表达将细胞周期阻滞在G0/G1期。
细胞凋亡是机体为维持细胞内环境稳态而发生的细胞主动死亡的有序过程,与多种肿瘤的发生、发展密切相关。Caspase家族是一种以非活化状态存在于细胞浆内的蛋白酶,在凋亡诱导、凋亡执行和凋亡效应途径中发挥着重要作用。Caspase-3是Caspase家族中级联反应下游的重要凋亡执行因子,Caspase-9是Caspase家族中级联反应上游的凋亡启动因子,一旦Caspase酶原活化为有活性的Caspase,将引起细胞凋亡[21]。SHI等[22]研究发现,在高糖诱导的糖尿病大鼠的足细胞中沉默USP22基因,可通过降低Bax/Bcl-2比值、Caspase-3的表达和TNF-α等炎症因子的分泌诱导细胞凋亡。李朝晖等[23]在研究siRNA沉默USP22基因对胶质瘤细胞增殖的抑制作用中发现,沉默USP22基因后胶质瘤细胞的凋亡率明显升高,且凋亡相关蛋白Procaspase-3和Procaspase-9表达明显下降。为了探讨USP22基因对肝癌HepG2细胞凋亡的具体机制,本研究采用Western blotting检测凋亡相关蛋白Cleaved caspase-3和Cleaved caspase-9表达,结果发现,与对照组相比,干预组中Cleaved caspase-3和Cleaved caspase-9表达均显著降低。结果提示,沉默USP22基因可能通过下调Cleaved caspase-3和Cleaved caspase-9表达诱导HepG2细胞凋亡。
总之,USP22基因在肝癌细胞凋亡过程中具有重要作用,USP22基因沉默可诱导肝癌HepG2细胞凋亡,其作用机制可能与周期蛋白Cyclin D1、CDK2及凋亡蛋白Cleaved caspase-3、Cleaved caspase-9的表达下降有关。肝癌细胞的凋亡是一个复杂的过程,USP22基因在肝癌中的具体作用机制还需更多更深入的研究。本研究结果为USP22基因在肝癌中的分子机制研究提供了参考,为肝癌的诊断和治疗提供了新的研究方向和治疗靶点。
[1] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012 [J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI: 10.3322/caac.21262.
[2] BEARD R E, HANTO D W, GAUTAM S, et al. A comparison of surgical outcomes for noncirrhotic and cirrhotic hepatocellular carcinoma patients in a Western institution [J]. Surgery, 2013, 154(3): 545-555. DOI: 10.1016/j.surg.2013.02.019.
[3] DONGIOVANNI P, ROMEO S, VALENTI L. Hepatocellular carcinoma in nonalcoholic fatty liver: role of environmental and genetic factors [J]. World J Gastroenterol, 2014, 20(36): 12945-12955. DOI: 10.3748/wjg.v20.i36.12945.
[4] 柏雪丽, 胡素香, 欧阳玲. USP22与肿瘤关系的研究进展[J]. 现代肿瘤医学, 2014, 22(2): 460-463. DOI: 10.3969/j.issn.1672-4992.2014.02.70.
BAI X L, HU S X, OUYANG L. The research progression of the relationship between USP22 and tumors [J]. Modern Oncology, 2014, 22(2): 460-463. DOI: 10.3969/j.issn.1672-4992.2014.02.70.
[5] WANG H, LI Y P, CHEN J H, et al. Prognostic significance of USP22 as an oncogene in papillary thyroid carcinoma [J]. Tumour Biol, 2013, 34(3): 1635-1639. DOI: 10.1007/s13277-013-0696-0.
[6] 胡晶, 李国强, 金然, 等. USP22和PTEN在非小细胞肺癌中的表达及临床意义[J]. 哈尔滨医科大学学报, 2015, 49(1): 45-51.
HU J, LI G Q, JIN R, et al. Expressions of USP22 and PTEN in non-small cell lung cancer and their clinical significances [J]. Journal of Harbin Medical University, 2015, 49(1): 45-51.
[7] MA Y, FU H L, WANG Z, et al. USP22 maintains gastric cancer stem cell stemness and promotes gastric cancer progression by stabilizing BMI1 protein [J]. Oncotarget, 2017, 8(20): 33329-33342. DOI: 10.18632/oncotarget.16445.
[8] TANG B, TANG F, LI B, et al. High USP22 expression indicates poor prognosis in hepatocellular carcinoma [J]. Oncotarget, 2015, 6(14): 12654-12667. DOI: 10.18632/oncotarget.3705.
[9] 王技军, 贺岩. USP22在恶性肿瘤中的研究进展[J]. 实用肿瘤学杂志, 2016, 30(6): 551-554. DOI: 10.11904/j.issn.1002-3070.2016.06.015.
WANG J J, HE Y. The research progresses in USP22 in malignant tumors [J]. Journal of Practical Oncology, 2016, 30(6): 551-554. DOI: 10.11904/j.issn.1002-3070.2016.06.015.
[10] ZHOU D, LIU P, SUN D W, et al. USP22 down-regulation facilitates human retinoblastoma cell aging and apoptosis via inhibiting TERT/P53 pathway [J]. Eur Rev Med Pharmacol Sci, 2017, 21(12): 2785-2792.
[11] JI M, SHI H, XIE Y, et al. Ubiquitin specific protease 22 promotes cell proliferation and tumor growth of epithelial ovarian cancer through synergy with transforming growth factor β1 [J]. Oncol Rep, 2015, 33(1): 133-140. DOI: 10.3892/or.2014.3580.
[12] TANG B, LIANG X, TANG F, et al. Expression of USP22 and Survivin is an indicator of malignant behavior in hepatocellular carcinoma [J]. Int J Oncol, 2015, 47(6): 2208-2216. DOI: 10.3892/ijo.2015.3214.
[13] IHLE M A, HUSS S, JESKE W, et al. Expression of cell cycle regulators and frequency of TP53 mutations in high risk gastrointestinal stromal tumors prior to adjuvant imatinib treatment [J]. PLoS One, 2018, 13(2): e0193048. DOI: 10.1371/journal.pone.0193048.
[14] 王轶, 徐桂芳, 张斌, 等. TGF-β1通过cyclin D3对肝细胞癌增殖能力的双重调控作用机制[J]. 胃肠病学和肝病学杂志, 2015, 24(9): 1053-1056. DOI: 10.3969/j.issn.1006-5709.2015.09.006.
WANG Y, XU G F, ZHAGN B, et al. The double regulation mechanisms of TGF-β1 in the proliferation of hepatocellular carcinoma by cyclin D3 [J]. Chin J Gastroenterol Hepatol, 2015, 24(9): 1053-1056. DOI: 10.3969/j.issn.1006-5709.2015.09.006.
[15] CASIMIRO M C, VELASCO-VELAZQUEZ M, AGUIRRE-ALVARADO C, et al. Overview of cyclins D1 function in cancer and the CDK inhibitor landscape: past and present [J]. Expert Opin Investig Drugs, 2014, 23(3): 295-304. DOI: 10.1517/13543784.2014.867017.
[16] PEURALA E, KOIVUNEN P, HAAPASAARI K M, et al. The prognostic significance and value of cyclin D1, CDK4 and p16 in human breast cancer [J]. Breast Cancer Res, 2013, 15(1): R5. DOI: 10.1186/bcr3376.
[17] 陈绍发. CKS1和Cyclin D1在老年肝细胞癌中的表达[J]. 中国老年学杂志, 2013, 33(18): 4556-4557. DOI: 10.3969/j.issn.1005-9202.2013.18.091.
[18] WANG X, LU Y, FENG W, et al. A two kinase-gene signature model using CDK2 and PAK4 expression predicts poor outcome in non-small cell lung cancers [J]. Neoplasma, 2016, 63(2): 322-329. DOI: 10.4149/220_150817N448.
[19] LI Z H, YU Y, DU C, et al. RNA interference-mediated USP22 gene silencing promotes human brain glioma apoptosis and induces cell cycle arrest [J]. Oncol Lett, 2013, 5(4): 1290-1294. DOI: 10.3892/ol.2013.1188.
[20] ZHUANG Y J, LIAO Z W, YU H W, et al. ShRNA-mediated silencing of the ubiquitin-specific protease 22 gene restrained cell progression and affected the Akt pathway in nasopharyngeal carcinoma [J]. Cancer Biol Ther, 2015, 16(1): 88-96. DOI: 10.4161/15384047.2014.987029.
[21] 黄婷, 邵勇. caspase与妊娠并发症的研究进展[J]. 中华内分泌外科杂志, 2014, 8(6): 512-514. DOI: 10.3760/cma.j.issn.1674-6090.2014.06.021.
[22] SHI J X, WANG Q J, LI H, et al. Silencing of USP22 suppresses high glucose-induced apoptosis, ROS production and inflammation in podocytes [J]. Mol Biosyst, 2016, 12(5): 1445-1456. DOI: 10.1039/c5mb00722d.
[23] 李朝晖, 王建, 付红, 等. siRNA沉默USP22基因对胶质瘤细胞增殖的抑制作用[J]. 中国微侵袭神经外科杂志, 2015, 20(9): 419-423. DOI: 10.11850/j.issn.1009-122X.2015.09.014.
LI Z H, WANG J, FU H, et al. siRNA-mediated silencing of the USP22 gene inhibits cell proliferation in human glioma cells [J]. Chin J Minim Invasive Neurosurg, 2015, 20(9): 419-423. DOI: 10.11850/j.issn.1009-122X.2015.09.014.
doi:10.3969/j.issn.1006-5709.2018.06.008
