程序性细胞死亡蛋白4在大鼠脑出血后血肿周围域的表达及作用
2018-06-25沈加兵季宇腾周婷婷曹茂盛陈颖曹茂红柯开富
沈加兵,季宇腾,周婷婷,曹茂盛,陈颖,曹茂红,柯开富
(1.南通大学医学院,南通226001;2.南通大学附属医院神经内科)
·基础研究·
程序性细胞死亡蛋白4在大鼠脑出血后血肿周围域的表达及作用
沈加兵1,季宇腾2,周婷婷2,曹茂盛2,陈颖2,曹茂红2,柯开富2
(1.南通大学医学院,南通226001;2.南通大学附属医院神经内科)
[摘要]目的探索程序性细胞死亡蛋白4(PDCD4)在脑出血(ICH)后血肿周围域的表达、作用及机制,为ICH疾病的后期康复治疗提供分子靶点。方法Western blot、免疫组织化学检测蛋白质的表达变化;免疫荧光技术检测蛋白质的空间定位情况;siRNA转染进行细胞内蛋白质的干预。结果PDCD4在大鼠ICH后血肿周围组织中表达上调,最高点位于ICH后第2天;上调的PDCD4主要与神经元NeuN存在共定位,并且与上调的凋亡蛋白活化Caspase-3之间也存在共定位;体外ICH模型中(即hemin诱导的神经元凋亡模型),通过siRNA靶向干预PDCD4的表达,则活化caspase-3明显降低,而存活因子p-Akt上调。结论ICH后血肿周围域PDCD4的表达上调与神经元的凋亡相关,并且是通过p-Akt通路发挥作用的。
[关键词]脑出血;血肿;程序性细胞死亡蛋白4;疾病模型,动物
脑出血(ICH)是中枢神经系统的急、重症,具有极高的致死率和致残率,给社会、家庭带来了沉重的痛苦和负担[1]。ICH的病理损伤主要表现为血肿周围区域神经元的损伤,以及胶质细胞的增生、活化[2]。由于中枢神经系统神经元的死亡不可再生,因此探索ICH后血肿周围区域神经元损伤的分子机制,对ICH疾病的治疗具有极大的意义。
程序性细胞死亡蛋白4(PDCD4),顾名思义为凋亡过程中上调的基因,广泛分布于各类组织器官中。文献报道PDCD4主要影响蛋白质的转录和翻译,从而对基因表达进行调控[3]。研究证明PDCD4在癌组织中表达缺如或低表达,对癌细胞的侵袭、扩散具有促进作用,因此它又称之为抑癌基因。目前已发现PDCD4在多种类型原发性肿瘤中低表达,如肺癌、肝癌、乳腺癌以及脑肿瘤等[4]。2016年,Zhen报道PDCD4 mRNA水平在非小细胞肺癌中下调,通过体外诱导PDCD4的表达能够明显抑制肿瘤细胞的生长、增殖和细胞周期的转换,原理上是通过灭活PI3K/Akt信号通路实现的[5]。近年来,越来越多的研究揭示PDCD4不仅对肿瘤的发生发展起调节作用,它与细胞转型、炎症、凋亡、增殖以及自噬等方面关系也很密切。例如,在小鼠模型中,PDCD4的缺失能够抑制脂多糖(LPS)诱导的致死性炎性反应[6];抑制高脂饮食诱导的肝脂质性损害[7]。此外,在糖尿病模型中,PDCD4的高表达能够诱导胰岛B细胞的凋亡[8]。也有学者们认为PDCD4的功能表达主要是维持增殖、分化和凋亡三者之间的动态平衡[9]。然而,PDCD4在ICH疾病中具有怎样的作用,目前还不得而知。因此,本研究将主要探索PDCD4在大鼠ICH模型中的表达、作用以及潜在的机制。
1 材料与方法
1.1 实验动物 成年雄性Sprague-Dawley(SD)大鼠(江苏省实验动物质量合格证书编号:201701835),240~260 g,SPF级,由南通大学实验动物中心提供。所有实验动物的护理及外科手术均遵照1996年颁布的国家研究委员会的伦理要求操作。
1.2 实验分组 主要分成2组。假手术组:只插针未注射;ICH组:颅内注射自体血50 μL。
ICH模型取3、6、12 h,1、2、3、5、7d为时间点,每组各12只大鼠,共96只;假手术组12只大鼠,总计108只大鼠。
1.3 ICH模型 以复合麻醉剂(3 mL/kg)腹腔注射麻醉;大鼠脑立体定位仪定位尾状核区域(以囟门为正中点,向前0.2 mm,向右旁开3.5 mm,进针深度5.5 mm),回针0.5 mm,以10 μL/min的速度注入自体血50 μL,或放置空针作为假手术组。麻醉过后,ICH组所有的大鼠表现左侧肢体功能的瘫痪(旋转或者向左侧倒去),证实ICH模型制作成功。
1.4 神经功能缺陷评分 前肢放置试验和轮转试验主要参照之前发表的方法[10-11]。
1.5 Western blot 取新鲜脑组织冰上裂解,充分匀浆后,蛋白样品定量。根据目的蛋白大小进行凝胶电泳。将转好的膜放入5%脱脂奶粉封闭。封闭结束,孵育相应的一抗(山羊抗PDCD4抗体购买于Santa Cruz公司,其他抗体均购置于Cell Signaling Technology),4 ℃过夜。孵育二抗,翻板室温翻转1 h后,ECL显影。
1.6 免疫组织化学 ICH后2天的大鼠以4%多聚甲醛灌注、取脑,浸泡12 h后,20%、30%蔗糖梯度脱水。进行冰冻切片,厚度12 μm,室温保存。
免疫组织化学主要运用免疫组织化学试剂盒(购于Abcam公司),按照说明书顺序进行,加入PDCD4孵育12 h;免疫荧光:取切片水化,0.5% Triton x-100通透细胞膜,0.1% BSA(胎牛血清)封闭后加入PDCD4、NeuN、GFAP及IBA1抗体,4 ℃孵育过夜,加入相应的二抗,荧光显微镜下拍照(德国莱卡)。
1.7 细胞培养与转染 孕18 d大鼠,乙醚麻醉后提取原代皮层神经元,培养在Neurobasal添加B27 supplement培养基中(购于Gibco公司),每3天换液1次,培养至5 d时以100 μM hemin刺激细胞,在不同时间点收细胞。进行转染siRNA时,PDCD4 siRNA和Control siRNA运用脂质体法(lipofectamine 2000)(均由Invetrogen提供)转染进入细胞内。转染的细胞培养30 h后,hemin刺激进行收细胞检测。
2 结果
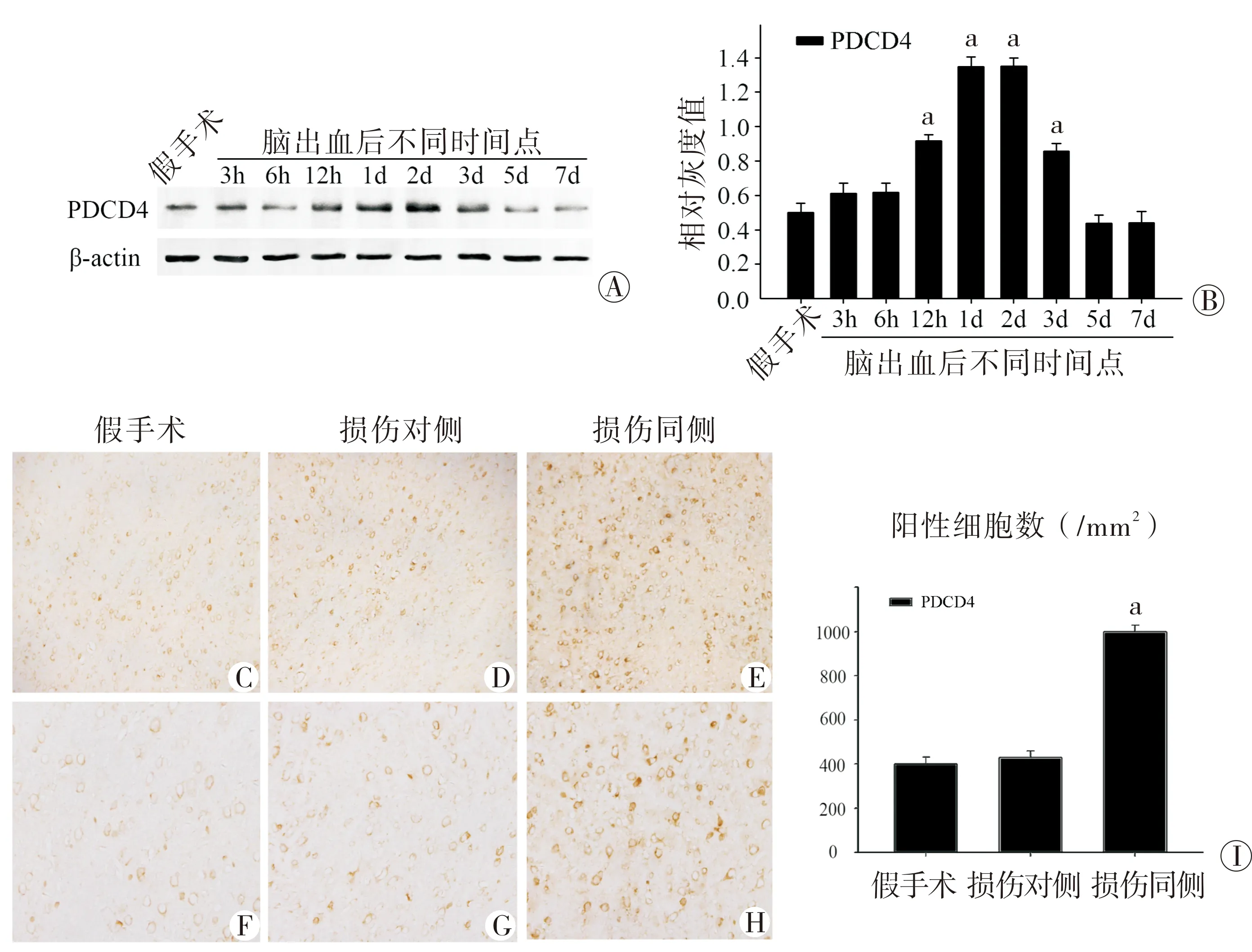
2.1 PDCD4在大鼠ICH后血肿周围组织中的表达情况 神经功能缺陷评分参照之前的研究[10-11]。图1A和图1B显示PDCD4蛋白水平在ICH后血肿周围组织中表达上调,随时间点增高呈现单峰趋势,最高点位于ICH后第2天。运用免疫组织化学的方法,本研究进一步验证了PDCD4的表达情况。从图1C~图1I中,可以观测到PDCD4主要在ICH后血肿周围区域表达增高,而血肿对侧脑域表达上调情况不明显。
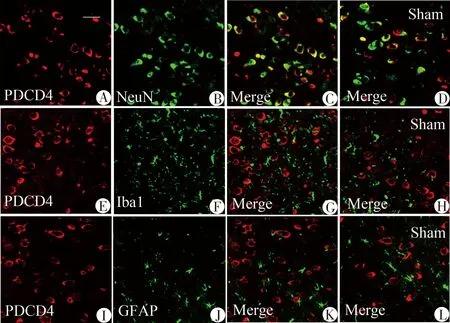
2.2 PDCD4在大鼠ICH后血肿周围域的定位 ICH后血肿周围域细胞环境非常复杂,为进一步探索PDCD4在其间的作用,本研究选用免疫荧光技术检测PDCD4与哪类神经细胞相关联。图2免疫荧光双标技术分别检测PDCD4与神经元(NeuN)、星形胶质细胞(GFAP)以及小胶质细胞(Iba1)的共定位情况。结果显示上调的PDCD4主要定位于神经元。
注:PDCD4为程序性细胞死亡蛋白4;a与Sham相比,差异有统计学意义(P<0.05)
图1脑出血后血肿周围域PDCD4的表达情况A为western blot检测PDCD4的蛋白水平;B为A的条形统计图;C、F为假手术(Sham)的对应区域PDCD4表达情况;D、G为ICH后2天血肿对侧区域PDCD4的表达情况;E、H为ICH后2天血肿同侧区域PDCD4的表达情况;I为C~H的统计图
注:PDCD4为程序性细胞死亡蛋白4
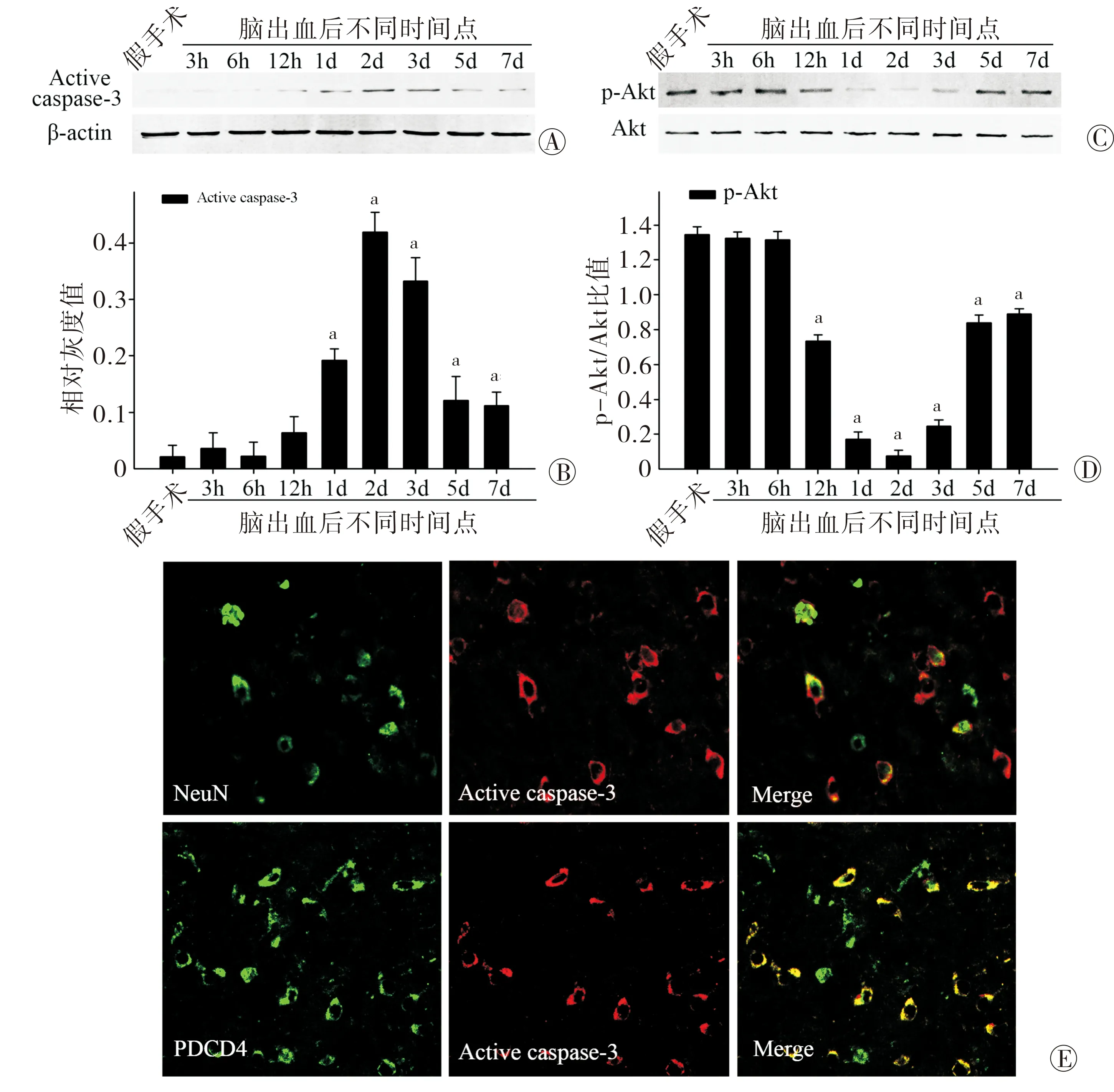
2.3 PDCD4与大鼠ICH后血肿周围域神经元凋亡的关系 ICH后神经功能的损伤主要表现为神经元的死亡,那么上调的PDCD4是否与神经元的凋亡相关。由此,本组检测了血肿周围域凋亡蛋白活化caspase-3的表达,以及促存活因子Akt的磷酸化情况。图3A~图3D结果显示活化caspase-3在ICH后第2天表达最高,而p-Akt在第2天表达最低。图3E免疫荧光技术检测显示活化caspase-3主要与神经元、PDCD4共定位,由此进一步证实了本组的猜想,上调的PDCD4可能与ICH后血肿周围域神经元的凋亡相关。
2.4 PDCD4在体外ICH模型中的表达 为进一步证实上调的PDCD4与神经元的凋亡存在相关性,本组构建了体外ICH模型,即血红素Hemin诱导的神经元凋亡模型。在此基础上,本研究检测了PDCD4的表达,以及活化caspase-3的表达。图4A和图4B显示PDCD4、活化caspase-3在hemin诱导的神经元凋亡模型中表达上调,并随时间逐渐增加,12 h后达最高峰。同样,图4C和图4D检测了p-Akt的表达情况,结果显示p-Akt随时间逐渐下降,于12 h达最低谷。与体内表达是一致的,由此证明血红素诱导的神经元凋亡模型(体外ICH模型)是成功的。
2.5 PDCD4在体外ICH模型中的作用 为证实PDCD4与神经元凋亡之间的因果联系。本组转染了PDCD4的特异性siRNA,图5A和图5B显示在Hemin刺激条件下,PDCD4 siRNA组PDCD4的表达明显低于Non-specific siRNA组。在此条件下,Active caspase-3表达减少,而p-Akt水平则增高。这些结果说明了PDCD4可以促进神经元的凋亡,并且可能通过p-Akt途径发挥作用的。
3 讨论
本研究发现PDCD4在ICH后血肿周围区域表达增高,并且在空间表型上主要与神经元存在共定位关系,与星形胶质细胞、小胶质细胞无共定位情况。因为ICH后神经元的凋亡/死亡是ICH疾病的最严重后果,由此本研究进一步检测了PDCD4的上调与神经元凋亡的关系。本研究发现ICH条件下,PDCD4与血肿周围域神经元、Active caspase-3之间存在时间、空间上的相关性,并且与p-Akt之间也存在一定关联。为明确PDCD4与神经元凋亡之间的因果联系,本组构建体外ICH模型,即Hemin诱导的神经元凋亡模型,运用PDCD4的特异性siRNA干预PDCD4的表达,来明确Active caspase-3、p-Akt的表达情况,结果显示PDCD4干预后,Active caspase-3随之下调,而p-Akt则上调。综上,本研究证实了在ICH条件下,PDCD4的上调与血肿周围域神经元的凋亡相关,并且是通过抑制Akt的磷酸化,抑制其促存活作用来发挥效应的。
注:PDCD4为程序性细胞死亡蛋白4;a与Sham组相比,P<0.05
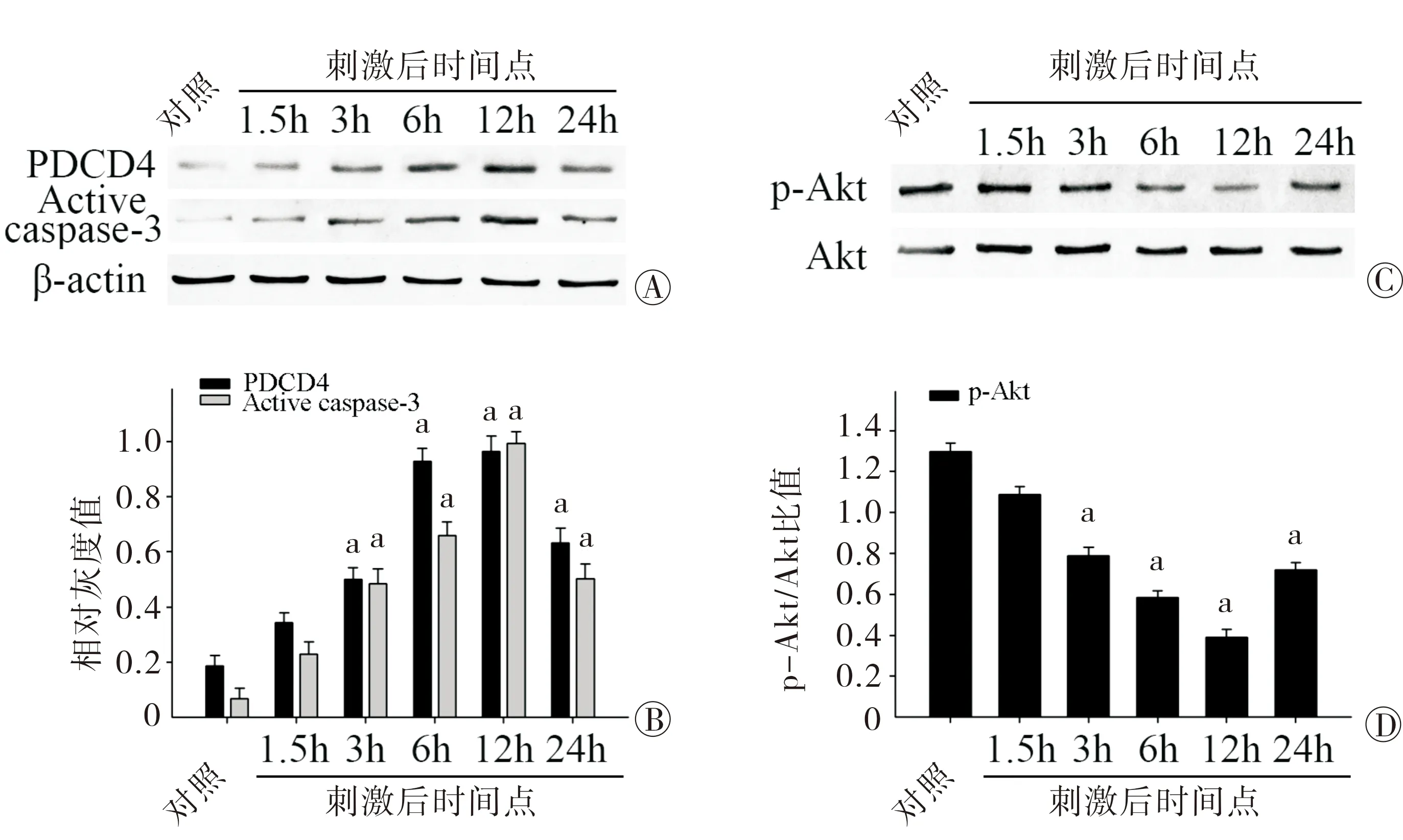
注:PDCD4为程序性细胞死亡蛋白4;a与Control组相比,P<0.05
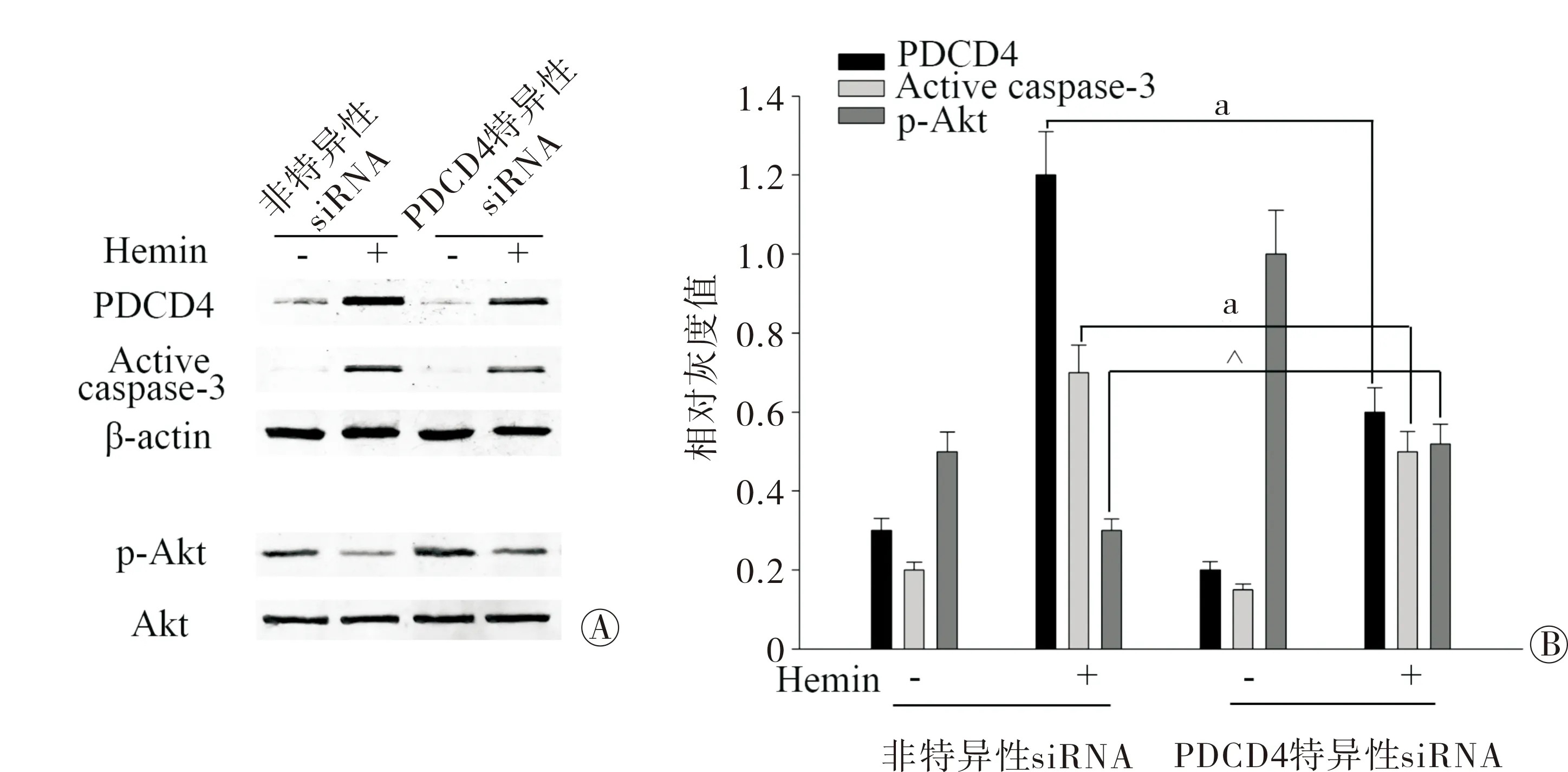
注:PDCD4为程序性细胞死亡蛋白4;a与Non-specific siRNA组相比,P<0.05
PDCD4,肿瘤抑制基因,能够结合到真核生物翻译起始因子4A1上,从而阻断RNA的结合发挥抑制蛋白质的翻译作用,因此其表达降低主要与肿瘤的增殖有关[12]。然而,越来越多的研究开始关注其在非肿瘤中的作用[13-14]。PDCD4发挥不同的作用可能与其所处的细胞环境相关。本研究证实,PDCD4在ICH后血肿周围域组织中上调,可能与促神经元凋亡相关。
PI3K/Akt通路是神经元存活过程中一条重要信号途径。PI3K的激活能够通过第二信使导致Akt从细胞质向细胞膜迁移,同时Akt活化,活化的Akt磷酸化促凋亡因子Bad,从而阻止了Bad与Bcl-2或Bcl-xl的结合,发挥促存活作用[15]。另外,激活的Akt还能够抑制caspase-9的活性,通过阻断Caspase级联反应,发挥保护作用[16]。本研究体外ICH模型中,通过siRNA干预PDCD4的表达,p-Akt水平则明显上调,由此证明PDCD4能够通过抑制Akt的磷酸化,从而发挥促凋亡作用。
PDCD4在ICH后血肿周围域发挥促神经元凋亡的作用,并且是通过下调p-Akt通路实现的。
[1] WANG G,WANG L,SUN X G,et al.Haematoma scavenging in intracerebral haemorrhage:from mechanisms to the clinic[J].J Cell Mol Med,2017,22(2):768-777.
[2] FALCONE G J,WOO D.Genetics of spontaneous intracerebral hemorrhage[J].Stroke,2017,48(12):3420-3424.
[3] LANKAT-BUTTGEREIT B,GOKE R.The tumour suppressor Pdcd4:recent advances in the elucidation of function and regulation[J].Biol Cell,2009,101(6):309-317.
[4] ZHU S,WU H,WU F,et al.MicroRNA-21 targets tumor suppressor genes in invasion and metastasis[J].Cell Res,2008,18(3):350-359.
[5] ZHEN Y,LI D,LI W,et al.Reduced PDCD4 expression promotes cell growth through PI3K/Akt signaling in non-small cell lung cancer[J].Oncol Res,2016,23(1/2):61-68.
[6] WANG Q,DONG Z,LIU X,et al.Programmed cell death-4 deficiency prevents diet-induced obesity,adipose tissue inflammation,and insulin resistance[J].Diabetes,2013,62(12):4132-4143.
[7] RODRIGUES P M,AFONSO M B,SIMAO A L,et al.Inhibition of NF-kappaB by deoxycholic acid induces miR-21/PDCD4-dependent hepatocelular apoptosis[J].Sci Rep,2015,5:17528.
[8] FERRIS W F,MARRIOTT C E,ALI T,et al.Tumor suppressor Pdcd4 is a major transcript that is upregulated during in vivo pancreatic islet neogenesis and is expressed in both beta-cell and ductal cell lines[J].Pancreas,2011,40(1):61-66.
[9] FU X,HE Y,WANG X,et al.Overexpression of miR-21 in stem cells improves ovarian structure and function in rats with chemotherapy-induced ovarian damage by targeting PDCD4 and PTEN to inhibit granulosa cell apoptosis[J].Stem Cell Res Ther,2017,8(1):187.
[10] KE K,SHEN J,SONG Y,et al.CDK5 contributes to neuronal apoptosis via promoting MEF2D phosphorylation in rat model of intracerebral hemorrhage[J].J Mol Neurosci,2015,56(1):48-59.
[11] SHEN J,CHEN X,LI H,et al.p75 neurotrophin receptor and its novel interaction partner,NIX,are involved in neuronal apoptosis after intracerebral hemorrhage[J].Cell Tissue Res,2017,368(1):13-27.
[12] WANG D,SUN X,WEI Y,et al.Nuclear miR-122 directly regulates the biogenesis of cell survival oncomiR miR-21 at the posttranscriptional level[J].Nucleic Acids Res,2017,45(1):1-18
[13] XU H,CAO H,ZHU G,et al.Overexpression of microRNA-145 protects against rat myocardial infarction through targeting PDCD4[J].Am J Transl Res,2017,9(11):5003-5011.
[14] WHITE K,DEMPSIE Y,CARUSO P,et al.Endothelial apoptosis in pulmonary hypertension is controlled by a microRNA/programmed cell death 4/caspase-3 axis[J].Hypertension,2014,64(1):185-194.
[15] PARCELLIER A,TINTIGNAC L A,ZHURAVLEVA E,et al.PKB and the mitochondria:AKTing on apoptosis[J].Cell Signal,2008,20(1):21-30.
[16] KENNEDY S G,KANDEL E S,CROSS T K,et al.Akt/Protein kinase B inhibits cell death by preventing the release of cytochrome c from mitochondria[J].Mol Cell Biol,1999,19(8):5800-5810.
ExpressionandroleofPDCD4intheareaadjacenttohematomaafterintracerebralhemorrhage
ShenJiabing*,JiYuteng,ZhouTingting,CaoMaosheng,ChenYing,CaoMaohong,KeKaifu
(*MedicalSchoolofNantongUniversity,Nantong226001,China)
Corresponding author:KeKaifu,Email:kekaifu_nt@126.com
[Abstract]ObjectiveTo explore the expression,role and potential mechanism of PDCD4 in area adjacent to hematoma after intracerebral hemorrhage (ICH),and provide a molecular target for the treatment and neuronal recovery of ICH in future.MethodsProtein levels were examined by western blot and immunohistochemistry;the spatial location for proteins was detected by immunofluorescence;siRNA transfection was used to intervene in the protein in the cells.ResultsPDCD4 expression was up-regulated in the area adjacent to hematoma after ICH,and the peak of the level for PDCD4 was reached in the second day after ICH;the up-regulated d PDCD4 expression had a co-localization with NeuN,and it also had a co-localization with neuronal apoptotic protein,activated caspase-3;in the ICH model in vitro,neuronal apoptotic model induced by hemin,the expression of activated caspase-3 was decreased,and the expression of the survival factors p-Akt was increased,by intervening in the expression of PDCD4 with siRNA.ConclusionThe up-regulation of PDCD4 expression in the area adjacent to hematoma after ICH is associated with neuronal apoptosis,which might be relevant to p-Akt signaling pathway.
[Keywords]Cerebral hemorrhage;Hematoma;Programmed cell death 4;Disease models,animals
中图分类号:R743.34
A
10.3969/J.issn.1672-6790.2018.03.025
基金项目:国家自然科学基金资助(81671135);江苏省学术学位研究生科研创新计划项目资助(KYZZ16_0356);南通大学研究生科技创新项目资助(YKC16058)
作者简介:沈加兵,博士在读,Email:shen_jia_bing@126.com
通信作者:柯开富,主任医师,教授,博士生导师,Email:kekaifu_nt@126.com
2017-12-21)
