草甘膦对入侵植物加拿大一枝黄花和伴生植物白茅光合特性的影响
2018-06-07古春凤叶小齐邵学新焦盛武
古春凤,叶小齐,吴 明,*,邵学新,焦盛武
1 中国林业科学研究院亚热带林业研究所,杭州湾湿地生态系统国家定位观测研究站,杭州 311400 2 杭州师范大学生命与环境科学学院,杭州 310036
在全球变化日益加速的背景下,外来植物入侵受到越来越多的关注[1]。入侵植物严重威胁了群落生物多样性、生态系统的结构和服务功能,给入侵地造成巨大的经济损失[2-3]。为了有效控制外来种入侵,经济高效的化学防除法是被广泛使用的主要手段[4],草甘膦是当前使用量最大的除草剂之一,能有效控制世界上危害最大的76种入侵植物[5-6],在杂草治理中发挥着重要作用。进入植物体内的草甘膦迅速积累于分生组织,除了抑制莽草酸途径中EPSPS酶活性、引起蛋白质合成受阻外,还会抑制叶绿素的合成以及光合过程中重要酶活性、光合磷酸化等而造成植物生理功能紊乱[6- 9],致使其枯萎、死亡。广谱灭生型除草剂草甘膦为茎叶施用,防除入侵种的过程中难免有药液直接作用于本地植物,或进入土壤后间接影响邻近植物正常的生理活动[10- 13]。
光合作用是高等植物最基本的生理代谢过程[9]。与本地植物相比,外来植物常表现出较高的净光合速率和相对生长速率[14- 16];入侵植物往往还具有克隆繁殖特性,分株间的生理整合有利于其在异质性生境中获得更高的光合能力和资源利用效率[17-18],这是入侵种快速生长和向外扩散的重要因素之一。大量研究已表明,草甘膦能有效抑制多数外来物种的生长发育[5,7,19-20]、草甘膦进入土壤将作为胁迫因素对本地作物营养生长及光合特性带来负效应[21- 24]、草甘膦将会影响本地作物产量与质量[13,23]等,目前较少研究对喷施除草剂后的入侵植物和本地植物进行对比。研究草甘膦对入侵植物与本地植物生理过程的影响差异,有助于评估草甘膦防除入侵植物所产生的生态影响,并为合理使用草甘膦提供理论参考。
菊科一枝黄花属多年生草本植物加拿大一枝黄花(Solidagocanadensis)是我国华东沿海地区危害严重的入侵种,入侵到多样的生境和植物群落类型中均能繁殖生长[25- 28]。野外调查发现,在杭州湾国家湿地公园内,加拿大一枝黄花自然入侵到本土白茅(Imperatacylindrica)群落中并不断向外蔓延,对此有必要采取措施控制入侵植物的进一步扩散。本研究以加拿大一枝黄花和其伴生植物白茅为试验材料,研究不同浓度草甘膦处理对两种植物生长以及光合特性的影响,初步探讨入侵植物加拿大一枝黄花与伴生植物白茅光合作用对草甘膦胁迫响应的差异性,以期为合理利用除草剂草甘膦提供数据支持。
1 材料与方法
1.1 研究区域
研究区位于浙江省宁波市杭州湾国家湿地公园生态保育区(121°08′43″E,30°18′40″N)。
该地区全年1月最冷,7月最热,1月平均气温为3.8℃,7月平均气温为28.2℃,年平均气温为16.0℃,年日照时数约2038.4h,年均降水量为1344.7mm[29]。地势平坦,土壤含盐量约为1‰—5‰,pH值为8—9[30]。
1.2 试验材料
于2016年3月初,在研究区内采集试验所需的加拿大一枝黄花和白茅植株,将采回植株的根状茎分别剪至2—3cm长度,使根状茎对单株影响基本一致,并栽种于杭州湾湿地生态系统定位观测站内继续生长。除草剂选用41%草甘膦异丙胺盐水剂(由中化作物保护品有限公司提供),配制成4种不同浓度的水溶液。
1.3 试验设计
试验于2016年6—7月在观测站大棚内进行。采取复合De Wit取代试验设计[31],3种种植方式分别为加拿大一枝黄花单独种植、白茅单独种植、加拿大一枝黄花和白茅混合种植,每盆种植4株植物(混种时,两个物种比例1∶1);草甘膦浓度为0(对照)、0.6、1.2、1.8mL/L,共12个处理,每个处理7个重复,共84盆。
挑选生长良好、长势相当的加拿大一枝黄花和白茅植株移栽于口径23cm、深17cm的塑料花盆。以当地土壤为基质,植物适应生长3周后,测量每株加拿大一枝黄花的初始株高和统计其叶片数,记录每株白茅的分蘖数和每叶片长度,随后用喷雾器对每盆植物均匀喷施不同浓度草甘膦各5mL。实验期间每10d更换花盆摆放位置,以减少环境差异造成的实验误差。草甘膦处理3周后,再次测定两个物种的各生长指标,然后用Li- 6400XT便携式光合作用测定系统(美 Li-COR公司生产)测定每种处理下加拿大一枝黄花和白茅叶片的光响应过程。
1.4 测定指标和方法
1.4.1 生长指标的测定
喷施草甘膦前后,测量每株加拿大一枝黄花的株高,并清数出绿叶数、黄叶数和枯萎叶数,计算株高累计生长量(CGh,cm)和叶片枯萎率(%);记录每株白茅的分蘖数、每叶片长度,计算蘖死亡率(%)和叶片枯萎率(%)。各生长指标测量标准如下:在每株植株底部用记号笔做标记,以记号为起点,用直尺(精确度为0.1cm)进行株高测量;对每盆中茎上的所有绿叶数进行统计,能进行光合作用的叶片均为绿叶,没展开的新叶也一并计入[32];株高累计生长量CG=Gt-G0,式中Gt为株高的测定值,G0为株高的初始值;加拿大一枝黄花叶片枯萎率=枯萎叶数/总叶数×100%;以分蘖处为起点,测定白茅每叶长度;分蘖死亡率=死亡分蘖数/(净分蘖数+死亡分蘖数)×100%;白茅叶片枯萎率=叶片枯萎长度/(叶片枯萎长度+绿叶长度)×100%。
1.4.2 光响应曲线的测定
测量前,从每处理中选取同一叶位的完全展开的加拿大一枝黄花、白茅叶做好标记。 在晴朗天气的7:30—11:30,对每种处理下的单种、混种加拿大一枝黄花和白茅进行测定,重复3次。在周围大气CO2浓度为(390±20)μmol/mol的自然状态下,采用红蓝光源将叶室内的光合有效辐射PAR依次设置为1500、1200、1000、800、600、400、200、150、100、50、20、0μmol m-2s-1,测定植物的净光合速率(Pn,μmol m-2s-1)、气孔导度(Gs,mol m-2s-1)、蒸腾速率(Tr,mmol m-2s-1)和胞间CO2浓度(Ci,μmol mol-1)。每个光强下控制测定时间为240s,数据稳定后记录。采用非直角双曲线方程对PAR-Pn曲线进行拟合[33],得到最大净光合速率(Pnmax)、光饱和点(LSP)、光补偿点(LCP)、表观量子效率(AQY)和暗呼吸速率(Rd)。计算采用的曲线拟合方程为:
式中,Pn代表光合速率,PAR代表光照强度,AQY代表表观量子效率,K代表光合曲线的曲率,大小介于(0,1)之间。
1.5 数据处理与统计分析
先采用双因素方差分析法(two-way ANOVA)分析草甘膦浓度、种植方式及其交互作用对加拿大一枝黄花和白茅生长指标、光响应参数的影响。以草甘膦浓度为自变量,对两个物种的各指标进行单因素方差分析(one-way ANOVA),存在显著差异时,用最小显著差数法(LSD)进行多重比较。对两种种植方式下植株的生长指标和方程拟合所得的光合特征参数进行独立样本t检验。数据处理和分析在Excel 2013中完成,方差分析和差异显著性检验在SPSS 19.0中实现,所有图形采用SigmaPlot 12.5软件绘制完成。
2 结果与分析
2.1 加拿大一枝黄花和白茅的生长特征
草甘膦显著影响了加拿大一枝黄花和白茅的生长(P<0.05,表1)。随处理浓度上升,单种、混种加拿大一枝黄花的株高积累生长量不断减小,萎蔫的叶片数不断增加;单种、混种白茅的分蘖死亡率和叶片枯萎率均随草甘膦浓度升高而增大(图1,图2)。经过21d的生长,0.6—1.8mL/L浓度下单种加拿大一枝黄花的株高生长量依次为对照组的26.24%、14.84%、0.65%,而混种加拿大一枝黄花的株高生长量则为对照组的46.03%、16.82%、-14.97%;混种加拿大一枝黄花在0.6—1.2mL/L下有比单种时生长较好的趋势,但不同种植方式之间差异不显著。叶片枯萎率呈现相近的变化,0.6—1.2mL/L处理下混种加拿大一枝黄花叶片枯萎率略低于单种加拿大一枝黄花,但差异不显著。方差分析结果还表明,在21d试验时间内,种间关系对加拿大一枝黄花茎的伸长和绿叶生长的影响不显著,种间关系和草甘膦的交互作用对其生长影响亦不显著。1.8mL/L浓度下,加拿大一枝黄花受到严重损伤,植株基本停止生长发育、叶片枯萎率超过50%。
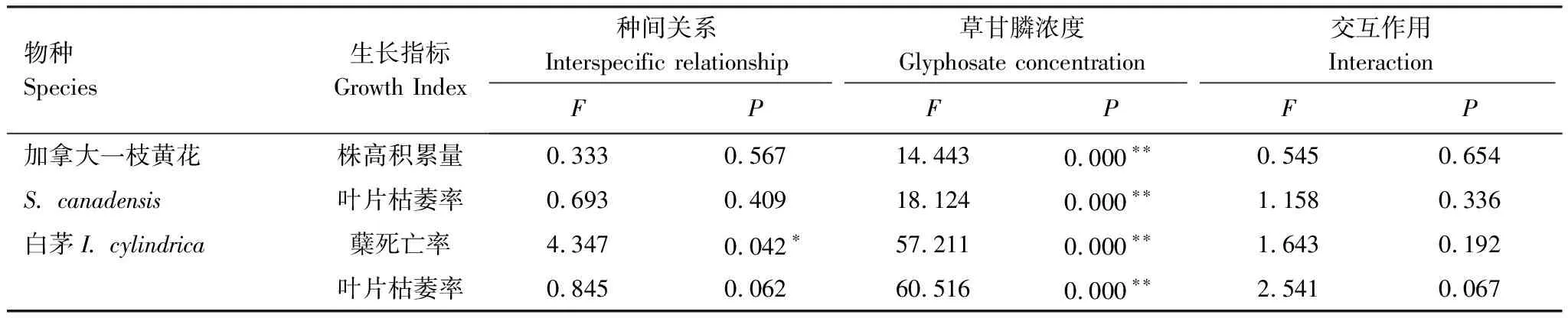
表1 种间关系和草甘膦处理对加拿大一枝黄花和白茅生长指标的影响
*P<0.05;**P<0.01
与加拿大一枝黄花相比,白茅对草甘膦处理更敏感。在1.2mL/L浓度处理21d后,单种、混种白茅的分蘖死亡率超过50%,叶片枯萎率超过60%;而1.8mL/L浓度下单种、混种加拿大一枝黄花的叶片枯萎率则分别为55%和61%。对照条件下,混种白茅分蘖死亡率和叶片枯萎率均高于单种白茅,并且两种种植方式间差异显著(P<0.05),表明自然条件下,加拿大一枝黄花和白茅存在种间竞争关系,白茅在竞争中处于劣势位置。随着处理浓度递增,混种白茅分蘖死亡率和叶片枯萎率呈现低于单种白茅的趋势,但不同种植方式间差异不显著。从表1还能得知,种间关系显著抑制白茅的分蘖能力(P<0.05),但对其绿叶长度影响不显著;种间关系和草甘膦的交互作用对白茅生长的影响并不显著。
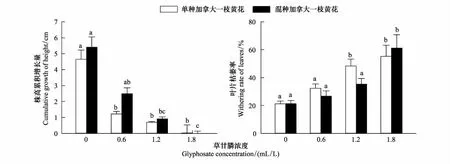
图1 草甘膦对加拿大一枝黄花株高累积增长量和叶片枯萎率的影响Fig.1 Effects of glyphosate on cumulative growth of height and withering rate of leaves of S. canadensis (mean+SE)数据为7次重复测定的平均值±标准误;不同字母表示不同浓度草甘膦处理之间的差异显著(P<0.05)

图2 草甘膦对白茅分蘖死亡率和叶片枯萎率的影响Fig.2 Effects of glyphosate on death rate of tillers and withering rate of leaves of I. cylindrica (mean+SE)
2.2 加拿大一枝黄花和白茅的光响应曲线
经过21d的生长,两个物种叶片的光合光响应曲线如图3、图4所示。加拿大一枝黄花叶片净光合速率(Pn)随着光合有效辐射强度(PAR)的增加而增加,然后达到饱和;白茅叶片Pn则随PAR增大先快速增加而后速度减缓。随着草甘膦浓度升高,单种、混种加拿大一枝黄花和白茅的Pn均不断下降,叶片利用光强的能力明显减弱。

图3 草甘膦处理下加拿大一枝黄花叶片的光合光响应曲线Fig.3 Light response curves of net photosynthetic rate (Pn), transpiration rate (Tr), stomatal conductance (Gs) and intercellular CO2 concentration (Ci) of S. canadensis under treatments of glyphosate
气孔是植物与外界进行气体交换的通道,其闭合程度直接影响植物的光合作用和蒸腾作用。对照组中,加拿大一枝黄花和白茅叶片的气孔导度(Gs)均随PAR增大而呈上升趋势,蒸腾速率(Tr)表现出与Gs相一致的变化规律;随着草甘膦浓度递增,加拿大一枝黄花和白茅的Gs和Tr均不断降低。0.6mL/L浓度对单种加拿大一枝黄花叶片气孔损伤较小,其Gs仍随PAR增大而增大,但同浓度处理明显损伤混种加拿大一枝黄花的气孔,使其Gs随PAR增大的变化不明显;1.2—1.8mL/L处理下单种、混种加拿大一枝黄花Gs随PAR增大的变化不明显,表明植株气孔受损严重,基本失去了调节作用。与生长指标相符,草甘膦对白茅光合作用的影响大于对加拿大一枝黄花的影响,0.6mL/L处理下单种白茅Gs的降低幅度更大,1.2—1.8mL/L浓度下单种、混种白茅Gs均对光强变化不敏感。

图4 草甘膦处理下白茅叶片的光合光响应曲线Fig.4 Light response curves of net photosynthetic rate (Pn), transpiration rate (Tr), stomatal conductance (Gs) and intercellular CO2 concentration (Ci) of I. cylindrica under treatments of glyphosate
两个物种的胞间CO2浓度(Ci)对草甘膦处理的响应也不相同。随处理浓度递增,单种加拿大一枝黄花的Ci先下降而后上升,而混种加拿大一枝黄花的Ci值则不断下降;但单种、混种白茅的Ci值均随草甘膦浓度增大而上升。
2.3 加拿大一枝黄花和白茅的光合特征参数
通过非直角双曲线模型进行计算,得出两种种植方式下加拿大一枝黄花和白茅的最大净光合速率(Pnmax)、光饱和点(LSP)、光补偿点(LCP)、表观量子效率(AQY)以及暗呼吸速率(Rd)。
Pnmax是衡量植物光合能力的重要指标。种间关系、草甘膦显著影响两个物种叶片Pnmax(P<0.05);此外,种间关系和草甘膦的交互作用对加拿大一枝黄花Pnmax影响显著(P<0.05)(表2)。随处理浓度递增,加拿大一枝黄花单种时Pnmax依次降低为对照组的81.37%、31.03%和21.49%,混种时Pnmax则为对照组的37.65%、33.40%和17.06%;单种白茅Pnmax依次减小为对照组的36.74%、8.34%和4.31%,混种白茅Pnmax为对照的24.61%、9.24%和4.89%;t检验结果显示,仅在0.6mL/L浓度下,两个物种Pnmax在不同种植方式之间差异显著(P<0.05)。LSP与Pnmax有着密切关系,草甘膦处理后加拿大一枝黄花和白茅LSP与Pnmax的变化相一致。同样的,草甘膦显著影响加拿大一枝黄花和白茅LCP(P<0.05),随着浓度上升,两个物种LCP均逐渐增大;但种间关系、种间关系和草甘膦交互作用对两个物种LCP的影响不显著;t检验表明,1.8mL/L浓度下加拿大一枝黄花LCP与其他浓度处理间差异显著(P<0.05),0.6mL/L处理后白茅LCP与对照组差异显著(P<0.05)。
表2种间关系和草甘膦处理对加拿大一枝黄花和白茅光响应特征参数的影响
Table2EffectsofinterspecificrelationshipandglyphosatetreatmentonlightresponsivephotosyntheticparametersofS.canadensisandI.cylindrica
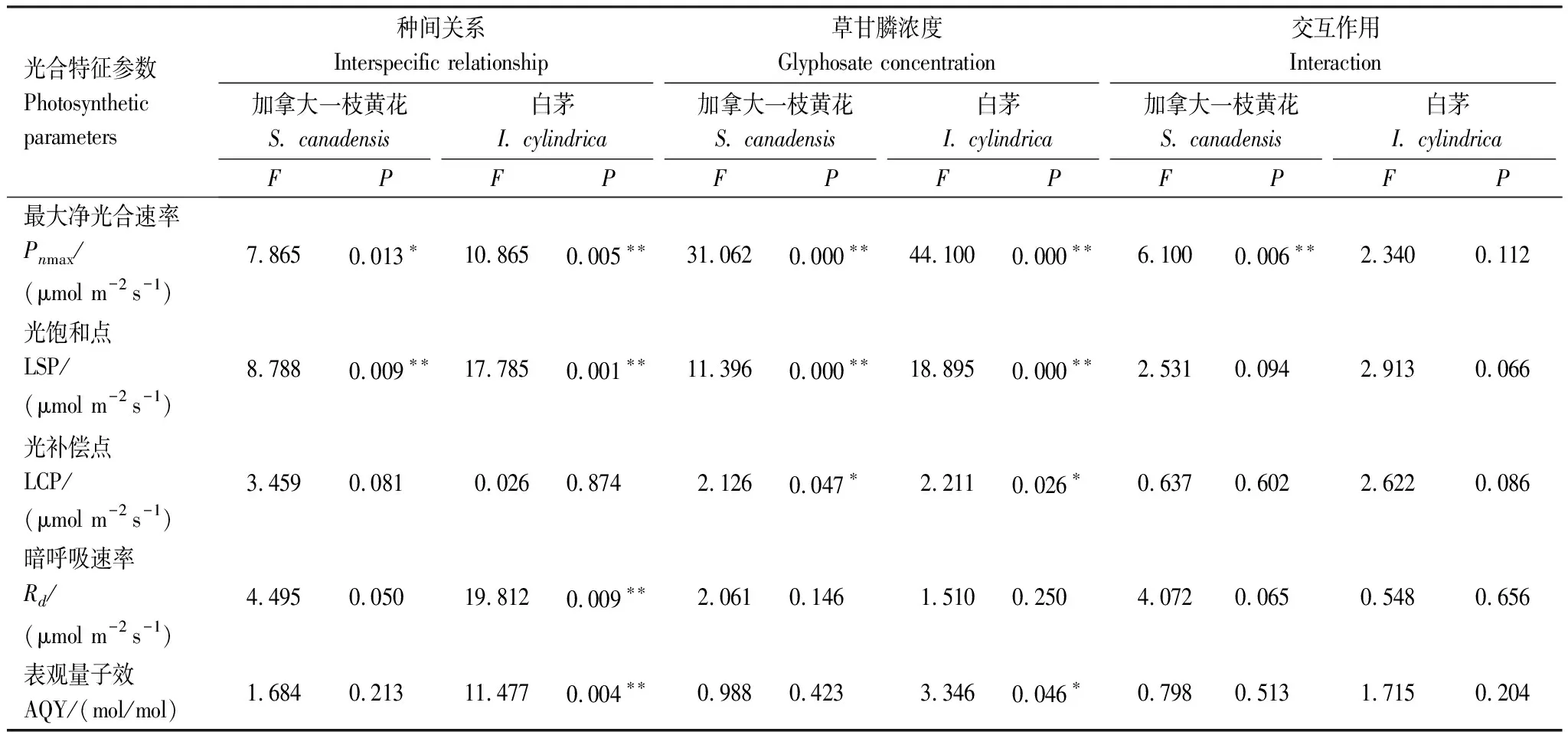
光合特征参数Photosynthetic parameters种间关系Interspecific relationship草甘膦浓度Glyphosate concentration交互作用Interaction加拿大一枝黄花S. canadensis白茅I. cylindrica加拿大一枝黄花S. canadensis白茅I. cylindrica加拿大一枝黄花S. canadensis白茅I. cylindricaFPFPFPFPFPFP最大净光合速率Pnmax/(μmol m-2 s-1)7.865 0.013∗ 10.865 0.005∗∗31.062 0.000∗∗44.100 0.000∗∗6.100 0.006∗∗2.340 0.112光饱和点LSP/(μmol m-2 s-1)8.788 0.009∗∗17.785 0.001∗∗11.396 0.000∗∗18.895 0.000∗∗2.531 0.094 2.913 0.066光补偿点LCP/(μmol m-2 s-1)3.459 0.081 0.026 0.874 2.126 0.047∗ 2.211 0.026∗ 0.637 0.602 2.622 0.086暗呼吸速率Rd/(μmol m-2 s-1)4.495 0.050 19.812 0.009∗∗2.061 0.146 1.510 0.250 4.072 0.0650.548 0.656表观量子效AQY/(mol/mol)1.684 0.213 11.477 0.004∗∗0.988 0.423 3.346 0.046∗ 0.798 0.513 1.715 0.204
Pnmax:maximum net photosynthetic rate(μmol m-2s-1); LSP:light saturation point(μmol m-2s-1); LCP:light compensation point(μmol m-2s-1);Rd:dark respiration rate(μmol m-2s-1); AQY:apparent quantum yield(mol/mol)
AQY反映了植物在弱光条件下对光照的利用效率。由表2可知,草甘膦对加拿大一枝黄花AQY影响不显著,但显著影响白茅AQY(P<0.05);种间关系同样显著影响白茅AQY(P<0.05)。除了1.2mL/L处理时加拿大一枝黄花叶片AQY和LCP在单种、混种间差异显著(P<0.05)外,其他浓度处理下,加拿大一枝黄花AQY、LCP、LSP在两种种植方式间的差异均不显著;0.6—1.8mL/L处理下,白茅AQY在不同种植方式间差异显著(P<0.05),其LCP和LSP则在1.2—1.8mL/L浓度处理下差异显著(P<0.05)。种间关系显著影响白茅Rd(P<0.05),但对加拿大一枝黄花Rd影响并不显著;草甘膦、种间关系和草甘膦交互作用对两个物种Rd的影响均不显著。
3 讨论
除草剂通过抑制多种次生代谢途径中关键酶的合成而造成植物死亡[24]。内吸传导性除草剂草甘膦可以在48h内经植物体内的木质部和韧皮部传遍整株,使多年生植物在7—10天呈现发黄、枯萎等受损症状[6]。已有研究表明,草甘膦能有效抑制菊科加拿大一枝黄花与禾本科白茅根、茎、叶的生长发育[7-8,34]。本研究发现与入侵植物加拿大一枝黄花相比,土著植物白茅对草甘膦更敏感。低浓度草甘膦处理下,白茅先于加拿大一枝黄花出现失绿、枯萎叶片,且在相同浓度作用后,白茅植株地上器官受到的损伤均大于加拿大一枝黄花所受的损伤。随着草甘膦浓度升高,与单种植株相比,混种加拿大一枝黄花和白茅均呈现生长较好的趋势(图1,图2)。植物在整个生命周期内不断与邻近个体发生相互作用,在试验期间非致死量草甘膦降低了两个物种的光合速率和生长[35-36],但在与白茅的竞争过程中,加拿大一枝黄花仍具有相对竞争优势[37],因而混种加拿大一枝黄花株高累计增长量较单种加拿大一枝黄花高、叶片枯萎率较单种时低。加拿大一枝黄花是具有强化感作用的外来入侵种[38],与对照相比,喷施草甘膦后混种白茅有生长较好的趋势,一方面可能是由于草甘膦减弱了种间竞争强度[37],另一方面很可能是因为除草剂改变了入侵植物根系分泌的化感抑制物质,减弱入侵种对土著种的化感抑制作用[39-40]。
光合作用是植物最基本的生理过程,成功入侵的外来植物比本地种拥有更强的光合能力[41]。Pn是衡量植物光合能力的重要指标,其大小决定物质积累能力的高低;LSP和LCP反映的是植物对强光和弱光条件的适应能力,AQY则是衡量植物光合机构功能效率的指标[42-44]。加拿大一枝黄花较高的净光合速率有利于其获得竞争优势、形成优势种群[45]。对照组中,混种加拿大一枝黄花叶片Pnmax远高于混种白茅,说明混种加拿大一枝黄花具有较强的光资源利用能力和较快的生长速率,与形态指标变化相符合(图3,图4)。大量研究已表明,加拿大一枝黄花植株中含有的化感物质对多种植物的种子萌发和幼苗生长均有影响[46-47],沈荔花等[38]研究发现加拿大一枝黄花能强烈抑制禾本科植物小麦的生长与光合作用。本研究中混种白茅的生长和光合均低于单种白茅,种间关系显著影响加拿大一枝黄花和白茅的光合速率(表2),说明与加拿大一枝黄花伴生时,禾本科植物白茅很可能受到了伴生入侵植物的化感抑制作用;混种加拿大一枝黄花则因抢占更多生存资源而生长更快。
进入植物体内的草甘膦将作用于植株绿色部分而导致多种生化性状的改变。通过抑制类胡萝卜素、叶绿素及氨基酸的生物合成、阻碍莽草酸途径,以及抑制光合磷酸化而使光能不能生成ATP及NADPH等,从而抑制植物正常的新陈代谢和光合过程[6,8,48-49]。物种光合能力强弱因遗传特性和外界环境的不同而有差异,其变化可作为判断植物抗逆性强弱的指标[50]。喷施除草剂后,加拿大一枝黄花和白茅叶片Pn、Gs、Tr均随处理浓度升高而不断降低,与加拿大一枝黄花相比,白茅叶片光合作用能力降幅更大(图3,图4)。低浓度草甘膦作用后,与单种种群相比,混种加拿大一枝黄花和白茅的Pn均下降得较快,随着草甘膦浓度上升,草甘膦对两个物种不同种植下光合作用的影响逐渐趋近。在非生物环境胁迫下,影响植物叶片光合能力的因素一般分为因气孔关闭导致的气孔限制和因叶肉细胞光合活性降低导致的非气孔限制[51]。Farquhar等[52]提出可依据胞间CO2浓度(Ci)和气孔限制值(Ls)的变化方向对主要限制因素进行判断,当Pn下降的同时Ci降低和Ls上升时,这种情况属于气孔限制因素为主导;反之,Pn下降伴随Ci升高或不变,同时Ls降低,则属非气孔限制因素为主导。本研究中,加拿大一枝黄花单独种植时的Ci先下降然后上升,表明低浓度处理下单种种群的Pn主要受气孔因素的限制,随处理浓度递增,植株叶肉细胞开始受到损伤,光合能力的下降主要由非气孔限制造成;混种加拿大一枝黄花的Ci则不断下降,在各浓度处理下该入侵种的Pn主要受气孔因素的限制。单种、混种白茅的Ci均逐渐升高,白茅对草甘膦的耐受性较弱,低浓度草甘膦可能直接作用于白茅叶片的叶绿体,损伤了单种、混种白茅的叶肉细胞,降低其光合合成有机物质的能力。
综上可知,外来植物加拿大一枝黄花具有比本地植物白茅更高的光合速率和生长速率,这有助于其入侵和蔓延。不同物种对除草剂的耐受性存在差异,草甘膦处理显著影响两种植物的生长和光合机制,本地种白茅对草甘膦更敏感,低浓度除草剂处理下白茅茎、叶枯萎率以及光合作用下降幅度均要大于加拿大一枝黄花。建议在加拿大一枝黄花与白茅伴生时,尽量减少或不施用除草剂,以减小对土著植被的影响;未来需要开展更多研究,以期更全面、准确评估使用除草剂对加拿大一枝黄花与本地物种造成的影响。
致谢:感谢中国林业科学研究院亚热带林业研究所张欣丽、赵林丽、陆琳莹给予的帮助。
参考文献(References):
[1] Westphal M I, Browne M, MacKinnon K, Noble I. The link between international trade and the global distribution of invasive alien species. Biological Invasions, 2008, 10(4): 391- 398.
[2] 鞠瑞亭, 李慧, 石正人, 李博. 近十年中国生物入侵研究进展. 生物多样性, 2012, 20(5): 581- 611.
[3] 闫小玲, 寿海洋, 马金双. 中国外来入侵植物研究现状及存在的问题. 植物分类与资源学报, 2012, 34(3): 287- 313.
在控制工程中,二阶系统的典型应用极为普遍。因此,在自动控制原理课程教学中着重介绍其分析和计算方法。典型二阶系统的闭环传递函数为:
[4] 强胜, 陈国奇, 李保平, 孟玲. 中国农业生态系统外来种入侵及其管理现状. 生物多样性, 2010, 18(6): 647- 659.
[5] Duke S O, Powles S B. Glyphosate: a once-in-a-century herbicide. Pest Management Science, 2008, 64(4): 319- 325.
[6] 周垂帆, 李莹, 张晓勇, 俞元春. 草甘膦毒性研究进展. 生态环境学报, 2013, 22(10): 1737- 1743.
[7] 戴雅娟. 加拿大一枝黄花(SolidagocanadensisL.)组织培养途径及草甘膦处理后生理生化指标变化的研究[D]. 金华: 浙江师范大学, 2009.
[8] Huang J L, Silva E N, Shen Z G, Jiang B, Lu H F. Effects of glyphosate on photosynthesis, chlorophyll fluorescence and physicochemical properties of cogongrass (ImperatacylindricalL.). Plant Omics Journal, 2012, 5(2): 177- 183.
[9] 刘文娟, 刘勇, 黄小琴, 周西全, 宋君, 尹全, 王东, 陶李, 张富丽, 常丽娟, 张蕾, 雷绍荣. 不同时期喷施草甘膦对抗草甘膦转基因大豆生长和产量构成的影响. 中国农业科学, 2012, 45(4): 675- 684.
[10] 谭效松, 贺红武. 除草剂的作用靶标与作用模式. 农药, 2005, 44(12): 533- 537, 557- 577.
[11] Teixeira M C, Duque P, Sá-Correia I. Environmental genomics: mechanistic insights into toxicity of and resistance to the herbicide 2, 4-D. Trends in Biotechnology, 2007, 25(8): 363- 370.
[13] 宋宏峰, 郭磊, 张斌斌, 汪晨雨. 除草剂对毛桃幼苗生长与光合的影响. 园艺学报, 2014, 41(11): 2208- 2214.
[14] Williams D G, Mack R N, Black R A. Ecophysiology of introducedPennisetumsetaceumon Hawaii: the role of phenotypic plasticity. Ecology, 1995, 76(5): 1569- 1580.
[15] Williamson M, Fitter A. The varying success of invaders. Ecology, 1996, 77(6): 1661- 1666.
[16] Funk J L, Vitousek P M. Resource-use efficiency and plant invasion in low-resource systems. Nature, 2007, 446(7139): 1079- 1081.
[17] Wang N, Yu F H, Li P X, He W M, Liu F H, Liu J M, Dong M. Clonal integration affects growth, photosynthetic efficiency and biomass allocation, but not the competitive ability, of the alien invasiveAlternantheraphiloxeroidesunder severe stress. Annals of Botany, 2008, 101(5): 671- 678.
[18] You W H, Fan S F, Yu D, Xie D, Liu C H. An invasive clonal plant benefits from clonal integration more than a co-Occurring native plant in nutrient-patchy and competitive environments. PLoS One, 2014, 9(5): e97246.
[19] Scherner A, Avila L. Schreiber F, Kruse N D, Fernando J A, Garcia E N. Susceptibility of peruvian watergrass and rice cutgrass to glyphosate under soil moisture variations. Crop Protection, 2017, 98: 1- 7.
[20] Alcantara R, Fernandez P, Smeda R J, Alves P L, Prado R D. Response ofEleusineindicaandPaspalumdistichumto glyphosate following repeated use in citrus groves. Crop Protection, 2016, 79: 1- 7.
[21] Song N H, Yin X L, Chen G F, Yang H. Biological responses of wheat (Triticumaestivum) plants to the herbicide chlorotoluron in soils. Chemosphere, 2007, 68(9): 1779- 1787.
[22] Mateos-Naranjo E, Perez-Martin A. Effects of sub-lethal glyphosate concentrations on growth and photosynthetic performance of non-target speciesBolboschoenusmaritimus. Chemosphere, 2013, 93(10): 2631- 2638.
[23] 谭伟, 王慧, 翟衡. 除草剂对葡萄叶片光合作用及贮藏营养的影响. 应用生态学报, 2011, 22(9): 2355- 2362.
[24] 郭磊, 张斌斌, 周懋, 宋宏峰. 除草剂对桃树生理特性和流胶的影响. 西北植物学报, 2017, 37(1): 81- 87.
[25] Pal R W, Chen S Y, Nagy D U, Callaway R M. Impacts ofSolidagogiganteaon other species at home and away. Biological Invasions, 2015, 17(11): 3317- 3325.
[26] 雷军成, 徐海根. 基于MaxEnt的加拿大一枝黄花在中国的潜在分布区预测. 生态与农村环境学报, 2010, 26(2): 137- 141.
[27] 杨如意, 昝树婷, 唐建军, 陈欣. 加拿大一枝黄花的入侵机理研究进展. 生态学报, 2011, 31(4): 1185- 1194.
[28] Gusev A P. The impact of invasive Canadian goldenrod (SolidagoCanadensisL.) on regenerative succession in old fields (the southeast of Belarus). Russian Journal of Biological Invasions, 2015, 6(2): 74- 77.
[29] 李长明, 叶小齐, 吴明, 邵学新. 水深及共存对芦苇和香蒲生长特征的影响. 湿地科学, 2015, 13(5): 609- 615.
[30] 叶小齐, 吴明, 邵学新, 蒋跃平, 王蒙. 不同土著草本群落对加拿大一枝黄花早期阶段入侵的抑制能力研究. 生态与农村环境学报, 2014, 30(5): 608- 613.
[31] De Wit C T. On competition. Verslagen Landbouwkundig Onderzoek, 1960, 66: 1- 82.
[32] 宁金花, 陆魁东, 霍治国, 解娜, 黄晚华. 拔节期淹涝胁迫对水稻形态和产量构成因素的影响. 生态学杂志, 2014, 33(7): 1818- 1825.
[33] 叶子飘. 光合作用对光和CO2响应模型的研究进展. 植物生态学报, 2010, 34(6): 727- 740.
[34] 黄建丽. 草甘膦对紫茎泽兰和白茅生理指标的影响及草甘膦在植物体内生物传导途径的研究[D]. 金华: 浙江师范大学, 2012.
[35] Yanniccari M, Tambussi E, Istilart C, Castro A M. Glyphosate effects on gas Exchange and chlorophyll fluorescence responses of twoLoliumperenneL. biotypes with differential herbicide sensitivity. Plant Physiology and Biochemistry, 2012, 57: 210- 217.
[36] Londo J P, McKinney J, Schwartz M, Bollman M, Sagers C, Watrud L. Sub-lethal glyphosate exposure alters flowering phenology and causes transient male-sterility inBrassicaspp. BMC Plant Biology, 2014, 14: 70- 70.
[37] 古春凤, 叶小齐, 吴明, 邵学新, 焦盛武. 草甘膦对加拿大一枝黄花和伴生植物白茅种间竞争关系的影响. 植物生态学报, 2017, 41(4): 439- 449.
[38] 沈荔花, 李国庆, 戎红, 于翠平, 林文雄. 入侵植物加拿大一枝黄花对小麦光合生理的影响. 中国农学通报, 2009, 25(14): 252- 255.
[39] Weidenhamer J R, Callaway R M. Direct and indirect effects of invasive plants on soil chemistry and ecosystem function. Journal of Chemical Ecology, 2010, 36(1): 59- 69.
[40] 李光义, 侯宪文, 邓晓, 王中, 张桂花, 李勤奋. 除草剂对蟛蜞菊化感作用的影响研究. 中国农学通报, 2010, 26(1): 173- 181.
[41] Zou J, Rogers W E, Siemann E. Differences in morphological and physiological traits between native and invasive populations ofSapiumsebiferum. Functional Ecology, 2007, 21(4): 721- 730.
[42] 刘全吉, 孙学成, 胡承孝, 谭启玲. 砷对小麦生长和光合作用特性的影响. 生态学报, 2009, 29(2): 854- 859.
[43] Chown S L, Slabber S, McGeoch M A, Janion C, Leinaas H P. Phenotypic plasticity mediates climate change responses among invasive and indigenous arthropods. Proceedings of the Royal Society B: Biological Sciences, 2007, 274(1625): 2531- 2537.
[44] 魏子上, 陈新微, 杨殿林, 皇甫超河. 辽宁地区两种菊科入侵植物与本地植物光合特性比较. 中国生态农业学报, 2017, 25(7): 975- 982.
[45] 胡天印, 方芳, 郭水良, 蒋华伟. 外来入侵种加拿大一枝黄花及其伴生植物光合特性研究. 浙江大学学报: 农业与生命科学版, 2007, 33(4): 379- 386.
[46] 梅玲笑, 陈欣, 唐建军. 外来杂草加拿大一枝黄花对入侵地植物的化感效应. 应用生态学报, 2005, 16(12): 2379- 2382.
[47] Abhilasha D, Quintana N, Vivanco J, Joshi J. Do allelopathic compounds in invasiveSolidagocanadensiss.l. restrain the native European flora? Journal of Ecology, 2008, 96(5): 993- 1001.
[48] Reddy K N, Hoagland R E, Zablotowicz R M. Effect of glyphosate on growth, chlorophyll, and nodulation in glyphosate-resistant and susceptible soybean (Glycinemax) varieties. Journal of New Seeds, 2000, 2(3): 37- 52.
[49] Muller R, Schreiber U, Escher B I, Quayle P, Nash S M B, Mueller J F. Rapid exposure assessment of PSII herbicides in surface water using a novel chlorophyll a fluorescence imaging assay. Science of the Total Environment, 2008, 401(1/3): 51- 59.
[50] 惠红霞, 许兴, 李前荣. 外源甜菜碱对盐胁迫下枸杞光合功能的改善. 西北植物学报, 2003, 23(12): 2137- 2142.
[51] 许大全. 光合作用气孔限制分析中的一些问题. 植物生理学通讯, 1997, 33(4): 241- 244.
[52] Farquhar C D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33: 317- 345.
