基于DGGE研究喀斯特金橘接种AMF对根际细菌多样性和植株生长的影响
2018-05-30雷芸林钰胡振兴邓荫伟田远春刘灵
雷芸 林钰 胡振兴 邓荫伟 田远春 刘灵

摘 要: 该研究分别以喀斯特地区的酸性土和石灰土为盆栽基质,对金橘分别接种摩西管柄囊霉 (Funneliformis mosseae, F.m) 或幼套近明囊霉 (Claroideoglomus etunicatum, C.e),采用变性梯度凝胶电泳 (DGGE) 等技术研究AMF对金橘根际细菌群落多样性及植株生长的影响。结果表明:与不接种处理相比,同类型土中分别接种C.e或F.m,金橘根际菌根侵染率相关指标 (F、m、v) 值均为C.e处理的最高,C.e或F.m处理后金橘根际土壤中蔗糖酶、酸性磷酸酶、蛋白酶及脲酶活性均显著提高。其中,蛋白酶和脲酶活性变化为石灰土中各处理酶活性值高于酸性土,蔗糖酶和磷酸酶活性变化则为酸性土中各处理酶活性值高于石灰土,差异均达显著水平 (P<0.05);两种土壤中上述四种土壤酶活性均为C.e处理的值最高;接种C.e或F.m后,金橘根际土壤细菌的DGGE图谱中,DNA条带数增多,其细菌丰富度(R)、多样性(H) 和均匀度(E) 指数均比不接种处理高,三种指数值均以C.e处理的最高。细菌DNA优势条带序列分析结果表明:与优势细菌同源性最高的大部分为不可培养细菌,包括酸酐菌属、变形杆菌属、根瘤菌属和放线菌属等,相似性均大于97%。此外,接种后,金橘整株生物量比不接种处理显著提高,而酸性土中接种C.e处理的金橘生物量最高。综上所述,C.e和F.m均能与金橘建立良好的共生关系,且C.e对金橘根系的侵染效果更好。
关键词: 喀斯特地区, 金橘, 丛枝菌根真菌, 土壤酶, PCR-DGGE, 细菌群落结构
中圖分类号: Q948.1
文献标识码: A
文章编号: 1000-3142(2018)01-0065-11
Effects of Fortunella margarita inoculated with AMF on rhizospheric bacterial community diversity based on DGGE
LEI Yun1, LIN Yu1, HU Zhenxing1, DENG Yinwei1,2, TIAN Yuanchun3, LIU Ling1,2*
( 1. Key Laboratory of Ecology of Rare and Endangered Species and Environmental Protection, Guangxi Normal University, Ministry of Education, Guilin 541004, Guangxi, China; 2. College of Life Sciences, Guangxi Normal University, Guilin 541004, Guangxi, China; 3. Campus Management Center, Guangxi Normal University, Guilin 541004, Guangxi, China )
Abstract: To overcome the soil infertility and poor crop output problem of karst region, we chose Funneliformis mosseae (F.m) and Claroideoglomus etunicatum (C.e) as AMF inoculants and two types of soil in karst region as potted matrix, the bacterial community diversity and growth of Fortunella margarita were investigated by PCR-DGGE (denaturing gradient gel electrophoresis) technique and other conventional approaches. The results were as follows: Comparing to no AM fungi treatment, the colonization rate of root system of F. margarita such as F, m, v inoculated with either C.e or F.m treatment increase significantly. No matter in either type of soil, C.e treatment are the highest. In addition, rhizospheric soil enzyme activities including invertase, phosphatase, protease and urease with either C.e or F.m treatment increase significantly. Among them, activities of protease and urease are the highest in lime soil (LS), and that of invertase and phosphatase in acid soil (AS) are higher than that in LS, the differences are significant with each other(P<0.05). Either in AS or LS, the four kinds of soil enzyme activities with C.e are the highest. In terms of bacterial diversity, the bands number of bacterial DNA with AMF of DGGE profile enriched, and the index of richness (R), diversity (H) and evenness (E) with AMF are higher than no AMF treatment. No matter in either type of soil, value of R, H and E with C.e are the highest. Additionally, based on the results of sequence analysis to DNA dominant bands of DGGE profile, all dominant bacterial strains are phylogenetically closen to uncultured microbes, including Acidobacterium, Proteus, Rhizobium and Actinomyce, the similarity of each is above 97%. Moreover, comparing to no AM fungi treatment, biomass of Fortunella margarita inoculated with either C.e or F.m treatment increases significantly, C.e treatment are the highest in AS. In conclusion, comparing to F.m, C.e represents better efficiency for F. margarita in karst region. AMF can enhance activities of four rhizospheric soil enzyme, stimulated diversities of soil bacteria population. As the result, plant biomass increase. It provides the information for improving growth of F. margarita by facilitating the conversion and dynamics of nutrients such as C, N, P and others.
Key words: karst region, Fortunella margarita, arbuscular mycorrhizal fungi (AMF), soil enzyme, PCR-DGEE, bacterial community structure
金橘[Fortunella margarita (Lour) Swingle]为芸香科(Rutaceae)金橘属(Fortunella)常绿灌木,是常见的药食同源性食物,主产于广西的阳朔、融安等地,在这些地区,金橘种植已成为当地的支柱产业之一。如2016年,阳朔县金橘种植面积超过1.25万hm2,年总产量30.1万t,面积和产量均超全国一半,预计产值达21.2亿元。但由于金橘喜肥,所以种植时必须有充足的肥料才能保证其高产和优质。而作为我国金橘主产区之一的广西为喀斯特地区,以强烈溶蚀作用形成的峰丛、孤峰、溶蚀洼地和干谷等为特征的喀斯特地貌分布面积约占其土地总面积的30%。喀斯特地区普遍土壤贫瘠,蓄水力差。在生产中,人们大量施用化肥以追求高产,但终因肥料当季利用率不高而导致增产效果不显著(张传博等, 2013)。因此,如何高效施肥获得高产一直是人们的研究热点之一。近年来,生物菌肥逐渐兴起,因其具有促进植物生長、价格便宜、效果持久、对环境无污染等优点成为替代化肥的首选 (段淇斌等, 2015)。丛枝菌根真菌 (Arbuscular mycorrhiza fungi, AMF) 即其中的一种。
AMF在自然界中普遍存在,能侵染绝大多数 (>90%) 陆生高等植物的地下根系,AMF必须与宿主植物共生才可存活。丛枝菌根是由AMF与高等植物根系形成的共生体,能为宿主提供更多养分而促进宿主发育(林双双等, 2013)。AMF有庞大的菌丝网,可伸入植物根系难以延伸到的土壤微小缝隙中,利用外生菌丝分泌的土壤酶加速土壤养分的循环和活化,刺激根际土壤微生物的活动,使植物可利用的养分增多(付晓峰等, 2016),帮助植物吸收更多的氮(赵乾旭等, 2016)、磷 (孙金华等, 2016)、钾 (毕银丽等, 2014)等矿质元素,尤其是土壤中易被固定的磷,减少植物对化肥的依赖。此外,AMF还有提高植物对低温 (武冲等, 2012)、重金属 (杨会玲等, 2015) 等逆境的抗性,促进宿主植物生长发育等作用。前人对AMF做了较为深入的研究,近年来也有学者致力于用AMF来提高土壤肥力和改善植物营养 (韦莉莉等, 2016; 陈永亮等, 2014),增加土壤酶活性 (郑舜怡等, 2014),促进植株生长 (张传博等, 2013),提高产量 (王晓燕等, 2016) 及植被修复 (何跃军等, 2016) 等。然而,有关在喀斯特生境下,应用PCR-DGGE (Denaturing Gradient Gel Electrophoresis)技术,研究金橘根际土壤微生物多样性及植株生长对AMF响应的报道却较少。
DGGE即变性梯度凝胶电泳,其原理是在电泳时,由于不同样品的DNA中存在有差异的碱基,会在不同浓度的变性剂条件下解链,从而停留在凝胶上的某个位置,最终使得不同目的基因的DNA分离。近年来因其可克服传统方法如平板法的不足,检测到难培养的微生物,并且可检测出数量仅占总群落数1%的微生物,具有检测结果准确可靠、重现性好,可同时分析大量样品的优点,PCR-DGGE技术在微生物生态学领域得到广泛的应用,至今仍是研究微生物群落结构特征的有效手段之一 (李德斌等, 2010)。本研究通过对生长于喀斯特生境中的金橘分别接种F.m或C.e,利用PCR-DGGE等方法进行分析,以期揭示AMF对不同类型土壤中金橘根际土壤酶活性和细菌群落结构多样性及植株生长的影响,为筛选出适应喀斯特生态环境的高效菌种、增加土壤肥力、提高肥料利用率,最终为提高金橘产量和质量提供科学依据。
1 材料与方法
1.1 材料
供试金橘品种 (Fortunella margarita)为一年生阳朔金橘嫁接苗;供试AMF为幼套近明囊霉 (Claroideoglomus etunicatum, 简写为C.e) 和摩西管柄囊霉 (Funneliformis mosseae, 简写为F.m),均购自北京市农林科学院植物营养与资源研究所“丛枝菌根真菌种质资源库 (BGC)”,中国丛枝菌根真菌种质资源库编号分别为BGC-NM01B和BGC-NM03D,由北京市农林科学院植物营养与资源研究所提供。
栽培基质为棕色石灰土 (简称石灰土, lime soil即LS) 和地带性硅酸盐红壤 (简称酸性土, acid soil即AS),均采自广西桂林潮田乡毛村 (110°53′ E, 25°19′ N)。土壤基本理化性质测定参照常规分析方法委托农业部广西南宁甘蔗品质监督检验测试中心检测(表1)。
1.2 试验设计
实验设有酸性土不接菌 AS-AM、酸性土接摩西管柄囊霉 AS+F.m、酸性土接幼套近明囊霉 AS+C.e、石灰土不接菌 LS-AM、石灰土接摩西管柄囊霉 LS+F.m 和石灰土接幼套近明囊霉 LS+C.e 共6个处理,每处理10个重复。将高压灭菌过的两种类型的土壤过149 μm 孔径的筛子,每种土壤3 kg分别装入用高锰酸钾灭菌过的花盆中 (口径28 cm × 高30 cm × 底径18 cm),选取长势一致,生长良好的金橘嫁接苗适当修剪后,金橘根部浸泡在浓度为200 mmol·L-1的ABT生根粉溶液中20~30 s后覆土栽培,每隔2 d浇一次Hoagland营养液,其余常规管理。
金橘幼苗恢复生长后进行AMF接种。在距盆顶端20 cm处挖开表土,分别在相应接种处理的金橘盆中接入混有F.m或C.e的根段、泡囊、孢子等菌根结构的混合菌剂各50 g,混匀播撒在金橘根部四周。对照处理放入相应同等质量已灭菌的混合菌剂,表土混匀后覆盖。接种后,每隔1 d浇0.1 mol·L-1的Hoagland营养液,接种30 d后换为0.5 mol·L-1的Hoagland营养液。接种60 d后与两不接种对照处理一样,浇等量1 mol·L-1的Hoagland营养液原液。每隔1个月转换花盆位置,尽量保持每株金橘光照等栽培条件的一致性。接种90 d后,每隔7 d取植物根样1次,每处理随机取5盆,每盆取30段以上幼嫩金橘根段,装入预先装有适量FAA固定液的离心管中,每盆根样装1管并标记。根段透明,酸化后,曲利苯蓝染色,制片镜检确认菌根侵染频度在30%以上时采集根际土样。随机取3盆金橘/重复,去除距盆表2 cm的表层土,用十字交叉法在花盆半径1/2处分4点用小铲取5~30 cm深土层土样,分别取100 g土样/盆,四分法取样。同一处理的3盆土样等量混匀为1个混合样,每处理3个重复。装入自封袋中标记,迅速放-4 ℃冰箱中保存。
1.3 方法
1.3.1 菌根侵染率和土壤酶指标测定 AMF侵染率测定和菌根依赖性按林钰 (2014) 方法。根系菌根侵染频度(F,%)、侵染根段菌根侵染强度(m,%)、侵染根段泡囊丰度(v,%)按Trouvelot & Kough(1986)的方法计算;磷酸酶、脲酶、转化酶测定分别用磷酸苯二钠比色法、苯酚钠—次氯酸钠比色法、二硝基水杨酸法 (关松荫, 1986),蛋白酶用改良茚三酮比色法 (蔡红和沈仁芳, 2005)。
1.3.2 金橘根际土壤总DNA的提取和扩增 取5 g土壤样品,加入5 mL 0.1 mol·L-1 pH 8.0的磷酸缓冲液、少许玻璃珠,振荡1 min,加入溶菌酶5 mg,室温振荡15 min,放置冰箱30 min,加125 μL 20% SDS振荡15 min,离心分装入1.5 mL离心管中,加酚抽提2次,氯仿-异戊醇 (1∶1) 抽提3次,加等体积异丙醇,室温放置2 h,离心,最后用75%乙醇清洗沉淀,200 μL TE溶解所提取样品的DNA。粗提后用上海生工生产的DNA胶回收试剂盒纯化,结果均用1.6% (w/v) 琼脂糖凝胶电泳检测,纯化后样品基于大多数细菌的16S rDNA基因V3区特异性的引物对,上游引物序列为F338GC(5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGG-GCACGGGGGGCCTACGGGAGGCAGCAG-3′), 下游引物为 R518 (5′-ATTACCGCGGCTGCTGG-3′)对土壤总细菌DNA进行扩增。
1.3.3 PCR产物的分离和克隆 用Bio-Rad公司Dcode TM基因突变检测系统对PCR产物进行分离。采用8%的聚丙烯酰胺凝胶,变性剂浓度范围为35%~75%,110 V恒定电压下,放置于电泳槽60 ℃电泳10 h。电泳结束后用银染法染色,用Bio-Rad公司GS800扫描仪成像拍照以待分析。取DGGE图谱上优势DNA条带割胶,进行第二次PCR-DGGE,纯化后回收,Takara PMD 18-T载体连接和克隆转化,送深圳华大基因有限公司 (Shenzhen Huada Gene Research Institute) 进行测序。
用Quantity One软件对DGGE图谱中DNA条带进行多样性分析,软件自动对每个条带的亮度和位置进行数值化,用陈法霖等 (2011) 的方法对每种处理的条带计算物种丰富度指数(R),均匀度指数(E)及多样性指数(H)。将DGGE图谱上的优势条带、共有条带和特异性条带DNA纯化、克隆、测序,所得16S rDNA序列用Blast程序在GenBank (http://www. ncbi.nlm.nih.gov/) 数据库进行序列相似性比对,得到可能表征的细菌种属。
1.4 统计分析
用Excel 2013和SPSS 20.0软件进行统计分析,采用邓肯氏新复极差检验法进行多重比较。
2 结果与分析
2.1 AMF对金橘根系菌根侵染率程度的差异
由表2可知,与两种不接种处理AS-AM和 LS-AM相比,不论何种土壤,分别接种F.m或C.e后,金橘根系侵染频度(F)、根段菌根侵染强度(m)和根段泡囊丰度(v)都显著提高 (P<0.05)。接种C.e后,同种土壤中金橘根际F、m和v值都显著高于接种F.m处理,其中AS+C.e处理的F、m和v在所有处理中最高。不同类型土壤中,金橘接种同种AMF,F表现为AS+C.e > LS+C.e > LS+F.m > AS+F.m。说明无论何种土壤,C.e对金橘根系的侵染能力比F.m强,C.e与金橘根系有较高的亲和力,菌根发育程度更好。从菌根依赖性MD看,无论接种F.m还是C.e,石灰土中生长的金橘菌根依赖性均高于酸性土,而无论在酸性土还是石灰土中,金橘对C.e的MD均高于F.m,反映出C.e与金橘根系有较高亲和力。而两种不接种处理AS-AM和LS-AM的F值低于5%,故忽略不计。
2.2 不同AMF处理对金橘根际土壤酶活性的影响
由图1可知,与两个不接种AMF处理相比,接种AMF处理的金橘根际土壤中,蔗糖酶 (图1:a)、酸性磷酸酶 (图1:b)、脲酶 (图1:c)、蛋白酶 (图1:d) 活性显著增高 (P<0.05)。如图1:a,b所示,酸性土的蔗糖酶和酸性磷酸酶活性比石灰土的相应要高。同种土壤中,金橘接种G.e处理其相应的蔗糖酶、脲酶活性均比接种F.m处理相应的要高,差异达显著水平 (P<0.05)。石灰土的脲酶活性高于酸性土(图1:c,d);两种土壤中金橘分别接种C.e和F.m后,与各自相应的不接种处理相比,土壤蛋白酶和脲酶活性均显著提高,两种土壤中均为C.e处理显著高于F.m处理,这与蔗糖酶、酸性磷酸酶的变化趋势相同。说明金橘接种AMF后,通过将与土壤中C、N、P转化相关的酶活性提高,为土壤肥力增加打下基础,而C.e与金橘根系共生更好,更有利于金橘生长。
2.3 AMF对金橘根际土壤细菌群落结构的影响
2.3.1金橘根际土壤細菌群落琼脂糖凝胶电泳图谱分析 由图2:a可知,提取得到的土壤微生物总DNA在琼脂糖凝胶电泳上呈现出清晰的条带,说明土壤微生物基因组总DNA完整,条带后出现明显的拖带,是因为酸性土壤中的腐殖酸杂质造成的。将提取到的土壤微生物总DNA纯化后,在核酸蛋白测定仪上检测,得到OD260 nm /OD280 nm达1.75,OD260 nm /OD230 nm达2.42,表明所提取的DNA纯度较高,可满足后续的实验要求。图2:b所示,金橘6个处理土壤DNA的PCR产物片段长度均在230 bp左右,且无明显特异性扩增,可用于DGGE实验。
2.3.2 金橘根际土壤细菌群落的DGGE图谱分析 从图3:a可以看出,每处理分离出的DNA条带数目不同,亮度也不同。说明不同处理金橘根际土壤样品中总的细菌群落结构和数量存在差异。一般情况下,DGGE图谱上每一个条带表示一种细菌种类。条带数目越多,说明细菌多样性越丰富;条带亮度越强,表明其所代表的细菌数量越大, 反映出土壤中细菌种类和数量的差异。
从图3:a可见,条带1是AS-AM和AS+F.m处理共有的,条带4是LS-AM和LS+F.m的共有条带,条带6是所有酸性土处理的共有条带;条带1在AS+F.m、条带4在LS+F.m处理后都变亮,说明受到F.m刺激后该种类微生物数量增多;条带6和条带9在接种F.m或C.e后亮度减弱,说明接种AMF使该种类细菌数量减少,条带9是岩溶土的共有条带;条带3是AS+C.e的特异性条带,条带2、5和10是AS+F.m所特有的条带,条带7和8是LS+C.e的特异性条带,条带11是LS+F.m的特异性条带,条带2、3、5、7、8、10、11是接种AMF处理后新增加的,表明接种处理后促进了某些根际细菌群落的生长,细菌群落多样性增加。
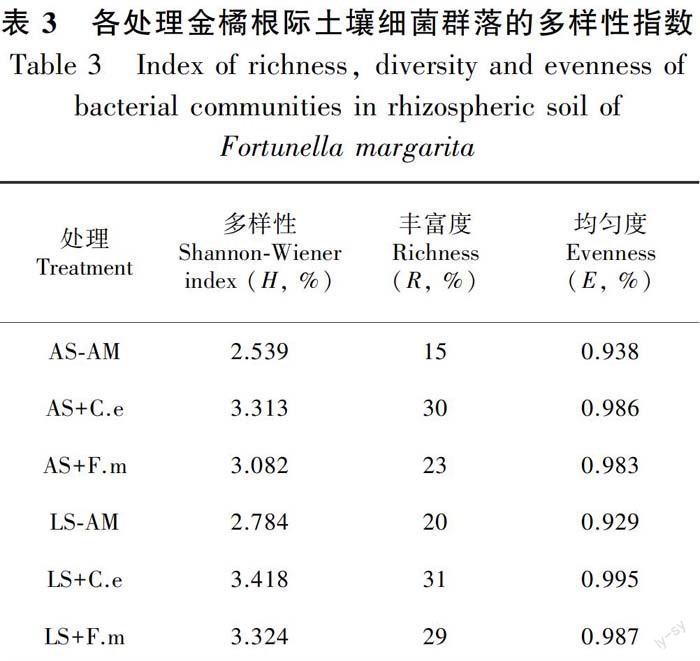
表3结果显示,从R值看,不同类型土壤中金橘根际接种AMF后细菌条带数量大小顺序为LS+C.e > AS+C.e > LS+F.m> AS+F.m > LS-AM > AS-AM。这说明无论何种土壤类型,分别接种C.e或F.m后,金橘土壤中细菌丰度增加,C.e处理的细菌丰度比F.m处理高,不接种AMF处理金橘根际土壤细菌丰度最低;而H值变化趋势为LS+C.e > LS+F.m > AS+C.e > AS+F.m > LS-AM > AS-AM。一般情况下,H值越大细菌群落多样性越高。分别接种F.m或C.e后,金橘根际土壤细菌多样性提高,微生物活性增强。在酸性土和石灰土中接种C.e处理细菌数量增加效果比F.m处理好;E值表示物种在环境中的分布状况,各物种数目越接近,均匀度数值越高。可见,各接种处理后金橘根际土壤细菌E值升高,而不论何种土壤,C.e处理的金橘根际细菌E值比F.m处理高。
将DGGE图谱上的DNA条带纯化、克隆、测序,结果见表4。上述条带均可在GenBank中找到同源性较高的种群序列。由于分析条带的DNA序列大小在169~195 bp范围内,碱基数少,所以只能鉴定到细菌的属而未能鉴定到种。表4表明,无论在酸性土或石灰土中接种C.e处理,条带7与数据库中的放线菌属相似性超过99%;在上述两种土壤中接种F.m处理,条带2、10、11与酸酐菌属、变形杆菌属、根瘤菌属相似性超过99%;条带6与酸酐菌属相似性100%。其余6个条带所表征的菌株与数据库中目前尚未获得纯培养的不可培养菌株之间存在97%~99%的相似性。上述结果表明,接种AMF后,与不接种处理相比,金橘根际土壤中不可培养细菌如酸酐菌属、变形杆菌属、放线菌属、根瘤菌属等促生细菌的数量增多,可加速土壤中营养物质的循环。
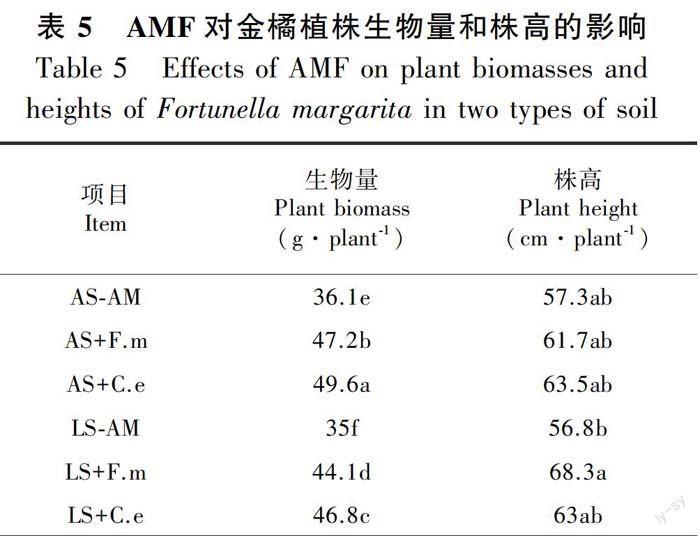
2.4 AMF对金橘植株生长的影响
从表5可见,分别接种F.m和C.e后,金橘植株生物量 (整株干重)显著高于不接种处理,变化趋势为AS+C.e > AS+F.m > LS+C.e > LS+F.m > AS-AM > LS-AM,差异均达显著水平;从金橘株高来看,除了石灰土中LS+F.m处理的株高显著高于LS-AM处理外,各接种处理间差异不显著(P<0.05)。
3 讨论与结论
本研究中,分别接种F.m或C.e后,各处理金橘根系F、m和v值与不接种处理相比均显著提高。说明接种AMF后金橘根系菌根侵染率提高。酸性土接种C.e处理的菌根侵染率最高,石灰土接种C.e处理次之。土壤类型是影响菌根侵染率的重要因素,张海波等 (2016) 研究发现, 石灰土中AMF的优势种为C.e。石灰土土质疏松,透气性好,有利于好氧性的AMF(例如C.e)的生长。因C.e适应能力强,也是酸性土中的优势菌种。而F.m属于广谱生态型菌种,对环境适应性强,宿主范围较广(张美庆等, 1994)。本研究中,F.m或C.e都能与喀斯特地区生长的金橘共生良好。由于金橘本身根毛稀疏,需要AMF来帮助其吸收更多的养分和水分,所以金橘对AMF的菌根依赖性高。而相对F.m、C.e与金橘的亲和力更强,更适应于喀斯特地区的特殊土壤生境,AMF与宿主建立共生关系有一定的选择性。这与杨会玲等(2015)的研究结论相似,而与邓溧等(2016)提出相较于C.e, F.m与柑桔侵染效果更好, F.m是优势菌种, 邹英宁等(2014)提出G.v与枳侵染率最高,F.m侵染率最低的结论不同。笔者认为,由于AMF与植物间的共生关系较复杂,盆栽实验中所用的土壤基质不同,生态环境不同,试验材料不同,不同菌种对不同植物存在生态位点上不同程度的竞争导致实验结果的差异,需要具体情况具体分析,才能得出正确的结论。
土壤酶主要来源于土壤微生物和植物根际分泌物,其活性高低反映土壤的综合肥力及土壤养分转化特征 (李欢等, 2016)。在一定范围内,其活性越高,土壤中养分转化速率越快,越有利于植物生长;蔗糖酶活性对增加土壤中易溶性营养物质起重要作用,土壤肥力高则其蔗糖酶活性相应也高,其活性可表征土壤生物学活性强度,蔗糖酶活性强弱能反映土壤营养供应能力、熟化程度和肥力水平 (孙双红等, 2016);蛋白酶直接参与土壤有机态氮水解为氨基酸的过程;脲酶直接参与土壤有机态氮的转化;磷酸酶直接影响土壤中有机磷化合物的分解、转化及其生物有效性,为植物提供有效磷元素 (欧洪等, 2016)。本研究分别接种F.m或C.e,金橘根际土壤磷酸酶、蔗糖酶、脲酶、蛋白酶活性均提高,这与宋福强等 (2013)、王振楠等 (2016) 的结果相似。C.e处理对土壤磷酸酶、蔗糖酶、脲酶、蛋白酶的增幅比F.m处理更大,而金橘根系与C.e亲和力更强。这四种酶是土壤中的重要酶,酶活性增加可促进根际土壤养分利用率,提高根际土壤生产力水平,最终促进宿主植株对养分的吸收。
土壤微生物是土壤生態系统变化的敏感指标之一,其群落结构变化能敏感地反映出土壤生态系统的质量和健康状况 (Zhong, 2004)。土壤细菌占土壤微生物总数的70%~90%,是土壤中最活跃的微生物。研究金橘幼苗根际土壤细菌数量的变化,可反映土壤的健康状态和微生境。本研究中,与不接菌处理相比,接种AMF处理的金橘根际土壤细菌种群差异较大,土壤细菌三种多样性指数R、H和E值均以AMF处理高于不接种处理,C.e处理又高于F.m处理。这与C.e与金橘根系亲和力更强相呼应。通过AMF菌根的根外菌丝网,可吸收土壤缝隙中养分并分解难溶解的营养元素,产生更多胞外酶,提高活跃的微生物量,增强土壤的营养元素循环(杨江山等, 2010)。本研究中接种AMF后,土壤中酸酐菌属 (Acidobacterium)、变形杆菌属 (Proteus)、根瘤菌属 (Rhizobium)、放线菌属 (Actinomyce) 等不可培养细菌群落增多,可能是接菌后金橘根系分泌有利于根际细菌数量和种类增多的物质,促进根际细菌的繁殖,某些根际细菌又可反过来促进植株生长,这可以从金橘植株的生物量显著提高的实验结果得到证实。
本研究中,接种AMF能促进土壤根际酶(蔗糖酶、酸性磷酸酶、脲酶、蛋白酶)活性、细菌群落多样性的增加,而且接种对金橘的生长有明显的促进,接种C.e和F.m后的金橘生物量与不接种处理相比显著提高,并且以酸性土中接种C.e处理的生物量最高。这与任禛等(2015)提出F.m和G.v是适合玉米接种的AMF,对玉米的生理活性有显著改善作用,C.e则无显著影响的结论不同。可能是玉米的根系发达,加上其盆栽土壤基质较肥沃,而本研究中金橘根系稀疏、根毛少,土壤基质较贫瘠。因此,在喀斯特环境下,C.e更适宜与金橘建立良好的共生关系而促进其生长。
综上所述,本研究在喀斯特的土壤基质(石灰土和酸性土)中分别接种C.e或F.m后,金橘根际土壤菌根侵染率比不接种处理显著提高,C.e与金橘根系亲和力最强;蔗糖酶、酸性磷酸酶、脲酶、蛋白酶活性比不接种处理显著提高,细菌群落多样性指数H、R、E值均比不接种处理增大,表明接种后金橘根际土壤酶活性和细菌群落多样性增大,C.e处理均比F.m处理高,最终表现为无论何种土壤类型,接种C.e处理的金橘生物量均比接种F.m高,均比不接种处理高,而酸性土中金橘生长量最高。因此,相对F.m,C.e为喀斯特地区能与金橘共生较好的菌种。研究结果为改善土壤肥力,加速土壤养分循环转化,降低化肥用量,促进金橘生长,为提高金橘的产量和质量、保护土壤微生态的应用奠定了基础。
参考文献:
BI YL, CHEN SL, KONG WP, et al, 2014. Effects of microorganism inoculation on growth of soybean and its rhizosphere soil [J]. Ecol Sci, 33(1): 121-126. [毕银丽, 陈书琳, 孔维平, 等, 2014. 接种微生物对大豆生长及其根际土壤的影响 [J]. 生态科学, 33(1): 121-126.]
CAI H, SHEN RF, 2005. Determination of soil protease activity with modified ninhydrin colorimetry [J]. Acta Pedol Sin, 42(2): 306-313. [蔡红, 沈仁芳, 2005. 改良茚三酮比色法测定土壤蛋白酶活性的研究 [J]. 土壤学报, 42(2): 306-313.]
CHEN FL, ZHANG K, ZHENG H, et al, 2011. Analyzing the effect of mixed decomposition of conifer and broadleaf litters on soil microbial communities by using pcr-dgge [J]. Chin J Appl Environ Biol, 17(2): 145-150. [陳法霖, 张凯, 郑华, 等, 2011. PCR-DGGE 技术解析针叶和阔叶凋落物混合分解对土壤微生物群落结构的影响 [J]. 应用与环境生物学报, 17( 2): 145-150.]
CHEN YL, CHEN BD, LIU L, et al, 2014. The role of arbuscular mycorrhizal fungi in soil nitrogen cycling [J]. Acta Ecol Sin, 34(17): 4807-4815. [陈永亮, 陈保冬, 刘蕾, 等, 2014. 丛枝菌根真菌在土壤氮素循环中的作用 [J]. 生态学报, 34(17): 4807-4815.]
DENG L, ZENG M, LI Y, 2016. Effects of AMF inoculation on growth andcalcium and nitrogen uptake of citrus seedlings [J]. S Chin Fruits, 45(3): 55-57. [邓溧, 曾明, 李燕, 2016. 盆栽柑桔苗接种丛枝菌根真菌的生长与钙氮吸收效应 [J]. 中国南方果树, 45(3): 55-57.]
DUAN QB, ZHAO DQ, YAO T, et al, 2015. Effects of using biofertilizer on forage maize growth and soil microbial number [J]. Grassl Turf, 35(2): 54-58. [段淇斌, 赵冬青, 姚拓, 等, 2015. 施用生物菌肥对饲用玉米生长和土壤微生物数量的影响 [J]. 草原与草坪, 35(2): 54-58.]
FU XF, ZHANG GP, ZHANG XW, et al, 2016. Effects of PSB and AMF on growth microorganisms and soil enzyme activities in the rhizosphere of Taxus chinensis var. mairei seedlings [J]. Acta Bot Boreal-Occident Sin, 36(2): 353-360. [付晓峰, 张桂萍, 张小伟, 等, 2016. 溶磷细菌和丛枝菌根真菌接种对南方红豆杉生长及根际微生物和土壤酶活性的影响 [J]. 西北植物学报, 36(2): 353-360.]
GUAN SY, 1986. Soil enzyme and its research methods [M]. Beijing: China Agricultural Press: 20-30. [关松荫, 1986. 土壤酶及其研究法 [M]. 北京:农业出版社: 20-30.]
HE YJ, WU CY, HE BH, et al, 2016. Composition and species diversity of AMF in different vegetation restoration stage in karst region [J]. J Soil Water Conserv, 30(5): 305-309. [何跃军, 吴春玉, 何丙辉, 等, 2016. 喀斯特不同植被恢复阶段土壤AMF组成及多样性研究 [J]. 水土保持学报, 30(5): 305-309.]
LI DB, YANG HY, LU L, 2010. Application of denaturing gradientgel electrophoresis in microbial ecology [J]. Biotechnol Bull, 12: 89-92. [李德斌, 杨洪一, 卢磊, 2010. 变性梯度凝胶电泳在微生物生态学中的应用 [J]. 生物技术通报技术与方法, 12: 89-92.]
LI H, DU ZY, LIU Q, et al, 2016. Effects of earthworm-mycorrhiza interaction on soil enzyme activities, root growth and nutrients uptake of sweet potato [J]. Plant Nutr Fert Sci, 22(1): 209-215. [李欢, 杜志勇, 刘庆, 等, 2016. 蚯蚓菌根互作对土壤酶活、甘薯根系生长及养分吸收的影响 [J]. 植物营养与肥料学报, 22(1): 209-215.]
LIN SS, SUN XW, WANG XJ, et al, 2013. Mycorrhizal studies and their application prospects in China [J]. Acta Pratacul Sin, 22(5) : 310-325. [林双双, 孙向伟, 王晓娟, 等, 2013. 我国菌根学研究进展及其应用展望 [J]. 草业学报, 22(5) : 310-325.]
LIN Y, 2014. Effects of arbuscular mycorrhizal fungi (AMF) on drought resistance of Kumquat in soil from the karst area [D]. Guilin: Guangxi Normal University. [林钰, 2014. 喀斯特土壤中接种AMF对金橘抗旱性的影響 [D]. 桂林: 广西师范大学.]
OU H, GUO DQ, LIN JJ, et al, 2016. Effects of different AM Fungi on quantity and enzyme activity of rhizosphere soil microorganism of Paris polyphylla var. yunnanensis [J]. J Chin Med Mat, 39(5): 948-955. [欧洪, 郭冬琴, 林俊杰, 等, 2016 . AM真菌对滇重楼根际土壤微生物数量及酶活性的影响 [J]. 中药材, 39(5): 948-955.]
REN Z, XIA TY, CHEN LJ, et al, 2015. Effect of different AMF on physiological related indexes of corn [J]. SW Chin J Agric Sci, 28(2):563-568. [任禛, 夏体渊, 陈丽娟, 等, 2015. 不同丛枝菌根真菌对玉米生理相关指标的影响 [J]. 西南农业学报, 28(2):563-568.]
SONG FQ, CHENG J, CHANG W, et al, 2013. The impact of AM Fungi on soybean growth with AM inoculum addition in field [J]. Chin Agric Sci Bull, 29(6):69-74. [宋福强, 程蛟, 常伟, 等, 2013. 田间施加AM菌剂对大豆生长效应的影响 [J]. 中国农学通报, 29(6): 69-74.]
SUN JH, BI YL, QIU L, et al , 2016. A review about the effect of AMF on uptaking phosphorus byhost plants in soil [J]. Chin J Soil Sci, 47(2): 499-504. [孙金华, 毕银丽, 裘浪, 等, 2016. 土壤中丛枝菌根真菌对宿主植物磷吸收作用机制综述 [J]. 土壤通报, 47(2): 499-504.]
SUN SH, CHEN LX, LI SB, et al, 2016. Characteristics of soil enzyme activity and nutrient content and their correlations at different succession stages of broadleaf-korean pine forest [J]. J Beijing For Univ, 38(2): 20-28. [孙双红, 陈立新, 李少博, 等, 2016. 阔叶红松林不同演替阶段土壤酶活性与养分特征及其相关性 [J]. 北京林业大学学报, 38(2): 20-28.]
TROUVELOT A, KOUGH JL, 1986. Mesure du taux de mycorhization VA dun système radiculaire. Recherche desmétho des destimation ayantune signification fonctionnelle [M] // GIANINAZZI-PEARSONV, GIANINAZZI S. The Mycorrhizae: Physiology and Genetics. Paris: Inra Presse: 217-221.
WANG XY, PENG LQ, JIN ZX, 2016. Effects of AMF inoculation on growth and photosynthetic physiological characteristics of sinocalycanthus chinensis under conditions of simulated warming [J]. Acta Ecol Sin, 36(16): 5204-5214. [王晓燕, 彭礼琼, 金则新, 2016. 模拟增温条件下接种AMF对夏蜡梅幼苗生长与光合生理特性的影响 [J]. 生态学报, 36(16): 5204-5214.]
WANG ZN, YANG ML, LIU Y, et al, 2016. Effects of arbuscular mycorrhization on the growth of safflower and the microenvironment of rhizosphere soil [J]. Jiangsu J Agric Sci, 32(4): 904-909. [王振楠, 杨美玲, 刘鸯, 等, 2016. 丛枝菌根真菌对红花生长及根际土壤微环境的影响 [J]. 江苏农业学报, 32(4): 904-909.]
WEI LL, LU CY, DING J, et al, 2016. Functional relationships between arbuscular mycorrhizal symbionts and nutrient dynamics in plant-soil-microbe system [J]. Acta Ecol Sin, 36(14): 4233-4243. [韦莉莉, 卢昌熠, 丁晶, 等, 2016. 丛枝茵根真菌参与下植物-土壤系统的养分交流及调控 [J]. 生态学报, 36(14): 4233-4243.]
WU C, ZHANG Y, MA N, et al, 2012. Response characteristics of Casuarina equisetifolia inoculated with mycorrhizal fungi under low temperature stress [J]. Acta Bot Boreal-Occident Sin, 32(10): 2068-2074. [武冲, 张勇, 马妮, 等, 2012. 接种菌根真菌短枝木麻黄对低温胁迫的响应特征 [J]. 西北植物学报, 32(10): 2068-2074.]
YANG HL, HUANG RH, CHEN K, et al, 2015. The effects of arbuscular mycorrhizal fungi(AMF) on growth of Sorghum haipense and rhizosphere soil enzymes activities under Cs stress [J]. Environ Chem, 34(4): 712-717. [杨会玲, 黄仁华, 陈珂, 等, 2015. 丛枝菌根真菌(AMF)對铯胁迫宿根高粱生长及根际土壤酶的影响 [J]. 环境化学, 34(4): 712-717.]
YANG JS, ZHANG EH, HUANG GB, et al, 2010. Effects of conservation tillage on soil microbes quantities and enzyme activities in wheat-herb rotation system [J]. Acta Ecol Sin, 30(3): 824-829. [杨江山, 张恩和, 黄高宝, 等, 2010. 保护性耕作对麦药轮作土壤酶活性和微生物数量的影响 [J]. 生态学报, 30(3): 824-829.]
ZHANG CB, TAN JY, LUO C, et al, 2013. Species diversity of arbuscular mycorrhizal fungi in the rhizosphere of Lmperate cylindrical in maolan kars forest and inoculation effects of the dominant AMF specie on Medicago sativa [J]. Guihaia, 33(3): 324-330. [张传博, 谭金玉, 罗充, 等, 2013. 茂兰地区白茅丛枝菌根真菌多样性及其对紫花苜蓿的接种效应研究 [J]. 广西植物, 33(3): 324-330.]
ZHANG HB, LIANG YM, FENG SZ, et al, 2016. The effects of soil types and plant species on arbuscular mycorrhizal fungi community and colonization in the rhizosphere [J]. Res Agric Mod, 37(1): 187-194. [张海波, 梁月明, 冯书珍, 等, 2016. 土壤类型和树种对根际土丛枝菌根真菌群落及其根系侵染率的影响 [J]. 农业现代化研究, 37(1): 187-194.]
ZHANG MQ, WANG YS, ZHANG C, et al, 1994. The ecological distribution characteristics of some genera and species of vam fungi in northern china [J]. Mycosystema, 13(3): 166-172. [张美庆, 王幼珊, 张弛, 等, 1994. 我国北方VA菌根真菌某些属和种的生态分布 [J]. 菌物学报, 13(3): 166-172.]
ZHAO QX, YUE XR, XIA YS, et al, 2016. Effects of arbuscular mycorrhizal fungus inoculation on growth and nitrogen utilization of intercropped maize and soybean in purple soil under facilitated condition [J]. Crop, 5: 94-100. [赵乾旭, 岳献荣, 夏运生, 等, 2016. 设施条件接种丛枝菌根真菌对紫色土上玉米/大豆生长及氮素利用的影响 [J]. 作物杂志, 5: 94-100.]
ZHENG SY, GUO SR, ZHANG Y, et al, 2014. Effects of arbuscular mycorrhizal fungi on characteristics of photosynthesis, microbial diversity and enzymes activity in rhizosphere of pepper plants cultivated in organic substrate [J]. Acta Bot Boreal-Occident Sin, 34(4): 800-809. [郑舜怡, 郭世荣, 张钰, 等, 2014. 丛枝菌根真菌對辣椒光合特性及根际微生物多样性和酶活性的影响 [J]. 西北植物学报, 34(4): 800-809.]
ZHONG WH, 2004. Effect of soil management practices and environmental factors on soil microbial diversity: a review [J]. Chin Biodivers, 12(4):456-465.
ZOU YN, WU QS, LI Y, et al, 2014. Effects of arbuscular mycorrhizal fungi on root system morphology and sucrose and glucose contents of Poncirus trifoliate [J]. Chin J Appl Ecol, 25(4): 1125-1129. [邹英宁, 吴强盛, 李艳, 等, 2014. 丛枝菌根真菌对枳根系形态和蔗糖、葡萄糖含量的影响 [J]. 应用生态学报, 25(4): 1125-1129.]
