miR-135a与前列腺癌细胞增殖相关因子信号转导及转录激活因子6的相关性研究
2018-05-29赵宇明郭冬梅
赵宇明,张 悦,王 华,田 宝,郭冬梅
(河北省秦皇岛市第一医院 066000)
前列腺癌是一种常见的泌尿系统恶性肿瘤,多发于老年患者,且病死率较高,是目前导致男性癌症病死的主要原因之一[1-2]。随着我国老龄化的不断加重,前列腺癌患者的发病率也持续增高,给家庭和社会带来了沉重的负担,如何控制癌细胞的转移和扩散并提高肿瘤治疗的效果,对改善患者的预后具有重要的临床意义[3-4]。多项研究表明,微小RNA(miRNA)可能在基因表达调控领域起重要作用,而多种miRNA 均参与肿瘤的发生、发展和转移过程[5-6]。为了进一步探讨miR-135a与前列腺癌细胞增殖相关因子信号转导及转录激活因子(STAT6)的相关性,现对前列腺癌DU145细胞分别转染miR-135a序列和空白序列后的细胞增殖情况、细胞周期、迁移和侵袭能力,以及p-STAT6和STAT6蛋白表达、miR-135a表达水平进行检测分析,为临床提供一定的治疗理论依据。
1 资料与方法
1.1一般资料 人激素非依赖前列腺癌细胞株DUl45购自中国科学院上海生命科学研究所细胞资源中心。
1.2仪器与试剂 (1)HR22型高速冷冻离心机(日本日立),FS-7900型PCR仪 (美国应用生物系统公司), Gel Doc 1000UV型分子定量成像系统(美国BIO-RAD公司), Napco-541型二氧化碳培养箱(美国),IX70型倒置相差显微镜(日本奥林巴斯),880型酶标仪(德国拜发)。(2)胎牛血清、DMEM培养基、F12K-DMEM培养基、胰蛋白酶、青霉素、链霉素均购自美国Gibco公司;Mature miRNA-135a和miRNA Negative Control(NC)均购自上海吉玛公司; Trizol提取试剂盒、逆转录试剂盒、RT-PCR试剂盒均购自美国Epitomics公司;脂质体(Lipofectamine)2000 购自Invitrogen 公司。CCK-8 试剂盒购自碧云天试剂公司;侵袭(Transwell) 小室购自美国Coring 公司;鼠抗人STAT6、p-STAT6 1抗和辣根过氧化物酶标记的山羊抗兔、抗鼠2抗均购自北京中杉金桥生物技术有限公司;四甲基偶氮唑盐(MTT)购自美国Bio Sharp公司。
1.3实验方法
1.3.1细胞培养 DU145细胞株采用含10%胎牛血清、100 μg/mL青霉素和50 μg/mL链霉素双抗的F12K-DMEM培养基,在5% CO2、37 ℃恒温培养箱中进行培养,待细胞密度约80%时进行传代培养,取指数生长期细胞进行实验。
1.3.2细胞转染 采用脂质体瞬时转染法进行转染:取对数期生长的细胞株接种于6孔培养板中,加入含10%胎牛血清的RMPI 1640完全培养基进行培养,待贴壁细胞生长至60%~70%融合后利用Lipofectamine 2000转染试剂分别转染has-miR135a序列(miR-135a转染组)及NC序列(空白转染组),转染终浓度为50 mmol/L,严格按照说明书进行操作,转染结束后加培养基增殖培养48 h。
1.3.3MTT检测细胞增殖 分别于转染48 h后取各组细胞悬液利用胰蛋白酶进行消化,加入含10%胎牛血清的RMPI 1640完全培养基进行培养,并于培养0、24、48 h时取各组细胞悬液加入MTT (5 mg/mL)孵育4 h,随后加入DMSO进行溶解并沉淀,使用酶标仪在490 nm波长测定各孔的吸光值(A),观察各组细胞增殖情况,每组实验重复3次。
1.3.4流式细胞仪检测细胞周期 分别于转染48 h后取各组细胞悬液,应用胰蛋白酶进行消化,1 000 r/min离心15 min后收集细胞沉淀,以PBS洗涤2次加入预冷75%乙醇在―20 ℃条件下固定24 h,1 000 r/min离心15 min弃上清液,最后加入500 μL细胞周期固定液重悬细胞,4 ℃避光孵育30 min,使用流式细胞仪测定细胞周期。
1.3.5Transwell细胞迁移侵袭实验 先以无血清培养基37 ℃润湿Transwell小室2 h,将转染48 h的各组细胞采用胰酶消化后计数,选取1×106个细胞以无血清的RPMI 1640培养液进行重悬并接种于上室,下室中仅加入10%的完全培养基,37 ℃、5% CO2培养48 h。取出滤膜后以10%多聚甲醛固定,苏木红染色在光镜下观察,计数穿膜细胞数,取其均值代表迁移力量值。
1.3.6蛋白免疫印迹法(Western blot)实验 取转染后培养48 h的各组细胞,洗去培养基后提取总蛋白,并取约75 μg以10% 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),分离后转移至孔径为0.45 μm的聚偏二氟乙烯(PVDF)膜,置于5%脱脂奶粉中封闭2 h;加入STAT6和p-STAT6 1抗后4 ℃孵育过夜,0.5%TBS-T溶液洗膜3次后再加入LRH标记的2抗进行反应,0.5%TBS-T溶液洗膜3次,使用化学发光法进行显色,并采用软件进行灰度值分析,计算各目标蛋白与β-actin的灰度比值。
1.3.7RT-PCR实验 取各组转染后培养48 h的细胞,采用Trizol提取试剂盒提取总RNA,使用逆转录试剂盒逆转录为DNA,在聚合酶作用下进行扩增,扩增引物为上游:5′-CCG ACG CGT TCT TTT CTG TTG CCC CAT C-3′;下游:5′-CCC AAG CTT GGA CCG CAG CAC CTA TCT-3′。扩增条件:95 ℃ 5 min后以95 ℃15 s 变性、60 ℃、60 s 退火、72 ℃ 5 min 30 s延伸,此为1个循环,共40个循环,电泳后进行RT-CPR测定,获得miR-135a的表达水平。严格按照试剂盒说明书进行操作。
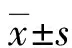
2 结 果
2.12组转染DU145细胞的miR-135a表达结果比较 转染后48 h,miR-135a转染组miR-135a相对表达量为(0.932±0.061),明显高于空白转染组(0.023±0.002)(t=36.482,P<0.05)。
2.22组miR-135a对DU145细胞的增殖能力结果比较 miR-135a转染组培养24、48 h的OD值分别为(0.210±0.045)、(0.281±0.052),明显低于空白转染组(P<0.05)。见表1。

表1 2组DU145细胞不同时间点OD值结果比较
2.32组miR-135a对DU145细胞周期影响的结果比较 miR-135a转染组G0/G1期细胞比例为(60.02±6.39)%,明显高于空白转染组(45.34±7.22)%(t=3.730,P<0.05)。

表2 2组DU145细胞迁移和侵袭的结果比较

图1 Transwell细胞迁移和侵袭图
2.42组miR-135a对DU145细胞迁移和侵袭的结果比较 miR-135a转染组迁移细胞数和侵袭细胞数分别为(116.93±30.02)个和(133.02±28.51)个,明显低于空白转染组(P<0.05)。见表2和图1。
2.52组miR-135a对DU145细胞STAT6表达影响的结果比较 miR-135a转染组p-STAT6和STAT6蛋白相对表达量分别为(0.947±0.114)和(0.437±0.077),明显低于空白转染组[(1.320±0.104)和(0.783±0.095)](t=-5.757、-6.931,P<0.05)。见图2。

注:1表示 miR-135a转染组;2表示空白转染组
图2 Western blot检测图
3 讨 论
前列腺癌是指发生在前列腺的上皮性恶性肿瘤,包括腺癌、导管腺癌、尿路上皮癌、鳞状细胞癌、腺鳞癌等,其中前列腺癌占95%以上[7-8]。随我国老龄化人口的加重,前列腺癌的发病率也逐渐上升,其病死率较高,现已成为危害男性健康的首位肿瘤[9]。前列腺癌的具体发病原因和机制尚不完全清楚,一般认为与遗传因素有关;且前列腺癌多侵袭膀胱、精囊、血管神经束等,并可通过盆腔淋巴结转移引起双下肢水肿,部分患者还会发生骨转移,给临床治疗造成难度[10-11]。miRNA是一类重要的内源性单链非编码小RNA分子,可调控细胞生物的发育、增殖、分化、代谢、凋亡、应激等过程,通过与靶mRNA的互补配对而在转录后水平上对基因表达进行负调控,导致mRNA的降解和翻译抑制[12]。越来越多的研究表明,miRNA与肿瘤的发生、发展等过程密切相关,但目前对于miRNA在前列腺癌中的发病机制研究较少[13]。miR-135a是miR-135家族的重要成员之一,具有促进细胞凋亡和抑制细胞增殖的作用,其在多种肿瘤的发生、发展中发挥了重要的调控作用。有研究报道,miR-135a促进细胞凋亡和抑制细胞增殖的作用是通过对JAK2(Janus kinase 2)及相关通路(JA-STAT)的调控而实现,但具体机制仍需作进一步的研究[14]。
本研究结果表明,转染48 h后miR-135a转染组miR-135a相对表达量明显高于空白转染组(P<0.05),提示miR-135a转染组细胞miR-135a明显高表达。通过MTT检测细胞增长率发现,miR-135a转染组培养24、48 h的OD值明显低于空白转染组(P<0.05),提示miR-10a高表达可抑制肿瘤的增长。通过流式细胞仪测定细胞周期显示,miR-135a转染组G0/G1期细胞比例为明显高于空白转染组(P<0.05),说明miR-135a可显著地阻滞DU145细胞周期,进一步抑制肿瘤细胞的增长。侵袭实验发现,miR-135a转染组迁移细胞数和侵袭细胞数分别明显低于空白转染组(P<0.05),提示miR-135a与前列腺癌细胞的侵袭和迁移高度相关,其高表达可抑制细胞的侵袭和迁移,但其具体机制仍需作进一步的深入研究。
STAT6是一种相对分子质量约为94×103的蛋白质,属于STAT家族,可通过JAK-STAT信号转导途径介导多种细胞因子的活化,进而参与多种疾病的发生和发展。有研究报道,STAT6是miR-135a的潜在靶基因,可能与miR-135a抑制癌细胞增殖、迁移、侵袭等机制有关,与本研究的研究结果基本一致[15]。本研究结果表明,miR-135a转染组p-STAT6和STAT6蛋白相对表达量均明显低于空白转染组(P<0.05),说明miR-135a高表达可抑制前列腺癌细胞STAT6蛋白的表达,而这可能是miR-135a抑制前列腺癌细胞增殖、迁移、侵袭的机制之一,但具体机制仍需作进一步的实验。
综上所述,miR-135a可抑制前列腺癌细胞增殖、迁移、侵袭的能力,可能与其抑制前列腺癌细胞STAT6表达有关。
参考文献
[1]GUZEL E,KARATAS O F,SENERCIOZ A,et al.Identification of microRNAs differentially expressed in prostatic secretions of patients with prostate cancer[J].Internat J Cancer,2015,136(4):875-879.
[2]YAM L T,WINKLER C F,JANCKILA A J,et al.Prostatic cancer presenting as metastatic adenocarcinoma of undetermined origin.Immunodiagnosis by prostatic acid phosphatase[J].Cancer,2008,51(2):283-287.
[3]褚英,沈碧玉.前列腺癌睾丸切除患者围术期的常见护理问题与对策[J].实用临床医药杂志,2015,19(18):164-165.
[4]曾蜀雄,林建水,许传亮,等.晚期前列腺癌治疗及其基因分型研究进展[J].中华泌尿外科杂志,2015,26(6):478-480.
[5]闫岩,张春妮.微小核糖核酸与肾细胞癌关系的研究进展[J].现代肿瘤医学,2016,24(1):145-148.
[6]兰敏.miR-370在肿瘤中的作用及其机制[J].中国肿瘤生物治疗杂志,2016,23(2):291-296.
[7]QUINN D I,SHORE N D,EGAWA S,et al.Immunotherapy for castration-resistant prostate cancer:progress and new paradigms[J].Urol Oncol,2015,33(5):245-260.
[8]姜辰一,俞俊杰,阮渊,等.LMO2蛋白在前列腺基质细胞中介导的IL-11、FGF-9旁分泌促进前列腺癌细胞增殖与侵袭[J].中国癌症杂志,2016,26(11):894-901.
[9]吴敏,赵红光,李英华,等.PET-CT 在前列腺癌诊断中的应用现状和展望[J].中国实验诊断学,2015,19(3):513-516.
[10]聂晓枫,王增利.腹腔镜下腹膜外保留血管神经束前列腺癌根治术对患者排尿及性功能的影响[J].中国性科学,2016,25(12):14-17.
[11]朱寅杰,王艳青,潘家骅,等.前列腺癌根治标本提示神经周围侵犯对预测前列腺癌进展和预后的价值[J].中华外科杂志,2016,54(3):217-221.
[12]张婷.miRNA-101在肿瘤中的研究进展[J].肿瘤预防与治疗,2016,29(6):339-342.
[13]云林,唐焕文.MicroRNA-124对肿瘤发生发展影响研究进展[J].中国职业医学,2016,43(2):227-229.
[14]赵宇明.miR-135a通过抑制STAT6表达及其磷酸化调控激素非依赖前列腺癌细胞增殖的研究[D].南京:东南大学,2013.
[15]张彦兵,王妍华,郭亚焕,等.miR-135b促进肝癌细胞侵袭和转移[J].细胞与分子免疫学杂志,2015,31(10):1316-1321.
