自研糖化血红蛋白床旁检测分析仪的性能评估*
2018-05-29李新华马凯惠张宪党
李新华,赵 珂,魏 芳,马凯惠,张宪党△
(1.山东省内分泌与代谢病研究所,济南 250062;2.山东中医药大学附属医院普外科,济南 250000)
糖化血红蛋白(HbA1c)是机体血液中血糖与血红蛋白结合的产物,两者结合呈不可逆,其结合速率与平均120 d寿命的红细胞糖化量呈正相关,临床HbA1c水平可反映患者近8~12周的血糖控制情况,作为糖尿病筛查、诊断、长期血糖控制、疗效评估的重要指标[1-3]。本课题组研发一款HbA1c床旁检测分析仪,基本原理是采用显色型亲和层析法,在3~5 min内实现HbA1c定量检测,更加方便、快捷、准确[4]。本研究对自研HbA1c床旁检测分析系统进行方法学评价,与美国Bio-Rad公司D10型HbA1c分析仪进行对比分析,为该仪器的临床应用提供实验数据。
1 资料与方法
1.1一般资料 选取该院及社区糖尿病筛查患者82例,年龄35~75岁。健康对照组为104例健康体检者,男56例,女48例,年龄22~66岁。所有研究对象分别抽取2 mL静脉血,置于乙二胺四乙酸二钾(EDTA-K2)试管中,充分混匀,2~8 ℃保存。同一标本分别由2种仪器检测1次,1周内完成。
1.2仪器与试剂 D10型HbA1c分析仪及其配套试剂(试剂批号R1:AA50235,R2:20236)、质控品(批号:33910,L1:5.4%;L2:9.9%)、校准样品(低值样品(level 1,批号AA50119,标定值为5.4%)、高值样品(level 2,批号AA50120,标定值为10.1%),中值样品(level 3,低值和高值等量混合,标定值为7.75%)。自研HbA1c床旁检测分析仪及其配套试剂(试剂批号160318)和质控品(Bio-Rad批号:33910,L1:5.4%;L2:9.9%)[4]。
1.3方法
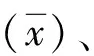
1.3.2相关性试验 选取82例新鲜抗凝全血分别在2种仪器上检测HbA1c并进行比较。以自研仪器检测结果(Y)对Bio-Rad D10检测结果(X)的直线回归方程:Y=bX+a,b可接受范围为0.095~1.05,相关系数R2>0.95,偏差符合率大于或等于90%(允许偏差:±3.5%)。
1.3.3参考值范围试验 选取104例健康体检者,纳入标准:血糖、血脂、血常规、肝功能等检查均正常;心电图、胸透、彩超无异常;排除标准:6个月内手术史、4个月内输血/献血史、妊娠者。采用自研仪器检测健康者HbA1c水平。
1.3.4干扰试验 每组取3例全血标本,分别收集高中低3个水平的果糖胺、葡萄糖、维生素C、总胆红素、血红蛋白F(HbF)、三酰甘油进行检测。干扰物质分别为:(1)果糖胺:20、10、5 mmol/L。(2)葡萄糖:100、50、25 mmol/L。(3)维生素C:40、20、10 mg/dL。(4)总胆红素:120、60、30 μmol/L。(5)HbF:20、10、5 mg/dL。(6)三酰甘油:20、10、5 mmol/L。
1.3.5校准品试验 全部校准品分装后于4 ℃保存,各水平标本每天取1管,检测之前充分混匀。仪器校准、质控测定,结果在控后进行常规操作。依照EP10-A文件[5],各标本每天按照中、高、低、中、中、低、低、高、高、中的顺序进行检测,检测5 d。第1个中值为检测起始用,不作统计,其余9个数据中的任何1个不合格都会使该批标本的全部数据作废,须重新检测。
1.4统计学处理 采用SPSS13.0统计软件及实验室专业评价软件1.82版对数据进行分析。P<0.05位为差异有统计学意义。
2 结 果
2.1离群点分析 横坐标为靶值浓度,纵坐标为测定值与靶值浓度偏差,每天校准品的测定值均标于图上,进行离群点观察,精密度初评。结果显示:无离群点、精密度良好。见图1。
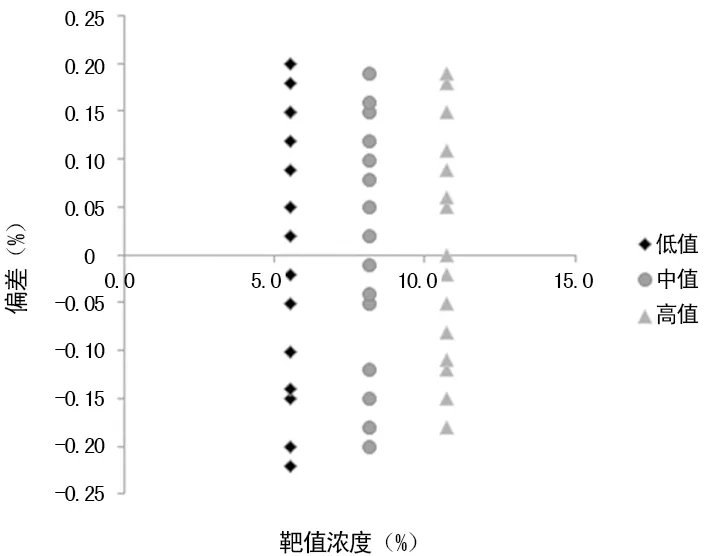
图1 HbA1c离群散点图
2.2线性评价 横坐标(X)为靶值,纵坐标(Y)为测定值,将低、中、高3个校准品靶值以X=Y绘制参考线,低、中、高3个校准品连续检测5 d的结果均值绘制测定线,与参考线比较,对线性、偏差进行初评。结果显示:线性良好、偏差小。见图2。
2.3偏差分析 偏差以校准品各浓度连续检测5 d的结果均值与其对应靶值之差计算,均未超过设定的范围,判断临床均可以接受。结果显示:高、中、低3个浓度校准品的绝对偏差分别为―0.05%、―0.03%、―0.01%,远低于允许偏差,均可接受。见表1。
2.4多元回归分析 根据5 d所有数据计算截距、斜率、非线性、漂移,作回归分析和t检验。HbA1c测定截距差异有统计学意义(P<0.01),与靶值有恒定误差(t>4.6,P<0.01);斜率、非线性、漂移差异均无统计学意义(―4.6
图2 HbA1c线性图
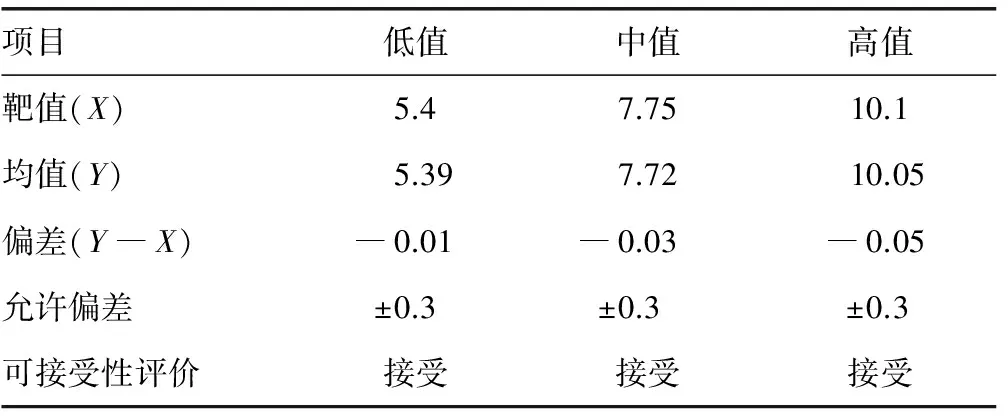
表1 偏差分析(%)
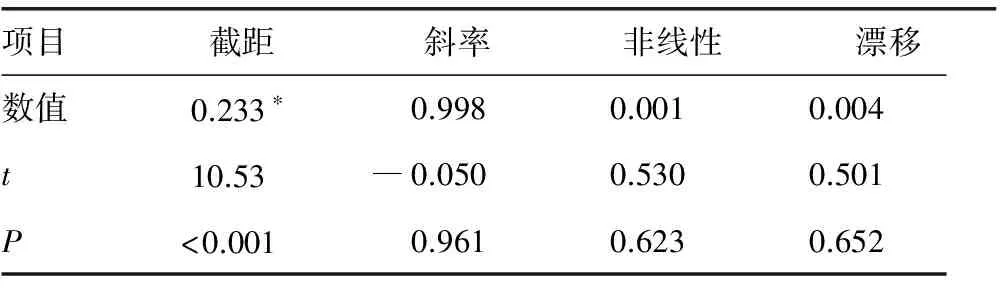
表2 HbA1c多元回归分析
注:与靶值回归分析截距比较,*P<0.01
2.5总不精密度分析 HbA1c低、中、高3个校准品的总不精密度(CV)分别为1.298%、0.906%、1.014%,远小于美国糖尿病协会规定的5%允许误差范围,临床均可接受。见表3。
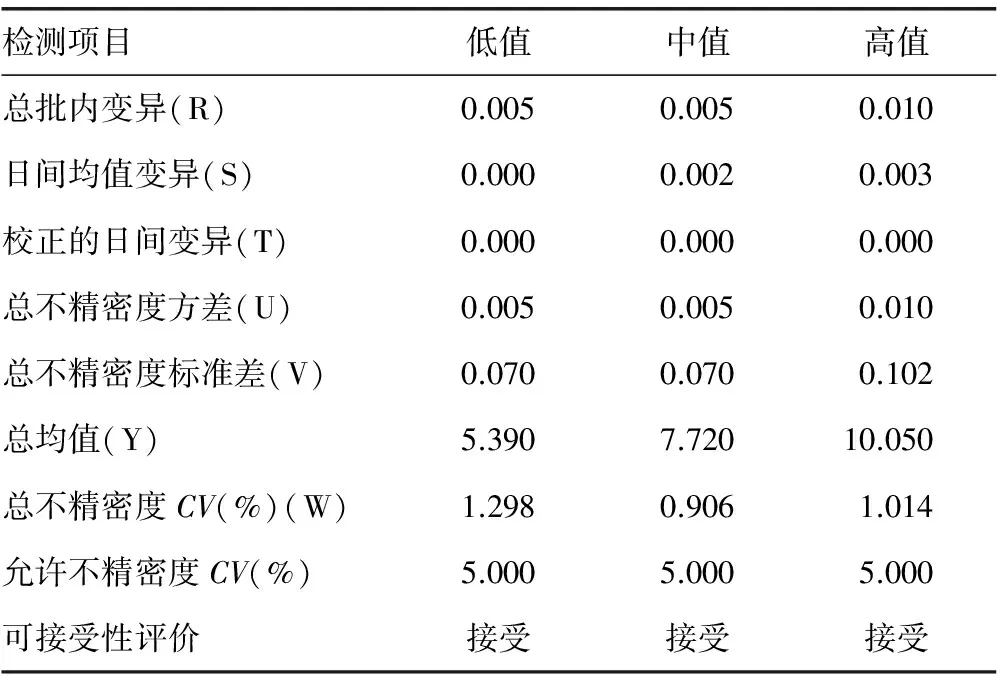
表3 HbA1c总不精密度分析
2.6精密度试验 自研仪器检测高值与低值全血标本和质控品,批内与批间不精密度均可接受。见表4。
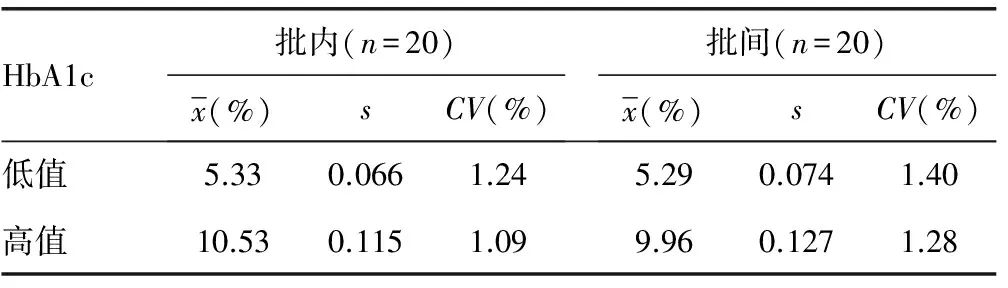
表4 精密度试验结果
2.7相关性试验 2种仪器检测HbA1c的结果高度相关。自研仪器(Y)对Bio-Rad D10(X)的直线回归方程:Y=1.004 9X―0.041 1(R2=0.998 2,P<0.001),预期偏倚0.06,相对偏倚0.83%,偏差符合率100%,自研仪器与Bio-Rad D10的对比试验达可接受范围。见图3。
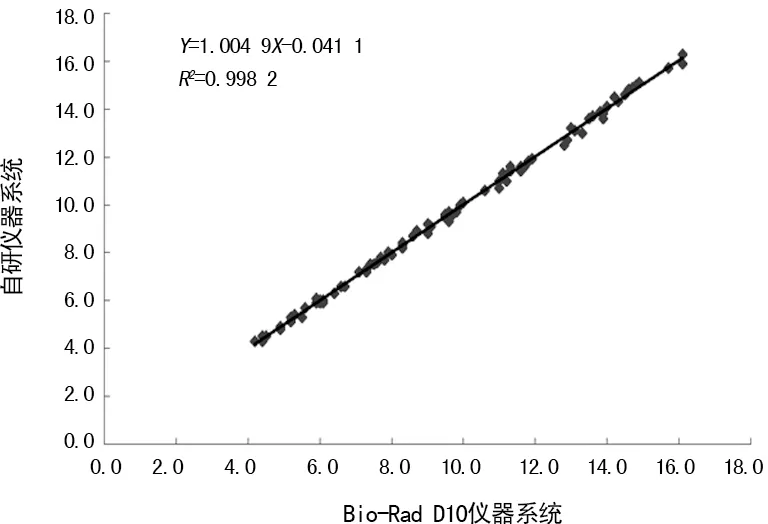
图3 2种仪器检测HbA1c结果的相关性
2.8参考值范围 自研仪器检测104例健康体检者,HbA1c平均值为5.3%(95%CI:4.7%~6.3%),检测范围3%~18%。健康体检者以每10岁为年龄段分为5组,即20~29岁、30~39岁、40~49岁、50~59岁、60~69岁,各组HbA1c平均值分别为5.1%、5.2%、5.3%、5.4%、5.4%。见表5。
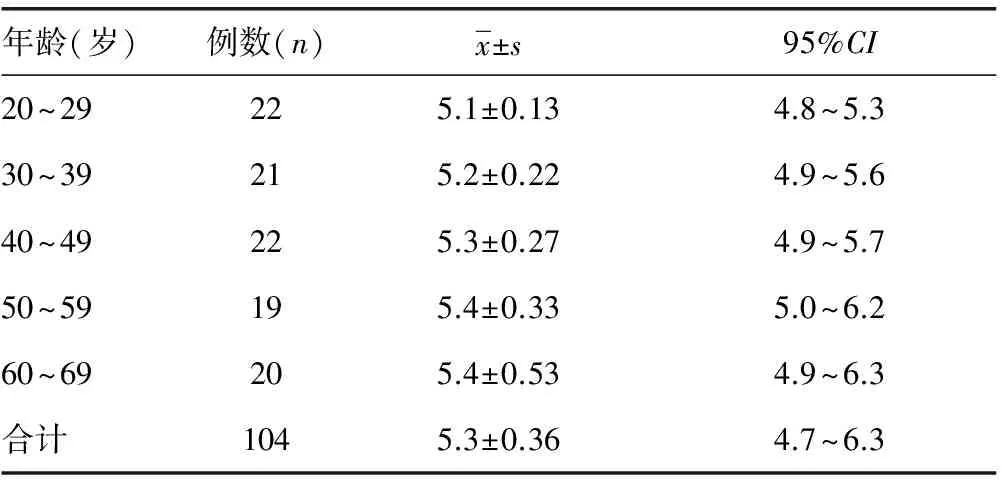
表5 自研仪器检测健康体检者的HbA1c值
2.9干扰试验 分别在全血标本中添加不同浓度的果糖胺、葡萄糖、维生素C、总胆红素、HbF、三酰甘油进行检测,各干扰物对HbA1c的变异系数分别为:果糖胺小于或等于1.60%、葡萄糖小于或等于0.90%、维生素C小于或等于0.40%、总胆红素小于或等于1.50%、HbF小于或等于1.80%、三酰甘油小于或等于1.10%。见表6。
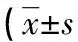
表6 不同干扰物对 HbA1c检测的结果或%)
3 讨 论
自研糖化血红蛋白床旁检测分析仪采用显色型亲和层析法,检测总HbA1c和总的非HbA1c,经过系统校正后获得HbA1c检测结果,不受血红蛋白变异体影响[6]。该方法是目前检测HbA1c的常用方法之一,曾经应用于美国糖尿病控制与并发症研究[7]。
本研究根据《糖化血红蛋白实验室检测指南》、美国临床和实验室标准协会(CLSI)、美国临床实验室标准化委员会(NCCLS)颁布的部分文件,对自研HbA1c床旁检测系统进行性能评估[2,5,8-10]。
本研究结果显示,自研仪器检测HbA1c的高值、中值、低值偏差与总不精密度均在允许范围,多元回归分析中斜率、非线性、漂移差异均无统计学意义(P>0.05),表明该仪器检测HbA1c的精密度和准确度良好,而截距差异有统计学意义(P<0.01),表明与靶值有恒定误差(t>4.6,P<0.01)。精密度试验显示自研仪器检测HbA1c批内与批间不精密度均可接受(均CV<1.50%),重复性较好,结果稳定。相关性试验证实2种仪器检测 HbA1c的结果显著相关(R2=0.998 2,P<0.01),预期偏倚0.06,相对偏倚0.83%,偏差符合率100%,处于可接受范围。果糖胺、葡萄糖、维生素C、总胆红素、HbF、三酰甘油等常见干扰物对检测结果影响小(均CV<1.80%)。HbA1c水平主要与血糖相关,但也受年龄、性别、药物、异常血红蛋白、贫血、红细胞增多等因素的影响[11]。该仪器参考值范围验证在选取健康体检者时也考虑上述影响因素,HbA1c参考值范围为4.7%~6.3%。
综上所述,自研糖化血红蛋白床旁检测分析仪检测HbA1c的线性、准确度、精密度等各项指标性能均符合临床要求。同时该仪器操作方便、准确度高、重复性好,且每例标本可独立操作,不产生携带污染,适合于急诊及床旁检测。
参考文献
[1]于秀娟,欧超伟.糖化血红蛋白检测的影响因素及临床意义[J].中国老年学杂志,2013,33(19):4930-4933.
[2]卫生部临床检验中心,北京市医疗器械检验所,北京大学人民医院.糖化血红蛋白实验室检测指南[J].中国糖尿病杂志,2013,21(8):673-678.
[3]ADA.Executive summary:Standards of medical care in diabetes——2013[J].Diabetes Care,2013,36(Suppl 1):S4-S10.
[4]李新华,赵珂,魏芳,等.显色型亲和层析法检测糖化血红蛋白的建立及性能评估[J].中国糖尿病杂志,2016,24(10):882-886.
[5]National Committee for Laboratory Standards.Preliminary evaluation of quantitative clinical laboratory methods:EP10-A[S].Wayne,PA,USA:NCCLS,1998.
[6]宋智心,徐国宾,马怀安,等.糖化血红蛋白测定的标准化现状[J].中华检验医学杂志,2012,35(6):497-500.
[7]JOHN W G.Haemoglobin a(1c):analysis and standardisation[J].Clin Chem Lab Med,2003,41(9):1199-1212.
[8]National Committee for Laboratory Standards.Evaluation of precision performance of quantitative measurement methods;approved guideline-second edition:EP5-A2[S].Wayne,PA,USA:NCCLSI,2004.
[9]National Committee for Laboratory Standards.Method comparison and bias estimation using patient samples;approved guideline-second edition:EP9-A2[S].Wayne,PA,USA,NCCLSI,2002.
[10]National Committee for Laboratory Standards.Evaluation of the linearity of quantitative measurement procedures;a statistical approach;approved guideline:EP6-A[S].Wayne,PA,USA:NCCLSI,2003.
[11]费小蔷,蒋伏松,陆志强.糖化血红蛋白的基础与临床应用[J/CD].中华临床医师杂志(电子版),2012,6(19):5966-5969.
