一株DDT降解菌的筛选及其降解特性
2018-05-25冯玉雪吕蒙蒙
冯玉雪,毛 缜,吕蒙蒙
一株DDT降解菌的筛选及其降解特性
冯玉雪,毛 缜*,吕蒙蒙
(中国矿业大学(徐州)环境与测绘学院,江苏 徐州 221116)
以DDT为目标污染物,通过筛选获得了一株效果稳定的DDT降解菌,并对其进行形态学观察,生理生化特性及16S rRNA测序鉴定.经鉴定,该菌株属于甲基菌属(),命名为. XLL03.菌株在pH值为7,温度30°C,外加碳源浓度0.5%,初始DDT浓度20mg/L时生长量最大.在pH值为6,温度30℃下,外加碳源(葡萄糖)浓度0.1%,初始DDT浓度20mg/L时对DDT的降解率最大.在优化条件下,4d后菌株XLL03对DDT最高降解率可达50.4%.利用GC-MS对DDT的降解中间产物进行定性分析,初步推断在菌株XLL03中,DDT最初分别通过脱氯和脱氯化氢生成DDD和DDE,随后DDD和DDE进一步脱氯得到DDMU,最终DDMU开环后又经过一系列反应被彻底矿化.在DDT的代谢过程中,未发现代谢中间产物的积累,表明菌株XLL03在修复受DDT污染的水或土壤中具有一定的应用前景.
DDT;微生物降解;降解特性;降解途径
DDT(2,2-双(4-氯苯基)-1,1,1-三氯甲烷)作为一种有机氯农药,被应用于农业生产以及控制疟疾等虫媒传播疾病[1-2],从20世纪40年代开始,在全球范围内被广泛应用[3].DDT作为一种典型的持久性污染物,能够通过食物链在人体及动物体内的脂肪器官组织中积累,进而致癌、使内分泌紊乱并且危害人体的生殖系统[4-6].因此,DDT及其中间产物DDD(2,2-双(双氯苯基)-1,1-二氯乙烷),DDE(2,2-双(对氯苯基)-1,1-二氯乙烯)已经被美国环境保护署列入优先污染物[7],一些发达国家在19世纪70年代就已经禁止其使用.虽然我国在1983年也已经禁止DDT的使用,但是在我国多地的水[8-12]、土壤[13-18]、空气[19-20]及食物中都检测到了一定程度的DDT残留.
为了解决DDT的环境残留问题,国内外许多学者研究并尝试了很多方法来修复DDT污染,其中物化方法包括挖掘,焚烧,热解吸附,表面活性剂洗脱,微波增强热处理,超临界液体抽提以及光催化氧化等[21-22].相比较微生物降解,物化方法处理DDT固然是快速,高效的,但在处理过程中极易造成二次污染且费用相对较高,研究发现在用于土壤修复时,物化法也会对土壤造成干扰与破坏.而生物修复技术对环境及土壤的干扰要小的多,于是,生物修复成为了研究重点.
有关DDT污染的微生物修复,国内外研究人员已经证实存在一些细菌和真菌能够有效降解DDT,包括无色杆菌,气杆菌,芽孢杆菌,梭状芽胞杆菌,埃希氏菌,假单胞菌,变形杆菌,链球菌,黄单胞菌,欧文氏菌,巴斯德梭菌,根瘤土壤杆菌等[23].例如工厂土样中分离的一株能够在好氧条件下降解DDT的菌株DH-7[3],10d后能将初始浓度为20mg/L的DDT降解73.6%,在优化培养条件后,降解率达到81.4%.此外分离得到的革兰氏阳性细菌W-1[1]和DB-1[24]对DDT的10d降解率可达67.4% (10mg/L)和83.6% (40mg/L).其中大多数被筛选出来的DDT降解菌都是在好氧条件下降解DDT菌,如真养产碱菌()[25],但也有细菌,例如反硝化产碱菌() ITRC-4在厌氧和好氧的条件下都能降解DDT[26].这些菌株在培养条件下虽然有着较高的DDT降解率,但是由于或降解周期较长,或浓度较高容易降解,或培养条件较苛刻等原因,在实际应用中并不广泛.
本实验以农田土壤作为原始菌源,旨在驯化筛选出几株以DDT为唯一碳源且具有高效降解能力的菌株,并选择其中一株降解效果较好的菌株,对其生长特性以及降解特性进行研究,以此为生物降解法提供高效降解菌菌源.
1 材料与方法
1.1 化学试剂与培养基
本实验所用药品为纯度不小于98.5%的P,P’-DDT(2,2-双(4-氯苯基)-1,1,1-三氯乙烷),由德国Dr.Ehrenstorfer GmbH公司生产,购于生工生物工程有限公司;色谱级的正己烷购于上海展云化工有限公司,培养基所用试剂及其他化学试剂均为分析纯.
实验所用4种培养基为无机盐培养基(NaNO34.0g/L,KH2PO41.5g/L,NaHPO40.5g/L, FeCl3.6H2O 0.0083g/L,CaCl20.01g/L,MgCl20.2g/ L),分离纯化培养基(NaNO34.0g/L,KH2PO41.5g/ L,NaHPO40.5g/L,FeCl3×6H2O 0.0083g/L,CaCl20.01g/L,MgCl20.2g/L,蛋白胨1.0g/L,琼脂 15~ 20g/L),富集培养基(蛋白胨10.0g/L,酵母膏 5.0g/L,NaCl 10.0g/L)和菌种保藏培养基(牛肉膏 3g/L,蛋白胨 10.0g/L,NaCl 5g/L,琼脂15~20g/L),每种培养基在使用前均调节pH值至7.0,121℃灭菌30min.由于DDT是半挥发性的,所以在培养基灭菌后再添加实验所需量的DDT.
1.2 DDT降解菌的富集与分离
从徐州市铜山区西南部农田中采集土样,以此作为微生物富集分离培养的来源.采样时,选取不同的农田,进行多点采样,以保证菌源的多样性,采集土样为地表10cm的土壤.
1.2.1 菌种的富集 取2g原始土样接入装有100mL无机盐培养基的三角瓶中,加入DDT为唯一碳源并使其终浓度为10mg/L.将三角瓶置于恒温振荡器中于30℃,180r/min条件下培养.按照此方法进行多次转接.经过几十天的富集培养后,培养基中的DDT降解菌大量生长.
1.2.2 菌种的分离与纯化 用接种环沾取最后一次富集培养的培养液,在分离纯化培养基上进行划线,30℃恒温培养2~3d.待菌株在平板培养基中富集后,通过肉眼观察,挑取颜色,形态及大小不同的单菌落于富集培养基中富集2~3d.再以5%的转接量将菌株转接至新鲜的无机盐基础培养基中继续培养6d.按照上面方法,不断划线分离直至获得菌落特征一样的菌株.
1.2.3 菌株的驯化 本实验采用逐量分批驯化法进行驯化,选择多个分离纯化出来的菌株进行驯化,用1.2.1的方法逐级提高DDT在无机盐培养基中的浓度,且每个浓度培养时间至少4d,以保证菌株降解DDT的效果及其稳定性.当菌株对DDT的降解率基本不变时,停止提高浓度,则该浓度为菌株最大耐受浓度.
1.3 菌种鉴定
1.3.1 形态学鉴定 (1)菌落形态观察:将获得的菌株用平板稀释法涂布于固体培养基上,置于30℃的恒温培养箱中培养2~3d,待菌落长出后,从其表面形态,大小,颜色等方面进行观察并记录.
(2)扫描电镜:从平板培养基挑取单菌落并用0.2M PBS清洗菌体1遍,向菌体中加入 2.5%戊二醛并混匀,然后于冰箱中静置4h;在8000r/min下离心5min,用蒸馏水清洗3次;再分别用梯度浓度酒精脱水;用纯乙酸异戊酯置换酒精2次后置于40℃的恒温干燥箱中烘8h 以上;将干燥好的菌株粉末送至中国矿业大学分析测试中心进行扫描电镜分析,观察菌株形态特征.
1.3.2 16S rRNA测序 使用生工生产的SK8255细菌基因组抽提试剂盒来提取菌株的基因组DNA.设计引物序列为 27F(5’ AGA GTT TGA TCM TGG CTC AG 3’),1492R(5’ TAC GGT TAC CTT GTT ACG ACT T 3’),片段长度1500bp.对提取的菌株基因组DNA进行PCR扩增.PCR产物经过琼脂糖凝胶电泳后利用SK8131胶回收试剂盒回收.回收的产物送到上海生物工程服务有限公司进行16S rRNA序列的测定,并进行序列Blast比对分析,取其近缘菌的16S rRNA 序列构建系统发育树.
1.3.3 生理生化特性实验 购买青岛海博生物技术有限公司生产的细菌生理生化特性检测试剂盒,并结合沈萍等编著的《微生物学实验》[27],完成革兰氏染色实验,淀粉水解实验,明胶液化实验,甲基红实验,吲哚实验,硝酸盐还原实验,硫化氢实验,3%过氧化氢酶实验,尿素酶实验,苯丙胺脱氨酶实验以及葡萄糖发酵实验.
1.4 分析测定方法
本实验采用的细菌计数法为比色法,即浑浊度计数法.用移液枪取少量培养物于比色皿中,使用可见分光光度计,与波长600nm处测定其吸光度,记为OD600,以OD600值来表示细菌的生长量.此过程去除DDT悬浊液的背景值.
取细菌培养液,经正己烷萃取后,有机相去除水分,过0.22µm滤膜后,用气相色谱/质谱联用仪(GC/MS)测定DDT含量.采用美国铂金-埃尔默公司的CLARUS SQ 8型气质联用仪.柱子类型为30m*0.25nm*0.25µm的毛细管柱,柱流量为 1.0mL/min;传输线和离子源温度均设为250°C;离子源电子能量为70eV;进样口温度设为250°C,不分流进样;柱箱温度设定为初始温度100°C,保持1min,再以20°C /min的速度升温至150°C然后以5°C /min的速度升温至260°C,并保持5min;质量范围选取 45~550amu;数据采集方式为选择离子扫描(SIM);溶剂延迟时间为3.5min,整个测试时间为30.5min.
1.5 DDT降解菌的生长及降解特性分析
将在无机盐培养基中生长至对数时期的细菌转接5%到新鲜的培养基中,分别考察pH(4, 5, 6, 7, 8, 9),外加碳源(葡萄糖)(0.0%,0.1%,0.3%, 0.5%,1.0%,1.5%),初始浓度(10, 20, 30, 40,50mg/ L)和温度(10, 20, 30, 35, 40℃)对DDT降解率的影响,进而确定菌株降解DDT的最适降解条件.
测定菌株对DDT降解能力的试验在最适降解条件下进行,将菌株接种到以20mg/LDDT为唯一碳源的无机盐培养基中培养,定时测定DDT残余浓度,并绘制降解细菌的生长曲线和降解曲线.
1.6 DDT降解菌代谢产物及代谢途径的分析
将菌株的培养液于冰浴的环境下置于超声波细胞破碎仪中进行充分破碎,加入15mL正己烷-丙酮(1:1)超声20min提取有机物.随后将提取的有机相置于旋转蒸发仪上浓缩,将获得的有机相定容至5mL,过0.22µm滤膜后用GC/MS分析.本实验通过GC/MS法测定DDT降解菌的代谢产物,并通过代谢产物分析DDT降解菌对DDT的代谢途径.GC/MS测试程序同1.4节.
1.7 数据处理及表达方式
所有实验都进行3组重复,每组实验数据测3次求平均值,由origin9.1绘制柱状图及折线图,并将误差线表示于图中.
2 结果与讨论
2.1 DDT降解菌的筛选与分离
用以DDT为唯一碳源的无机盐培养基进行菌种的驯化,在DDT浓度为60mg/L的培养基上筛选出一株降解率达到50%以上降解率的菌株,并将其命名为XLL03.菌株XLL03对DDT的耐受极限为60mg/L.
2.2 菌种的鉴定
2.2.1 16S rRNA测序鉴定 菌株XLL03经过16S rRNA测序,将序列在NCBI中进行BLAST分析,用Mega 6.06软件绘制菌株XLL03系统发育树.结果表明菌株XLL03与相似度达到99.79%.
2.2.2 形态及生理生化鉴定 菌株XLL03在牛肉膏蛋白胨琼脂培养基上30℃恒温培养后,为乳白色的不透明圆形菌落,质地粘稠,边缘整齐,表面光滑.通过革兰氏染色后观察到菌株颜色呈紫色,为革兰氏阴性菌,在扫描电镜下的个体形态为短杆状,大小在1mm左右.生理生化实验表明,菌株XLL03具有过氧化氢酶及尿素酶活性,并且可以发酵葡萄糖以及还原硝酸盐,但不能液化明胶,分解含硫有机物生成硫化氢,没有苯丙氨酸脱氨酶.此外,菌株XLL03的甲基红实验和吲哚实验均呈阴性.由此可以看出,菌株XLL03与个体形态和生理生化特性均具有相似性[26].结合菌株XLL03与的生理生化特性,初步确定菌株XLL03为甲基菌属,并将其命名为sp.XLL03.
2.3 DDT降解菌的生长及降解特性
2.3.1 初始pH值对菌株生长及降解能力的影响 如图1(a)所示:生长量在初始pH值为7左右时达到最大,而最高降解率56.5%则出现在pH值为6左右.由此可以推测菌株XLL03的最适生长初始pH值为7,最适DDT降解初始pH值为6.

图1 pH值,外加碳源,DDT初始浓度和温度对菌株XLL03生长及降解能力的影响
2.3.2 外加碳源浓度对菌株的生长及降解能力的影响 如图1(b)所示,当外加碳源浓度为0.5%时生长量最大,因此认为葡萄糖是更加便于细菌利用的碳源,所以会加快细菌的生长繁殖.当外加碳源浓度为0.1%时,XLL03对DDT的降解率最大46.6%,降解率随葡萄糖浓度的增加而降低,可以认为细菌优先利用了葡萄糖而对DDT的降解率反而降低.考虑菌株对DDT的降解率,认为0.1%为最佳外加碳源.
2.3.3 DDT初始浓度对菌株的生长及降解能力的影响 菌株的生长及绝对降解量如图1(c)所示:当DDT浓度从10mg/L逐渐增至50mg/L时,菌株XLL03的生长量和绝对降解量都呈现出先增加后降低的趋势,但菌株生长量在DDT浓度为20mg/L时达到最大值,而绝对降解量在DDT浓度为40mg/L时达到最大值.认为一定浓度的DDT能够促进菌株的生长量,而浓度大于20mg/L的DDT就会抑制菌株的生长,推测在10~40mg/L的浓度变化中菌株对DDT的耐受性较强,而在浓度达到40mg/L时才会表现出对DDT的降解优势.
2.3.4 温度对菌株的生长及降解能力的影响 在20~35℃范围内,菌株XLL03的生长量和对DDT的降解率都比较好,在30℃时降解率可以达到48.2%(如图1(d)所示).可以明显得出,菌株XLL03与大部分细菌一样嗜中温,能够在温度适宜的条件下进行各项代谢活动.
2.3.5 菌株的生长曲线与DDT降解曲线 通过研究菌株的生长特性和降解特性,将菌株的优化条件设为初始pH 6,初始DDT浓度为20mg/L,外加碳源浓度0.1%,培养温度30℃.在此条件下将菌株XLL03连续培养10d,将10d的生长量及DDT残留量绘制成图2:可以看出菌株XLL03的生长曲线与细菌的群体生长规律基本一致,前2d菌株处于延迟期,是对新环境进行适应的过程;在培养的第3d菌株开始快速生长,且在第4d达到最大值,因此这2d对应为对数期,菌株处于最适条件下,生长繁殖很快,相应的消耗有机物的速率也较快,对DDT的降解率也在第4d达到最高值50.4%;此后菌株的数量基本维持平稳的状态,而DDT的剩余量虽略有回升,但基本维持平稳的状态,分析认为除了XLL03的增殖对DDT的降解量增大之外,同时还对DDT有一定的吸附作用,所以之后部分被吸附于菌株表面的DDT又被释放出来,此阶段也即稳定期和衰老期,随着DDT的逐渐耗尽,代谢产物不断积累,生长条件如pH值,氧化还原电位等条件改变,不利于菌株XLL03的生长繁殖,因此生长曲线基本上为水平曲线,而DDT的剩余量也几乎不再变化.

图2 XLL03的生长曲线和DDT降解曲线
2.3.6 DDT代谢产物分析 通过GC/MS得到菌株代谢物的总离子流图和代谢产物离子特征图如图3和图4所示:可知DDD,DDE以及DDMU都是DDT的初步代谢产物.并且在检测过程中,未发现代谢产物的积累,说明菌株XLL03对DDT的代谢是一个完整的矿化过程.
2.3.7 DDT代谢途径的初步确定 结合本实验的中间产物检测结果与现有研究,推测甲基属菌XLL03对DDT可能的代谢途径为:
(1)一个氢原子取代脂肪链上的一个氯原子将DDT还原脱氯生成DDD,这种代谢方式在微生物Proteus vulgaris 代谢DDT的途径中出现过,Proteus vulgaris 是最早报道的能够将DDT还原成DDD的微生物之一[28],2003年Ahuja等[26]也提出过在厌氧环境下DDT会被降解为DDD;接着DDD通过进一步脱氯作用被脱去一个氯原子生成DDMU,这一过程在海洋沉积物的实验也曾被证明,DDE和DDD在产甲烷和硫代微生物中被脱氯至DDMU[29-30].
(2)DDT脱氯化氢后生成DDE,这一途径与Thomas[31]和Hay[32]的文章中提到的一致,菌株首先将DDT脱氯化氢生成DDE,再在酶的作用下将苯环开环继续降解;随后DDE被脱去氯原子生成DDMU.
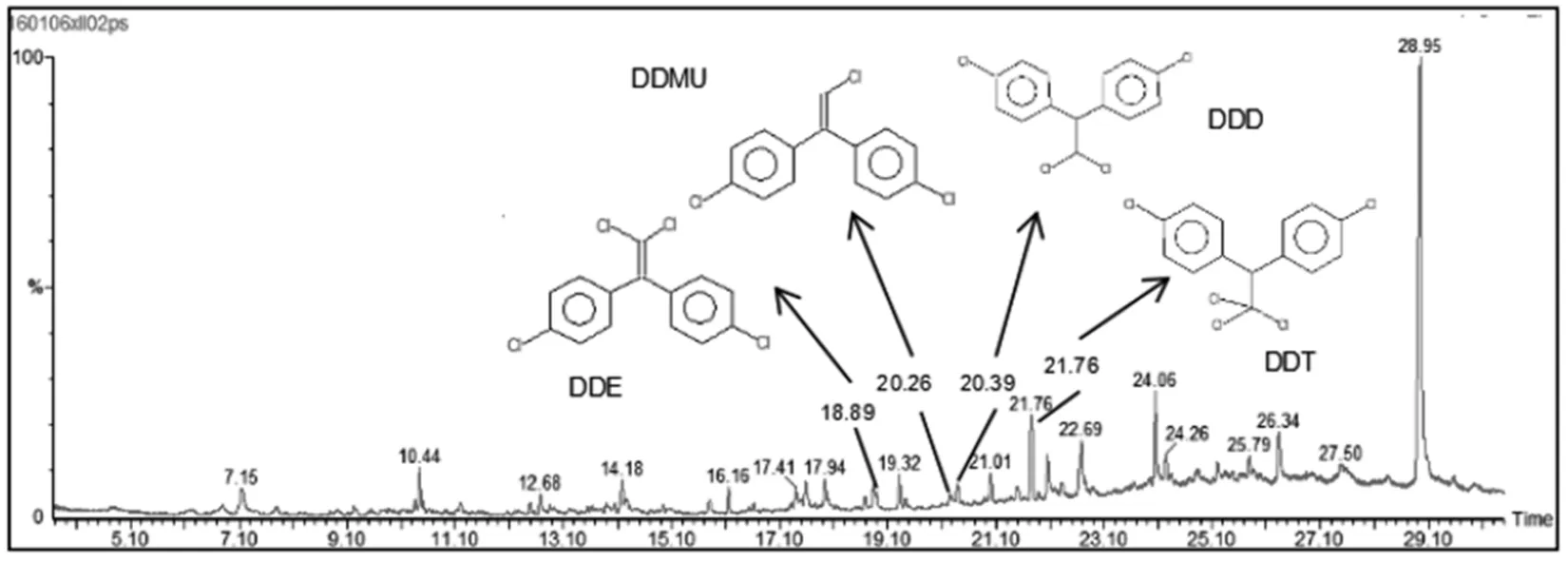
图3 菌株XLL03代谢物的总离子流

图4 DDT, DDD, DDE和DDMU的离子特征
最终DDMU经过一系列反应可能被矿化为二氧化碳,而DDT和DDE也可能在加氧酶的作用下被直接开环,再通过一系列反应被矿化,大致代谢通路如图5所示.与本研究得出的结论类似,一些其他细菌如气单胞菌()HS01[33],黄金杆菌() PYR2[34],红球菌()ⅡTR03[35]和恶臭假单胞菌()T5[36]等细菌都能够在各种媒介中将DDT代谢为DDE和DDMU.此外,Fang等[37]还在宏基因组的基础上得出包括DDT最初经过脱氯作用转化为DDD和DDE,再进一步通过脱氯变为DDMU,最后去氧成为DDA后进一步矿化等涉及还原脱氯,氢化,双加氧,羟基化,脱羧,水解和间位环裂解反应的多步骤过程.而Pan等[38]在基因组功能注释和质谱结构分析的基础上,将苍白杆菌() DDT-2降解DDT过程中的每一步机理都用相应的基因注释标注,在基因方面证实了DDT降解途径的准确性.

图5 菌株对p,p’-DDT的代谢途径
3 结论
3.1 从农田土壤中分离到一株能利用DDT作为唯一碳源生长的菌株,经鉴定,该菌株属于甲基菌属() ,命名为sp. XLL03.
3.2 菌株XLL03在温度30°C,pH值为7,外加碳源(葡萄糖)浓度0.5%,初始DDT浓度20mg/L时生长量达最大;在温度30°C,pH值6,外加碳源浓度0.1%,初始DDT浓度20mg/L时对DDT最高降解率可达50.4%.
3.3 利用GC/MS分析代谢产物,推测菌株XLL03在代谢DDT的过程中,最初分别通过脱氯和脱氯化氢将DDT转化为DDD和DDE,随后DDD和DDE进一步脱氯得到DDMU,最终DDMU开环后又经过一系列反应被彻底矿化.
[1] 顾立峰,何 健,张明星,等. DDT降解细菌W-1的分离鉴定及其降解特性研究[J]. 农业环境科学学报, 2007,26(2):568-571.
[2] 徐 亮,刘月雪,包维楷.生物体内有机氯农药的研究进展[J]. 四川环境, 2003,22(5):15-18.
[3] 李红权,李红梅,蒋继志,等.一株DDT降解菌的筛选,鉴定及降解特性的初步研究[J]. 微生物学通报, 2008,35(5):696-699.
[4] 刘文斌. DDTs好氧降解菌株的筛选及其降解特性研究[D]. 大连:大连理工大学, 2009.
[5] 王占杰.有机氯化物滴滴涕降解研究[D]. 北京:北京化工大学, 2008.
[6] 李延红,郭常义,汪国权,等.上海地区人乳中六六六,滴滴涕蓄积水平的动态研究[J]. 环境与职业医学, 2003,20(3):181-185.
[7] 潘淑颖.土壤中有机氯农药DDT原位降解研究[D]. 济南:山东大学, 2009.
[8] 郁亚娟,黄 宏,王 斌,等.淮河(江苏段)水体有机氯农药的污染水平[J]. 环境化学, 2004,23(5):568-572.
[9] 杨嘉谟,王 赟,苏青青.长江武汉段水体悬浮物中有机氯农药的残留状况[J]. 环境科学研究, 2004,17(6):27-29.
[10] 杨清书,麦碧娴,傅家谟,等.珠江干流河口水体有机氯农药的研究[J]. 中国环境科学, 2005,25(S1):47-51.
[11] 夏 凡,胡雄星,韩中豪,等.黄浦江表层水体中有机氯农药的分布特征[J]. 环境科学研究, 2006,19(2):11-15.
[12] 张秀芳,董晓丽.辽河中下游水体中有机氯农药的残留调查[J]. 大连工业大学学报, 2002,21(2):102-104.
[13] 丛 鑫,薛南冬,梁 刚,等.有机氯农药污染场地表层土壤有机-矿质复合体中污染物的分布[J]. 环境科学, 2008,29(9): 2586-2591.
[14] Gao H J, jiang X, Wang F, et al. Residual level sand new inputs of chlorinated POPS in agricultural soils from Taihu Lake region [J]. Pedosphere, 2005,15(3):301-309.
[15] 罗 飞,宋 静,潘云雨.典型滴滴涕废弃生产场地污染土壤的人体健康风险评估研究[J]. 土壤学报, 2012,49(1):26-35.
[16] 吴志昇,谢光炎,杨国义,等.广州市农业土壤中六六六(HCHs)和滴滴涕(DDTs)的残留特征[J]. 生态环境学报, 2009,18(4): 1256-1260.
[17] 周晓燕,崔兆杰.土壤及果树中HCH和DDT残留及分布规律研究[J]. 环境科学与技术, 2009,32(5):62-65.
[18] 李倦生,陈一清,吴小平,等.湖南省土壤中有机氯农药的残留规律研究[J]. 环境科学研究, 2008-21(5):85-90.
[19] 程翠莉.大连地区大气中DDT和HCH的监测与来源解析[D]. 大连:大连海事大学, 2009.
[20] 邵丁丁,史双昕,周 丽,等.长江沿岸四省大气中的有机氯农药残留量调查[J]. 环境保护, 2007,(24):68-69.
[21] 李常亮,刘文彬,汪 莉,等. DDT废弃处理与环境修复技术综述[J]. 四川环境, 2007,26(5):87-92.
[22] 董玉瑛,冯 宵.持久性有机污染物分析和处理技术研究进展[J]. 环境工程学报, 2003,4(6):49-55.
[23] Kale S P, Murthy Nbk, Raghu K, et al. Studies on degradation of 14C-DDT in the marine environment [J]. Chemosphere, 1999. 39(6):959-968.
[24] 张明星,洪 清,何 健,等. DDT降解菌株DB-1的分离,系统发育及降解特性[J]. 中国环境科学, 2005,25(6):674-677.
[25] Nadeau L, Menn F, Breen A, et al. Aerobic degradation of 1,1,1-trichloro-2,2-bis(4-chlorophenyl)ethane(DDT) by Alcaligenes eutrophus A5 [J]. Appl. Environ. Microbiol., 1998,60:51-55.
[26] Ahuja R, Kumar A. Metabolism of DDT(1,1,1-Trichloro-2, 2-bis (4-chlorophenyl)ethane)byITRC-4 under aerobic and anaerobic conditions [J]. Current microbiology, 2003,46:65-69.
[27] 范秀荣,李广武,沈 萍.微生物实验 [M]. 2版.北京:高等教育出版社, 1989.
[28] Tang J C, Wang R G, Niu X W, et al. Enhancement of soil petroleum remediation by using a combination of ryegrass () and different microorganisms [J]. Siol & Tillage Research, 2010,110:57-93.
[29] Rd Q J, Mueller S A, Jain M K, et al. Reductive dechlorination of DDE to DDMU in marine sediment microcosms [J]. Science, 1998,280(5364):722-724.
[30] Rd Q J, Tiedje J M, Jain M K, et al. Factors controlling the rate of DDE dechlorination to DDMU in Palos Verdes margin sediments under anaerobic conditions [J]. Environmental Science & Technology, 2001,35(2):286-291.
[31] Doronina N V, Kaparullina E N, Trotsenko Y A. Methylovorus menthalis, a novel species of aerobic obligate methylobacteria associated with plants [J]. Microbiology, 2011,80(5):713-719.
[32] Hay A G, Focht DD. Transformation of 1,1-dichloro-2, 2-(4- cholorophenyl)ethane (DDD) by[J]. Fems Microbiology Ecology, 2000,31:249-253.
[33] Cao F, Liu T X, Wu C Y, et al. Enhanced biotransformation of DDTs by an iron- and humic-reducing bacteriaHS01upon addition of goethite and anthraquinone-2, 6-disulphonic disodium salt (AODS) [J]. Agric. Food Chem, 2012,60(45):11238-11244.
[34] Rangachary L, Rajagopalan R P, Singh T M, et al. Purification and characterization of DDT-dehydrohalogenease from Pseudompnas putida T5 [J]. Prep. Biochem. Biotechnol. 2012, 42(1):60-76.
[35] Bajaj A, Mayilraj S, Mudiam M K R, et al. Isolation and functional analysis of a glycolipid producingsp. Strain ⅡTR03 with potential for degradation of 1,1,1-trichloro-2, 2-bis(4-chlorophenyl)ethane (DDT) [J]. Bioresour. Technol. 2014,167:398-406.
[36] Qu J, Xu Y, Ai G M, et al. Novel Chryseobacterium sp. PYR2degrades various organochlorine pesticides (OCPs) and achieves enhancing removal and complete degradation of DDT in highly contaminated soil [J]. Environ. Manag. 2015,161:350-357.
[37] Fang H, Dong B, Yan H, et al. Characterization of a bacterial strain capable of degrading DDT congeners and its use in bioremediation of contaminated soil [J]. Hazard. Mater. 2010, 184:281-289.
[38] Pan Xiong, Xu Tian heng, Xu Hao yu, et al. Characterization and genome functional analysis of the DDT-degrading bacterium Ochrobactrum sp.DDT-2 [J]. Science of the Total Environment, 2017,592:593-599.
Screening and degradation characteristics of a DDT-degrading bacteria.
FENG Yu-xue, MAO Zhen*, LÜ Meng- meng
(School of Environmental Science and Spatial Informatics, China University of Mining and Technology, Xuzhou 221116, China)., 2018,38(5):1935~1942
DDT was used as the target pollutant, and a strain capable of degrading DDT was obtained by isolation and the identification of the strain was carried out through morphological observation, experiments on physiological and biochemical characteristics and 16S rRNA sequencing. The strain was identified as, and named assp. XLL03. The best growing condition for the strain was as follow: pH of 7, 30°C, external carbon source concentration of 0.5% , and initial DDT concentration of 20mg/L. The best degradation condition for the strain was as follow: pH of 6, 30°C, external carbon source(glucose) concentration of 0.1%, and initial DDT concentration of 20mg/L. Under the optimized conditions, the highest degradation rate of DDT by strain XLL03 was 50.4% 4 days later. The qualitative analysis of degradation intermediates of DDT was carried out by GC-MS. It was initially concluded that DDT could first be transformed into DDD and DDE via dechlorination and dehydrochlorination respectively, subsequently both DDD and DDE converted to DDMU by further dechlorination, and then after ring opened, DDMU went through a series of reactions was completely mineralized. No metabolic intermediates was found during the metabolism of DDT, which indicating that strain XLL03 has potential application prospects in repairing DDT-contaminated water or soil.
DDT;biodegradation;degradation characteristics;degradation pathway
X172
A
1000-6923(2018)05-1935-08
2017-09-23
国家自然科学基金资助项目(51778612)
* 责任作者, 副教授, mzhen80@163.com
冯玉雪(1993-),女,宁夏中卫人,中国矿业大学环境与测绘学院硕士研究生,主要从事微生物、土壤修复方面的研究.
