p53-miR-34a-SIRT1反馈环在血管内皮祖细胞复制性衰老过程中的调控作用及机制
2018-05-21宋云林谭秋婵马燕白林林柴瑞峰王毅于湘友
宋云林,谭秋婵,马燕,白林林,柴瑞峰,王毅,于湘友
血管内皮祖细胞(EPC)是干细胞移植治疗缺血性疾病的重要种子细胞,目前基础研究已有一定进展,但长期疗效值得商榷,其中EPC复制性衰老可能是影响其长期疗效的重要因素。p53可诱导细胞周期阻滞引起衰老或凋亡;沉默信息调节因子2相关酶1(SIRT1)参与了多种重要的抗衰老基因的调控,能使p53蛋白活性下降;微小核糖核酸(miR)-34a能抑制SIRT1及细胞周期调节蛋白等的基因表达,进而加速细胞衰老;故推测p53-miR-34a-SIRT1反馈环在细胞衰老过程中起着重要作用[1]。同时,活化后的p53也能增加miR-34a的表达,进一步强化对细胞凋亡的调控作用。另一方面,miR-34a通过抑制SIRT1的产生,从而促进p53的活化[2,3]。故由此推测p53-miR-34a-SIRT1形成的正反馈环在细胞凋亡和增殖的过程中扮演者重要的角色。本研究的目的为明确p53-miR-34a-SIRT1在EPC复制性衰老过程中的反馈调节机制,评估miR-34a抑制因子能否成为延缓EPC衰老的靶点,为提高EPC治疗缺血性疾病的疗效提供理论依据。
1 材料与方法
材料:20份脐血,每份50 ml(来源于暨南大学附属第一医院,均签署知情同意书并获医院科研伦理委员会同意)。
试剂及仪器:EGM-2培养基(Lonza公司,瑞士);人淋巴细胞分离液(LymphoprepTM,Axisshield 公司,挪威);胰蛋白酶(Tryptase,Sigma 公司,美国);小鼠抗人CD34单克隆抗体(BD公司,美国);小鼠抗人CD133单克隆抗体 (Miltenyi公司,德国); 小鼠抗人p53单克隆抗体、小鼠抗人乙酰化p53(Ac-p53)单克隆抗体和兔抗人SIRT1多克隆抗体(CST公司,美国);细胞周期检测试剂盒和AnnexinV/PI 细胞凋亡检测试剂盒(凯基生物有限公司,中国);β-半乳糖苷酶染色试剂盒(碧云天生物技术研究所,中国);超净工作台(SW-CJ-2F,苏净集团安泰空气公司,中国);二氧化碳细胞培养箱(Thermo Formo公司,美国);倒置荧光显微镜(Nikon公司,日本);光学显微镜(OlymPus公司,日本);流式细胞仪(DB公司,美国)。
EPC分离、培养、扩增、鉴定方法:在胎盘、脐带与母体和胎儿完全分离以后,无菌条件下取脐血约50 ml。脐血中加入肝素(20 U/ml)抗凝,以1 000 rpm离心10 min,吸除上清液,以10 ml含10%小牛血清的磷酸缓冲盐溶液(PBS)稀释细胞,加入人淋巴细胞分离液15 ml,以2 000 rpm离心15 min,轻轻旋转吸取呈乳白色的第2层单核细胞(MNC)层,加入EGM-2培养基,调节细胞密度为 1×105/cm2,置于12.5 ml培养瓶内,在37℃、5%二氧化碳培养箱中培养。每日观察细胞扩增情况,待细胞长满到细胞瓶80%左右传代。采用免疫荧光技术对第二代细胞进行EPC细胞标志物CD133、CD34鉴定。观察第三代和第六代细胞在衰老、凋亡、周期和血管形成等方面的差异,检测第三代和第六代细胞p53、乙酰化的p53(Ac-p53)、SIRT1的表达情况。构建携带干扰SIRT1的miR-34a抑制因子的慢病毒载体(由复能基因有限公司构建合成),以第六代EPC作为实验对象,以空载慢病毒转染EPC作为对照组,miR-34a抑制因子慢病毒载体转染EPC作为转染组,检测两组细胞p53和SIRT1的表达差异,观察两组细胞在衰老、凋亡和血管形成等方面的差异,明确外源性miR-34a抑制因子能否延缓EPC的凋亡。
流式细胞仪测定EPC凋亡率:采用AnnexinVFITC/PI双染色法流式细胞术检测EPC的凋亡率。0.25%胰酶消化收集各组细胞,PBS洗涤2次,2 000 rpm离心5 min,弃上清,收集5×105个细胞,加0.5 ml结合缓冲液重悬细胞;加入5 μl AnnexinV-FITC,混匀后在加入5 μl PI,混匀并室温避光反应10~20 min,在1 h内进行流式细胞仪检测。流式细胞仪检测结果分析:左下象限为阴性正常细胞(Annexin V-/PI-);右上象限为晚期凋亡细胞(Annexin V+/PI+);右下象限为早期凋亡细胞(Annexin V+/PI-)。
流式细胞仪分析EPC细胞周期:收集各组细胞,用PBS洗涤1次,2 000 rpm离心5 min,重悬细胞,调整浓度为1×106/ml,取1 ml细胞悬液2 000 rpm离心5 min,弃上清,加入500 μl 70%冷乙醇固定,4℃过夜;离心后弃乙醇,PBS洗涤1次后加入100 μl 5'核酸内切酶,37℃孵育30 min,再加入500 μl PI染色,4℃避光反应30 min;流式细胞仪检测激发波长488 nm处红色荧光,分析数据。
β-半乳糖苷酶染色标记EPC衰老细胞:β-半乳糖苷酶染色试剂以5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-Gal)为底物,只有衰老特异性的β-半乳糖苷酶催化下会生成深蓝色产物。0.25%胰蛋白酶消化细胞后以5×103/孔的细胞密度种植在12孔板中;次日吸除细胞培养液,PBS洗涤1次,每孔加入500 μl β-半乳糖苷酶染色固定液,室温固定15 min;PBS洗3次,每次3 min;每孔加入500 μl染色工作液;37℃恒温水浴箱中孵育过夜;普通光学显微镜下观察、计数蓝染的细胞。
EPC血管形成实验:将保存于-20℃的基质胶拿出4℃过夜解冻;12孔板和枪头都提前放在-20℃冰箱降温30 min;把基质胶加入12孔板之后4℃放置20 min,再室温放置30 min,后放入37℃孵箱30 min;每孔种植EPC 1.5×105个,于6 h光学显微镜下观察细胞血管形成情况。
蛋白质印迹法检测EPC中p53、Ac-p53、SIRT1蛋白的表达:PBS洗待测细胞2 次,每孔加入 120 μl裂解液,含 1.2 μl苯甲基磺酰氟(PMSF);细胞刮刀收集细胞于1.5 ml离心管中,冰上放置30 min,让细胞充分裂解;12 000 g(4℃)离心15 min收集上清至EP管中冰上放置;使用BCA蛋白定量试剂盒进行蛋白定量。5×上样缓冲液加入到已调整好浓度的蛋白样品中,煮沸5 min使蛋白变性,-20℃保存备用。配制10%蛋白电泳分离胶和5%浓缩胶,取30 μg蛋白上样,电泳80 V/180 min,半干法转膜15 V/20 min;5%脱脂奶粉/TBS-T(加了Tween的三乙醇胺缓冲盐水溶液)封闭聚偏二氟乙烯(PVDF)膜1 h;一抗稀释液配置一抗p53、Ac-p53和 SIRT1(1:1 000)孵育 PVDF膜 4℃过夜,TBS-T 洗涤5次;TBS-T 稀释相应的二抗(1:6 000),室温孵育 PVDF膜 1 h;TBS-T 洗涤 5次。凝胶成像系统扫描PVDF膜,Imag-J测量光密度值,以目的蛋白和β-肌动蛋白带的密度比值表示目的蛋白表达水平。
携带miR-34a 抑制因子的慢病毒载体转染:转染前24 h,将细胞以1×105/孔种植到24孔板中。使细胞在慢病毒转染时的数量为2×105/孔左右。次日用含6 μg/ml聚凝胺的2 ml新鲜培养基替换原培养基,加入16 μl慢病毒悬液(最适感染复数MIO值≈15.3;miR-34a 抑制因子慢病毒滴度=1.9×108TU/ml)。37℃孵育,4 h后加入2 ml新鲜培养基以稀释聚凝胺。继续培养24 h,用新鲜培养基替换含病毒的培养基。继续培养,48 h后进行相关实验。
统计学方法:用SPSS 20.0统计软件进行分析,数据均采用均数±标准差(±s)表示,组间差异采用t检验方法,P<0.05认为差异有统计学意义。
2 结果
2.1 血管内皮祖细胞的培养和鉴定
培养3 d后,EPC开始贴壁生长,细胞多呈长梭形。7 d左右,出现由多角形和梭形细胞组成的小集落,随后细胞迅速生长。约10~14 d可出现大面积集落,呈典型铺路石样,即为EPC 细胞集落。取第二代EPC进行鉴定,免疫荧光技术检测CD34、CD133均呈阳性反应,符合EPC表型特点。
2.2 第三代与第六代血管内皮祖细胞显微镜下状态、衰老和血管形成能力方面的差异(图1):
EPC在传代的过程中发生了复制性衰老。与第三代EPC相比,显微镜下第六代EPC凋亡脱落的细胞较多;β-半乳糖苷酶染色显示,第六代EPC衰老细胞明显增多 [(7.0±2.8)% vs(31.2±5.4)%,P<0.05];第六代EPC的血管形成能力也明显减弱(P<0.05)。
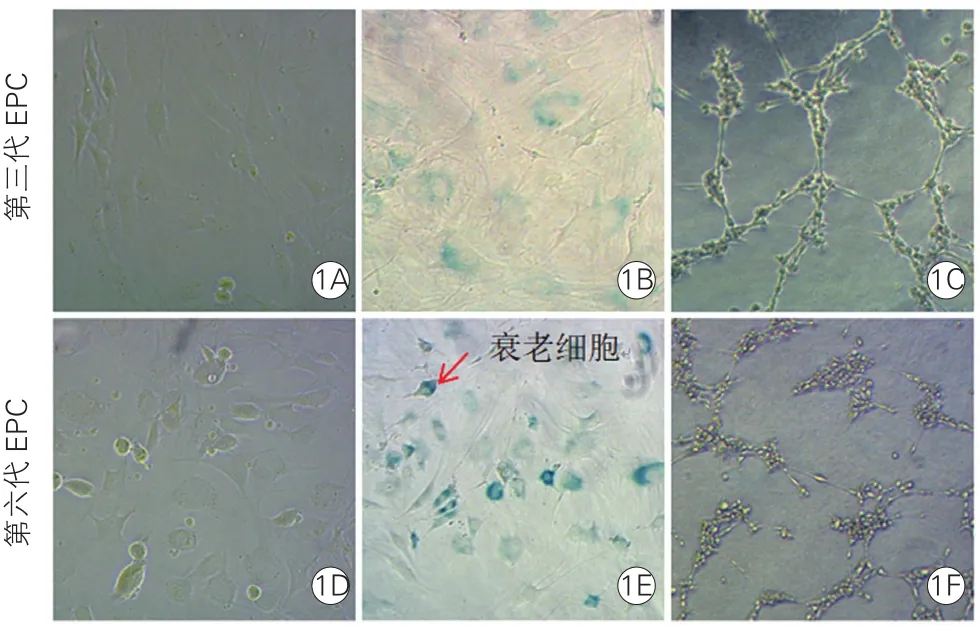
图1 第三代与第六代血管内皮祖细胞显微镜下状态、衰老及血管形成能力比较(×10,n=3)
2.3 第三代与第六代血管内皮祖细胞中p53、Ac-p53和SIRT1蛋白的表达差异(图2)
第六代EPC中p53表达量高于第三代EPC,相反Ac-p53表达量则比第三代EPC少,SIRT1的表达量也低于第三代EPC(P均<0.05)。
2.4 第三代与第六代血管内皮祖细胞各细胞周期的情况和细胞凋亡率比较(表1)
与第三代EPC相比,第六代EPC大部分阻滞于G0/G1期,S 期及G2/M期减少。AnnexinV-FITC/PI双染色结果显示,第六代EPC晚期凋亡率高于第三代EPC,差异有统计学意义(P<0.01)。
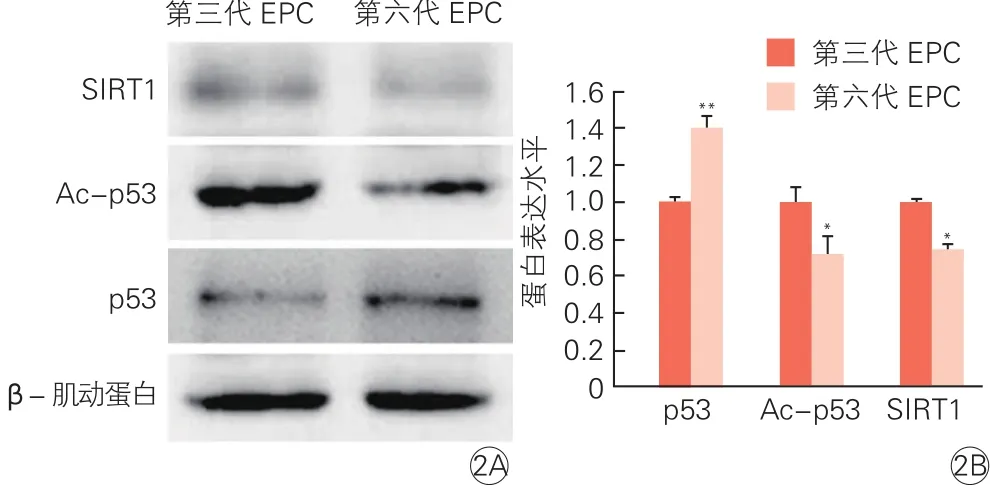
图2 第三代和第六代血管内皮祖细胞中p53、Ac-p53和SIRT1蛋白的表达差异(n=3)
表1 流式细胞术检测第三代和第六代血管内皮祖细胞各细胞周期比例和凋亡率(%,±s,n=3)
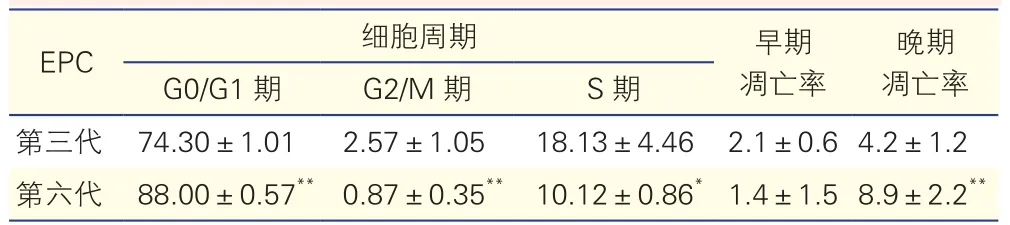
表1 流式细胞术检测第三代和第六代血管内皮祖细胞各细胞周期比例和凋亡率(%,±s,n=3)
注:EPC:内皮祖细胞。与第三代同期EPC比较**P<0. 01 *P<0. 05
第三代 74.30±1.01 2.57±1.05 18.13±4.46 2.1±0.64.2±1.2
2.5 转染miR-34a抑制因子慢病毒载体后的第六代血管内皮祖细胞中SIRT1和p53蛋白的改变(图3)
蛋白质印迹法检测结果显示,转染组的SIRT1蛋白表达较对照组明显增多[(1.35±0.04) vs(1.00±0.03),P<0.05],p53蛋白表达则明显减少[(0.65±0.08) vs (1.00±0.07),P<0.01 ]。
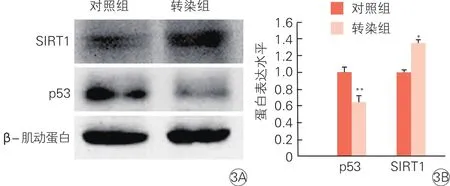
图3 第六代血管内皮祖细胞对照组和转染组中SIRT1 和p53蛋白表达情况(n=3)
2.6 转染miR-34a抑制因子慢病毒质粒的第六代血管内皮祖细胞衰老、血管形成能力及凋亡情况(图4)
与对照组相比,转染组衰老情况有所改善,血管形成能力也增强,晚期凋亡率明显减少[(9.46±3.61)% vs(3.72±3.64)%,P<0.01]。

图4 第六代血管内皮祖细胞对照组和转染组细胞衰老、血管形成能力及细胞凋亡情况(×10,n=3)
3 讨论
EPC作为具有增殖潜能的血管内皮细胞前体细胞,不仅参与生理性血管形成,在多种病理状态下也能被动员出骨髓并分化为成熟内皮细胞,促进形成新生血管,缓解组织缺血和修复血管损伤[4]。研究表明,血循环中的EPC可来源于多种组织,如骨髓、髓外的脂肪组织、脾脏、肌肉、动脉外膜等,脐带血及脐带组织也是EPC体外研究重要的来源之一。另外,循环中的多能干细胞也可以在细胞因子刺激下分化为EPC。EPC能显著改善肢体缺血[5]。Kalka等[6]报道,接受人EPC治疗的小鼠下肢血流量明显增加,缺血肢体成活率显著提高。作为干细胞的一种,EPC治疗缺血性疾病在动物模型中的短期疗效已有诸多报道,但其长期治疗效果和安全性少有报道,在临床中也未得到广泛应用。
细胞复制性衰老是指细胞经过一定次数的分裂后进入不可逆的细胞周期阻滞状态。正常体细胞在体外经历一段时间的培养后,细胞会停止增殖进入衰老状态,无法继续传代培养,恶性肿瘤细胞则不进入衰老状态而能保持持续的增殖状态。衰老和肿瘤的关系非常密切,随着年龄的增加,衰老细胞数量增加,肿瘤的发生率也逐渐增加,特别是在更新频繁的组织中更加明显,例如造血系统和消化系统[7,8]。复制性衰老可能是影响EPC长期疗效的重要因素,基于现有的理论和实验结果,推测细胞凋亡过度是EPC衰老的原因之一[9]。p53是重要的凋亡调节因子。SIRT1是组蛋白去乙酰化酶Sirtuin家族的成员,参与了多种重要抗衰老基因的调控等诸多细胞活动[10]。SIRT1能对p53蛋白去乙酰化,从而使p53蛋白活性下降。miR-34a能抑制SIRT1及细胞周期调节蛋白CDK等的基因表达,进而加速细胞衰老,提示miR-34a在衰老的调控中可能发挥着重要的作用[1]。活化后的p53也能增加miR-34a表达,miR-34a可通过抑制SIRT1的产生,而促进p53的活化。由此推测,p53-miR-34a-SIRT1形成的正反馈环在细胞凋亡和增殖的过程中扮演者重要的角色。
本课题通过研究进一步证实了EPC的复制性衰老,该衰老途径与SIRT1对p53的去乙酰化相关;随着细胞的传代,SIRT1的表达减少,p53的活性增强,通过转录调控阻滞细胞周期,启动细胞衰老和凋亡并降低了细胞的血管形成能力。外源性的miR-34a 抑制因子可减少SIRT1在EPC细胞分裂过程中的损失,保持细胞p53的活性,减少了EPC的凋亡并可达到延缓EPC衰老的进程。因此,由p53-miR-34a-SIRT1构成的正反馈环在EPC的复制性衰老过程中有着重要的意义,miR-34a 抑制因子可能是延缓EPC衰老的靶点,可为缺血性疾病的治疗提供科学依据,但其具体调控机制仍需进一步研究。
参考文献
[1] He L, He X, Lim LP, et al. A microRNA component of the p53 tumour suppressor network[J]. Nature, 2007, 447(7148): 1130-1134. DOI: 10.1038/nature05939.
[2] Yamakuchi M, Lowenstein CJ. MiR-34, SIRT1 and p53: the feedback loop[J]. Cell Cycle, 2009, 8(5): 712-715. DOI: 10. 4161/cc. 8. 5. 7753.
[3] Vaziri H, Dessain SK, Eaton EN, et al. hSIR2(SIRT1) functions as an NAD-dependent p53 deacetylase[J]. Cell, 2001, 107(2): 149-159.
[4] Hakami NY, Ranjan AK, Hardikar AA, et al. Role of NADPH oxidase-4 in human endothelial progenitor cells[J]. Front Physiol,2017, 8: 150. DOI: 10. 3389/fphys. 2017. 00150.
[5] Zhou P, Tan YZ, Wang HJ, et al. Hypoxic preconditioning-induced autophagy enhances survival of engrafted endothelial progenitor cells in ischaemic limb[J]. J Cell Mol Med, 2017, 21(10): 2452-2464. DOI:10. 1111/jcmm. 13167.
[6] Kalka C, Masuda H, Takahashi T, et al. Transplantation of ex vivo expanded endothelial progenitor cells for therapeutic neovascularization[J]. Proc Natl Acad Sci USA, 2000, 97(7): 3422-3427. DOI: 10. 1073/pnas. 070046397.
[7] Jeyapalan JC, Ferreira M, Sedivy JM, et al. Accumulation of senescent cells in mitotic tissue of aging primates[J]. Mech Ageing Dev, 2007,128(1): 36-44. DOI: 10. 1016/j. mad. 2006. 11. 008.
[8] Krishnamurthy J, Torrice C, Ramsey MR, et al. Ink4a/Arf expression is a biomarker of aging[J]. J Clin Invest, 2004, 114(9): 1299-1307. DOI:10. 1172/JCI22475.
[9] Schellenberg A, Lin Q, Schuler H, et al. Replicative senescence of mesenchymal stem cells causes DNA-methylation changes which correlate with repressive histone marks[J]. Aging, 2011, 3(9): 873-888.DOI: 10. 18632/aging. 100391.
[10] Kong X, Guan J, Li J, et al. P66Shc-SIRT1 regulation of oxidative stress protects against cardio-cerebral vascular disease[J]. Mol Neurobiol, 2017, 54(7): 5277-5285. DOI: 10. 1007/s12035-016-0073-2.
