白羽鹌鹑IFN-γ基因克隆、序列分析及原核表达
2018-05-10刘梓欣赵宏敬邢明伟
刘梓欣,赵宏敬,王 雨,陶 金,邢明伟
(东北林业大学野生动物资源学院,黑龙江 哈尔滨 150040)
干扰素是一种具有广谱抗病毒、抗肿瘤和免疫调节等功能的细胞因子,可以通过调节机体的某些细胞来间接发挥抗病毒生物学作用,抑制病毒生长,促进免疫细胞活性。IFN-γ属于Ⅱ型干扰素,主要是由活化的T细胞、NK细胞、NKT细胞产生的糖蛋白[1]。IFN-γ诱导基因转录主要通过干扰素信号肽转导的经典模式 JAK-STAT途径[2-3]。IFN-γ对体液免疫和细胞介导的非特异免疫反应具有重要调控作用。白羽鹌鹑的肉和蛋中含有丰富的蛋白质,具有较高的营养价值和药用价值,在我国更是有“动物人参”的美誉[4]。其中白羽鹌鹑是中国自主培育出的优良品种,养殖户也大规模的发展起来,饲养量已占全世界的1/5,已经成为世界第一鹌鹑养殖大国[5]。随着鹌鹑集约化养殖程度不断提高,鹌鹑病毒性疾病的感染率也在逐年上升[6]。新城疫、支气管炎、鹌鹑痘病是引起鹌鹑死亡的主要疾病[7]。对克隆到的白羽鹌鹑Ⅱ型IFN-γ基因进行生物信息学分析,旨在利用大肠杆菌建立高效表达白羽鹌鹑IFN-γ(coIFN-γ)的体外表达系统,为进一步研究鹌鹑IFN-γ干扰素蛋白在机体抗病毒分子机制的研究和抗病毒药物的开发奠定了基础。
1 材料与方法
1.1 材料 白羽鹌鹑(体长约为15 cm,体重为300~350 g),由哈尔滨市郊区某鹌鹑养殖场提供。克隆载体 pMD19-T、表达载体 pET-32a(+)、DL-2 000 DNA Marker、DL-10 000 DNA Marker由 TaKa-Ra(大连)公司提供;PCR引物由博仕生物公司合成;DNA凝胶回收试剂盒、高纯质粒小量制备试剂盒,由Omega公司提供。
1.3 白羽鹌鹑IFN-γ基因的引物设计和PCR扩增 参考 GenBank中火鸡(AJ000725)、雉鸡(AJ001289)、柳雷鸟(DQ473434)、原鸽(NM001282845)等已知的IFN-γ基因序列,在同源性较高的位置设计特异性引物:coIFN-1a P1:5′-ATGACTTGCCAGACTTACAACTTGT-3′;coIFN-2b P2:5′-TTAGCAACTGCATCTCCTCAGACAC-3′,以脾脏提取的cDNA为模板进行PCR扩增。PCR体系(10 μL)为:10× PCR Buffer 1 μL,dNTP(2.5 mmol/L)0.8 μL,cDNA 1 μL,引物 coIFN-1a 0.5 μL,引物 coIFN-2b 0.5 μL,rTaq 酶(5 U/μL)0.1 μL,补水至 10 μL。
采用热启动方法进行PCR,反应条件设为94℃预变性5 min,94℃变性40 s,53℃退火30 s,72℃延伸45 s,30个循环后以72℃最终延伸10 min。扩增结束,取扩增产物进行1%琼脂糖凝胶电泳,按照多功能DNA纯化回收试剂盒说明书回收扩增后的目的片段。
1.4 阳性重组质粒pMD19-T-coIFN-γ的鉴定 取胶回收产物4 μL、pMD19-T克隆载体1 μL和 Solution I 5 μL混匀,16℃连接 5 h;取感受态细胞DH5α,冰浴中融化;将 10 μL pMD19-T-coIFN-γ 的连接产物加入含有100 μL感受态细胞的EP管中,混匀;冰浴30 min,42℃水浴热激90 s,快速冰浴3~5 min。将200 μL LB培养基(不加抗生素)加入到EP管中,37℃,180 r/min,温育1 h。最后将EP管中的液体转移到Amp/LB平板上,37℃培养12 h;挑取白色单克隆菌落于5 mL Amp/LB液体培养基中,180 r/min(37℃)震荡培养过夜,对菌液进行PCR鉴定。
选择经鉴定为阳性的菌液提取质粒,取5 μL提取质粒用限制性内切酶EcoR I和Hind III各0.5 μL以及10×M Buffer 1 μL,ddH2O 补至10 μL于37℃水浴锅中双酶切2 h,然后取5 μL酶切产物进行1%琼脂糖凝胶电泳,选取结果为阳性的质粒pMD19-T-coIFN-γ送至哈尔滨博仕生物技术有限公司进行测序。
1.5 白羽鹌鹑IFN-γ基因的序列分析 利用DNA Star-MegAlign对coIFN-γ基因的开放阅读框序列进行同源性分析。用Clustal X和MEGA 4.0软件进行进化树的构建分析;利用DNAMAN对鹌鹑、原鸡(FJ788637)、原鸽(NM001282845)、灰雁(AY524421)、红腿叫鹤(XM009701660)等的IFN-γ氨基酸序列进行相似性比对分析;利用在线软件SWISS-MODEL对coIFN-γ进行3D结构模拟预测;利用在线软件SignalP对coIFN-γ的氨基酸序列进行信号肽预测;利用在线软件NetO Glyc-3.1对coIFN-γ的氨基酸序列进行糖基化位点分析。
1.6 白羽鹌鹑原核表达质粒 pET32a(+)-IFN-γ的构建根据测序结果设计引物P3:5′-CCGGAATTCCATACTGCAAGTAGTCTAAATC-3′(划线部分酶切位点是EcoR I);P4:5′-CCGCTCGAGTTAGCAACTGCATCTCCT-3′(划线部分酶切位点是Xhol I),在上、下游引物5′端分别引入EcoR I和Xhol I酶切位点,以重组质粒pMD19-T-coIFN-γ为模板,以P3、P4为引物扩增白羽鹌鹑成熟肽基因。分别以EcoR I和Xhol I双酶切含 coIFN-γ成熟肽基因的 T载体和 pET32a(+)原核表达载体,切胶回收目的片后,在T4DNA连接酶的作用下,22℃连接10 min,转化至DH5α感受态细胞。提取重组质粒,EcoR I和Xhol I双酶切鉴定后,送至哈尔滨博仕生物技术有限公司测序,测序正确的重组质粒命名 pET32a(+)-coIFN-γ。
1.7 重组表达质粒pET32a(+)-coIFN-γ的诱导表达和鉴定 将pET32a(+)-coIFN-γ转化至表达宿主菌BL21感受态细胞中,于37℃,加入终浓度为1.0 mmol/L的IPTG进行诱导表达。分别于诱导前、诱导后4 h收集菌液。同时设含表达载体pET32a(+)诱导后的 BL21阴性对照。取菌液1 mL,于室温5 000 r/min离心5 min,收集菌体,重悬于50 mmol/L PBS(pH值为7.4)中,冰浴中超声破碎(200 W ×10次,每次 3 s,间歇 3 s),最后于4℃、12 000 r/min离心10 min,收集上清和沉淀,于100℃加热变性10 min,进行10%SDS-PAGE分析。
2 结果
2.1 白羽鹌鹑IFN-γ基因的PCR扩增结果 将得到的PCR的产物经1%琼脂糖凝胶电泳分析后,出现一条约495 bp特异性条带(图1),与预期大小一致。
1.2.1 纳入标准 ⑴所有入选患者均经MRI、X线检查及术中关节镜探查确诊;⑵无其他软组织损伤;③均伴有不同程度的膝后侧酸胀、膝关节不适、行走或上下楼梯时膝关节局部交锁、弹响等临床表现。
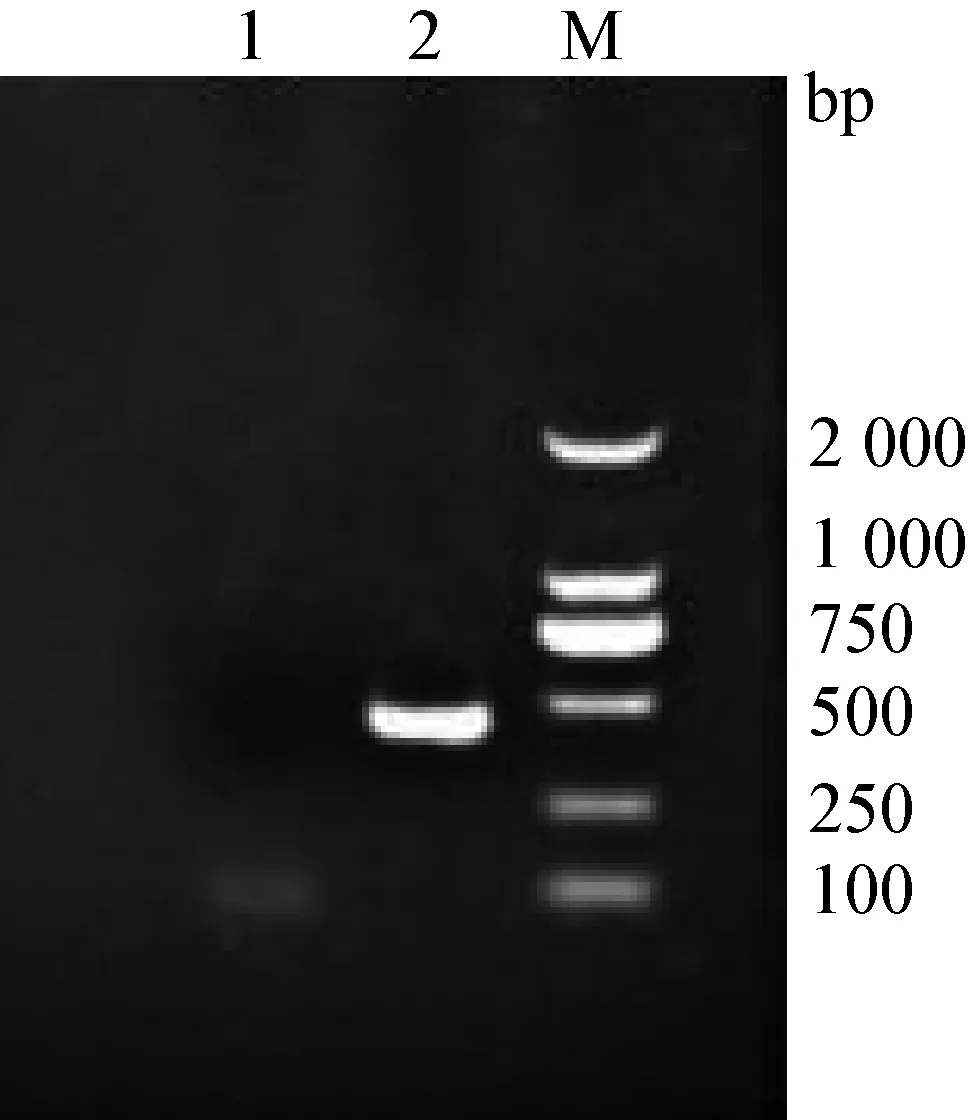
图1 PCR产物电泳结果
2.2 测序结果与白羽鹌鹑IFN-γ基因的序列分析测序结果表明,coIFN-γ基因的核苷酸序列为495 bp。
利用DNAMAN软件对鹌鹑的γ干扰素氨基酸序列进行分析,成熟蛋白的理论分子量是18.90 kDa,等电点是9.17。经 http://www.cbs.dtu.dk/services/.网站提供的信号肽预测软件分析,coIFN-γ氨基酸序列包含一个由24个氨基酸组成的信号肽序列和140个氨基酸组成的成熟肽序列,有2个糖基化位点(见封三彩版图2,3)。
应用MEGA4.1生物软件,对 coIFN-γ基因的ORF序列与GenBank数据库中已有的其他禽类和一些常见水禽类动物的IFN-γ基因核苷酸序列进行同源性比较(见图4)。分析结果显示,coIFN-γ基因与日本鹌鹑同源性最高,能达到100%,与鸡形目动物差异不明显,同源性能达到95.6%。在系统进化树中,白羽鹌鹑和日本鹌鹑在同一分支中,亲缘关系较为接近,而与灰雁则较远(图5)。
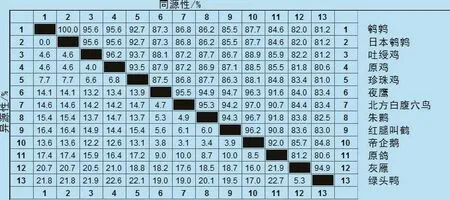
图4 鹌鹑IFN-γ基因核苷酸同源性比较
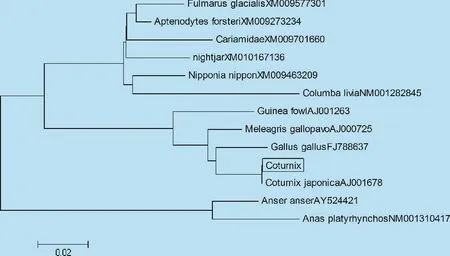
图5 鹌鹑IFN-γ基因核苷酸系统发育树
2.3 白羽鹌鹑重组表达质粒的鉴定 coIFN-γ成熟肽基因与pET32a(+)连接后,转化至DH5α,挑取白色菌落提取重组质粒,经 EcoR I和;Xhol I单、双酶切和PCR鉴定。1%琼脂糖凝胶电泳显示,双酶切和PCR检测的插入片段长约500 bp(图6),与预期结果相符。将鉴定为阳性的重组质粒测序,测序结果与coIFN-γ成熟肽基因的编码序列完全一致。证实成功地构建了重组原核表达质粒pET32a(+)-coIFN-γ。
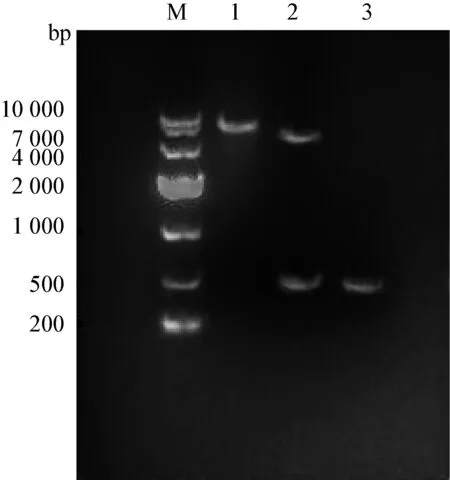
图6 鹌鹑IFN-γ重组表达载体的鉴定
2.4 重组白羽鹌鹑IFN-γ成熟肽基因的表达、鉴定在BL21中,重组表达质粒pET32a(+)-IFN-γ在IPTG诱导表达下,在30~40 kDa处可见特异蛋白质条带,而以pET-32a(+)空载体对照,在相应位置没有产生特异性条带(图7)。
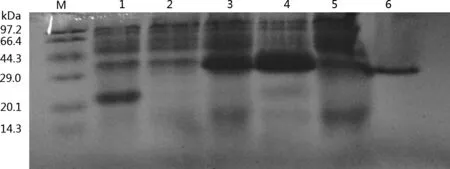
图7 鹌鹑IFN-γ蛋白的SDS-PAGE
3 讨论
白羽鹌鹑是我国重要的经济动物,具有一定的营养价值,养殖规模大,经济价值高,随着白羽鹌鹑规模化养殖的不断发展,各种禽传染性疾病的发生更为频繁和严重,而且大量使用化学药物会严重威胁禽肉等食品的安全,制约鹌鹑业的进一步发展。为此试验开发新型抗病毒性生物制剂和免疫增强剂成为防治白羽鹌鹑重大疫病的重要途径。IFN系统是机体对抗病毒感染的重要防疫系统,一般情况下,动物体内相关细胞的IFN基因处于静止状态,只有在病毒等因素的诱导下才能微量表达。同时,当IFN系统被激活后,血清IFN可以很快的散布到身体各器官处,细胞在接触IFN的短时间内,就会产生抗病毒状态,并且动物在1~3周内对病毒的重复感染都有抵抗作用。近年来,各国学者广泛开展了禽类重组IFN抗病毒的研究。Plachy等[8]进行了鸡重组IFN防治劳斯肉瘤病毒(RSV)肿瘤的研究;王玉东等[9-10]分别用鸡 IFN-γ蛋白去抑制水泡性口炎病毒、新城疫的复制,证明了鸡IFN-γ的抗病毒作用。李志中、曾岩等人的研究也表明鸡IFN-γ与新城疫、禽流感灭活疫苗联合作用也可以显著提升免疫保护作用[11-12]。由于不同物种的IFN具有种属特异性,许多在研究中应用的有效方法和成功经验不能用于白羽鹌鹑IFN的研究[13]。
因为禽类的IFN-γ必须经过诱导因子刺激才能产生,本试验从体外分离、经过刀豆素蛋白A刺激的鹌鹑外周血淋巴细胞中,应用TRIZol法提取鹌鹑总RNA,反转录得到鹌鹑的cDNA,用PCR扩增获取IFN-γ基因,对核苷酸序列同源性及IFN-γ蛋白的理化性质、疏水性、保守区域结构进行分析,并对信号肽、糖基化位点、蛋白3D结构模拟预测。结果表明,coIFN-γ基因与日本鹌鹑同源性最高,能达到100%,与鸡形目动物差异不明显,同源性能达到95.6%,而与水禽差异性较大,coIFN-γ的同源性与动物分类地位是一致的,推测其IFN-γ生物学功能具有一定的种属间特异性。对coIFN-γ的潜在糖基化位点进行预测,可为进一步研究coIFN-γ蛋白的真核表达载体选择提供理论依据。构建的成熟肽原核表达质粒pET32a(+)-coIFN-γ在IPTG诱导表达下,成功在BL21细胞中表达了40 kDa左右的蛋白质,这为coIFN-γ走向临床应用创造了条件。
相比于其他经济动物,目前对于白羽鹌鹑IFN的应用研究报道还较少[14],本试验从分子水平上对鹌鹑IFN进行研究,并建立IFN-γ成熟肽原核表达系统,实现表达,这为进一步研究鹌鹑干扰素蛋白在抗病毒作用和调节免疫等方面的作用提供了坚实的理论依据,并且为鸡形目的免疫进化机制研究提供丰富资料。
参考文献:
[1] Storey M,Jordan S.An overview of the immune system[J].Nurs Stand,2009,23(15-17):47-56,58,60.
[2] Stark G R.How cells respond to interferons revisited:from early history to current complexity[J].Cytokine Growth Factor Rev,2007,18(5-6):419-423.
[3] 张月美,陈伟业,葛金英,等.牛γ干扰素单克隆抗体的制备与抗原捕获ELISA检测方法的建立[J].中国预防兽医学报,2009,31(12):953-957.
[4] 张巍,李绍章,杜金平.中国鹌鹑研究概况[J].湖北农业科学,2012,51(24):5 572-5 575.
[5] 张增峰,罗殿中,樊晓晖.鹌鹑流感病毒SA受体的分布特点及其在流感病毒生态系统中的作用[J].广西医学,2010(11):1 313-1 317.
[6] 林德军,谭明芬.鹌鹑常见病的防治措施[J].当代畜牧,2015,(03):17-18.
[7] 张全,孙惠民,石春军.鹌鹑肺型曲霉菌病的诊断[J].吉林畜牧兽医,2010,9(01):17.
[8] Plachy J,Weining K C,Kremmer M J,et al.Proctive effects of typeⅠand typeⅡinterferon toward Rouse Sarcoma virus-induced tumors in chicken[J].Virology,1999(256):85-88
[9] 李皓洋.鸡干扰素α和γ在家蚕中的表达及其抗病毒活性检测[D].北京:中国农业科学院,2015.
[10] Karpala A J,Morris K R,Broadway M M,et al.Molecular cloning,expression,and characterization of chicken IFN-lambda[J].J Interferon Cytokine Res,2008,28(6):341-350.
[11] 曾岩,任晓峰,蔡皓,等.重组鸡γ-干扰素对H5亚型禽流感灭活苗的免疫增强作用[J].东北农业大学学报,2010,43(10):87-90.
[12] 姜新发,吴晶娥,沈志华,等.干扰素与黄芪多糖对鸡传染性囊病治疗效果[J].当代畜牧,2008(08):10-12.
[13] Marcus P L,Heide V D,Sekellick M J.Interferon action on Avain virus[J].J Administ Chicken Interf Cytokine Res,1999,(19):881-885.
[14] 夏春,汪明,朱凌云,等.惠阳胡须鸡IFN-α基因克隆和序列分析[J].畜牧兽医学报,2000,31(06):563-566.
