覆膜栽培方式对雨养区马铃薯土壤酶活性和土壤微生物及产量的影响
2018-04-19李浩然曹君迈苏红玉
李浩然,曹君迈,苏红玉
(北方民族大学生物科学与工程学院,宁夏 银川 750021)
【研究意义】土壤酶是具有高度催化作用的生物催化剂,作为土壤的组成部分,是土壤中的各种生物化学过程的动力。土壤酶活性是维持土壤肥力的一个潜在指标,它的高低反映了土壤养分转化的强弱[1],可以反映土壤的表观肥力。土壤微生物在土壤有机质分解和生态系统养分循环的过程中发挥着关键作用,影响植被的发育[2],对土壤生态系统功能和评价土壤有机质和肥力状况有重要意义。【前人研究进展】近年来,众多研究围绕不同轮作施肥和不同陪肥方式对马铃薯田土壤酶活性和微生物数量的影响[3-5]。【本文切入点】鉴于此,本试验探求正常施用农家肥的条件下,不同覆膜栽培方式对马铃薯田土壤酶活性以及土壤微生物数量的影响规律,为当地马铃薯实际生产提供理论依据。
1 研究区域概况
研究区位于宁夏回族自治区中南部、黄土高原西北部中卫市海原县树台乡,属黄河中游黄土丘陵沟壑区,境内丘陵起伏,沟壑纵横,海拨1366~2955 m,南北长95km,东西宽80 km,总面积6899 km2。东与原州区相连,南与西吉县接壤,西临甘肃靖远、会宁县,北濒同心县。位于东经105°09′~106°10′,北纬36°06′~37°04′,大陆性季风气候明显,特点是春暖迟、夏热短、秋凉早、冬寒长。年均气温7 ℃,≥10 ℃积温2398 ℃,年日照时数2710 h,无霜期149~171 d。年降水量多年平均值为389.0 mm,年最大降水量为706.0 mm,年最小降水量为194.5 mm。蒸发量多年平均值为2099.6 mm,年干燥度2.17,属于干旱半干旱带,土壤类型为黑垆土。
2 材料与方法
2.1 试验设计
本试验以宁南山区普遍种植的马铃薯品种“青薯9号”为供试材料,于2015年5月1日播种,共设5个处理,分别为处理1:露地平种种植(CK),处理2:单垄单行垄上种植,处理3:单垄双行垄上种植,处理4:单垄双行半覆膜垄上种植,处理5:单垄双行全覆膜垄上种植。种植方法:各处理株距均为40 cm,处理1行距50 cm,处理2行距100 cm,处理3、处理4、处理5为宽窄行行距60~40 cm,各处理种植深度为20~25 cm。处理2种植密度位25 000株/hm2,其余处理种植密度为50 000株/hm2,每处理面积为10.0 m ×4.0 m,小区间距70 cm,周边200 cm的保护行。4次重复,随机排列。
2.2 土壤样品采集
2015年7月下旬和8月下旬,分别在每个样方内按照S型选取采样点,用直径4 cm土钻分别取0~20和20~40 cm土样,无菌密封带回实验室。将每个土样除去沙砾、植物根系等杂物,混匀后分为两部分,一部分鲜土立即用于测定土壤微生物,一部分在室温下风干,将风干土过1 mm筛,用于测量土壤酶活性。
2.3 测定项目与方法
2.3.1 土壤酶活性测定 过氧化氢酶活性测定采用KMnO4滴定法,结果以每单位土壤质量消耗0.002 mol/L KMnO4的毫升数表示。脲酶活性测定采用苯酚钠次氯酸钠比色法测定,结果以没100 g土壤的NH4+-N的毫克数表示。磷酸酶活性采用磷酸苯二钠比色法测定,结果以每100 g土壤中酚毫克数表示,蔗糖酶活性的测定方法为3,5-二肖基水杨酸比色法,结果以24 h,1 g干土生成葡萄糖毫克数表示[6]。
2.3.2 土壤微生物测定 放线菌培养采用改良高氏1号培养基,土壤悬浊液浓度采用10-3、10-4、10-5;细菌培养采用营养琼脂培养基,土壤悬浊液浓度采用10-3、10-4、10-5;真菌培养采用玫瑰红钠琼脂培养基,土壤悬浊液浓度采用10-2、10-3、10-4,每个培养基浓度重复3次,采用平板涂抹法接种。然后置于恒温箱中培养,在无菌条件下进行操作。计数采用《数量指标计算细菌统计表》[7]。
1 g干土中的菌数=2个平板菌落数×稀释度干土的百分数×100
2.4 数据处理
实验中得出的数据用Excel2003和SPSS 17.0数据处理软件进行统计分析
3 结果与分析
3.1 不同覆膜栽培方式下土壤酶活性变化
土壤酶是具有蛋白质性质的高分子生物催化剂,参与土壤中各种生物化学过程。土壤酶活性是土壤生物活性的总体现,反映了土壤的综合肥力特征及土壤养分转化进程,可以作为衡量土壤肥力水平高低的较好指标[8]。
由表1可知,各处理中土壤酶活性均表现为蔗糖酶>磷酸酶>脲酶>过氧化氢酶;在5种处理中土壤过氧化氢酶、磷酸酶活性表现为单垄双行全覆膜垄上种植>单垄双行半覆膜垄上种植>单垄双行垄上种植>单垄单行垄上种植>露地平种(CK);而脲酶酶活性表现为单垄双行半覆膜垄上种植>单垄双行全覆膜垄上种植>单垄双行垄上种植>单垄单行垄上种植>露地平种(CK),蔗糖酶活性表现为单垄双行全覆膜垄上种植>单垄双行半覆膜垄上种植>露地平种(CK)>单垄双行垄上种植>单垄单行垄上种植。单垄双行全覆膜垄上种植的土壤过氧化氢酶、磷酸酶、蔗糖酶、脲酶酶活性分别高出露地平种(CK)50.0 %、10.2 %、0.4 %、21.9 %;单垄双行半覆膜垄上种植的土壤过氧化氢酶、磷酸酶、蔗糖酶、脲酶酶活性分别高出露地平种(CK)48.5 %、4.7 %、0.3 %、22.8 %;单垄双行垄上种植的土壤过氧化氢酶、磷酸酶、脲酶酶活性分别高出露地平种(CK)33.3 %、2.7 %、8.8 %;单垄单行垄上种植的土壤过氧化氢酶、磷酸酶、脲酶酶活性分别高出露地平种(CK)30.3 %、0.4 %、6.5 %。单垄双行全覆膜垄上种植的土壤磷酸酶活性比单垄双行半覆膜垄上种植高出5.3 %。
3.2 不同覆膜栽培方式下土壤微生物数量变化
土壤微生物是土壤有机质和土壤养分转化和循环的动力,在生态系统物质转化和能量流动过程中起主导作用,具有巨大的生物化学活性[9]。
由表2可知,不同覆膜栽培模式各土壤微生物数量表现为细菌>放线菌>真菌,不同覆膜栽培模式土壤微生物总数表现为单垄双行全覆膜垄上种植>单垄双行半覆膜垄上种植>单垄双行垄上种植>单垄单行垄上种植>露地平种(CK),单垄双行全覆膜垄上种植、单垄双行半覆膜垄上种植、单垄双行垄上种植、单垄单行垄上种植的土壤细菌、真菌、放线菌分别高出露地平种(CK)16.1 %、12.8 %、8.9 %、3.7 %,32.8 %、49.3 %、35.8 %、0和70.3 %、67.6 %、48.2 %、22.3 %。

表1 不同覆膜栽培模式酶活性
3.3 不同覆膜栽培方式下各类土壤酶活性、土壤微生物数量及产量的相关性分析
由表3 可知,土壤微生物总数与土壤酶活性呈显著正相关关系,微生物总数与蔗糖酶活性相关性不显著。不同土壤微生物数量与不同土壤酶活性相关程度不同,放线菌数量与过氧化氢酶、脲酶活性显著相关,与磷酸酶、蔗糖酶相关性不显著。

表2 不同覆膜栽培模式土壤微生物数量分布
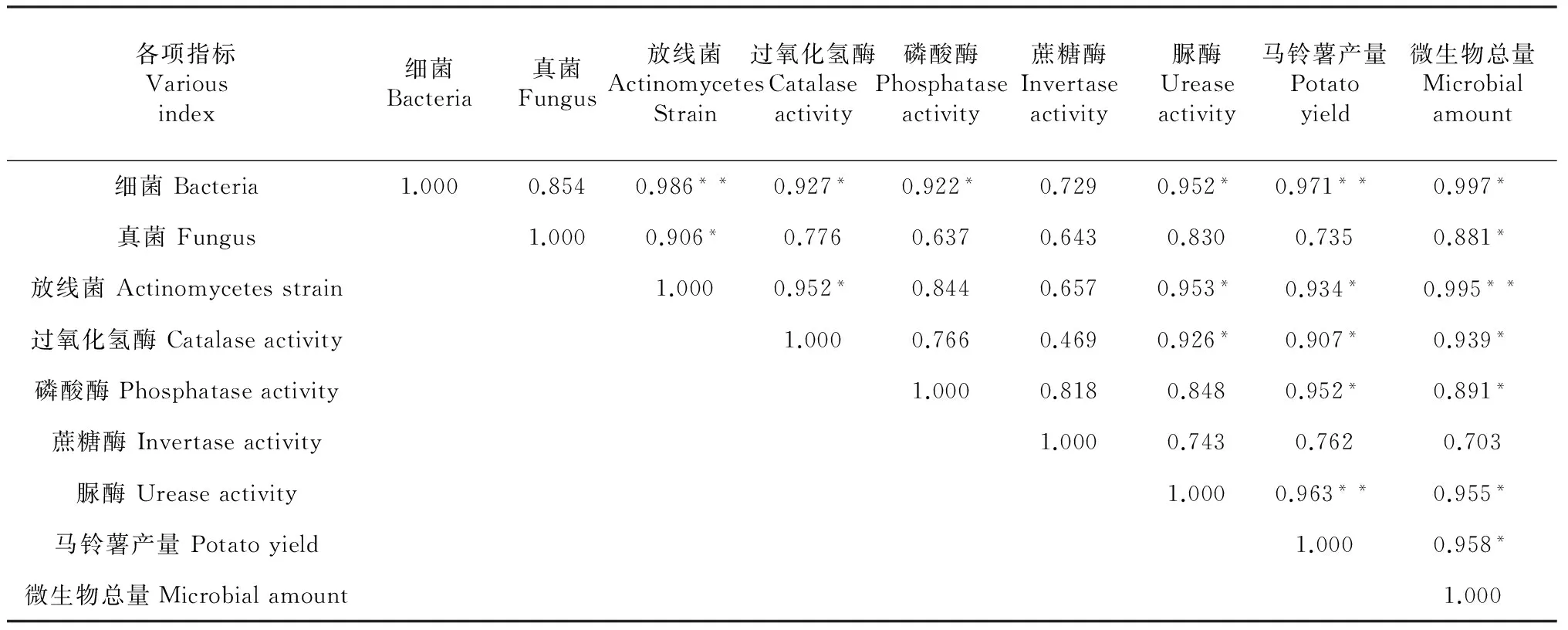
表3 各项指标之间的相关性分析
注:*表示在0.05水平上达到了显著性,**表示在0.01水平上达到了显著性。
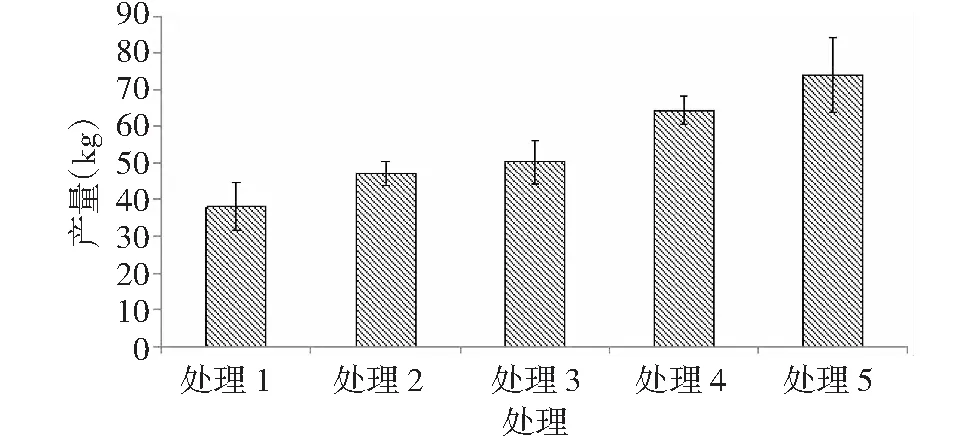
图1 各处理马铃薯产量Fig.1 Different processing of potato produciton
马铃薯产量与细菌、脲酶呈极显著正相关,与放线菌、过氧化氢酶、磷酸酶呈显著正相关,而与真菌、蔗糖酶相关性不显著。
3.4 不同覆膜栽培方式下马铃薯产量的变化
由图1可以看出,处理5单垄双行全覆膜栽培方式、处理4单垄双行半覆膜栽培方式的马铃薯产量明显高于其他处理,并且处理5的产量最高。分别高于处理1、处理2、处理3、处理4: 98.4 %、57 %、47.3 %、15 %。
4 讨 论
4.1 不同覆膜栽培方式下土壤酶活性和土壤微生物数量
有研究表明,土壤酶主要来源于土壤微生物活动分泌、植物根系分泌和植物残体以及土壤动物区系分解[1],土壤微生物与植物根系关系密切。由于覆膜方式不同,马铃薯根系对土壤养分的活化、吸收以及土壤微生物和土壤酶对土壤有机质的分解转换,不同种类的酶与土壤微生物数量表现出不同程度的相关性[10-11],本试验结果也证明土壤微生物总数与土壤酶活性呈显著正相关关系。土壤微生物数量极易受到气候、土壤类型和土壤环境因子的影响[12]。本试验结果表明,起垄和起垄覆膜的栽培方式均能增加土壤中的微生物数量,并且以起垄覆膜的栽培方式为最优。其原因是起垄和起垄覆膜均能在不同程度上减少土壤水分的蒸发,起垄覆膜还可以保护土壤的温度,促进植物根系产生分泌物,刺激了土壤微生物的生长和繁殖,进而提高了土壤酶的活性。
4.2 不同覆膜栽培方式的马铃薯产量
产量是农业生产中最重要的数值,直接关系到产区的经济效益。通过本试验可以看出,单垄双行全覆膜栽培方式的产量最优,其原因是试验当地气候干燥,年降水量少,年蒸发量巨大,通过全覆膜的栽培方式,可以抑制土壤水分的蒸发,在播种期有效的达到保墒的作用。并且在各生育期尽可能的减少土壤中的水分流失,维持土壤温度,为马铃薯田土壤微生物、土壤酶提供适宜的环境,有效的促进了土壤中营养物质的循环,从而达到增产的最终目的。
5 结 论
针对试验地宁夏回族自治区中卫市海原县树台乡当地年降水量少,年蒸发量巨大,年均气温较低等气候特点,推荐采用单垄双行全覆膜垄上种植的栽培方式作为当地种植马铃薯的首选模式。
参考文献:
[1]刘善江,夏 雪,陈桂梅.土壤酶的研究进展[J].中国农业学报,2011,27(21):1-7.
[2]Kennedy A C, Smith K L. Soil microbial diversity and the sustainability of agricultural soils[J].Plant and Soil,1995,170:75-86.
[3]臧逸飞.长期不同轮作施肥土壤微生物学特性研究及生物肥力评价[D].西北农林科技大学,2016.
[4]汪 帆,林德喜,袁照年,等. 袋控施肥对甘蔗地土壤养分含量和酶活性的影响[J].江苏农业学报,2016,32(2):325-330.
[5]杨金娟. 不同陪肥方式对中部干旱区马铃薯植株及土壤质量的影响[D].宁夏大学,2013.
[6]周礼恺. 土壤酶学[M].北京:科学出版社,1987:112-123.
[7]沈 萍,范秀荣,李广武. 微生物学实验[M].北京:高等教育出版社,1999:49-95.
[8]吴际友,叶道碧,王旭军. 长沙市城郊森林土壤酶活性及其与土壤理化性质的相关性[J].东北林业大学学报,2010,38(3):97-99.
[9]姚 拓,马丽萍,张德罡. 我国草地土壤微生物生态研究进展及浅评[J].草业科学,2005,22(11):1-6.
[10]曹 莉,秦舒浩,张俊莲,等.垄沟覆膜栽培方式对马铃薯土壤酶活性及土壤微生物数量的影响[J].甘肃农业大学学报,2012,47(3):42-46.
[11]李旺霞,陈彦云,陈科元,等.不同覆膜栽培对马铃薯土壤酶活性和土壤微生物的影响[J].西南农业学报,2015,28(5):2154-2157.
[12]张 地,张育新,曲来叶,等. 坡位对东灵山辽东栎林土壤微生物数量的影响[J].生态学报,2012,32(20):6412-6421.
