3株甘薯干腐病菌的生物学特性研究
2018-04-16杨冬静谢逸萍孙厚俊张成玲
杨冬静,谢逸萍,孙厚俊,徐 振,张成玲
(江苏徐淮地区徐州农业科学研究所/农业部 甘薯生物学与遗传育种重点实验室,江苏 徐州 221131)
我国是世界上最大的甘薯生产国,每年种植面积约500万hm2,年产量约 1.1万t,约占世界甘薯产量的82.2 %。甘薯干腐病(Dry rot of sweet potato)是甘薯贮藏期重要病害之一,在江苏、山东、浙江等省发生非常普遍,该病发生严重时可导致全窖发病,造成重大的经济损失。引起甘薯干腐病的病原菌有两类:一类是镰刀菌属的串珠镰刀菌[Fusariummoniliforme(Sheldon.) Snyd. & Hans.]、尖镰刀菌[Fusariumoxysporum(Schlecht.) Snyd. & Hans.]以及腐皮镰刀菌[Fusariumsolani(Sacc.) Mart.]等;另一类是子囊菌亚门间座壳属的甘薯间座壳菌。这两类病原菌引起的甘薯干腐病的症状有所差异。系统地研究甘薯干腐病病原菌的生物学特性可为该病害的防治提供理论依据[1]。镰刀菌属的病菌可引起多种作物发生多种病害,已经引起了世界各国植保专家的密切关注;而我国关于镰刀菌属病原菌生物学特性的报道也很多,如朱迎迎等(2016)[2]对引起火龙果果腐病的单层镰刀菌进行了分子鉴定并对其进行了生物学特性研究;杨焕青等(2008)[3]研究发现PSA是引起草莓枯萎病的尖孢镰刀菌草莓专化型菌株菌丝生长和产孢的最佳培养基,并测定了该菌株对几种杀菌剂的敏感性;郑肖兰等(2006)[4]研究发现引起西瓜枯萎病的尖孢镰刀菌西瓜专化型菌株的最佳生长和产孢培养基为PDA,并发现烯唑醇对该菌株的毒力最强;康迅等(2017)[5]报道了辣木枝枯病的病原菌木贼镰刀菌的生物学特性;李健等(2016)[6]研究发现杂草马唐的生防菌厚垣孢镰刀菌ZC201301的最适产孢培养基为马唐汁液培养基。迄今国内外有关甘薯干腐病的研究报道较少,对甘薯干腐病病原菌进行系统的生物学特性研究未见报道。本课题组前期分离到3株甘薯干腐病菌并经科赫式法则验证。本文对这3株甘薯干腐病菌进行了系统的生物学特性研究,以期为甘薯干腐病的综合防控提供理论依据。
1 材料与方法
1.1 供试菌株
本课题组从江苏徐州甘薯研究中心甘薯贮藏库中采集甘薯干腐病薯块,采用组织分离法和单孢分离法分离得到3株甘薯干腐病病原菌并经科赫式法则验证,这3株干腐病菌分别被命名为GF1Y、GF2Y和GF3Y。将分离纯化得到的这3株甘薯干腐病菌保存于4 ℃冰箱中。
1.2 菌丝及孢子形态特征
将活化好的GF1Y、GF2Y和GF3Y菌株接种到PDA培养基平板上,于25 ℃恒温培养5 d,观察菌丝生长,并采用倒置显微镜观察各菌株产生孢子的形态。
1.3 甘薯干腐病菌生物学特性的研究
1.3.1pH值对菌丝生长、产孢及产色素的影响用0.1 mol/L HCl和0.1 mol/L NaOH调节PDA培养基的pH值,制备成pH值分别为5、6、7、...、12等8个梯度的平板各9个;打取3个供试菌株的菌碟,每个菌株每个梯度pH值的平板接种3个;将接种好的平板倒置于25 ℃生化培养箱中培养,6 d后采用十字交叉法测量菌落直径,并用5 mL无菌水洗涤孢子,采用血球计数板测定产孢量。
1.3.2光照对菌丝生长、产孢及产色素的影响接种各菌株菌碟到PDA平板中,分别置于完全光照、完全黑暗和12 h光照12 h黑暗光暗交替条件下,每个处理3个重复,其他培养和测量方法同1.3.1。
1.3.3碳源对菌丝生长、产孢及产色素的影响以査氏培养基为基础培养基[7],以等量的山梨醇、麦芽糖、葡萄糖、蔗糖、可溶性淀粉和D-木糖等制备成6种不同碳源的培养基,分别命名为C1~C6,以不添加碳源的培养基C0作为对照,其他接种、检测和培养方法同1.3.1。
1.3.4氮源对菌丝生长、产孢及产色素的影响以査氏培养基为基础培养基,分别加入等量的牛肉膏、蛋白胨、甘氨酸、L-苯丙氨酸、氯化铵和尿素等,制备成6种不同氮源的培养基,分别命名为N1~N6,以不添加氮源的培养基N0作为对照,其他接种、检测和培养方法同1.3.1。
1.3.5菌丝和孢子致死温度的测定设置42、45、48、50、52、55、58、60 ℃共8个温度梯度,在无菌条件下将6 mm菌丝块和孢子悬浮液分别置入装有5 mL无菌水的试管中,塞好棉塞,水浴10 min,然后将热处理后的菌丝块移入PDA平板中,于25 ℃下恒温培养,每处理设3个重复,根据菌落形成与否,确定致死温度及相应的时间。
2 结果与分析
2.1 3株甘薯干腐病菌的菌丝及孢子形态
将25 ℃下培养5 d的GF1Y、GF2Y和GF3Y这3个菌株的PDA平板取出观察,发现3个菌株的菌丝浓密程度和产色素颜色均有差异,其中GF1Y和GF2Y的菌丝较为浓密,而GF3Y的菌丝非常浓密;从菌丝生长速度来看,GF1Y生长最快,GF2Y其次,GF3Y生长速度最慢;从产色素来看,GF1Y产生淡紫色的色素,GF2Y产生紫色的色素,而GF3Y产生淡淡的黄色。在显微镜下观察各菌株的孢子形态,发现3个菌株均产生大型镰刀状分生孢子和小型分生孢子,大型分生孢子具有3~5个隔,小型分生孢子椭圆形或卵形,具有0~1个隔,初步判断这3个菌株均为镰刀属病菌。
2.2 不同培养条件对甘薯干腐病菌菌丝生长及产色素的影响
2.2.1pH值对菌丝生长及产色素的影响不同pH值对3株干腐病菌菌丝生长影响的结果如图1所示。由图1可以看出:GF1Y在pH值9~12下生长速度较快,平均菌落直径在7.30~8.00 cm;在pH值5~9条件下平均菌落直径在6.63~7.30 cm;在pH值10~12下的菌落直径与pH值5~8下的呈极显著水平差异,说明在pH值10~12下GF1Y的菌丝生长速度最快。GF2Y的菌丝生长速度总体来看也是随pH值的增加而增加,在pH值12条件下菌落平均直径最大,为7.27 cm;在pH值5~9条件下平均菌落直径较小。GF3Y在pH值5~12条件下的平均菌落直径在5.53~5.90 cm,说明该菌株在pH值5~12条件下均能较好地生长。因此,这3个菌株在不同酸碱度条件下均能较好地生长,但GF1Y和GF2Y在碱性较强的环境下菌丝生长速度更快,而GF3Y对酸碱度不敏感。

不同小写、大写字母分别表示在5%和 1%水平下差异显著。下同。图1 不同pH值对干腐病菌菌丝生长的影响
3个菌株在不同酸碱度条件下菌丝致密程度如图2上部所示。从该图可见:GF1Y在pH值5~9条件下菌丝致密,但是在pH值10~12条件下尽管菌落
直径变长,但是菌丝变得稀疏;GF2Y的菌丝致密程度变化规律与GF1Y基本相同;而GF3Y在pH值5~12条件下菌丝都非常致密,但是在pH值10~12条件下可见到菌落中呈现絮状菌丝。3个菌株在不同酸碱度条件下产色素情况如图2下部所示,从图中可见GF1Y在pH值5~7之间可产生淡紫色色素,但随着碱性增强,该菌株产色素的能力降低,从平板背面几乎看不到色素;GF2Y在pH值7~9之间可产生紫色色素,而在酸性和pH值10条件下该菌株产色素的能力增强,从平板背面可观察到深紫色色素;GF3Y在pH值5条件下可见浅红色色素产生,而随着pH值增加,未见明显色素产生。尽管在pH值11和12的条件下,由于制作的平板自身颜色变深,肉眼已无法观察出色素产生能力,但是从pH值5~10下的色素产生情况来看,在酸性条件下这3个菌株的产色素能力均变强。

图2 不同pH值对干腐病菌菌丝生长及产色素的影响
2.2.2光照对菌丝生长及产色素的影响光暗条件对菌落直径的影响如图3所示,从该图可以看出:3个菌株在完全光照条件下的菌落直径均低于光暗交替和完全黑暗条件下的,但是GF1Y和GF2Y在光暗条件下的平均菌落直径并无显著性差异,说明这两个菌株对光照不敏感;GF3Y在光暗交替条件下的菌落直径为6.53 cm,与黑暗条件下的菌落直径6.00 cm呈极显著水平差异,而在完全光照条件下该菌株的菌落直径为5.27 cm,又与黑暗条件下的菌落直径呈极显著水平差异,说明GF3Y对光照比较敏感。
从菌丝致密程度来看,在光照条件下GF1Y的菌丝比完全黑暗和光暗交替条件下显得更为致密,而GF2Y和GF3Y的菌丝致密程度变化不明显。从产色素方面分析,GF1Y在光暗交替条件下呈现淡淡的紫色,而在完全光照和完全黑暗的条件下未见明显色素产生;GF2Y在光暗交替条件下呈现紫色,而在完全光照和完全黑暗的条件下颜色更深,平板背面已呈深紫色;GF3Y在光暗交替和完全黑暗条件下平板背面呈现浅黄色,而在完全光照的条件下产生的色素更少(图4)。
2.2.3碳源对菌丝生长及产色素的影响以查式培养基为基础培养基,分别添加山梨醇、麦芽糖、葡萄糖、蔗糖、可溶性淀粉和D-木糖等6种不同碳源,培养结果如图5所示。GF1Y在以可溶性淀粉为碳源的培养基中菌落直径最大,达8.13 cm;在以蔗糖为碳源的培养基中菌落直径最小,只有6.83 cm,且与其他几种碳源和不加碳源条件下的菌落直径呈极显著差异;而在其他的碳源和不加碳源条件下得到的菌落直径均无显著性差异,说明GF1Y菌株的菌丝生长可不依赖碳源。在不添加碳源的条件下,GF2Y的菌落直径为6.37 cm,与其他6种添加碳源条件下的菌落直径呈极显著水平差异,其中GF2Y对蔗糖的利用又是最佳的,其菌落直径达到7.10 cm,与其他5种碳源下
的菌落直径呈极显著水平差异。菌株GF3Y的生长也不依赖碳源,其在未添加碳源的条件下菌落直径最大,为5.6 cm,且与山梨醇和可溶性淀粉为碳源条件下的菌落直径无显著性差异;而该菌株对麦芽糖、葡萄糖和D-木糖的利用较差。

图3 不同光照条件对干腐病菌菌丝生长的影响

图4 光暗处理对干腐病菌菌丝生长及产色素的影响

图5 不同碳源对干腐病菌菌丝生长的影响
在不添加碳源条件下,尽管3个菌株的菌丝生长都较快,但是从图6可以明显看出,这3个菌株的菌丝都非常稀薄;其次,在以山梨醇为碳源的培养基中3个菌株的菌丝也较为稀薄。
从产色素情况来看,PDA平板培养的GF1Y可产生淡紫色色素,而以查式培养基为基础培养基、以6种不同碳源制备的培养基中培养得到的菌落完全不产生淡紫色色素,仅麦芽糖和D-木糖条件下平板背面呈现淡黄色;GF2Y也完全不呈现原来在PDA平板中的紫色,仅在麦芽糖、葡萄糖和D-木糖条件下平板背面呈现淡黄色;GF3Y也是在麦芽糖和D-木糖条件下平板背面呈现淡黄色,在其他几种碳源条件下几乎不产生色素。
2.2.4氮源对菌丝生长及产色素的影响 以查式培养基为基础培养基,分别添加牛肉膏、蛋白胨、甘氨酸、L-苯丙氨酸、氯化铵和尿素等6种不同氮源,菌丝生长速度如图7所示。在不添加任何氮源的条件下GF1Y的菌落直径可达8.10 cm,与以牛肉膏为氮源条件下的菌落直径8.20 cm无显著差异;其次GF1Y对蛋白胨和L-苯丙氨酸的利用较好,菌落直径分别为7.20 cm和7.37 cm;但是该菌株对甘氨酸和尿素的利用较差,对氯化铵的利用最差,其菌落直径仅为4.07 cm,与其他各种氮源条件下的菌落直径呈极显著差异。GF2Y和GF3Y对氮源的利用规律与GF1Y相似。总体来看,3个菌株在无氮源条件下均能生长,说明它们的生长不依赖氮源,但是对不同氮源的利用又有所差异,其中3个菌株对氯化铵的利用均最差。

图6 不同碳源对干腐病菌菌丝生长及产色素的影响
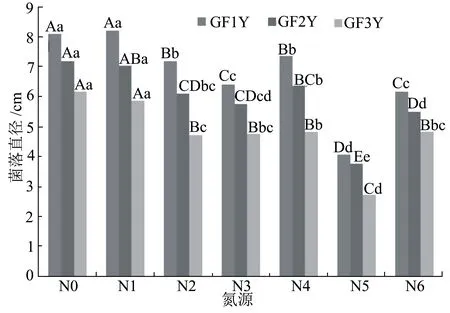
图7 不同氮源对干腐病菌菌丝生长的影响
从图8可以看到:尽管3个菌株在不添加氮源的条件下菌丝生长速度均很快,但是菌丝都非常稀薄;在以牛肉膏为氮源的条件下菌丝也比较稀薄;在以氯化铵为氮源的条件下菌丝非常致密。GF1Y在以牛肉膏为氮源的条件下平板背面呈现淡淡的紫色,而在其他氮源条件下均未见明显色素产生;GF2Y在以蛋白胨为氮源的培养基中呈现紫色,在以牛肉膏为氮源的培养基中呈现深紫色,在以L-苯丙氨酸为氮源的培养基中呈现浅紫色,在以氯化铵为氮源的培养基中呈现紫红色,在其他氮源条件下基本不产生色素;GF3Y在以L-苯丙氨酸为氮源的培养基中呈现浅红色,在以氯化铵为氮源的培养基中呈现红色,在其他氮源条件下基本不产生色素。该结果说明氮源不仅影响各菌株的菌丝生长,还影响其产色素能力。
2.3 不同培养条件对甘薯干腐病菌产孢的影响
2.3.1pH值对病菌产孢的影响从表1可知,pH值对3个菌株的产孢量有一定的影响。对于GF1Y而言,该菌株在各个pH条件下的产孢量均较小,其中pH值为6和7时产孢量相对较高,分别为22.68×106CFU/mL和14.68×106CFU/mL,与其他各个pH条件下的产孢量呈极显著差异;GF2Y的产孢量相对较高,其中pH 9和10条件下该菌株的产孢量分别达到153.2×106CFU/mL和145.2×106CFU/mL,与其他pH条件下的产孢量呈极显著差异;菌株GF3Y的自身产孢量很小,在各pH值条件间未见显著性差异。

图8 不同氮源对干腐病菌菌丝生长及产色素的影响
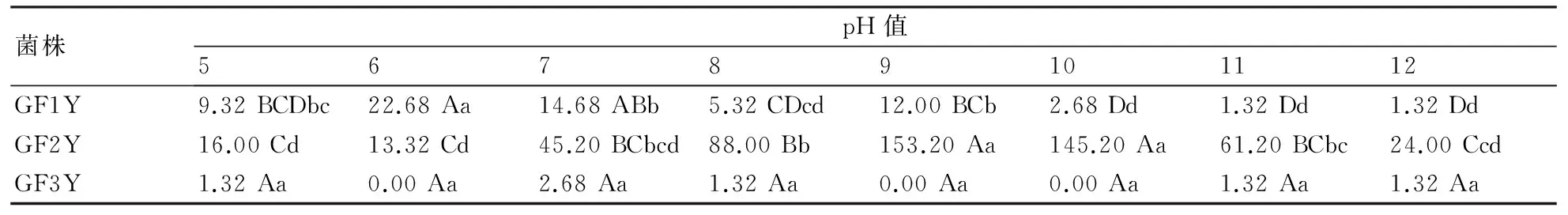
表1 不同pH值条件下甘薯干腐病菌的产孢量 106CFU/mL
2.3.2光照对病菌产孢的影响经不同光照条件处理后在显微镜下观察产孢量,未见菌株GF1Y和GF3Y产孢;对于GF2Y来说,在光照条件下该菌株的产孢量可达61.20×106CFU/mL,与黑暗条件下的产孢量36.00×106CFU/mL呈显著水平差异,而在光暗交替条件下该菌株的产孢量最小,为21.32×106CFU/mL,与完全光照和完全黑暗条件下的产孢量呈极显著水平差异。

表2 不同光照条件下甘薯干腐病菌的产孢量 106CFU/mL
2.3.3碳源对病菌产孢的影响碳源对3个甘薯干腐病菌菌株的产孢量影响如表3所示。从表3可以看到:GF1Y在以D-木糖为碳源条件下产孢量最高,为24.00×106CFU/mL,其次在以蔗糖为碳源条件下产孢量为17.32×106CFU/mL,在以麦芽糖、葡萄糖和可溶性淀粉为碳源条件下产孢量较低,而在以山梨醇为碳源和不添加碳源的情况下,GF1Y未见产孢;GF2Y在以葡萄糖和麦芽糖为碳源条件下产孢量较高,分别为100.00×106CFU/mL和92.00×106CFU/mL,在以蔗糖、可溶性淀粉和D-木糖为碳源的条件下产孢量较低,在以山梨醇为碳源和不添加碳源的情况下几乎不产孢;对于GF3Y菌株,该菌株本身产孢量很小,因此在各种不同碳源条件间其产孢量无显著性差异。
2.3.4氮源对病菌产孢的影响从表4可以看出:在不同氮源条件下GF1Y和GF3Y几乎不产孢;GF2Y在以尿素和L-苯丙氨酸为氮源条件下产孢量较高,分别为77.20×106CFU/mL和72.00×106CFU/mL,极显著高于其他几种氮源条件下的产孢量;GF2Y在以牛肉膏、蛋白胨、甘氨酸和氯化铵为氮源条件下的产孢量较低,而在未添加氮源条件下平均每个血球计数板内仅有1个孢子,产孢量很少。

表3 不同碳源条件下甘薯干腐病菌的产孢量 106CFU/mL

表4 不同氮源条件下甘薯干腐病菌的产孢量 106CFU/mL
2.4 菌丝和孢子的致死温度
GF1Y菌丝经过不同温度水浴处理后回接到PDA平板,经过培养后发现,经58 ℃处理10 min后该菌株无法再产生菌落,因此认为GF1Y的菌丝致死温度为58 ℃,10 min;同样处理和调查发现GF2Y和GF3Y的菌丝致死温度均为60 ℃,10 min。此外,GF1Y的孢子液经过48 ℃处理10 min后该菌株无法再产生菌落,因此认为GF1Y的孢子致死温度为48 ℃,10 min;而GF2Y和GF3Y的孢子致死温度均为50 ℃,10 min。
3 讨论与结论
镰刀菌广泛分布于土壤、空气以及动植物有机体中,虽然有研究认为镰刀菌可作为生防菌株用于杂草防治[6],但大多数镰刀菌与植物病害有关,如Prospero等(2004)报道的香蕉萎蔫病[8]、Díaz Arias等(2013)报道的大豆根腐病[9]、Ivors等(2006)报道的玉米穗腐病[10]、Marasas等(2006)报道的杧果畸形病[11]、陈瑶等(2012)[12]报道的草莓根腐病、孔琼等(2005)报道的香荚兰根腐病[13],以及杨辉辉等(2014)报道的芝麻枯萎病[14]等都是由镰刀菌属病菌引起的,并由此造成了非常重大的经济损失。镰刀菌属病菌在甘薯上还能引起甘薯根腐病[15-16]、褐斑病[17]以及苗床烂苗[18]等病害。
目前关于镰刀菌的生物学特性有较为广泛的报道,但是引起甘薯干腐病的镰刀菌属病菌的生物学特性还未见相关报道。本文系统地研究了3个甘薯干腐病菌菌株的生物学特性,结果表明:GF3Y的菌丝生长速度较慢,而GF1Y和GF2Y的菌丝生长速度较快;GF1Y和GF2Y在碱性较强的环境下菌丝生长速度更快,而菌株GF3Y对酸碱度不敏感;这3个菌株的产色素能力随着酸碱度的变化而变化;光照条件对3个菌株的菌丝生长速度影响不是太大;3个菌株的生长完全不依赖碳源和氮源,但是在缺失碳源和氮源的条件下菌丝极为稀薄;GF1Y和GF3Y的产孢能力较差;GF2Y的产孢能力较强,其在pH 9~10、完全光照、以D-木糖为碳源和以尿素和L-苯丙氨酸为氮源条件下的产孢量最大,在碳源和氮源缺失的条件下该菌株几乎不产孢。由此可见,本研究中3个干腐病菌菌株的菌丝生长、产孢数量和产色素等特性存在较大的差异,且与其他报道的镰刀菌的生物学特性[19-22]也存在一定的差异,由此也表明对甘薯干腐病的防控存在一定的复杂性。下一步我们将对这3个菌株进行高效低毒药剂筛选和防治效果试验,以进一步为该病害的综合防控奠定理论基础。
参考文献:
[1] 郭予元.中国农作物病虫害[M].3版.北京:中国农业出版社,2015:94-95.
[2] 朱迎迎,高兆银,李敏,等.火龙果镰刀菌果腐病病原菌鉴定及生物学特性研究[J].热带作物学报,2016,37(1):164-171.
[3] 杨焕青,王开运,范昆,等.草莓枯萎病菌的生物学特性及7种杀菌剂对其抑制作用[J].植物保护学报,2008,2(35):169-174.
[4] 郑肖兰,崔昌华,冯慧丽,等.尖孢镰刀菌西瓜专化型菌株的生物学特性[J].热带作物学报,2006,1(27):97-100.
[5] 康迅,靳鹏飞,冯霞,等.辣木枝枯病病原菌鉴定及其生物学特性[J].植物保护学报,2017,44(3):481-487.
[6] 李健,李岩,高兴祥,等.马唐生防菌厚垣孢镰刀菌ZC201301的生物学特性研究[J].草业学报,2016,3(25):234-239.
[7] 沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007.
[8] Prospero S, Blank J A, Wtnton L M. Isolation and chracterization of mocrosatellite markers inPhytophthoraramorum, the causal agent of sudden oak death [J]. Molecular Ecology Notes, 2004(4): 672-674.
[9] Díaz Arias M M, Leandro L F, Munkvold G P. Aggressiveness ofFusariumspecies and impact of root infection on growth and yield of soybeans [J]. Phytopathology, 2013, 103(8): 822-832.
[10] Ivors K, Garbelotto M, Vries I D E, et al. Microsatellite markers identify three lineages ofPhytophthoraramorumin US nurseries, yet single lineages in US forest and European nursery populations [J]. Molecular Ecology, 2006, 15: 1493-1505.
[11] Marasas W F O, Ploetz R C, Wingfield M J, et al. Mango malformation disease and the associatedFusariumspecies [J]. Phytopathology, 2006, 96(6): 667-672.
[12] 陈瑶,王树雪,魏艳敏,等.草莓根腐病菌C16-4的分离鉴定及生物学特性研究[J].果树学报,2012,29(4):638-643.
[13] 孔琼,王云月,朱有勇,等.香荚兰尖孢镰刀菌生物学特性[J].西南农业学报,2005,1(18):47-49.
[14] 杨辉辉,王坦,黄思良,等.一株芝麻枯萎病菌的鉴定及其生物学特性[J].中国油料作物学报,2014,36(3):385-392.
[15] 柴一秋,陈利锋,王金生.甘薯根腐病病原菌粗毒素对甘薯生长的影响[J].植物病理学报,2007,37(6):604-609.
[16] 赵永强,孙厚俊,陈晓宇,等.6种生物源杀菌剂对甘薯根腐病菌的室内毒力测定[J].江西农业学报,2011,23(2):115-116.
[17] 张成玲,赵永强,徐振,等.3株不同镰刀菌对甘薯致病性及7种杀菌剂敏感性测定[J].华北农学报,2013,28(增刊2):376-379.
[18] 张成玲,赵永强,谢逸萍,等.甘薯苗床镰刀菌病害分子检测及分析[J].江西农业学报,2017,29(4):58-62.
[19] 高婧,张园园,王凯,等.向日葵枯萎病菌的分离鉴定及其生物学特性[J].中国油料作物学报,2016,38(2):214-222.
[20] 秦涵淳,杨腊英,李松伟,等.培养基营养成分对香蕉枯萎病尖孢镰刀菌生长的影响[J].热带作物学报,2009,12(30):1852-1857.
[21] 王勇,杨秀荣,杨依军,等.茄根腐病致病病原——茄病镰刀菌及其蓝色变种的生物学特性研究[J].天津农学院学报,2002,2(9):21-25.
[22] 潘龙其,张丽,杨成德,等.紫花苜蓿根腐病原菌——拟枝孢镰刀菌的鉴定及其生物学特性研究[J].草业学报,2015,10(24):88-98.
