类固醇生成因子1及细胞角蛋白8在垂体腺瘤中的表达及意义
2018-04-08吴会芳王俊宽冯怡锟杨婉菁胡桂明任景丽
吴会芳 王俊宽 常 佳 顾 斌 冯怡锟 杨婉菁 张 岩 胡桂明 陈 琛 任景丽
1)郑州大学第二附属医院病理科,河南 郑州 450014 2)郑州大学第一附属医院神经外科,河南 郑州 450052
垂体腺瘤是鞍区最常见的肿瘤[1-2],因压迫视神经、激素分泌的增多或减少引起视野缺损或内分泌紊乱等多种症状[3]。部分肿瘤呈侵袭性生长,甚至出现远处转移(垂体癌)[4-6]。正常垂体中,类固醇生成因子1(steroidogenic factor-1,SF1)可以促进垂体促性腺激素细胞的分化,在垂体促性激素细胞胞核中高表达[7]。我们通过免疫组织化学方法,研究SF1和细胞角蛋白8(cytokeratin8,CK8)在垂体腺瘤中的表达,探讨其在垂体腺瘤分类及预后中的意义。
1 资料及方法
1.1病例收集2016—2017年在郑州大学第二附属医院神经外科接受手术治疗的垂体腺瘤49例,其中促性腺激素细胞腺瘤(图1)20例,非促性腺激素细胞腺瘤11例(生长激素细胞腺瘤3例,泌乳激素细胞腺瘤7例,促肾上腺皮质激素细胞腺瘤1例),无激素分泌的腺瘤18例。男21例,女28例;中位年龄52岁。
1.2常规处理手术切除的组织标本,经10%福尔马林固定、石蜡包埋后切片,切片厚度3 μm。
1.3免疫组织化学染色单克隆鼠抗人抗体SF1(克隆号OT110E2,中衫金桥生物技术有限公司,即用型)。单克隆鼠抗人细胞角蛋白8(克隆号TS1,基因科技上海有限公司,1:200)。EnVision二步法染色,以缓冲液代替一抗作阴性对照。免疫组织化学结果判读标准[8]:将染色强度分为阴性(0)、低至中等(1)、强(2);将阳性肿瘤细胞百分比计为0(0%)、0.1(1%~9%)、0.5(10%~49%)和1(50%或以上)。根据两者相乘的结果将染色进行半定量分析(histochemistry score,H-score),分为阴性(0,图2~3)、低表达(0.1~0.5,图4~5)、高表达(1~3,图6~7)3组。正常垂体作阳性对照,肿瘤间质血管内皮细胞作内部阴性对照。SF1核着色[9],CK8胞浆着色(弥漫、点状、核旁、环状等)[10],低表达及高表达均为免疫染色阳性。

图1 促性腺激素细胞腺瘤(HE染色,×200倍) 图2 促性腺激素细胞腺瘤SF1阴性(免疫组织化学染色 EnVision二步法,×200倍)
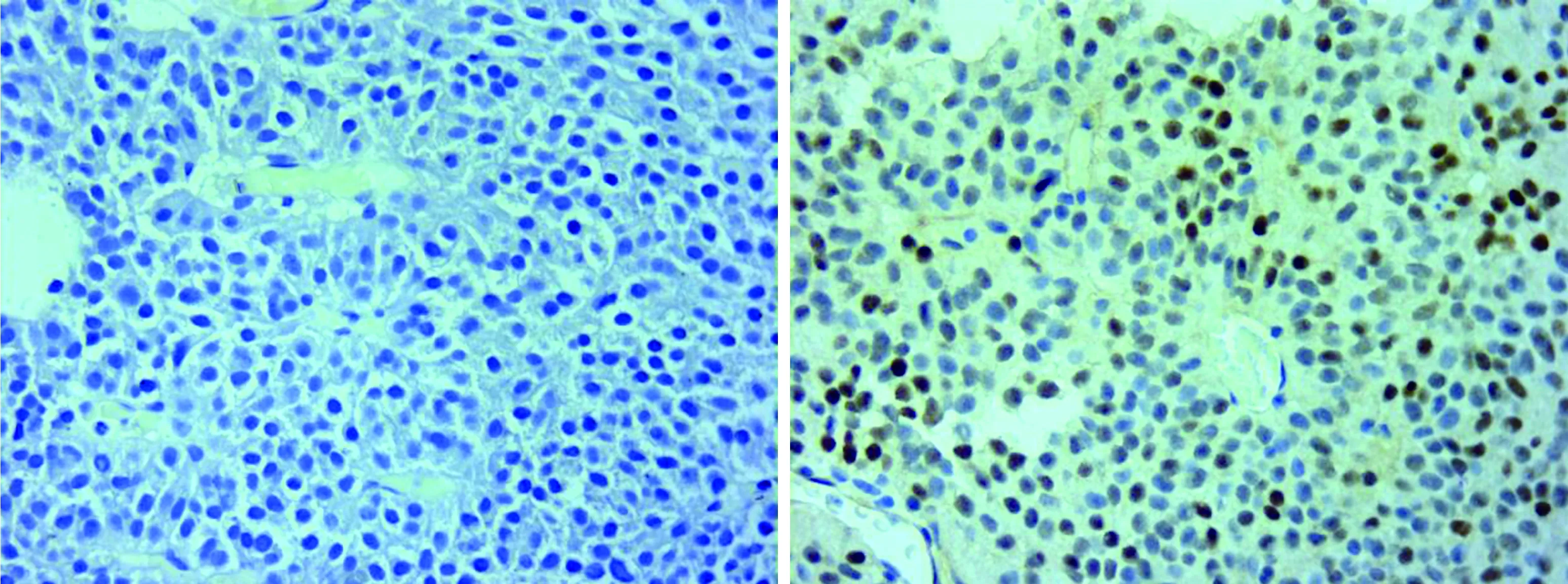
图3 促性腺激素细胞腺瘤CK8阴性(免疫组织化学染色 EnVision二步法,×200倍) 图4 促性腺激素细胞腺瘤SF1低表达(免疫组织化学染色 EnVision二步法,×200倍)

图5 促性腺激素细胞腺瘤CK8低表达(免疫组织化学染色 EnVision二步法,×200倍) 图6 促性腺激素细胞腺瘤SF1高表达(免疫组织化学染色 EnVision二步法,×200倍)
1.4统计学方法采用SPSS 17.0 统计学软件进行分析,计数资料组间比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
SF1在促性腺激素细胞腺瘤中的阳性率(90%,18/20)明显高于其他类型垂体腺瘤(0),差异有统计学意义(P<0.01);SF1在FSH/LH高表达、低表达病例中,均以高表达为主(64%,7/11;67%,6/9),差异无统计学意义(P>0.05);49例垂体腺瘤中,6例出现SF1胞浆棕黄色颗粒状着色(3例生长激素细胞腺瘤,2例无激素分泌的腺瘤,1例促性腺激素细胞腺瘤),见表1、图8;CK8在SF1阳性的垂体腺瘤中的高表达率(21%,5/24)明显低于SF1阴性的垂体腺瘤(92%,23/25),差异有统计学意义(P<0.01),见表2。

图7 促性腺激素细胞腺瘤CK8高表达(免疫组织化学染色 EnVision二步法,×200倍) 图8 生长激素细胞腺瘤SF1胞浆表达(免疫组织化学染色 EnVision二步法,×200倍)

项目n低表达高表达胞浆表达促性腺激素细胞腺瘤(FSH/LH高表达)112(18)7(64)1(9)促性腺激素细胞腺瘤(FSH/LH低表达)93(33)6(67)0非促性腺激素细胞腺瘤 PRL腺瘤7000 GH腺瘤3003(100) ACTH腺瘤1000无激素分泌腺瘤1804(22)2(11)合计495176

表2 CK8在垂体腺瘤中的表达 [n(%)]
3 讨论
SF1是由NR5A1基因编码生成,其对性腺发育及类固醇的生成有重要的调节作用[11-12],表达在垂体促性腺激素细胞、肾上腺皮质、性腺、脾脏、腹内侧下丘脑等部位[13-14]。2017版WHO内分泌肿瘤分类中,对激素(FSH、LH、α-SU、PRL、GH、TSH、ACTH)的免疫组化检测成为垂体腺瘤分类的基础,但FSH/LH的免疫组化经常出现局灶或弱表达[4],使促性腺激素细胞腺瘤的病理诊断出现一定困难。
我们的研究显示,SF1的表达不受FSH/LH表达强弱,甚至不表达的影响,在促性腺激素细胞腺瘤中有极高的敏感性和特异性。有研究显示,无激素分泌的腺瘤占垂体腺瘤的25.6%[15],将SF1用于分类后,可以将FSH、LH弱表达,甚至是不表达的无激素分泌腺瘤进一步分类,为垂体腺瘤的临床管理提供更确切的依据。
近年研究显示,CK8在不同的垂体腺瘤中有不同的表达模式[16-17]。本研究显示,CK8在大部分SF1阳性的腺瘤中为阴性或低表达,而在SF1阴性的腺瘤中为高表达,提示CK8阴性或低表达是促性腺激素细胞腺瘤的分子特征之一,可辅助用于垂体腺瘤的分类。
垂体腺瘤的分类、肿瘤细胞的增生活性与预后有一定的相关性[18-19],但至今仍无可靠指标预测垂体腺瘤的生物学特性[20-21],只能在垂体腺瘤出现转移后才能确诊为垂体癌[4,22-23],延迟了患者的早期治疗。有研究显示,增加SF1剂量可以引起肾上腺皮质细胞增殖和肿瘤[24],其表达与肾上腺皮质癌的预后呈负相关[8,25-26]。本研究发现,SF1的表达程度与FSH/LH的表达与否及表达程度无相关性。有研究显示,NR5A1基因突变可以导致SF1的表达部位由胞核转为胞浆[27]。本研究中出现6例胞浆着色,特别是3例生长激素细胞腺瘤,全部出现胞浆着色。总之,SF1和CK8的免疫组化检测对垂体促性腺激素细胞腺瘤有较高的诊断价值,而SF1与垂体腺瘤预后间的关系及SF1胞浆表达的意义有待进一步研究。
[1]AFLOREI E D,KORBONITS M.Epidemiology and etiopathogenesis of pituitary adenomas[J].J Neuroon-col,2014,117(3):379-394.
[2]KLEINSCHMIDT-DEMASTERS B K.Histological features of pituitary adenomas and sellar region masses[J].Curr Opin Endocrinol Diabetes Obes,2016,23(6):476-484.
[3]刘小海,冯铭,王任直.垂体腺瘤分型的历史、现状及展望[J].中国神经精神疾病杂志,2016,42(9):565-568.
[4]LLOYD R V,OSAMURA R Y,KLÖPPEL G,et al.WHO Classification of Tumours of Endocrine Organs[M].4th ed.IARC:Lyon,2017:14-18.
[5]李松远,王守森.非典型垂体腺瘤诊断标记物的研究与困惑[J].中华神经医学杂志,2017,16(10):1 077-1 080.
[6]赵国强,宋来君,郭付有,等.非典型垂体瘤的临床特点及疗效分析[J].中国实用神经疾病杂志,2015,18(8):43-44.
[7]COHEN L E.Genetic regulation of the embryology of the pituitary gland and somatotrophs[J].Endocrine,2000,12(2):99-106.
[8]SBIERA S,SCHMULL S,ASSIE G,et al.High Diagnostic and Prognostic Value of Steroidogenic Factor-1 Expression in Adrenal Tumors[J].J Clin Endocrinol Metab,2010,95(10):E161-E171.
[9]NISHIOKA H,INOSHITA N,METE O,et al.The Complementary Role of Transcription Factors in the Accurate Diagnosis of Clinically Nonfunctioning Pituitary Adenomas[J].Endocr Pathol,2015,26(4):349-355.
[10]METE O,GOMEZ-HERNANDEZ K,KUCHARCZYK W,et al.Silent subtype 3 pituitary adenomas are not always silent and represent poorly differentiated monomorphous plurihormonal Pit-1 lineage adenomas[J].Mod Pathol,2016,29(2):131-142.
[11]SUNTHARALINGHAM JP,BUONOCORE F,DUNCAN AJ,et al.DAX-1 (NR0B1) and steroidogenic factor-1(SF-1,NR5A1) in human disease[J].Best Pract Res Clin Endocrinol Metab,2015,29(4):607-619.
[12]WERNER R,MÖNIG I,LÜNSTEDT R,et al.New NR5A1 mutations and phenotypic variations of gonadal dysgenesis[J].PLoS One,2017,12(5):e0176720.
[13]OZISIK G,ACHERMANN J C,MEEKS J J,et al.SF1 in the development of the adrenal gland and gonads[J].Horm Res,2003,59(Suppl 1):94-98.
[14]ZHAO L,BAKKE M,KRIMKEVICH Y,et al.Steroidogenic factor 1 (SF1) is essential for pituitary gonadotrope function[J].Development,2001,128(2):147-154.
[15]SAEGER W,LÜDECKE D K,BUCHFELDER M,et al.Pathohistological classification of pituitary tumors:10 years of experience with the German Pituitary Tumor Registry[J].Eur J Endocrinol,2007,156(2):203-216.
[16]GOMEZ-HERNANDEZ K,EZZAT S,ASA S L,et al.Clinical implications of accurate subtyping of pituitary adenomas:perspectives from the treating physician[J].Turk Patoloji Derg,2015,31(suppl 1):4-17.
[17]MCDONALD W C,BANERJI N,MCDONALD K N,et al.Steroidogenic Factor 1,Pit-1,and Adrenocorticotropic Hormone:A Rational Starting Place for the Immunohistochemical Characterization of Pituitary Adenoma[J].Arch Pathol Lab Med,2017,141(1):104-112.
[18]李松远,王守森.非典型垂体腺瘤诊断标记物的研究与困惑[J].中华神经医学杂志,2017,16(10):1 077-1 080.
[19]刘小海,王任直.垂体腺瘤预后的再认识[J].中国神经精神疾病杂志,2017,43(1):1-3.
[20]TORTOSA F,WEBB S M.Atypical pituitary adenomas:10 years of experience in a reference centre in Portugal[J].Neurologia,2016,31(2):97-105.
[21]SAV A,ROTONDO F,SYRO L V,et al.Invasive,atypical and aggressive pituitary adenomas and carcinomas[J].Endocrinol Metab Clin North Am,2015,44(1):99-104.
[22]ASA S L.Practical pituitary pathology:what does the pathologist need to know?[J].Arch Pathol Lab Med,2008,132(8):1 231-1 240.
[23]TUFTON N,RONCAROLI F,HADJIDEMETRIOU I,et al.Pituitary Carcinoma in a Patient with an SDHB Mutation[J].Endocr Pathol,2017,28(4):320-325.
[24]DOGHMAN M,KARPOVA T,RODRIGUES G A,et al.Increased steroidogenic factor-1 dosage triggers adrenocortical cell proliferation and cancer[J].Mol Endocrinol,2007,21(12):2 968-2 987.
[25]武鲁铭,王卫庆.肾上腺皮质癌的分子生物学研究进展[J].中华内分泌代谢杂志,2016,36(1):77-79.
[27]ROBEVSKA G,VAN DEN BERGEN J A,OHNESORG T,et al.Functional characterization of novel NR5A1 variants reveals multiple complex roles in disorders of sex development[J].Hum Mutat,2018,39(1):124-139.
