MicroRNA-210对卵巢癌细胞生长及放射敏感性的影响
2018-03-30钟莉莉赵银龙李炳锦邹晓晗程子倩崔然吉
钟莉莉,赵银龙,李炳锦,邹晓晗,程子倩,崔然吉
(1.吉林大学第二医院研究中心 吉林省重大疾病分子与化学遗传学重点实验室,吉林 长春 130041;2.吉林大学第二医院核医学科,吉林 长春 130041)
卵巢癌是最常见的妇科恶性肿瘤之一,其发病率仅次于子宫颈癌和子宫内膜癌,居妇科恶性肿瘤的第3位,但其病死率却高居妇科肿瘤的首位[1-2]。放射治疗是卵巢癌治疗中常用的一种局部治疗手段,特别是在晚期卵巢癌治疗中起着越来越重要的作用,其机制是通过放射线的电离作用抑制和杀灭肿瘤细胞[3]。但在实际治疗过程中,经常遇到辐射不敏感或辐射抵抗的现象[4],其机制尚不完全明确。
MicroRNA(miRNA)是一组由内源基因编码的长度为20~24个核苷酸的非编码单链RNA分子[5]。近年来研究[6-7]表明: miRNA表达水平与肿瘤的形成、肿瘤细胞的增殖和治疗均有着密切的联系。与其他类型肿瘤一样,卵巢癌miRNA表达也有其特殊的异常,已有研究[8-9]显示:miR-16、 miR-96、 miR-141和miR-200等miRNA在卵巢癌组织中异常高表达, miR-140、miR-145和miR-199a等miRNA在卵巢癌组织中异常低表达,与卵巢癌细胞的发生发展有关;另有研究[10]显示:miR-210与卵巢癌的化疗耐药有关,但miR-210与卵巢癌细胞的生长和放射治疗的关联性目前尚无相关报道。本研究探讨miR-210对卵巢癌细胞生长的影响及其与放射治疗敏感性的关系,并进一步阐明miR-210在卵巢癌发展和治疗中的作用及其可能的分子机制,为卵巢癌的放射治疗提出新的观点,为临床卵巢癌早期诊断、治疗效果预测提供可能的理论依据。
1 材料与方法
1.1细胞株﹑主要试剂与仪器人卵巢癌细胞株OVCAR3和SKOV3购于美国ATCC细胞库。细胞培养用的RPMI-1640培养基﹑胎牛血清、青链霉素抗生素试剂和胰蛋白酶,miR-210 mimic、anti-miR-210抑制剂,Lipofectamine 2000,BCA Protein Assay Kit,TaqMan MicroRNA逆转录试剂盒和Super Singal West Dura发光试剂盒(美国 Invitrogen公司);MTT和DMSO(美国 Amresco公司);一抗和二抗(美国CST公司)。细胞培养箱﹑PCR仪和酶联免疫检测仪(美国Thermo公司),倒置显微镜(日本 Olympus公司),核酸电泳仪和凝胶成像系统(美国Bio-rad公司),细胞照射设备(美国Varian 23Ex医用高能电子直线加速器)。
1.2细胞培养卵巢癌细胞株培养于含10%胎牛血清、100 U·mL-1青霉素和100 mg·L-1链霉素的RPMI-1640培养基中,放置于37℃、5%CO2细胞培养箱中静置培养。倒置显微镜下观察细胞生长融合达80%时,用0.25%胰蛋白酶消化传代(1∶3),用于后续实验。
1.3构建过表达miR-210和低表达miR-210的卵巢癌细胞株采用Lipofectamine 2000转染试剂,根据试剂盒说明书,将miR-210 mimic和anti-miR-210抑制剂分别转染至卵巢癌细胞株。转染48 h后,提取总RNA,用TaqMan MicroRNA逆转录试剂盒合成cDNA,采用Real-time PCR法检测卵巢癌细胞株中miR-210的表达水平。实验以GAPDH作为内部参照。结果计算采用比较阈值法,即目的基因的量=2-ΔΔCt,将Real-time PCR得到的Ct值转化成miRNA的扩增倍数,ΔΔCt=(实验组Ct目的基因-实验组Ct内参基因)-(对照组Ct目的基因-对照组Ct内参基因)。
1.4MTT法检测转染后卵巢癌细胞的生长将处于对数生长期经转染的卵巢癌细胞制成细胞悬液,调整细胞浓度至5×104mL-1。于96孔细胞培养板中每孔加入100 μL细胞悬液,将细胞置于5% CO2、37℃培养箱中孵育。每48 h取3孔细胞,每孔加入10 μL MTT溶液(5 g·L-1),然后继续培养4 h,之后取出细胞,每孔加入150 μL DMSO,将细胞培养板置于摇床上低速振荡10 min,使结晶物充分溶解,在酶联免疫检测仪490 nm处测量各孔的吸光度(A)值,以A值代表卵巢癌细胞的增殖活性。
1.5MTT法检测电离辐射条件下过表达miR-210卵巢癌细胞的生长细胞照射条件:美国Varian 23Ex医用高能电子直线加速器,6 MV X射线照射,照射源到液面距离100 cm,剂量率300 cGy·min-1。将处于对数生长期的过表达miR-210的卵巢癌细胞接种于6孔细胞培养板中。采用不同剂量(30、50和100 Gy)的离子辐射作用于细胞,然后消化处理细胞转种至96孔板,采用MTT法检测经放射处理后的过表达miR-210卵巢癌细胞的增殖活性,操作步骤见1.4。
1.6Western blotting法检测电离辐射条件下过表达miR-210卵巢癌细胞中相关凋亡蛋白表达收集经放射处理后的卵巢癌细胞,加入适量细胞裂解液于冰上静置15 min后,低温下离心,收取上清液,用BCA Protein Assay Kit测定细胞总蛋白浓度。将待电泳的蛋白样品用SDS-PAGE蛋白电泳上样缓冲液混和,于100℃加热5 min。将蛋白样品加样于SDS-PAGE进行电泳分析,然后依次进行转膜,于室温下采用5%脱脂奶粉封闭1 h后,加入一抗于4℃孵育过夜。次日洗膜后加入二抗于室温下孵育1 h。使用Super Singal West Dura发光试剂盒检测目的蛋白的表达,以GAPDH作为内参蛋白,得到的条带采用凝胶成像分析仪进行灰度分析。
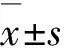
2 结 果
2.1Real-time PCR法鉴定过表达和低表达miR-210卵巢癌细胞模型卵巢癌细胞株OVCAR3和SKOV3转染miR-210 mimic及anti-miR-210抑制剂后,采用Real-time PCR法验证miR-210在OVCAR3和SKOV3细胞中的表达量。结果显示:转染miR-210 mimic后,OVCAR3和SKOV3细胞中miR-210表达水平明显升高,而anti-miR-210抑制剂则抑制了OVCAR3和SKOV3细胞中miR-210的表达(P<0.05)。见表1。
表1转染后卵巢癌细胞中miR-210表达水平


MiRNAOVCAR3ControlMiR⁃210mimicControlAnti⁃miR⁃210inhibitorSKOV3ControlMiR⁃210mimicControlAnti⁃miR⁃210inhibitormiR⁃210580±2023000±501∗575±15200±10∗400±2519000±300∗410±35180±20∗
*P<0.05 compared with control group.
2.2过表达和低表达miR-210卵巢癌细胞增殖活性细胞转染后,MTT法检测肿瘤细胞增殖活性结果显示:增加miR-210表达水平,OVCAR3和SKOV3细胞增殖活性增加(P<0.05);降低miR-210表达水平,OVCAR3和SKOV3细胞增殖活性降低(P<0.05)。见表2。
表2过表达和低表达miR-210卵巢癌细胞的增殖活性


TimeOVCAR3ControlMiR⁃210mimicControlAnti⁃miR⁃210inhibitorSKOV3ControlMiR⁃210mimicControlAnti⁃miR⁃210inhibitorDay10.25±0.090.26±0.08∗0.41±0.110.40±0.11∗0.30±0.090.31±0.08∗0.30±0.100.29±0.10∗Day30.57±0.110.66±0.11∗0.81±0.090.71±0.09∗0.87±0.100.96±0.11∗0.52±0.090.48±0.09∗Day50.90±0.131.75±0.13∗1.52±0.101.21±0.10∗1.26±0.121.65±0.11∗1.20±0.110.91±0.10∗Day71.67±0.142.77±0.13∗2.21±0.101.73±0.11∗1.97±0.112.77±0.11∗1.91±0.111.33±0.11∗
*P<0.05 compared with control group.
2.3电离辐射条件下过表达miR-210卵巢癌细胞的增殖活性MTT检测结果显示:电离辐射条件下miR-210过表达组卵巢癌细胞增殖活性明显高于对照组(P<0.05)。见表3和4。
表3电离辐射照射后过表达miR-210 OVCAR3细胞增殖活性


TimeLowdoseofradiation(30Gy)ControlMiR⁃210mimicMiddledoseofradiation(50Gy)ControlMiR⁃210mimicHighdoseofradiation(100Gy)ControlMiR⁃210mimicDay12.52±0.102.49±0.092.56±0.102.50±0.062.58±0.072.53±0.06Day31.85±0.111.99±0.10∗1.45±0.101.60±0.09∗1.31±0.101.56±0.06∗Day51.09±0.101.53±0.11∗0.88±0.091.22±0.09∗0.65±0.111.08±0.09∗Day70.53±0.111.20±0.10∗0.32±0.110.88±0.09∗0.11±0.110.59±0.10∗
*P<0.05 compared with control group.
表4电离辐射照射后过表达miR-210 SKOV3细胞增殖活性


TimeLowdoseofradiation(30Gy)ControlMiR⁃210mimicMiddledoseofradiation(50Gy)ControlMiR⁃210mimicHighdoseofradiation(100Gy)ControlMiR⁃210mimicDay13.01±0.102.99±0.093.11±0.093.08±0.093.10±0.103.11±0.10Day32.45±0.102.58±0.11∗2.25±0.102.43±0.09∗1.99±0.102.17±0.09∗Day51.63±0.072.09±0.11∗1.45±0.111.88±0.06∗1.11±0.111.57±0.09∗Day70.84±0.111.58±0.10∗0.80±0.121.38±0.12∗0.29±0.110.82±0.11∗
*P<0.05 compared with control group.
2.4电离辐射条件下过表达miR-210卵巢癌细胞中凋亡相关蛋白表达与对照组比较,过表达miR-210的OVCAR3和SKOV3细胞给予50 Gy放射线照射后,2株细胞中BAX表达水平均明显下降,而Bcl-2表达水平均明显升高。见图 1。

Lane 1: Control group; Lane 2: miR-210 group.
图1电离辐射照射后过表达miR-210 OVCAR3(A)和SKOV3(B)细胞中凋亡相关蛋白表达电泳图
Fig.1 Electrophoregram of expressions of apoptosis-related proteins in OVCAR3 and SKOV3 cells overexpressing miR-210 after radiation
3 讨 论
肿瘤的发生与细胞异常增殖、分化及凋亡密切关联。研究[11]显示:一些miRNA与肿瘤的发生、肿瘤细胞的生长和凋亡均有着密切的联系。深入探讨miRNA在肿瘤发生过程中的调控作用及机制,对于人们不断认识和战胜肿瘤具有重要的意义。miRNA与卵巢癌关系的研究也早已展开。miR-141、miR-200a、miR-200b和miR-200c等在卵巢癌中呈高表达,而miR-125b-1﹑miR-140和miR-145等呈低表达。这些不同表达的miRNA提示其在卵巢癌中起着不同的调控作用,同时也具有潜在治疗靶点的意义[12]。随后的研究[13-16]显示:在早期卵巢肿瘤患者和健康人的血液中可检测到一些差异表达的miRNA,并且这些miRNA表达水平与肿瘤的进展呈一定的相关性。这些研究结果进一步提示可通过检测患者血液中的miRNA进行卵巢癌的早期诊断,并可针对差异表达的miRNA制定相应的治疗方案。
miR-210是目前公认的缺氧特异性miRNA,在缺氧环境的细胞中表达明显升高。肿瘤生长的特点是在缺氧和氧化应激之间转变。在乏氧持续刺激下miR-210的表达最突出。提示这可能是癌症细胞在肿瘤发病中的一个原因。以往有研究[17]显示:miR-210可以通过抑制靶基因的转录而调节乳腺肿瘤细胞的生长。最近的研究[18]显示:在卵巢癌组织中miR-210表达水平明显升高,提示miR-210可能与卵巢癌的发生发展有着密切的联系。
近年来,研究[19]显示:miR-210除了参与卵巢癌的发生发展外,还与卵巢癌的化疗耐药有关,miR-210可能通过HOXA9、FGFRL1、EFNA3、VEGF和E2F3等参与其耐药的形成,但目前对于miR-210与卵巢癌放疗相关性的研究相对较少。卵巢癌发病率较高,预后较差,死亡率高居妇科恶性肿瘤首位,其中最重要一个原因为卵巢癌患者在放疗治疗过程中产生抵抗[20]。因此阐明卵巢癌辐射抵抗的确切机制已成为当前医学研究中极其紧迫而重要的研究课题。
基于上述理论和研究结果,本文作者应用细胞转染法制备miR-210过表达及低表达模型,采用Real-time PCR法进行鉴定,通过MTT法检测miR-210对卵巢癌生长的影响,结果显示:miR-210过表达有明显的促进卵巢癌生长作用。为了验证其与放疗的敏感性,本文作者设置低﹑中和高3个辐射剂量组,对过表达miR-210卵巢癌细胞进行照射,结果显示:过表达miR-210细胞组细胞对辐射存在一定的抵抗,这种辐射抵抗也许与miR-210表达异常有关;为了明确其分子机制,本文作者对其凋亡相关蛋白进行了检测,结果显示:凋亡相关蛋白BAX表达下降,而Bcl-2表达升高,提示这种辐射抵抗是通过抑制凋亡实现的。
随着对miR-210的进一步深入研究,本文作者发现miR-210在卵巢癌治疗中确有潜在的作用,有可能成为新的基因治疗途径。但miR-210是否直接或间接参与卵巢癌侵袭、转移和复发尚需进一步研究。
[参考文献]
[1] Kujawa KA, Lisowska KM. Ovarian cancer--from biology to clinic[J].Postepy Hig Med Dosw(Online), 2015, 69: 1275-1290.
[2] Dong X, Men X, Zhang W, et al. Advances in tumor markers of ovarian cancer for early diagnosis[J]. Indian J Cancer, 2014, 51(3): 72-76.
[3] De Felice F, Marchetti C, Di Mino A, et al. Recurrent Ovarian Cancer: The Role of Radiation Therapy[J]. Int J Gynecol Cancer, 2017, 27(4): 690-695.
[4] Liao Q, Zhang HM, Li HH,et al. A preliminary study on the radiation-resistance mechanism in ovarian cancer[J]. J Cancer Res Ther,2013,9(1): 22-24.
[5] Reddy KB. MicroRNA (miRNA) in cancer[J]. Cancer Cell Int, 2015,15:38.
[6] 霍红日,杨智勇,朱玲莉. miRNA-193a在肺腺癌患者体内的表达水平及意义[J]. 国际检验医学杂志,2017, 38(13):1773-1775.
[7] Wu Q, Yang Z, Shi Y, et al. MiRNAs in human cancers: the diagnostic and therapeutic implications[J]. Curr Pharm Des, 2014, 20(33): 5336-5347.
[8] Li Y, Fang Y, Liu Y, et al. MicroRNAs in ovarian function and disorders[J].J Ovarian Res, 2015,8:51.
[9] Zhang S, Lu Z, Unruh AK, et al. Clinically relevant microRNAs in ovarian cancer[J].Mol Cancer Res, 2015,13(3): 393-401.
[10]Liu M, Zhang X, Hu CF, et al. MicroRNA-mRNA functional pairs for cisplatin resistance in ovarian cancer cells[J]. Chin J Cancer, 2014, 33(6): 285-294.
[11]Su Z, Yang Z, Xu Y, et al. MicroRNAs in apoptosis, autophagy and necroptosis[J]. Oncotarget, 2015, 6(11): 8474-8490.
[12]Wang ZH, Xu CJ. Research Progress of MicroRNA in Early Detection of Ovarian Cancer[J]. Chin Med J (Engl), 2015, 128(24): 3363-3370.
[13]Gao YC, Wu J.MicroRNA-200c and microRNA-141 as potential diagnostic and prognostic biomarkers for ovarian cancer[J]. Tumour Biol,2015,36(6): 4843-4850.
[14]Shapira I, Oswald M, Lovecchio J, et al. Circulating biomarkers for detection of ovarian cancer and predicting cancer outcomes[J]. Br J Cancer, 2014, 110(4): 976-983.
[15]Mahdian-Shakib A, Dorostkar R, Tat M, et al. Differential role of microRNAs in prognosis, diagnosis, and therapy of ovarian cancer[J]. Biomed Pharmacother, 2016, 84: 592-600.
[16]Pal MK, Jaiswar SP, Dwivedi VN, et al. MicroRNA: a new and promising potential biomarker for diagnosis and prognosis of ovarian cancer[J]. Cancer Biol Med, 2015, 12(4): 328-341.
[17]Liu D, Xia H, Wang F, et al. MicroRNA-210 interacts with FBXO31 to regulate cancer proliferation cell cycle and migration in human breast cancer[J]. Onco Targets Ther, 2016, 9: 5245-5255.
[18]Li L, Huang K, You Y,et al. Hypoxia-induced miR-210 in epithelial ovarian cancer enhances cancer cell viability via promoting proliferation and inhibiting apoptosis[J]. Int J Oncol, 2014, 44(6) :2111-2120.
[19]张萍,王敏,接智慧,等. miR-210在化疗耐药与化疗敏感卵巢浆液性癌组织中的检测及意义[J]. 中国医科大学学报, 2014, 43(6): 487-492.
[20]Rai B, Bansal A, Patel FD, et al. Radiotherapy for ovarian cancers - redefining the role[J]. Asian Pac J Cancer Prev, 2014, 15(12): 4759-4763.
[21]刘书中,李子全,李政垚,等.外周血miR-21检测在胰腺癌中的意义研究进展[J].中国实验诊断学,2016,20(6):1038-1042.
[22]付霞霏,何援利,王雪峰,等.化疗性卵巢功能早衰动物模型及患者血清miR-21水平的变化[J].解放军医学杂志,2016,41(11):915-918.
