灯盏花素TPGS聚合物胶束在大鼠体内药动力学及药效学评价
2018-03-29李云贵李天平邹柳
李云贵 李天平 邹柳
灯盏花素(breviscapine)又称灯盏细辛,是菊科植物短葶飞蓬的干燥全草,其中主要成分为灯盏花乙素(即野黄芩苷),另含少量灯盏花甲素,其中灯盏花乙素含量达95﹪以上,为灯盏花素的主要有效成分[1]。灯盏花素具有改善心脑微循环、增加血流量、抗氧化、抗炎及拮抗心肌缺血再灌注损伤等药理作用[2~6],其中最显著的作用是保护心脑血管[7]。目前上市的灯盏花素制剂中存在生物利用度低、体内消除迅速、半衰期短等缺点。本研究以实验室自制灯盏花素TPGS聚合物胶束(Bre/TPGS)为研究对象,采用高效液相色谱法测定灯盏花素TPGS聚合物胶束在大鼠体内的血药浓度变化过程,用3P97药动学软件对血药浓度进行分析并计算其药动学参数[8~13];同时采用灯盏花素TPGS聚合物胶束对FeCl3诱导大鼠颈动脉血栓溶解作用进行研究。
1 材料与方法
1.1 实验动物 SPF级SD大鼠32只,体质量200~250g,雌雄各半,南华大学实验动物中心提供,生产许可证号:SCXK(湘)2015-0002。
1.2 药品与试剂 灯盏花素原料药(批号:HB20121102,湖南恒生制药有限公司);灯盏花素胶束(实验室自制,批号:20170305);灯盏花素粉针剂(批号:15150504,湖南恒生制药有限公司);芦丁(批号:201610,中国药品生物制品检验所);肝素钠(规格:2ml∶1.25万U,批号:20161120);灯盏花乙素标准品(中国药品生物制品检验所);其他试剂均为分析纯。
1.3 实验仪器 1260型高效液相色谱仪(美国Agilent Technologies);Y-1型涡旋振荡器(大龙兴创实验仪器有限公司);pH计(上海梅特勒-托利多仪器有限公司);5810R高速冷冻离心机(德国Eppendorf 公司);SY-1220恒温水浴槽(美国精琪公司);移液枪(德国Eppendorf公司)。
1.4 建立HPLC测定体内分析
1.4.1 色谱条件 色谱柱:月旭 C18柱(250mm×4.6 mm,5μm);流动相:乙腈-0.1﹪ 磷酸水,pH 3.0(27:73,v/v);流速:0.7ml/min;UV 检测波长:335nm;柱温:30℃;进样量:20μl。
1.4.2 血浆样品的预处理 精密吸取100μl大鼠血浆样品,加入20μl芦丁内标液(100μg/ml),涡旋混和,加 入 20μl磷 酸(1mol/L),20μl EDTA-2Na(2g/L),0.5ml甲醇,涡旋混和5min,离心5min(10 000r/min),分离上清液于另一只1.5ml EP离心管中,下层沉淀再加入0.5ml甲醇,涡旋混和5min,离心5min(10 000r/min),分离上清液,合并两次上清液,置于37℃水浴氮气吹干,残留物加入100μl甲醇溶解并混匀,0.22μm微孔滤膜过滤,取20μl样品进行HPLC检测。
1.4.3 方法专属性考察 空白血浆样品:采用移液枪吸取100μl大鼠空白血浆,按1.4.2项方法处理样品,其中不加芦丁内标液。灯盏花乙素空白血浆样品:采用移液枪吸取100μl大鼠空白血浆,加一定浓度的灯盏花乙素标准溶液,按1.4.2项方法处理样品,其中不加芦丁内标液。给药后的血浆样品加内标芦丁:采用移液枪吸取100μl给药后的血浆样品,按1.4.2项方法处理样品。
1.4.4 标准曲线的建立 采用移液枪吸取数份100 μl大鼠空白血浆,加入20μl不同浓度的灯盏花乙素标准储备液,配制成灯盏花乙素浓度分别为 0.05、0.1、0.5、1、5、10、20、30、40μg/ml的血浆样品,每一浓度配制3份样品,按1.4.2项方法处理样品,以药物浓度(C)为横坐标,以灯盏花乙素与芦丁内标峰面积比(As/Ai)为纵坐标,进行线性回归,绘制标准曲线。
1.4.5 回收率试验
1.4.5.1 方法回收率 采用移液枪吸取3份大鼠空白血浆各100μl,加入一定量的灯盏花乙素标准品溶液,分别制成低(0.1μg/ml)、中(5μg/ml)、高(30μg/ml)3种不同浓度的灯盏花素血浆样品,每一浓度设置3个平行组,按1.4.2 项方法处理样品,根据 1.4.4 所得标准曲线计算实际药物浓度,可得出其方法回收率,即实际浓度/理论浓度×100﹪。
1.4.5.2 提取回收率 精密吸取3份大鼠空白血浆各100μl,加入一定量的灯盏花乙素标准品溶液,分别制成低(0.1μg/ml)、中(5μg/ml)、高(30μg/ml)3 种不同浓度的灯盏花素血浆样品,每一浓度设置3个平行组,按1.4.2 项方法处理样品,测定灯盏花素峰面积(A1);分别配制低(0.1μg/ml)、中(5μg/ml)、高(30μg/ml)3种不同浓度的灯盏花乙素标准品溶液,HPLC测定峰面积(A2),可得出其提取回收率,即A1/A2×100﹪。
1.4.6 精密度实验 分别配制低、中、高3种不同浓度的灯盏花乙素血浆样品,每一浓度设置3个平行组,按1.4.2项方法处理样品。以一天中测5次,观察其日内精密度,计算RSD。同法,用上述样品每天测定1次,连续测定3 d,观察其日间精密度,计算RSD。
1.4.7 血浆样品的稳定性 制备多份浓度为30.0μg/ml的灯盏花素血浆样品,分为两组,一组用磷酸(1mol/L)调pH至3.0左右,另一组不加磷酸调 pH。每一组又分成两小组,样品分别保存在室温和-20℃冰箱中,在安排的时间点取出样品,按1.4.2项方法处理样品,测定样品中灯盏花乙素含量。
1.5 尾静脉注射药物体内动力学研究
1.5.1 给药方案与样品采集 取SD 大鼠 12只,雌雄各半,体质量200~250g。随机分为两组,给药前禁食12h,自由饮水。分别尾静脉注射灯盏花素粉针剂(对照组)以及Bre/TPGS(Bre/TPGS组),给药剂量均为10mg/kg(以灯盏花素溶度计算),于给药后3min、10min、30min、45min、1h、2h、3h、4h、5h、6h、12h、24h和48h,经大鼠眼眶静脉丛取血约0.5ml,放入预先加肝素钠抗凝的1.5ml EP中,以4 000r/min离心10min,离心后马上取上层血浆,放到-20℃冰箱保存备用,按1.4.2项方法进行处理测定。
1.5.2 数据处理 绘制Bre/TPGS的血药浓度-时间曲线,采用3P97药代动力学软件,计算药动学参数。
1.6 尾静脉注射药物体内药效学研究
1.6.1 大鼠尾静脉注射给药 大鼠在自然光条件下于温度(25±2)℃、相对湿度(75±5)﹪环境中饲养1周后,随机分为5组,每组4 只,雌雄各半。实验分组:①模型组(n=4):给生理盐水1ml/100g;②市售灯盏花素粉针剂组:给市售药1ml/100g(相当于灯盏花素1 mg/kg);③低剂量胶束组:给胶束药1ml/100g (相当于灯盏花素0.5mg/kg);④中剂量胶束组:给胶束药1ml/100g(相当于灯盏花素1mg/kg);⑤高剂量胶束组:给胶束药1ml/100g (相当于灯盏花素2mg/kg)。
1.6.2 用35﹪FeCl3建立颈动脉血栓模型 5组大鼠于造模前12h禁食不禁水,1﹪戊巴比妥钠麻醉(5 ml/kg),分离大鼠左侧颈总动脉2cm,其下放置塑料薄膜(4cm×2cm),其目的是保护血管周围组织,将吸有35﹪FeCl3溶液的小片滤纸(1cm×1cm)敷于右侧颈总动脉上,30min后去除纸片,生理盐水清洗后缝合伤口。待大鼠清醒后连续尾静脉注射给药3d,再将大鼠麻醉,取出左侧血栓,并在右侧取与血栓相同长度的一段正常血管,放于甲醇溶液中固定,于60℃烤箱烘干2h,以电子分析天平秤其血栓的重量,计算给药组的溶栓率。血栓重量=血栓与血管壁的总重量-同样长度血管壁重量。溶栓率=(模型组血栓重量-药物组血栓重量) / 模型组血栓重量×100﹪。
1.7 统计学分析 应用SPSS 16.0统计学软件进行分析,显著性检验采用组间t或χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 方法专属性 按1.4.2项方法处理各样品,结果见图1~3。在此色谱条件下,灯盏花素的出峰时间约6.8min,且与其他杂质峰分离度大于1.5,内源性物质无干扰。表明在该条件下,血浆中内源性物质不会影响灯盏花素的检测,其方法符合体内药物含量测定要求。
图1 大鼠空白血浆样品HPLC图
图2 灯盏花素空白血浆HPLC图
图3 给药后血浆+芦丁的HPLC图
2.2 血浆样品标准曲线 按1.4.2项方法处理,配置一系列浓度的样品,测定其灯盏花乙素峰面积(As)与芦丁内标峰面积(Ai),计算 As/Ai,各浓度样品数据结果为 0.151、0.163、0.254、0.386、1.426、2.824、4.502、7.274、9.071,标准曲线绘制图见图4。其标准曲线的线性回归方程式为y=0.2282x+0.1401,R2=0.9956。结果表明,灯盏花素浓度在0.05~40μg/ml范围内峰面积线性关系良好,满足测定要求。
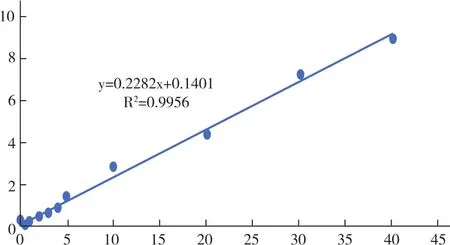
图4 灯盏花素在大鼠血浆中标准曲线
2.3 回收率实验 灯盏花素血浆中方法回收率和提取回收率实验结果见表1,回收率满足生物样品的分析测定要求。

表1 灯盏花素提取回收率和方法回收率(﹪)
2.4 精密度实验 灯盏花素血浆中日内与日间精密度实验结果见表2。样品精密度良好,RSD<15﹪,满足生物样品的分析测定要求。
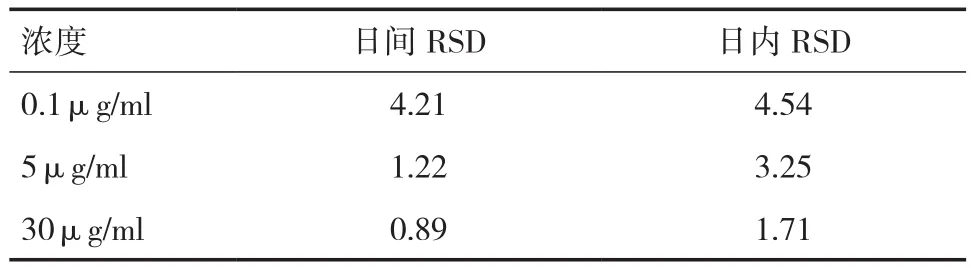
表2 灯盏花素日间、日内精密度测定结果(﹪)
2.5 稳定性实验 血浆样品的稳定性结果见表3、4。结果表明,当血浆样品用磷酸调节pH 至3.0时,其在-20℃条件下与室温下样品的稳定性均较好。未用磷酸调节的血浆样品在室温下不稳定,降解比较快。血浆样品在-20℃条件下,磷酸调节pH与未调节pH稳定性无明显差异。考虑血浆样品需要长时间存放,并且需要在室温下解冻,所以样品用磷酸调节 pH 后再冷冻保存更好。
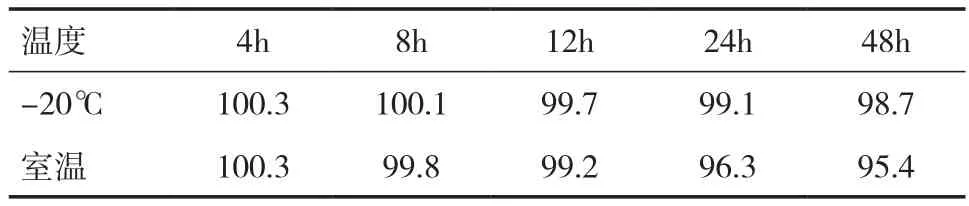
表3 磷酸调节的灯盏花素血浆样品稳定性(﹪)
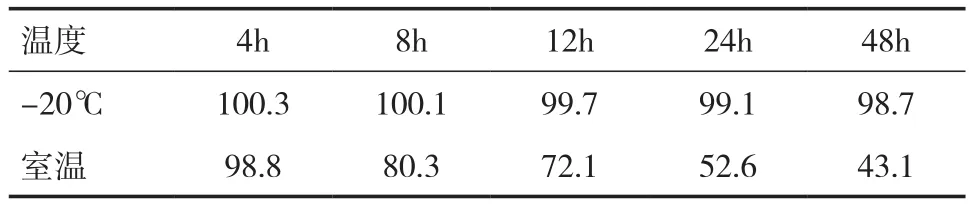
表4 未用磷酸调节的灯盏花素血浆样品稳定性(﹪)
2.6 大鼠尾静脉注射给药后血药浓度 尾静脉注射市售灯盏花素粉针剂与Bre/TPGS后,HPLC法测定血浆样品浓度,绘制血药浓度-时间曲线见图5。市售灯盏花素粉针剂组药物在大鼠体内4h已经检测不到灯盏花乙素,而Bre/TPGS在24h还能检测到药物,Bre/TPGS能明显改善其体内药动学行为。从表5中可知,在同等给药剂量下,市售灯盏花素粉针剂组和 Bre/TPGS 组的 T1/2、AUC0-t、MRT0-t均存在显著性差异(P<0.05)。

图5 大鼠血浆中灯盏花素浓度-时间曲线图注:A为注射后24h;B为注射后4h;n=6
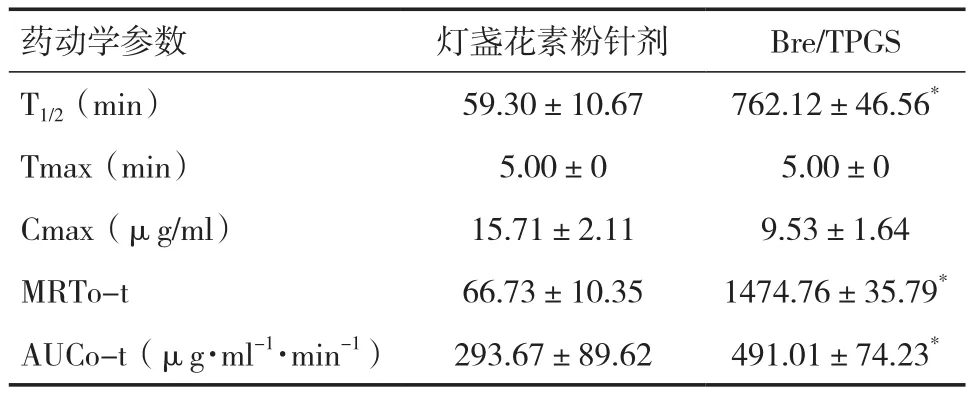
表5 尾静脉注射给药后大鼠体内药动学参数
2.7 大鼠尾静脉注射给药后血栓疗效 各药物组血栓实验数据结果见表6,结果表明,与模型组相比,各药物组血栓重量都有不同程度的减少,差异有统计学意义(P<0.05);且低、中、高剂量胶束组溶栓作用呈浓度依赖性。中、高剂量胶束组与灯盏花素粉针剂组相比较,胶束组血栓重量明显减少,血栓溶栓率也明显增高,差异有统计学意义(P<0.05)。灯盏花素粉针剂组及低剂量胶束组血栓干重下降,但两者比较无显著性差异(P>0.05)。表明将灯盏花素制成聚合物胶束可提高药物的溶栓作用。
表6 不同组血栓的比较(±s,n=4)
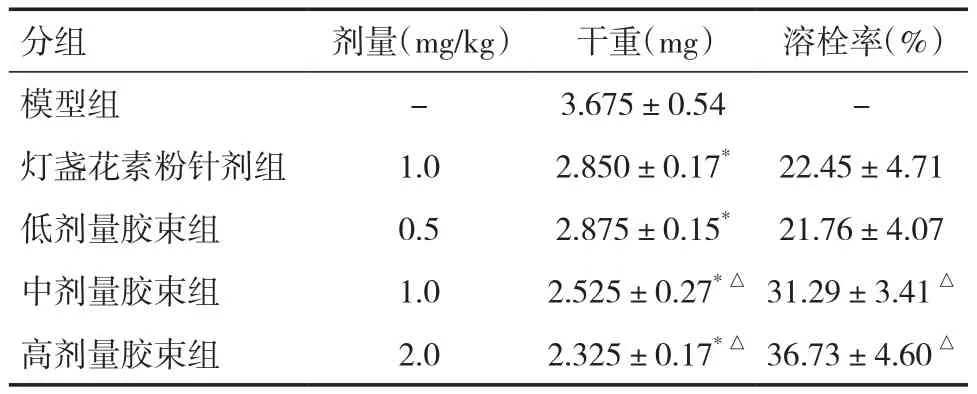
表6 不同组血栓的比较(±s,n=4)
注:与模型组比较,*P<0.05;与灯盏花素粉针剂组比较,△P<0.05
分组 剂量(mg/kg) 干重(mg) 溶栓率(﹪)模型组 - 3.675±0.54 -灯盏花素粉针剂组 1.0 2.850±0.17* 22.45±4.71低剂量胶束组 0.5 2.875±0.15* 21.76±4.07中剂量胶束组 1.0 2.525±0.27*△ 31.29±3.41△高剂量胶束组 2.0 2.325±0.17*△ 36.73±4.60△
3 讨论
随着我国经济、社会生活水平的提高,居民的生活方式发生很大变化,如缺乏锻炼、吸烟饮酒、膳食结构不平衡及工作生活压力增大等,这些与行为密切相关的心血管疾病危险因素水平呈增高趋势,缺血性心脑血管病发病率也逐年上升[2]。缺血性心脑血管病发病原因是心脑血管急性血流障碍所引起的突发性局部性功能障碍。对于血栓性疾病的预防和治疗,需要研究探讨血栓形成的生理病理机制,而良好的动物血栓模型对这些机制研究具有尤为关键的作用。
大鼠体内药代动力学行为结果表明,与市售灯盏花素粉针剂相比较,Bre/TPGS在血液循环中消除速度相对缓慢,T1/2为前者的12.8倍左右。由于Bre/TPGS粒径较小且被PEG链形成的水化物理屏障层所保护,能够让胶束不容易被网状内皮系统(RES)识别及吞噬或被肝脏、脾脏等组织排泄,延长药物体内循环时间并保持稳定,使药物在血液循环中具有较长的滞留时间。因此,与灯盏花素粉针剂相比,载药胶束具有更好的药动学行为,表现出显著增加的T1/2、MRT和AUC,从而提高灯盏花素的治疗效果;并具有促进血栓溶解作用,在相同剂量下,Bre/TPGS溶解血栓效果优于市场销售的灯盏花素粉针剂。
1 Zhang Weidong,Chen Wansheng,Wang Yonghong,et al.Studies on the flavone glycosides from the extract of erigeron breviscapus[J].Chinese Traditional & Herbal Drugs,2000,31:565-566
2 王一茗,束彦页.自噬在缺血性心脑血管疾病中的作用研究进展[J].中国全科医学,2016,19(3):347-351
3 田利华,赵离钟,顾佳,等.灯盏花素上市品种概况以及新剂型研究进展 [J].中国中药杂志,2014,39(19):3719-3722
4 Wang M,Xie C,Cai RL,et al.Studies on antioxidant activities of breviscapine in the cell-free system[J].American Journal of Chinese Medicine,2008,36(6):1199-1207
5 Jia JH,Chen KP,Chen SX,et al.Breviscapine,a traditional chinese medicine,alleviates myocardial ischaemia reperfusion injury in diabetic rats[J].Acta Cardiologica,2008,63(6):757-765
6 Zhang Z,Feng SS.Nanoparticles of poly(lactide)/vitamin E TPGS copolymer for cancer chemotherapy:Synthesis,formulation,characterization and in vitro drug release[J].Biomaterials,2006,27(2):262-270
7 姬海婷.灯盏花素胃漂浮缓释片的研究[D].吉林大学,2015
8 武莉,马倩倩,张轩萍,等.灯盏花素对大鼠2型糖尿病胰岛素抵抗的影响 [J].中国实验方剂学杂志,2014,20(16):152-155
9 王艳芳,张钰,郝冠中,等.灯盏花素的临床应用进展[J].疾病监测与控制,2010,4(3):138-140
10 Duca L,Sippl R,Snell-Bergeon JK.Is the risk and nature of cvd the same in type 1 and type 2 diabetes[J].Curr Diab Rep,2013,13(3):350-361
11 王竞,霍美蓉,周建平,等.基于透明质酸-紫杉醇前药的载药胶束的制备及大鼠体内药代动力学[J].中国药科大学学报,2013,44(6):520-525
12 赵锦,史继峰,熊晔蓉,等.去氧鬼臼毒素聚合物胶束在大鼠体内的药动学 [J].中国新药杂志,2014,23(22):2659-2663
13 张迪,许茜,刘珂,等.2种姜黄素聚合物胶束在大鼠体内的药动学比较研究 [J].中国中药杂志,2016,41(19):3668-3673
