罗氏沼虾冻藏过程中质构与理化特性研究
2018-03-11柳佳彤姜启兴许艳顺夏文水
柳佳彤 姜启兴 杨 方 王 斌 许艳顺 夏文水 徐 岩
(1. 江南大学食品学院,江苏 无锡 214122;2. 江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122;3. 江南大学生物工程学院,江苏 无锡 214122)
罗氏沼虾(Macrobrachiumrosenbergii)又称马来西亚大虾、淡水长臂大虾,2016年中国罗氏沼虾养殖产量为1.327×105t,比2015年增加2.49%[1]。罗氏沼虾个体大,营养丰富,因此备受广大消费者青睐,但其生长适宜水温为20~34 ℃,季节性较强,使得市场销售仅限于7~10月,所以目前很多企业将其加工成冷冻产品,以满足消费者全年消费的需求。但是发现在传统的速冻工艺及冻藏条件下,随着冻藏时间的延长,虾肉会变得松软无弹性,严重影响产品的食用品质,因此迫切需要开展冻藏罗氏沼虾品质劣变相关的研究,从而为开发高品质冷冻罗氏沼虾加工关键技术提供理论依据。
研究[2]4-10表明,内源酶降解作用是导致水产品低温保藏过程中品质变化的主要原因。Ge等[3]研究了草鱼冰藏条件下组织蛋白酶在贮藏期间的活性和分布规律,并确定了内源组织蛋白酶和钙激活蛋白酶是造成冰藏草鱼质构劣化的主要因素。Navarrete等[4]研究发现凡纳滨对虾肝胰腺中的胰凝乳蛋白酶对胶原蛋白等底物水解性能很高。陈诗研等[5]发现凡纳滨对虾在冰藏过程中虾头中的内源酶会随着贮藏时间的延长迁移到肉中。吉宏武等[6]研究了南美白对虾冰藏期间内源酶对虾肉蛋白的降解作用,发现随着贮藏时间的延长,内源酶对肌原纤维蛋白的肌球蛋白重链(MHC)和肌动蛋白(Actin)降解程度增大,其中虾头中胰蛋白酶对肌原纤维蛋白的降解作用最强。颜龙杰等[7]发现凡纳滨对虾在4 ℃贮藏5 d后,组织蛋白酶L的相对活性仍保持在80%以上,SDS-PAGE分析发现组织蛋白酶L在贮藏过程中持续参与虾肌肉蛋白的分解,尤其对组成肌肉的主要蛋白MHC的降解最为显著。而目前中国关罗氏沼虾尤其是对其冻藏期间质构劣变和内源酶变化的研究相对较少,且主要集中在冻藏温度和冻结方式等条件对虾类多酚氧化酶活性的影响,尚未见有关冻藏期间内源蛋白酶的变化情况及其与质构劣变相关性方面的研究。因此,本研究拟以罗氏沼虾为研究对象,并以刀额新对虾为对照,研究冻藏对罗氏沼虾蛋白劣化和质构特性的影响,考察虾头中蛋白酶向虾肉中迁移的情况,并分析蛋白劣化和内源酶之间的相关性,以期为阐明罗氏沼虾品质劣变的机理提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活罗氏沼虾、刀额新对虾:购于江苏省无锡市滨湖区华润万家超市,罗氏沼虾平均体质量(25.00±5.00) g,体长(10.00±2.00) cm;刀额新对虾平均体质量(10.50±0.50) g,体长(10.00±2.00) cm,在塑料袋中加入适量碎冰,30 min内活运至实验室;
甲醛、三氯乙酸、NaOH、KCl、NaCl、EGTANa2、MgCl2、KH2PO4、K2HPO4、K3PO4:分析纯,国药集团化学试剂有限公司;
平板计数琼脂:生化试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
FRINOX速冻柜:FDS-35型,上海漯城餐饮设备有限公司;
高速冷冻离心机:3K-30 型,德国 Sigma 公司;
物性分析仪:TA-XT2i 型,英国 Stable Micro System 公司;
紫外可见分光光度计:UV-1000型,上海天美科学仪器有限公司;
激光粒度分析仪:S3500 型,美国Microtrac公司;
高速分散机:T18型,德国 IKA 公司;
pH计:EL20 型,梅特勒-托利多仪器上海有限公司;
立式台式杀菌锅:LDZX-50KBS型,上海跃进医疗器械厂;
超净工作台:S.SW-CJ-1F型,上海跃进医疗器械厂;
恒温培养箱:PYX-DHS·350-BY-II型,上海跃进医疗器械厂。
1.3 试验方法
1.3.1 样品处理与贮藏试验 将鲜活的罗氏沼虾和刀额新对虾加冰猝死,低温流水冲洗干净后分成3组。A:整只罗氏沼虾冻品;B:去头罗氏沼虾冻品;C:整只刀额新对虾冻品。A、B、C 3组单层摆放于不锈钢盘上,置于(-33±2) ℃的鼓风速冻机中进行冻结,用直径约1 mm的温度探针插入虾肉第一腹节中心位置待其温度达到-18 ℃时取出,随机装入自封袋中,于(-18±2) ℃冰箱中贮藏。贮藏过程中每隔2周随机取样,置于4 ℃冰箱中过夜解冻,解冻后去头去壳取虾肉进行质构、理化和蛋白酶活等相关指标的分析。
1.3.2 剪切力测定 取虾的一、二腹节,采用质构分析仪,垂直于肌肉纤维走向进行测定,每组样品至少6个平行样。参数设定:探头型号A/CKB,刀片探头下降速度 2 mm/s,压缩比90%。
1.3.3 TCA-溶解肽测定 参照Sriket等[8]的方法稍加改动。将虾解冻处理后取一、二腹节虾肉绞碎,称取2 g虾肉,加入质量分数5%的三氯乙酸(TCA)溶液18 mL,用高速分散机均质1 min,冰浴30 min后,于4 ℃、11 000×g离心10 min,上清液中肽的含量用lowry法[9]测定,结果用μmol Tyr/g 肉表示。每组样品做3个平行样。
1.3.4 肌原纤维小片化指数(MFI值)测定 根据文献[9],按式(1)计算MFI值。每组样品做3个平行样。
MFI=A540×200,
(1)
式中:
MFI——肌原纤维小片化指数;
A540——540 nm处的吸光度值。
1.3.5 肌原纤维表观直径(D3,2)测定 参照Culler等[10]方法并略有改动。虾解冻处理后取一、二腹节肉绞碎,取2 g肉加入30 mL预冷缓冲液(100 mmol/L KCl,20 mmol/L K3PO4,1 mmol/L EDTA,1 mmol/L MgCl2,pH 7.2)均质1 min,于4 ℃、1 000×g离心15 min,所得沉淀重复上述操作,再次得到的沉淀悬于15 mL上述缓冲液中,取1.5 mL用粒度分析仪测定粒径分布,按照规则球体的折射系数1.54计算粒径。肌原纤维表观直径以表面积计算的平均粒径(MA)表示,即D3,2(μm)。每组样品做3个平行样。
1.3.6 虾肉中总蛋白酶活测定 参照Sriket等[11]方法略有改动。虾解冻处理后取一、二腹节虾肉分别绞碎,加入3倍体积的磷酸盐缓冲液(pH 7.6),均质,置于冰浴(<4 ℃)中,用磁力搅拌器连续搅拌30 min后,10 000×g离心30 min,上清液即为粗酶液。移取200 μL粗酶液加入200 μL蒸馏水和625 μL反应缓冲液(0.2 mol/L Na2HPO4-0.1 mol/L 柠檬酸,pH 5.0),最后加入10 g/L酪蛋白溶液200 μL,于50 ℃ 恒温水浴反应15 min,加入质量分数50% TCA溶液200 μL终止反应,10 000×g、4 ℃离心10 min,上清液中肽的含量用lowry法测定。一个酶活单位(U)定义为50 ℃下每分钟水解酪蛋白并释放1 μmol酪氨酸的量。每组样品做3个平行样。
1.3.7 菌落总数测定 样品的处理参照GB 4789.20—2003中虾类检样的处理方法,于无菌条件下取虾腹节内的肌肉2.5 g 放入灭菌乳钵中,用灭菌剪子剪碎加入22.5 mL生理盐水,均质后,依次梯度稀释;菌落总数的检测参照GB 4789.2—2016,采用倾注平板法按照水产品菌落总数的培养条件在平板计数培养基(PCA)上(30±1) ℃培养(72±3) h。
1.3.8 微观结构观察 根据文献[12]。
1.4 数据统计分析
数据采用Origin绘图,采用SPSS对数据进行统计分析,利用Pearson双变量分析法进行相关性计算分析。
2 结果与分析
2.1 冻藏过程中虾肉的剪切力变化情况
质构特性是水产品加工过程中评价产品质量和可接受程度的一个重要指标。其中剪切力是表征质构变化常用的指标之一[13]。整只罗氏沼虾冻品、去头罗氏沼虾和整只刀额新对虾冻品在冻藏过程中剪切力的变化情况如图1所示。由图1可知,在整个冻藏期间,3组样品的剪切力均随着冻藏时间的延长而下降,贮藏16周后整只罗氏沼虾冻品、去头罗氏沼虾冻品和整只刀额新对虾冻品剪切力分别下降了36.81%,25.40%,22.83%。整只罗氏沼虾冻品基本呈直线下降趋势。整个冻藏周期内整只刀额新对虾剪切力值始终高于其他样品,且下降幅度最小。冻藏前期去头罗氏沼虾剪切力明显低于整只罗氏沼虾冻品,但在8周之后去头罗氏沼虾剪切力下降幅度变小,并在10周之后高于整只罗氏沼虾冻品,图2~4也呈现类似变化趋势,去头罗氏沼虾冻品在前期各项指标劣化的程度要大于整只罗氏沼虾冻品,而在后期劣变程度则低于整只罗氏沼虾冻品。以上结果表明,相比于整只刀额新对虾冻品和去头罗氏沼虾冻品,整只罗氏沼虾冻品剪切力下降程度最大,说明冻藏期间其品质劣化最大。
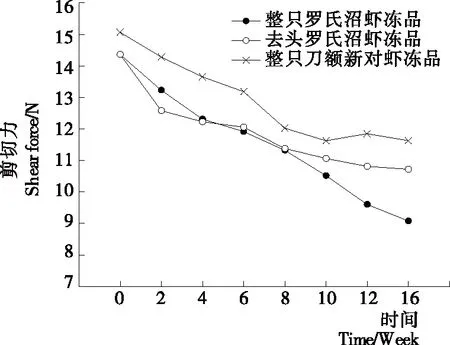
图1 冻藏过程中虾肉的剪切力变化情况Figure 1 Changes in shear force of different samples during frozen storage
2.2 冻藏过程中肌原纤维小片化指数(MFI)变化
MFI值反映了肌节Ι带附近关键细胞骨架蛋白的降解程度[14]。MFI 越大,表明肌原纤维内部结构完整性破坏的程度就越大[15]。由图2可知,随着冻藏时间的延长,整只罗氏沼虾冻品、去头罗氏沼虾冻品和整只刀额新对虾冻品的MFI值均呈上升趋势,且分别在前2周、前4周和前8周上升的较快,之后变化较平缓。整只罗氏沼虾冻品、去头罗氏沼虾冻品和整只刀额新对虾冻品在冻藏周期内分别较初始值上升了1.45,1.70,1.86倍。2~16周内3组样品之间一直存在显著性差异,且较为明显(P<0.05)。冻藏初期去头罗氏沼虾的MFI值高于整只罗氏沼虾冻品,可能是去头过程对虾肉造成了损伤,使部分细胞破裂,细胞内酶释放出来,从而加剧了蛋白的降解和肌肉结构的破坏;从第4周开始整只罗氏沼虾冻品的MFI值开始超过去头罗氏沼虾冻品,可能是随着冻藏时间的延长,虾头中的内源蛋白酶缓慢迁移到虾肉中,从而加剧了对虾肉蛋白的降解和结构的破坏,这可以从图5冻藏过程中不同罗氏沼虾样品中总蛋白酶活的变化得到验证。而图4中TCA-溶解肽的变化趋势基本与MFI值的变化类似,也初步说明蛋白的降解可能是导致品质变化的原因之一。Jiang等[16]通过扫描电镜(SEM)观察乌鳢鱼片在-20 ℃贮藏时肌原纤维的变化情况,发现不同冻结方式和温度的乌鳢鱼片在冻藏期间肌原纤维都会出现不同程度的片状化,并推测这一变化是由蛋白脱水导致的,这些变化会直接引起鱼片质构和持水力的变化。Kaale等[17]研究表明大西洋鲑鱼微冻保藏过程中冰晶的形成往往伴随着肌原纤维的碎片化。
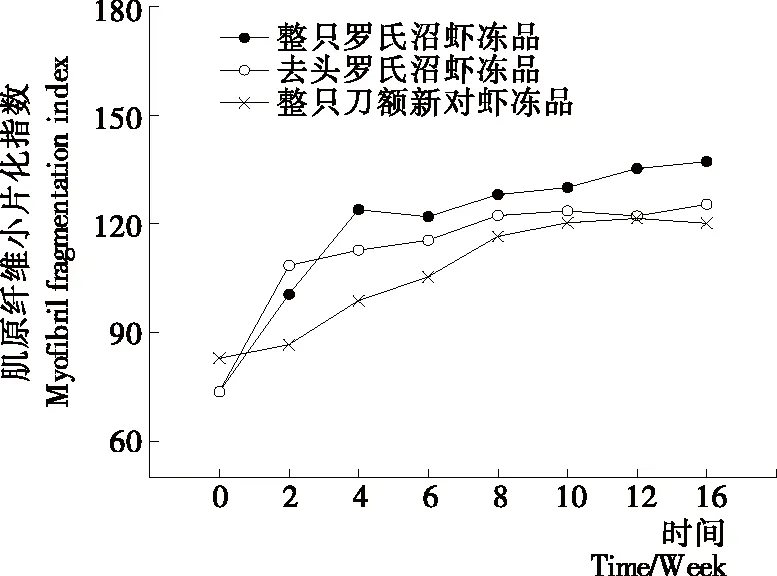
图2 冻藏过程中肌原纤维小片化指数(MFI)变化情况Figure 2 Changes in myofibril fragmentation index of different samples during frozen storage
2.3 冻藏过程中肌原纤维表观直径变化
肌原纤维表观直径是用于量化肉制品在贮藏过程中肌原纤维被破坏程度的指标[2]20。如图3所示,3种样品D3,2均随着冻藏时间的延长而下降,前2周冻藏过程中3组样品之间无显著性差异(P>0.05),而4~16周时3组样品之间存在显著性差异(P<0.05)。到达冻藏终点时,刀额新对虾、整只和去头罗氏沼虾冻品的D3,2分别下降了31.94%,38.32%,34.42%。整个冻藏周期内整只刀额新对虾冻品D3,2值始终高于其他样品,且下降幅度最小。贮藏前期去头罗氏沼虾冻品D3,2值始终低于整只罗氏沼虾冻品,后期随着去头罗氏沼虾冻品D3,2下降幅度变小,在6周之后整只罗氏沼虾冻品D3,2值反而低于去头罗氏沼虾冻品,这一趋势与剪切力的变化类似。说明整只罗氏沼虾冻品冻藏过程中肌原纤维表观直径下降的最为严重,肌原纤维破坏程度最大。林婉玲等[18]在研究浸渍冻结和静止空气冻结对冻藏凡纳滨对虾肌肉组织结构影响时,同样发现随着冻藏时间的延长,浸渍冻结和静止空气冻结的对虾肌纤维直径显著变小。

图3 冻藏过程中肌原纤维表观直径变化情况Figure 3 Changes inmyofibril apparent diameter of different samples during frozen storage
2.4 冻藏过程中TCA-溶解肽变化
TCA-溶解肽是反映内肽酶和微生物等对蛋白降解程度的指标之一[2]19,TCA-溶解肽含量越高,说明蛋白降解程度越高[19]。从图4中可以看出,3组样品在冻藏过程中,随着冻藏时间延长TCA-溶解肽的含量逐渐升高,整体而言,整只罗氏沼虾冻品前8周上升较快,8周后变化平稳,而去头罗氏沼虾冻品和整只刀额新对虾冻品则在前2周增加速率较快,之后变化缓慢。整只刀额新对虾冻品TCA-溶解肽的含量在冻藏周期内始终低于其他样品,并且与罗氏沼虾之间存在显著性差异(P<0.01),可能是刀额新对虾中内源酶系较罗氏沼虾而言相对不发达。去头罗氏沼虾在去头时直接破坏了细胞,内源酶释放出来,另外,去头过程中会受到微生物的污染[20],微生物代谢也会产生酶,各种酶的释放和产生加速了蛋白的降解,可能是导致前期去头虾TCA-溶解肽含量在冻藏前2周增加较快的原因。在冻藏2周之后,整只罗氏沼虾冻品中TCA-溶解肽逐渐高于去头罗氏沼虾冻品,并逐渐呈现显著性差异(P<0.01),可能是整只虾冻品虾头中的内源酶向虾肉中迁移,使得虾肉中蛋白酶活增大,蛋白降解程度增大。图5中冻藏过程中不同罗氏沼虾样品总酶活的变化情况可以很好地说明酶的迁移并解释2组罗氏沼虾样品TCA-溶解肽的变化情况。Cai等[21]和Jiang等[16]在真鲷鱼片和草鱼片冰藏过程中发现了相似的结果,TCA-溶解肽的含量显著增加,表明样品在贮藏过程中受到了内源酶的作用,导致肌原性含氮降解产物的增加,因而促进了微生物的生长和繁殖,加速样品品质的劣化[22]。以上结果表明,冻藏期间整只罗氏沼虾冻品TCA-溶解肽含量升高最为明显,去头罗氏沼虾冻品TCA-溶解肽的产生相对缓慢。

图4 冻藏过程中TCA-溶解肽变化情况Figure 4 Changes in TCA-soluble peptide of different samples during frozen storage
2.5 冻藏过程中总蛋白酶变化
由图5可知,冻藏过程中,整只罗氏沼虾冻品和去头罗氏沼虾第一、二腹节虾肉中总蛋白酶活均有所增加,整个周期内整只罗氏沼虾冻品总蛋白酶始终高于去头罗氏沼虾冻品,并且上升幅度大于去头罗氏沼虾冻品,而整只罗氏沼虾冻品虾头内总蛋白酶活远高于虾肉中的蛋白酶活性,但呈逐渐下降趋势,可能是蛋白酶从虾头中逐渐往虾肉中迁移引起的。Benjakul等[23]发现凡纳滨对虾和罗氏沼虾在冰藏2,4 d后虾头内的胰蛋白酶便会迁移到虾肉的第一腹节内。Maria等[24]研究了红鳟鱼在-10~80 ℃贮藏18个月内组织蛋白酶D的活性变化,发现不同温度贮藏对组织蛋白酶的活性影响不大。所以,整只罗氏沼虾冻品在贮藏期间虾头内的内源酶发生迁移,从而使得酶活上升较快,进而可能促进了蛋白降解,同时也很好地解释了TCA-溶解肽和MFI值等指标在贮藏后期劣化程度显著高于去头罗氏沼虾冻品。
2.6 冻藏过程中菌落总数变化
图6反映了3种样品冻藏过程中菌落总数的变化情况。由图6可知,随着冻藏时间的延长,3种样品的菌落总数均呈下降趋势。在冻藏前2周菌落总数下降明显,之后趋于缓和。这与李燕等[25]发现的罗氏沼虾在-10 ℃冻藏过程中细菌总数在一定时间内随着贮藏时间的延长不断减少的现象一致。前2周菌落总数快速下降可能是速冻过程中温度急剧下降,微生物的新陈代谢未能迅速重新调整,导致微生物的死亡率增加[26]。2周之后菌落总数仍处于下降趋势,可能是在-18 ℃贮藏过程中,蛋白会发生降解和冷冻变性等,此外冰晶对微生物细胞也会产生机械破坏,以致微生物死亡率相应增加。在整个冻藏过程中去头罗氏沼虾的菌落总数始终高于整只罗氏沼虾冻品,可能是在去头过程中受到微生物的污染。冻藏过程中微生物数量逐渐下降,因此,可能微生物的作用对质构的影响较小。

图5 冻藏过程中虾肉总蛋白酶变化情况Figure 5 Changes in total proteolytic activity of different samples during frozen storage
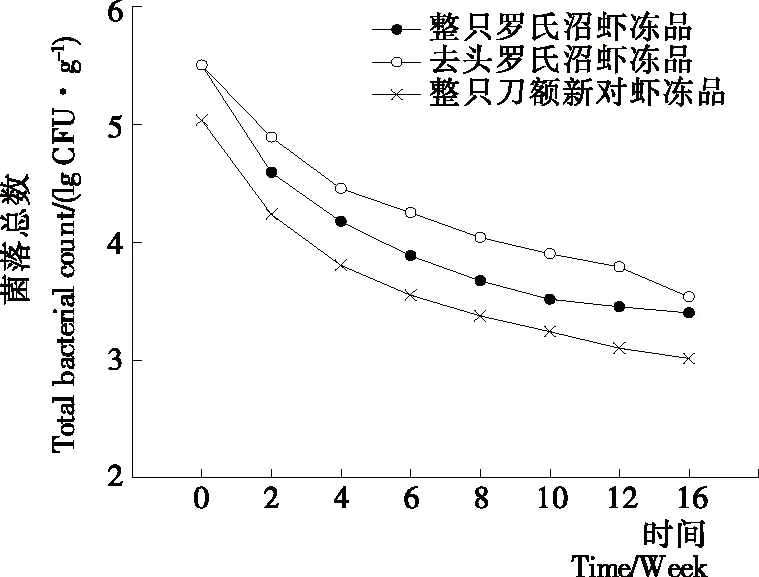
图6 冻藏过程中菌落总数变化情况Figure 6 Changes in aerobic bacterial count of different samples during frozen storage
2.7 冻藏过程中微观结构的变化
图7、8分别为整只罗氏沼虾冻品虾肉横断面和纵断面伊红染色微观组织结构的变化情况。新鲜的罗氏沼虾虾肉纤维在初期轮廓清晰,排列整齐,并且被一层薄的结缔组织(肌内膜)包围,呈不规则多边形形状。经过8周和16周的冻藏后,肌纤维出现明显的变化,肌纤维内部间隙变大,肌纤维之间出现明显分离。从纵断面的结构图可以看出,肌纤维在冻藏过程中发生了断裂。Bahuaud等[27]研究了大西洋鲑鱼在微冻贮藏过程中品质的变化,在对肌纤维的观察过程中也发现了孔隙的出现,并指出这与冰晶的形成有直接关系。此外,有研究[28]表明,肌肉纤维是通过胶原纤维和结缔组织相连接,贮藏过程中由于内源酶的作用,肌纤维和胶原纤维都会被降解,从而导致肌纤维和肌内膜之间脱离,进一步形成间隙。
2.8 相关性分析
对冻藏期间整只罗氏沼虾冻品剪切力、MFI值、D3,2、TCA-溶解肽以及虾肉中总蛋白酶活性等指标进行相关性分析,结果如表1所示。剪切力与MFI值、TCA-溶解肽和虾肉中总蛋白酶活性呈负相关(P<0.01),与D3,2呈正相关(P<0.01),说明剪切力和蛋白劣化、蛋白酶活之间存在一定联系;而MFI值与TCA-溶解肽和虾肉中总蛋白酶活性呈正相关(P<0.01),D3,2与TCA-溶解肽和虾肉中总蛋白酶活性呈负相关(P<0.01),说明酶活与蛋白劣化之间存在一定联系,通过以上可以推断,虾肉中蛋白酶的作用加速了蛋白的降解,导致了蛋白各项指标的劣化,进而导致剪切力的下降。

图7 冻藏过程中罗氏沼虾微观组织结构(横断面)的影响(放大倍数:200×)Figure 7 Changes in cross sections of muscle tissue of Macrobrachium rosenbergii during frozen storage (magnification: 200×)

图8 冻藏过程中罗氏沼虾微观组织结构(纵断面)的影响(放大倍数:200×)Figure 8 Changes in longitudinal sections of muscle tissue of Macrobrachium rosenbergii during frozen storage (magnification: 200×)
3 结论
整只罗氏沼虾冻品蛋白劣化和虾肉中蛋白酶活性明显并高于去头罗氏沼虾冻品,且质构下降程度也较大。这可能是冻藏期间虾头内的内源蛋白酶随着时间的延长迁移至虾肉中并加速了蛋白的降解,从而使得MFI值和TCA-溶解肽等指标在冻藏后期变化较快,蛋白劣化严重并最终导致质构劣变程度较高。

表1 整只罗氏沼虾冻品冻藏过程中剪切力、蛋白变化和蛋白酶活性变化等指标的相关性分析†Table 1 Pearson, correlation between changes in protein, protease activity and texture deterioration of Macrobrachium rosenbergii during frozen storage
本研究中主要就总酶活进行了分析,但在整个冻藏过程中内源酶到底是否发挥了降解蛋白的作用还未知,因此还需要通过进一步研究,深入分析内源酶在整只罗氏沼虾冻品蛋白劣化和质构变化进程中的作用,深入揭示整只罗氏沼虾冻品贮藏期间质构劣变机理。
