子宫内膜癌组织中miR-106b、DAB2 表达与临床病理及预后的相关性
2018-02-20董爱华
董爱华 韩 克
1.南京大学医学院( 210093) ;2.南京鼓楼医院
子宫内膜癌是常发生于子宫内膜中的一种上皮性恶性肿瘤,具有较高的发病率与死亡率,确诊时多为中晚期,早期确诊并有效治疗可延长患者生存时间[1]。目前临床常通过检测血清标志物而诊断早期子宫内膜癌,但缺乏特异性及敏感性导致预后效果差,因而需寻找新的子宫内膜癌生物学标志物以提高临床诊疗效果并有效评估预后[2]。miRNAs 是一类非编码单链核苷酸RNA 分子,可通过与mRNA 3’UTR 区序列结合降解并抑制靶基因表达。有研究表明在胃癌组织中微小RNA106b ( miR-106b) 上调表达并促进肿瘤细胞的增殖及迁移[3]。恶性肿瘤的发生与癌基因及抑癌基因的活性状态有关,残疾基因同源物2( DAB2) 是一种抑癌基因并可在多种肿瘤发生发展进程中发挥重要作用[4]。目前关于miR-106b 与DAB2 在子宫内膜癌组织中的表达研究相对较少,为此,本研究探讨子宫内膜癌组织中miR-106b 与DAB2 表达水平与临床病理特征的关系,探究其预后评定价值。
1 资料与方法
1.1 一般资料
收集2010 年5 月—2015 年2 月本院手术切除的子宫内膜癌病例资料70 例( 观察组) ,年龄( 36.2±2.6) 岁( 31~65 岁) ,均经病理证实为子宫内膜癌。收集临床病理资料包括FIGO 分期、淋巴结转移、组织学分级、肌层浸润、P53 及Ki67 表达等。按照FIGO 分期标准[5]分为I 期34 例,Ⅱ期21 例,Ⅲ期15例;根据组织内膜癌分级法[6]分为G1 期16 例,G2期44 例,G3 期10 例。P53、Ki67 呈棕黄色或棕褐色颗粒标记为阳性,以阳性细胞占每个视野下全部肿瘤细胞的平均比例作为量化指标:即P53,阳性细胞数≥10%为阳性( +) ,<10%为阴性( -) ;Ki67,阳性细胞数≥14%为阳性( +) ,<14%为阴性( -) 。另选取同期于本院进行子宫内膜癌切除手术70 例患者的癌旁正常组织标本为正常组,年龄( 36.6±3.3) 岁(32~71 岁) 。纳入标准: 患者术前未接受化疗或放疗以及激素治疗,知情且签署知情同意书。排除标准:①患有多处原发性肿瘤;②患有其他肿瘤或重大疾病病史;③肝肾等重要器官严重损伤;④临床资料不完整。两组患者年龄比较无差异( P>0.05) 。
1.2 实验室检测方法
1.2.1 子宫内膜组织中miR-106b、DAB2 表达检测采用Trizol 法( 北京恩硕生物科技有限公司) 提取子宫内膜组织标本总RNA,DEPC 水溶解RNA 并测定RNA 浓度及纯度。利用反转录试剂盒( 天根生化科技( 北京) 有限公司) 将RNA 反转录为cDNA。按照SYBR Green qRT-PCR 试剂盒( 北京恩硕生物科技有限公司) 说明书进行检测,其中miR-106b 上游引物序列为: 5’-TTTTCGCCCTTAGCGTGAAGA-3 ’, 下 游 引 物 序 列 为: 5 ’ - GAGGCAGTCGAAGCTCTCG -3’,以U6 为内参基因,上游引物序列为: 5’-CTCGCTTCGGCAGCACA-3’,下游引物序列为:5’-AACGCTTCACGAATTTGCGT-3’,DAB2 上游引物序列为: 5’-TGGACGATGTGCTCT ATGCC-3’,下游引物序列为: 5’-GGATGGTGATGGTTTGGTAG-3’,以β?actin 为内参基因,上游引物序列为: 5’-GAGCTACGAGCTGCCTGACG-3’,下游引物序列为:5’-GTAGTTTCG TGGATGCCACAG-3’。qRT-PCR 反应体系为15 μl,其中cDNA 1 μl,引物各0.5 μl,SYBR Green Mix 7.5 μl,RNase-free ddH2O5.5 μl。每个样品为3 个生物学重复,在实时荧光定量RCR 仪上进行反应,程序设置为95 ℃10 min;95℃15s、60 ℃15s,72 ℃15s,共40 个循环。反应结束后将数据保存并对所得数据Ct 值进行分析,采用2-ΔΔCt算法计算miR-106b 与DAB2 mRNA 相对表达量,并分析miR-106b 与DAB2 表达与患者临床病理特征的关系。
1.2.2 子宫内膜组织中DAB2 蛋白表达检测 按照免疫组化试剂盒( 美国Bioassay Technology 公司) 说明书检测组织中DAB2 蛋白表达。将子宫内膜组织制作成石蜡切片,梯度脱水、PBS 清洗后置于柠檬酸钠溶液( pH7.2~7.4) 中20 min 抗原修复,PBS 清洗后加入稀释1:100 的DAB2 一抗( 上海优宁维生物科技股份有限公司) 并置于4 ℃冰箱过夜,次日PBS冲洗标本并滴加生物素标记二抗( 北京九州天瑞卡机有限公司) ,37 ℃孵育30 min 后滴加DAB( 福州迈新生物技术开发有限公司) 显色10 min,苏木精复染后用蒸馏水清洗,滴加二甲苯后封片光学显微镜下观察。
1.2.3 结果判定 DAB2 主要位于细胞质,染色呈黄色、棕黄色、棕褐色,挑选每张切片较清晰的7 ~10个视野统计阳性染色细胞数量,根据阳性细胞数与染色程度综合评判结果[7]: 阳性细胞<25%为0 分,26%~50%为2 分,51%~75%为3 分,>75%为4 分。染色程度,未着色为0 分,黄色为1 分,棕黄色为2分,棕褐色为3 分。两项相加之和为0 ~1 分为阴性( -) ,2~3 分为弱阳性( +) ,4 ~5 分为阳性( ++ ,≥6分为强阳性( +++) ,将( +、++、+++) 作为阳性表达组,( -)作为阴性表达组。
1.3 随访
所用患者均于本院建立资料并通过电话、门诊等随访3 年,统计患者开始治疗到肿瘤进展或死亡时间即无生存进展期( PFS) 。
1.4 统计学方法
采用统计学软件SPSS19.0 进行数据分析。计量资料符合正态分布以均数±标准差( 珋x±s) 表示,两组间比较采用t 检验;计数资料用[n( %) ]表示,采用检验;Pearson 法进行相关性分析;采用Kaplan-Meier 分析患者生存情况。以P<0.05 为差异具有统计学意义。
2 结果
2.1 子宫内膜组织中miR-106b、DAB2 表达
观察组miR-106b 表达水平( 3.18±0.10) 高于正常组( 1.05±0.34) ,而DAB2 表达水平( 0.30±0.02)低于正常组( 1.03±0.05) ( P<0.05) 。
2.2 子宫内膜组织中DAB2 蛋白表达
免疫组化检测子宫内膜组织中DAB2 蛋白表达结果显示,DAB2 位于细胞质,染色呈黄色、棕黄色、棕褐色。观察组中DAB2 蛋白阳性表达率低于正常组( P<0.05) 。详见表1。
2.3 miR-106b、DAB2 表达与临床病理特征的关系
miR-106b 表达量中位值为2.12±0.25,高于中位值有42 例( 高表达) ,余28 例低于中位值( 低表达) 。临床病理分析结果显示,miR-106b 表达与FIGO 分期、淋巴结转移、组织学分级、P53 及Ki67 有关,DAB2 表达与FIGO 分期、肌层浸润程度、P53 及Ki67 有关( P<0.05) 。详见表2。
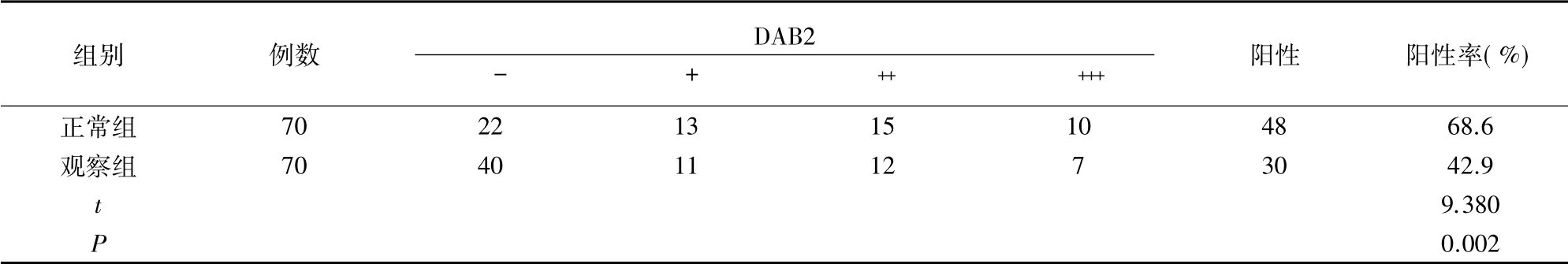
表1 两组子宫内膜组织中DAB2 蛋白表达情况比较(例)
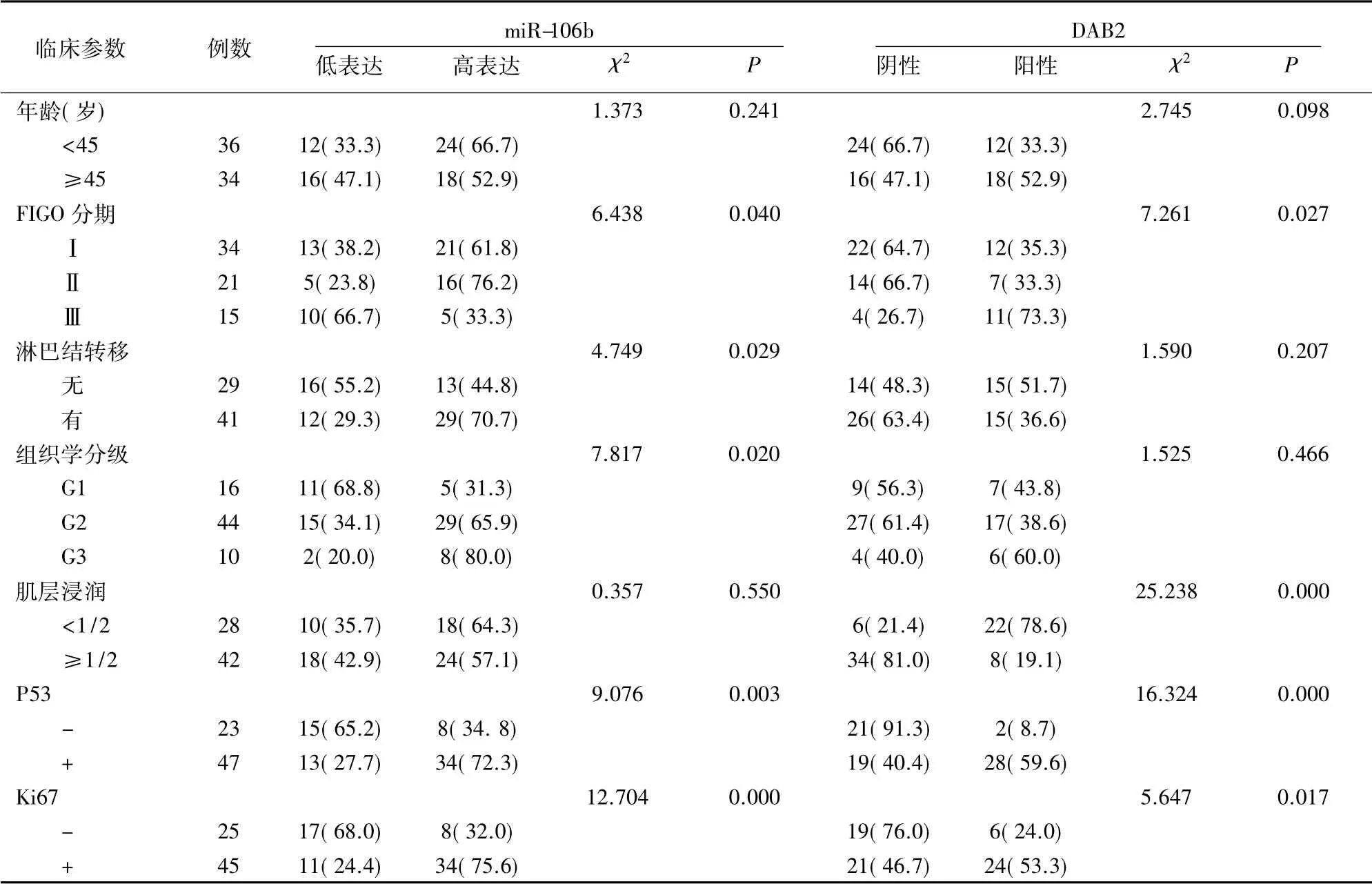
表2 观察组内膜组织miR-106b、DAB2 表达与临床病理特征关系[例(%)]
2.4 miR-106b 与DAB2 表达相关性分析
Pearson 相关性分析显示,miR-106b 与DAB2 表达呈负相关( r=-0.358,P=0.012) 。见图1。
2.5 子宫内膜癌组织中miR-106b、DAB2 表达与预后关系
Kaplan-Meier 曲线显示miR-106b、DAB2 表达与PFS 相关,miR-106b 低表达组PFS( 40.0%) 高于高表达组(20.0%),DAB2 阳性表达组PFS(38.6%) 高于阴性表达组(21.4%) ( P<0.05) ,见图2。将影响子宫内膜癌患者预后的危险因素进行Cox 多元回归分析,结果显示miR-106b、DAB2 表达、组织学分级及肌层浸润程度均是患者预后的危险因素。见表3。
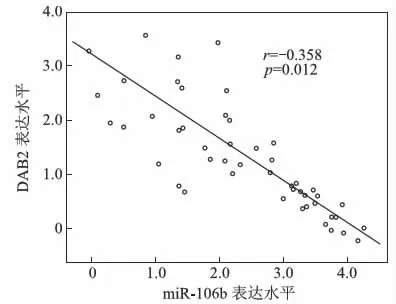
图1 miR-106b 与DAB2 表达水平相关性分析
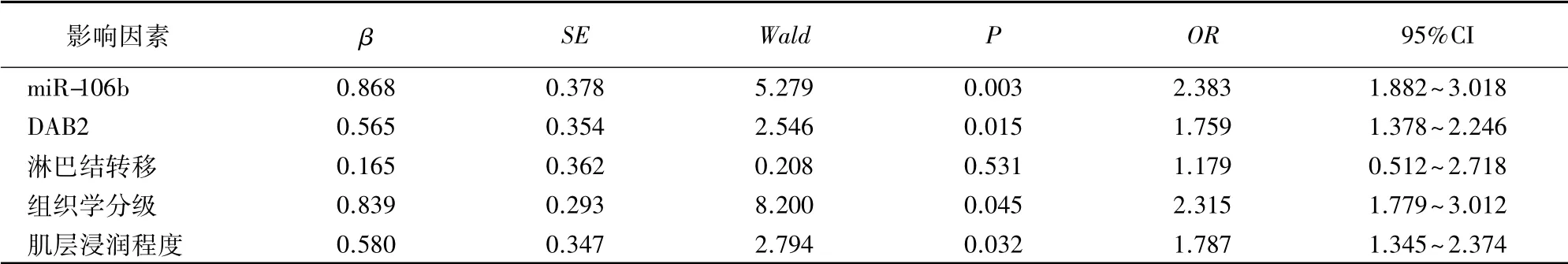
表3 子宫内膜癌患者预后的危险因素分析

图2 miR-106b、DAB2 表达与PFS 的关系
3 讨论
子宫内膜癌根据发生原因可分为雌激素依赖型与非雌激素依赖型,前者主要源于子宫内膜增生,后者包括子宫内膜浆液性癌、黏液癌、腺鳞癌等[8]。目前临床实践中主要依据病理类型进行诊断,但无法准确评估病理分期等肿瘤生物学特征,因此依靠特异性及敏感性较高的分子标记物从而掌握肿瘤生物学行为具有重要临床意义。miRNAs 可通过调控下游靶基因蛋白表达并介导基因转录后,一个或多个共同调控蛋白编码基因[9]。研究表明miRNAs 参与细胞增殖等细胞生命活动过程并对肿瘤发生发展发挥重要作用[10]。探讨子宫内膜癌细胞转移或侵袭有关的miRNAs 与靶基因,对早期诊治及评估预后具有重要应用价值。
miR-106b 位于人类7 号染色体且在编码基因MCM7 的第13 个内含子区域内,研究表明miR-106b在前列腺癌中上调表达并促进癌细胞增殖即发挥促癌功能[11]。肝癌组织中miR-106b 高表达进而促使E-Cadherin 等上皮或间质细胞标志物下调表达从而促进肝癌细胞增殖及侵袭[12]。在胃癌组织中miR-106b 上调表达而靶基因Smad7 下调表达,通过促使肿瘤细胞增殖进而参与胃癌发生发展过程[13]。近来相关研究表明乳腺癌组织中miR-106b 上调表达可活化TGF?β 通路从而促使上皮间质发生转化导致癌症发生[14]。目前关于miR-106b 在子宫内膜组织中的表达及与临床病理关系的研究相对较少。
本研究检测子宫内膜癌组织miR-106b 的表达水平显著高于正常组织,说明miR-106b 可能参与子宫内膜癌细胞侵袭及迁移过程。进一步分析miR-106b 表达与患者临床病理特征关系显示,miR-106b表达与FIGO 分期、淋巴结转移、组织学分级、P53 及Ki67 呈正相关,且P53、Ki67 阳性表达与子宫内膜癌的生物学行为及预后不良相关[15]。说明miR-106b 表达与肿瘤组织分化、恶化程度密切相关,推测其可作为诊断子宫内膜癌的分子标记物。
DAB2 是一种磷蛋白,研究表明miR-106b 可调控靶蛋白DAB2 表达而促进宫颈癌细胞上皮间质转化导致肿瘤细胞增殖分化[16]。DAB2 可参与丝裂原信号转导通路,同时DAB2 与结合蛋白相互作用可参与胞外信号调节激酶等多种肿瘤相关信号途径[17]。有报道证实在前列腺癌中DAB2 表达下调从而影响血管生成及肿瘤细胞存活或凋亡等生物学过程[18]。研究表明DAB2 是一种抑癌基因并可在肿瘤发生发展过程中发挥作用,肝癌组织中DAB2下调表达并与肿瘤病理分级及预后相关[19]。本研究检测子宫内膜癌组织中DAB2 表达显著低于正常组,且免疫分析DAB2 蛋白阳性表达率低于正常组,说明DAB2 参与子宫内膜癌发生及发展。临床病理特征结果显示DAB2 表达与FIGO 分期、肌层浸润程度、P53 及Ki67 正相关,说明DAB2 表达可能作为判断病情发展的参考指标。Pearson 相关性分析显示出miR-106b 与DAB2 表达呈负相关,说明子宫内膜癌中miR-106b 可通过下调靶基因DAB2 表达促使肿瘤细胞增殖及侵袭导致病情恶化。对子宫内膜癌患者预后分析显示,miR-106b 低表达组PFS 高于高表达组,DAB2 阳性表达组PFS 高于阴性表达组。将影响子宫内膜癌患者预后的危险因素进行Cox 多元回归分析,结果显示miR-106b、DAB2 表达均是患者预后的危险因素,说明二者不仅与子宫内膜癌预后相关,且均是患者生存时间的危险因素。提示miR-106b、DAB2 表达与子宫内膜癌发生发展相关,二者可预测病情严重程度并可作为评估预后的有效指标。
综上所述,子宫内膜癌组织中miR-106b 上调表达,而DAB2 下调表达,二者呈负相关关系且均与患者临床病理特征及预后相关,二者均可作为临床诊断子宫内膜癌及评估患者预后的分子标记物。本研究也存在不足之处,miR-106b 与DAB2 在子宫内膜癌中的生物学功能还有待进一步研究。
