神经肌肉电刺激对卒中后吞咽障碍治疗作用的研究
2018-01-18
卒中患者吞咽障碍发生率为30%~65%[1-2]。此类患者往往会出现营养不良、脱水、吸入性肺炎等多种并发症,从而导致预后不良,病死率升高[1-3]。适宜的吞咽功能康复能提高患者吞咽功能,降低误吸的发生。长期以来,卒中后吞咽障碍治疗多采用代偿性方法,但其治疗效果差异大,且缺乏大规模临床试验证实[2-3]。近年,神经肌肉电刺激(neuromuscular electrical stimulation,NMES)作为新型吞咽刺激技术治疗方法,日益引起大家的重视,但其有效性的科学证据尚不充足[4-6]。本研究旨在应用视频透视吞咽功能检查(video fluoroscopy swallowing study,VFSS)从吞咽运动学角度评价NMES技术在卒中后吞咽障碍患者康复治疗中的效果,以期为临床治疗提供更多的参考。
1 对象与方法
1.1 研究对象 选取2013年3月-2015年3月于中国康复研究中心神经康复中心进行治疗,经VFSS检查证实存在吞咽障碍的卒中患者。本研究经医院伦理委员会批准,入组患者均签署知情同意书。
入组标准:①符合中华医学会第四届全国脑血管学术会议通过的《各类脑血管疾病诊断要点》中出血性和缺血性卒中的诊断标准[7];②经颅脑计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)证实病变部位及性质;③年龄20~80岁;④生命体征稳定,血压控制在140/90 mmHg以下,病情无进展;⑤经吞咽功能筛查确定存在吞咽障碍;⑥能配合NMES和吞咽功能训练;⑦患者同意参与研究并签署知情同意书。
排除标准:①有认知障碍:简易智力状况检查法(Mini-Mental State Examination,MMSE)<14分;②合并神经系统其他疾病而影响吞咽功能者;③严重吞咽障碍,临床或VFSS发现口咽吞咽运动完全消失者;④存在食管动力性疾病者;⑤有严重肺部疾患,1秒钟用力呼气容积(forced expiratory volume in one second,FEV1)<50%正常值者;⑥有咽喉部占位性病变或手术史者;⑦其他电刺激及磁刺激禁忌证者,如存在严重精神疾病,颅内压高,体内存在金属置入物、心脏起搏器、药物泵、电刺激装置等;⑧存在严重失语或口颜面失用,不能配合完成吞咽功能检查者;⑨有严重肢体运动及躯干平衡障碍,单人扶持下仍不能保持坐位者。
1.2 吞咽障碍的诊断 所有患者经同一语言治疗师进行吞咽功能筛查,筛查采用3盎司咽水试验(3-ounce water swallow screen)及脉冲血氧饱和度测定。咽水前连续测量血氧饱和度2 min,读取血氧饱和度基线数值,吞咽3盎司(约90 ml)温水后监测血氧饱和度2 min,记录最低值。咽水试验中出现呛咳、不能连续饮完或饮水前后血氧饱和度下降>2%者为筛查试验异常。对吞咽筛查异常的患者进行VFSS检查[8]。VFSS检查包括3 ml液态钡食、10 ml液态钡食、半固体钡食及固体钡食4种食团吞咽检查。患者出现以下情况之一者认定为存在吞咽障碍:①任意食团吞咽时存在/误吸;②任意食团吞咽时口咽残留量≥50%食团体积。
1.3 分组和干预 将符合纳入和排除标准的患者应用随机数字表法分为研究组和对照组。研究组给予NMES真刺激,对照组给予假刺激。
两组患者均给予吞咽功能常规训练治疗,一天一次,每次30 min,5次/周,共进行4周。训练方法包括直接、间接方法。直接方法包括:有食吞咽时体位调整、超声门上吞咽、Mendelsohn手法等特殊吞咽方法的应用。间接方法包括:口轮匝肌训练、舌运动训练、增强吞咽反射能力的训练、咽喉运动训练、空吞咽训练等。
采用VitalStim®Model 5900进行NMES。脉冲电流设置为:脉冲频率80 Hz,脉冲持续时间为700 ms。刺激电极采用两对双极表面电极(VitalStim®,adult sized,REF 59000),电极直径为2.1 cm。一对电极放置于两侧颏下区域,舌骨上1 cm,颈中线左右旁开1 cm处。另一对电极放置于舌骨与甲状软骨之间中点,颈中线左右旁开1 cm处。首先确定患者的感觉阈值。逐步增加刺激强度,此后加大电流强度,直至患者出现可视性颈部肌肉收缩或达到最大承受强度。记录患者最大承受电流强度。真刺激强度设置为患者颈部出现可视性肌肉收缩时的输出强度。假刺激强度设置为患者感觉阈值强度。每次刺激20 min,每天1次,每周5 d,持续4周。
1.4 研究指标 记录患者基本信息(性别、年龄、病程、卒中性质及病变部位等)。治疗前使用美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评估神经功能情况,使用改良Rankin量表(modified Rankin Scale,mRS)评估功能残疾水平。
所有患者均在治疗前3 d内进行VFSS检查,记录4种食团吞咽中Rosenbek渗透-误吸量表(penetration-aspiration scale,PAS)评分及吞咽咽期运动学参数。运动学参数中时间参数包括咽传递时间(pharyngeal transit time,PTT)、咽延迟时间(pharyngeal delayed time,PDT)。空间参数包括舌骨向前最大幅度、向上运动最大幅度;喉向前最大幅度和向上运动最大幅度[8]。食团气道侵入程度用PAS量表进行评估[9]。治疗结束后3 d内再次进行VFSS,记录上述吞咽运动学参数。比较两组间治疗前后吞咽运动学参数的差异。
1.5 统计学方法 采用SPSS 18.0进行统计学处理。计量资料先进行正态性检验及方差齐性检验,符合正态分布的计量资料用(表示,组间均数比较采用独立样本t检验,组内治疗前后比较采用配对t检验;不符合正态分布的计量数据用中位数和四分位数表示,组间采用秩和检验。计数资料以频数表示,采用χ2检验。PAS评分按等级资料行秩和检验。以P<0.05为差异有显著性。
2 结果
2.1 一般资料 共有43例患者入选本研究,研究组23例,其中男性14例,女性9例,平均(59.1±11.2)岁;对照组20例,其中男性12例,女性8例,年龄(61.6±10.3)岁。两组患者性别、年龄、入组时病程、卒中性质、卒中部位、入组时NIHSS评分及mRS评分差异均无显著性(表1)。
2.2 两组患者治疗前后PAS评分比较 治疗前后两组患者各食团PAS评分组间比较均无显著差异。对照组治疗后各种食团PAS评分均较本组治疗前显著下降,其中3 ml液体、10 ml液体、半固体和固体的P值分别为0.017、0.002、0.008和0.014;研究组治疗后各种食团PAS评分也均较本组治疗前显著下降,其中3 ml液体、10 ml液体、半固体和固体的P值分别为0.008、0.034、0.001和<0.001(表2)。
2.3 两组患者VFSS时间和空间参数比较
2.3.1 时间参数比较 两组间治疗前后的PTT、PDT均无显著差异。对照组和研究组治疗后不同食团的PTT均较同组治疗前显著下降,其中研究组3 ml液体、10 ml液体、半固体和固体的P值分别为0.014、0.013、0.019和0.043。对照组和研究组治疗后不同食团的PDT均较同组治疗前显著下降,其中对照组3 ml液体、10 ml液体、半固体和固体的P值分别为0.034、0.004、<0.001和<0.001;研究组3 ml液体、10 ml液体、半固体和固体的P值分别为0.028、0.002、<0.001和<0.001(表3)。
2.3.2 空间参数比较 治疗前两组间舌骨向前、向上运动,喉向前、向上运动的最大幅度差异均无显著性。治疗后,研究组各食团吞咽时舌骨向上运动的最大幅度均较对照组显著增大,其中3 ml液体、10 ml液体、半固体和固体吞咽时P值分别为0.019、0.021、0.046和<0.001;喉向上运动的最大幅度也均较对照组增大,其中3 ml液体、10 ml液体、半固体和固体吞咽时P值分别为<0.001、0.023、<0.001和<0.001。两组舌骨向前、喉向前运动差异无显著性。
对照组治疗后3 ml液体吞咽时舌骨向前(P=0.002)、向上运动(P<0.001)及喉向上(P=0.039)、向前运动(P=0.034)最大幅度均较同组治疗前提高;10 ml液体吞咽时喉向前运动的最大幅度较治疗前提高(P=0.005),而舌骨向上、向前运动及喉向上运动最大幅度均较治疗前无显著变化;半固体吞咽时,舌骨向前运动(P=0.001)、喉向前运动(P=0.021)、喉向上运动(P=0.003)的最大幅度较治疗前提高,而舌骨向上运动的最大幅度较治疗前无明显变化;固体吞咽时舌骨向前(P=0.007)、喉向前(P=0.004)及喉向上运动(P=0.002)的最大幅度较治疗前提高,而舌骨向上运动的最大幅度均较治疗前无显著变化。

表1 对照组和研究组一般资料比较
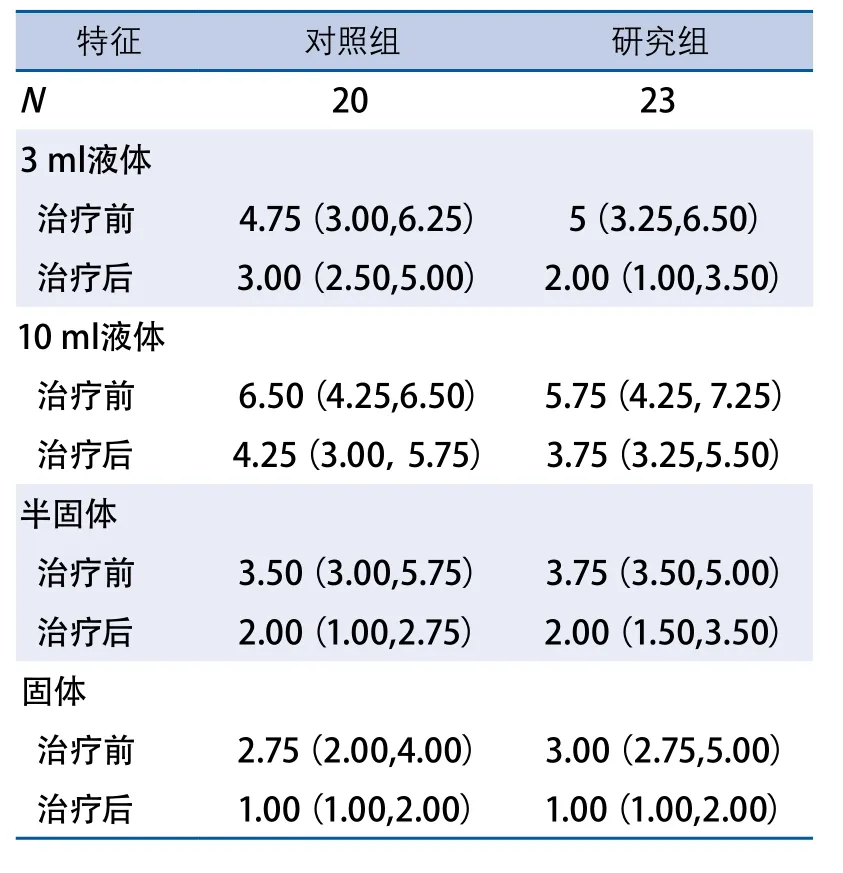
表2 两组患者渗透-误吸量表评分比较(分)
研究组治疗后4种食团吞咽时舌骨向前运动、舌骨向上运动、喉向前运动、喉向上运动的最大幅度均较治疗前提高,其中3 ml液体吞咽P值分别为0.003、<0.001、0.038和0.015;10 ml液体吞咽P值分别为0.011、0.019、0.001和<0.001;半固体吞咽P值分别为0.001、0.039、0.019和<0.001;固体吞咽P值分别为0.016、0.021、0.006和0.001(表4)。

表3 两组患者视频透视吞咽检查时间参数比较

表4 两组患者治疗前后视频透视吞咽检查空间参数变化
3 讨论
吞咽运动是由多种感觉、运动神经共同支配的复杂运动,可以人为地按照食团的位置分为口腔准备期、口腔期、咽期和食管期[10]。实际上吞咽运动各期之间密不可分,在中枢神经系统的调控下,各期协同运动完成。误吸是吞咽障碍最为严重的表现,是指在吞咽过程中,有数量不等的液体或固体,包括分泌物等进入到声门以下,出现在吞咽运动的咽期[11]。
卒中可造成口咽部感觉障碍、肌肉运动功能障碍,导致患者出现:吞咽启动延迟,食团进入咽部而声门尚未关闭导致吞咽前误吸;吞咽时喉-舌骨复合体活动不良,不能完全遮蔽声门导致吞咽中误吸;吞咽后仍有食团残留咽部可导致吞咽后误吸。目前针对吞咽障碍的治疗多是针对上述问题的一个或多个方面进行。目前,临床认可的NMES可能的作用机制是通过电极传递一个小的经皮电流来刺激神经肌肉接头,绕过受损中枢神经环路而激活神经组织及对应肌肉,从而产生肌肉收缩,使神经肌肉功能恢复[12]。有研究认为应用NMES可使咽部肌肉收缩能力增强,从而减少误吸,改善吞咽功能[13]。目前,有关NMES对卒中后吞咽障碍的疗效尚无统一认识。本研究采用随机对照研究对NMES的疗效与假刺激进行了比较,系统观察了4种食团吞咽的气道侵入情况及时空运动学参数,以及客观准确地反映NMES对患者吞咽功能的影响。
本研究结果显示,治疗后两组患者PAS评分均较治疗前明显下降,吞咽运动时间缩短,舌骨、喉运动幅度加大,表明吞咽相关结构运动能力提高、吞咽的安全性提高。所以,NMES和常规吞咽康复训练均可改善卒中患者的吞咽功能。不同食团下两组间比较,治疗前2组间舌骨向前、向上运动,喉向前、向上运动的最大幅度差异均无显著性;治疗后研究组各食团吞咽时舌骨向上运动、喉向上运动的最大幅度均较对照组增大,但两组舌骨向前、喉向前运动差异无显著性,表明患者各食团吞咽时喉及舌骨运动幅度有提高,提示咽部肌肉收缩力得到一定程度增强。但两组间治疗前、后的PTT、PDT差异均无显著性,两组间治疗前后各种食团吞咽中PAS评分比较差异均无显著性,提示这种治疗可以提高咽喉部肌肉收缩能力,但对改善渗透-误吸的作用不明显。已有研究表明,对于神经源性吞咽障碍患者,NMES技术的疗效与常规吞咽康复训练比较,效果并无明显差异,并不能明显减轻患者吞咽时食团侵入气道程度[5,14-15]。产生这种结果的原因可能是NMES首先选择性地优先募集Ⅱ型肌纤维,而Ⅱ型肌纤维比Ⅰ型肌纤维具有更强的收缩能力,所以电刺激的肌力增强作用比单纯主动肌力增强训练更强[16]。Park等[17]研究也表明,NMES可提高舌骨、喉的运动幅度。但吞咽障碍尤其是误吸产生机制不仅是控制喉舌运动的肌肉肌力减弱,同时也由口咽部感觉障碍运动协调、模式异常等诸多因素造成,所以单纯提高肌力并不能完全改善吞咽功能[18]。
综上所述,对卒中吞咽障碍患者进行治疗时,应从患者吞咽功能客观检查结果出发选择适宜的治疗方法。对咽部收缩不足、喉抬高幅度低的患者适宜采用NMES术;而对咽部感觉差,VFSS表现为隐匿性误吸,咽延迟时间延长的患者,应用该技术并无明显效果。然而,由于本研究观察周期较短,不能说明NMES对吞咽障碍治疗的长期效果。同时,由于入组病例数限制未对患者病变部位进行分组分析,尚不能说明NMES对不同部位卒中患者治疗作用是否存在差异,有待后续研究进一步明确NMES对吞咽障碍的治疗价值。
1 Takizawa C,Gemmell E,Kenworthy J,et al. A systematic review of the prevalence of oropharyngeal dysphagia in stroke,Parkinson's disease,Alzheimer's disease,head injury,and pneumonia[J]. Dysphagia,2016,31:434-341.
2 Cecconi E,Di Piero V. Dysphagia--pathophysiology,diagnosis and treatment[J]. Front Neurol Neurosci,2012,30:86-89.
3 Rogus-Pulia N,Robbins J. Approaches to the rehabilitation of dysphagia in acute poststroke patients[J]. Semin Speech Lang,2013,34:154-169.
4 Bulow M,Speyer R,Baijens L,et al. Neuro-muscular electrical stimulation (NMES) in stroke patients with oral and pharyngeal dysfunction[J]. Dysphagia,2008,233:302-309.
5 Philip M,Polly S,Jo L,et al. Pharyngeal electrical stimulation for treatment of dysphagia in subacute stroke[J]. Stroke,2016,47:1562-1570.
6 Clark H,Lazarus C,Arvedson J. Evidence-based systematic review:effects of neuromuscular electrical stimulation on swallowing and neural activation[J]. Am J Speech Lang Pathol,2009,18:361-375.
7 中华神经科学会. 各类脑血管病诊断要点[J]. 中华神经科杂志,1996,29:379-380.
8 Bingjie L,Tong Z,Xinting S,et al. Quantitative videofluoroscopic analysis of penetration-aspiration in post-stroke patients[J]. Neurol India,2010,58:42-47.
9 Robbins JA,Sufit R,Rosenbek J,et al. A modification of the modified barium swallow[J]. Dysphagia,1987:83-86.
10 Aslam M,Michael FV. Dysphagia in the elderly[J]. Gastroenterol Hepatol,2013,9:784-795.
11 Cohen DL,Roffe C,Beavan J,et al. Post-stroke dysphagia:A review and design considerations for future trials[J]. Int J Stroke,2016,11:399-411.
12 Huang KL,Liu TY,Huang YC,et al. Functional outcome in acute stroke patients with oropharyngeal dysphagia after swallowing therapy[J]. J Stroke Cerebrovasc Dis,2014,23:2547-2553.
13 Park JW,Oh JC,Lee HJ,et al. Effortful swallowing training coupled with electrical stimulation leads to an increase in hyoid elevation during swallowing[J]. Dysphagia,2009,24:296-301.
14 Christiaanse ME,Mabe B,Russell G. Neuromuscular electrical stimulation is no more effective than usual care for the treatment of primary dysphagia in children[J]. Pediatr Pulmonol,2011,46:559-565.
15 Langmore SE,McCulloch TM,Krisciunas GP,et al. Efficacy of electrical stimulation and exercise for dysphagia in patients with head and neck cancer:A randomized clinical trial[J]. Head Neck,2016,38:E1221-1231.
16 Poorjavad M,Talebian Moghadam S,Nakhostin Ansari N,et al. Surface electrical stimulation for treating swallowing disorders after stroke:a review of the stimulation intensity levels and the electrode placements[J]. Stroke Res Treat,2014:918 057.
17 Park JS,Oh DH,Hwang NK,et al. Effects of neuromuscular electrical stimulation combined with effortful swallowing on post-stroke oropharyngeal dysphagia:a randomised controlled trial[J]. J Oral Rehabil,2016,43:426-434.
18 González-Fernández M,Ottenstein L,Atanelov L,et al. Dysphagia after stroke:an overview[J]. Curr Phys Med Rehabil Rep,2013,1:187-196.
【点睛】应用视频X线检查吞咽时气道侵入及运动学参数对卒中后吞咽障碍患者的治疗效果进行观察,显示神经肌肉电刺激和常规吞咽康复训练均可改善卒中患者的吞咽功能,而且神经肌肉电刺激更能提高喉-舌骨复合体的向上运动。
