有机纳米材料在植物核酸递送中的研究进展
2018-01-06霍爱玲陈金慧甄艳夏兵陈桢雨施季森
霍爱玲+陈金慧+甄艳+夏兵+陈桢雨+施季森
摘要: 将外源遗传物质导入植物细胞是植物生物技术研究中一项非常重要的技术,对农林业的发展有十分重要的意义,目前常用的植物转基因方法主要包括农杆菌转染法和基因枪法,随着纳米生物技术的发展,基于纳米材料为载体的植物转基因技术为植物遗传转化提供了新途径。本文综述了近年来有机纳米材料作为外源基因载体的特点、携带基因的能力、进入受体植物细胞的机制,并展望了有机高分子纳米载体在植物遗传转化中的应用,以期促进植物转基因技术的发展。
关键词: 有机纳米材料;载体;核酸递送;壳聚糖;聚乙烯亚胺;多聚赖氨酸;树枝状聚合物
中图分类号: Q785 文献标志码: A
文章编号:1002-1302(2017)22-0001-04
自1983年首次研究获得转基因烟草以来,植物转基因技术迅速发展,至2015年全球转基因作物的种植面积已达到1.797亿hm2。植物基因传递系统——将外源基因导入植物细胞的方法,是植物生物技术中一个最基本的技术。目前可以使用不同的方法将外源基因导入植物基因组中[3]。根据转化过程中是否使用载体介导,通常可以分为载体介导转化和直接遗传转化。在常用的载体介导转基因方法中,农杆菌介导是最广泛使用的转化手段;基因枪法是另一种常用的转基因手段,但是转化率较低、会产生大量嵌合体等问题是限制其使用的主要瓶颈。将植物细胞酶解去壁后获得原生质体再进行遗传转化,也是一类常用的转基因方法,但原生质体再生完整植株的难度较大、稳定性差的特点限制了这种方法在植物转基因中的广泛应用。针对上述植物转基因技术的局限,研发新的转基因方法和挖掘新的基因载体成为现代基因工程研究中的热点,业界期待着植物转基因新理论和新技术的突破,来促进植物转基因技术及其相关产业的发展。相对于源自病毒基因改造的遗传转化载体,基于纳米材料构建的载体具有制备容易、稳定性好、容易修饰、生物和环境安全性高等优点,因此纳米生物技术已成为划时代、跨学科的研究重点[4]。
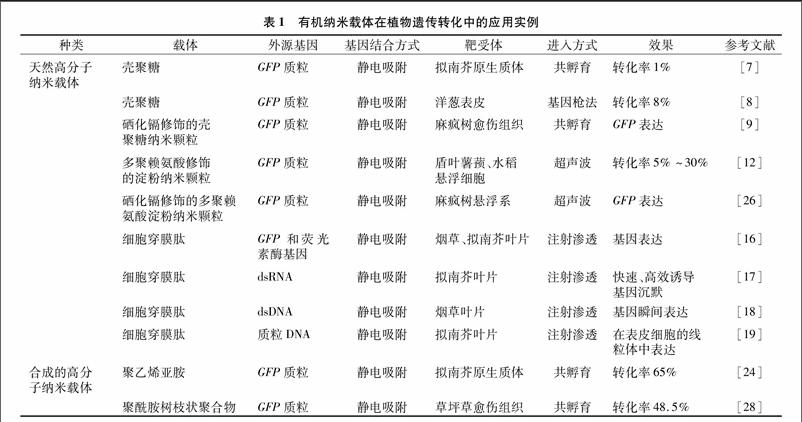
根据纳米材料的组成,可分为无机纳米材料和有机高分子纳米材料,其中无机纳米材料用作植物转基因载体开展得较早,已有较多介绍。本文重点介绍有机纳米材料载体转基因技术的特点,并结合其在植物基因转化研究中的应用实例阐述这些方法的优点及存在的问题,详见表1。
1 天然高分子纳米基因载体
1.1 壳聚糖(chitosan,简称CS)
壳聚糖是广泛分布于甲壳类动物、昆虫和真菌细胞壁中的甲壳质在碱作用下脱乙酰化后得到的氨基多糖。Mulligan等首次利用壳聚糖为载体把外源DNA运输到哺乳动物细胞内,壳聚糖纳米载体由于来源天然、生物相容性好、可生物降解、可溶性强、无毒等特点,在生物医学上成为研究较多的天然高分子纳米基因载体系统[5-6]。
在植物转基因研究中,壳聚糖纳米载体的研究处于刚刚起步阶段。宋瑜等用壳聚糖为基因载体,制备了CS/DNA纳米复合物,直接将绿色荧光蛋白基因(简称GFP)转化到拟南芥原生质体中,但转化效率很低,而且对细胞有毒害作用[7]。王凤华等用交联法制备了壳聚糖纳米颗粒,通过静电作用吸附质粒DNA后,用基因枪法转化洋葱细胞,观察到有8%的细胞转化成功并表达目的基因[8]。Wang等通过静电吸附作用将CS/DNA纳米颗粒和硒化镉量子点(简称QDs)纳米颗粒连接起来,制备了CS/DNA—QDs复合纳米颗粒[9]。这种复合纳米颗粒对外源基因具有显著的酶切保护作用,并实现了GFP转载基因在麻疯树细胞内的表达。
从上述研究结果来看,壳聚糖纳米载体在植物细胞中的转化效率较低,对去壁的植物细胞原生质体有一定的毒性。但壳聚糖作为一类天然的高分子聚合物,可以对其进行化学和生物学的修饰来提高它在生理溶液中的稳定性、基因转移的特异性和在细胞内逃逸的能力。壳聚糖被开发成为一类环境友好的新型植物基因工程介导物质具有较好的前景。
1.2 淀粉
淀粉是一类价格便宜、产量丰富、可再生的天然材料,通过物理、化学或者酶解的方法可以大大改善它的性能。在医药领域,淀粉常被用作填充剂,由于它具有生物相容性和生物可降解性,也常被用作药物和基因载体系统。Xiao等利用反向微乳液法合成多聚赖氨酸-淀粉纳米颗粒,在乳腺癌细胞中成功地进行了转化试验[10]。Liu等研究表明,在利用超声波介导的基因转移试验中发现,多聚赖氨酸淀粉纳米基因载体能够保护DNA,使其不受超声波的影响,而裸露的DNA则会被超声波破坏[11]。Liu等在超声波的作用下,用多聚赖氨酸淀粉纳米颗粒将含有绿色荧光蛋白的质粒转入到盾叶薯蓣和水稻悬浮细胞中并实现了表达[12]。Wang等利用反向微乳液法合成磁性淀粉纳米颗粒,包封多聚赖氨酸,连接异硫氰酸荧光素(简称FITC),得到了既有荧光标记、又有磁性的双功能淀粉纳米颗粒,有望成为一种新型的基因载体[13]。
1.3 细胞穿膜肽(cell-penetrating peptides,简称CPPs)
细胞穿膜肽是一大类由10~30个氨基酸组成的短肽,具有很强的跨膜转运能力,能够携带多种活性物质进入细胞,而且可以导入几乎所有的细胞中[14]。由于细胞穿膜肽具有很强的跨膜转运能力,对细胞膜不会产生永久性损伤,在一定浓度范围内对宿主细胞无毒害作用。因此,细胞穿膜肽作为一种新型的药物输送工具和基因治疗的载体引起人们极大的关注和广泛的使用[15]。
在植物基因运载方面,近几年Lakshmanan等利用细胞穿膜肽载体分别将质粒DNA、dsRNA、dsDNA用注射渗透法转化烟草和拟南芥的叶片,可以实现外源基因在植物细胞内的瞬间表达或者快速、高效诱导基因沉默[16-18]。最近,Chuah等用含有线粒体定位肽的阳离子聚合物结合质粒DNA,单独或者同细胞穿膜肽再结合,用注射渗透法转化拟南芥叶片,孵育12 h后,報告基因能够在拟南芥叶片表皮细胞的线粒体中表达[19]。从已有的研究报道可见,细胞穿膜肽作为基因载体可将质粒DNA、dsRNA、dsDNA转运进入完整的植物细胞或者某个特定的细胞器中并表达。未来经过优化和提高其转化率后,细胞穿膜肽这类信号肽类的载体有望成为又一类新兴的植物转基因载体,但其入胞机制特别是如何穿过植物细胞壁还值得进一步研究。endprint
2 合成的高分子纳米基因载体
除了利用天然高分子材料制备纳米基因载体之外,用人工合成的高分子材料制备纳米基因载体更具优势,合成和制备相对容易、经济,并且能够规模化生产。目前在植物基因转化中使用较多的由合成高分子材料制备的纳米载体包括聚乙烯亚胺(polyethylenimine,简称PEI)、多聚赖氨酸(poly-L-lyine,简称PLL)和树枝状聚合物。
2.1 聚乙烯亚胺
聚乙烯亚胺是一种常用的阳离子聚合物,是动物细胞转基因中常用的体外或体内非病毒基因载体,主要以分支状或线状结构形式存在[20]。分支状聚乙烯亚胺含有伯胺、仲胺、叔胺,线状聚乙烯亚胺主要含有仲胺。这些氨基基团使分支状聚乙烯亚胺在较宽pH值范围内具有缓冲能力,即所谓的“质子海绵效应”,PEI/DNA复合物被细胞内吞后,引起外源质子内流,随后水分大量涌入导致内吞囊泡裂解、释放出的PEI/DNA复合物穿过核膜进入细胞核,通过这个过程完成基因转染[21-22]。由于PEI本身对动物细胞有一定的毒害作用,最近主要通过使用交联低分子量PEI或者将低分子量PEI和生物可分解的阴离子基团结合起来的方法来减少PEI载体对细胞的毒性,提高转染率[23]。在用于植物基因转染方面,Ying等以PEI(分子量25 000)为载体介导含有绿色荧光蛋白的质粒在拟南芥原生质体中瞬间表达,转化率达到65%[24]。但PEI是否能进入有壁的植物细胞以及进入植物原生质体的机制尚有待进一步研究。
2.2 多聚赖氨酸
多聚赖氨酸是一种以赖氨酸分子为重复单元的线状多肽结构,它最大的优点是易于对其结构进行修饰,因此常被用作修饰物结合到其他纳米材料的表面[25]。在生理条件下,多聚赖氨酸中的氨基被质子化,能与DNA通过静电作用结合,多聚赖氨酸与DNA能以不同的比例相结合,相应形成从50 nm到700 nm不同尺寸的微粒。由于多聚赖氨酸缺少等电点处于5~7之间的氨基基团,利用多聚赖氨酸作为基因载体时,须要额外提供辅助因子如加入融合肽或氯喹,以促使溶酶体或内吞体裂解。在植物中尚未见将多聚赖氨酸单独用作基因载体的报道,多是将其修饰在其他纳米材料表面用于结合质粒DNA[19,26]。
2.3 树枝状聚合物
树枝状聚合物指的是一类以内核分子为中心,延伸出许多具有树枝状高度分枝结构的球形分子,常用的包括聚乙二胺、聚乙烯亚胺和聚酰胺树枝状聚合物[27]。其中,聚酰胺树枝状聚合物(polyamidoamine dendrimers,简称PAMAM)由于容易合成,也容易得到市售产品,成为一类广泛使用的基因运送聚合物载体。PAMAM的基本特点是分散指数较低,容易形成球形,不饱和双键数量多,表面功能特性易于控制等。树枝状聚合物通常是通过分支末端带正电荷的基团和DNA带负电荷的磷酸基团之间的静电作用相互结合,形成直径约为50 nm的DNA-树枝状多聚复合物,能够保护DNA免受核酸酶的降解作用。在植物转基因研究中,Pasupathy等曾使用PAMAM将绿色荧光蛋白的质粒导入草坪草的愈伤组织细胞中,转化率可以达到48.5%[28]。
3 高分子纳米载体的入胞机制
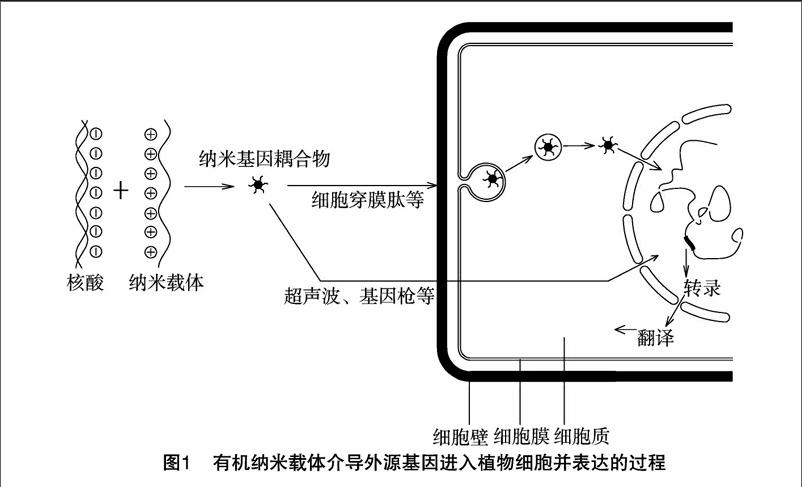
制备的纳米材料与基因耦合构建成的转基因载体,能否顺利穿过细胞壁进入植物细胞,是能否在植物转基因工程中应用的关键。而纳米载体的入胞机制和效率,受到纳米材料尺寸、表面理化性质、植物细胞壁特征、共孵育环境条件等诸多因素的影响。目前,已经成功将外源基因导入植物细胞的有机纳米载体有壳聚糖、淀粉纳米颗粒、细胞穿膜肽、聚乙烯亚胺等,揭示的纳米载体携带外源基因进入植物细胞的机制见图1。
首先,DNA或RNA等外源分子可以通过疏水作用、静电吸附作用或共价键结合等结合在纳米颗粒的表面或者封装在纳米颗粒的内部,形成装载有外源基因的纳米颗粒耦合物。载有外源基因的纳米颗粒耦合物可以通过2条途径将外源基因送进植物细胞并得到表达。一类是利用物理力或场对细胞施加的主动影响,如电激、超声波、基因枪、外加磁场或低能重离子束场,在细胞上同时形成一些可逆的瞬间通道,外源基因被直接送入到细胞质或细胞核内[29];另一类是利用载有外源基因的纳米颗粒耦合物通过静电吸附等作用附着在植物组织或细胞的周围,然后经胞间连丝等细胞壁上的孔隙通过细胞壁,或者利用修饰过的工程纳米颗粒同细胞壁上受体的相互作用来扩大细胞壁的孔径以提高纳米颗粒的摄入[16]。穿过细胞壁后,大多数纳米颗粒耦合物载体通过细胞膜的内吞作用进入细胞质,有的可能通过细胞膜上的转运载体蛋白或者离子通道转运进入细胞质。Ghosh等认为,纳米载体携带的基因,进入到细胞以后,在细胞内源因素(如pH值刺激)和外源因素(如光刺激)的激发下释放出纳米载体所携带的遗传物质。显然内源的激发基因释放机制是按照生物学的方式运作的,而外源的激发基因释放机制则提供一种可以通过时间和空间控制释放基因的方法[30]。
其次,DNA导入细胞核并整合到植物基因组中發挥功能。一般来说,分子都是通过核孔复合物进入细胞核的。对于DNA是单独进入细胞核还是与纳米载体整合后一起进入细胞核仍无定论,目前主要有2种理论。一种是纳米载体在内涵体或细胞质中被溶解,然后释放DNA转运进核,同植物细胞的基因组发生非同源重组,从而整合到植物基因组上得以稳定表达;另一种是携带DNA的纳米载体直接到达细胞核表面,然后DNA转运进核,并离开基因载体还原成具有生物活性的DNA,最后经过转录、翻译步骤合成目标蛋白[31]。
4 展望
虽然按照构成材料组成可以将纳米颗粒分为无机和有机2种,在纳米材料载体实际的制备和运用中,通常是充分利用各类材料的优势,使用的是复合型纳米材料。例如常在各类无机纳米颗粒和有机高分子材料的表面修饰上多聚赖氨酸、聚乙烯亚胺等高分子聚合物,甚至是再连接上量子点荧光标记或者加上细胞穿膜肽等靶分子,使其成为一个“超级复合纳米载体”——可以大量装载DNA、RNA等外源基因,高效定向地进入有壁的植物细胞实现外源基因的稳定表达。endprint
多基因轉化是近年来植物转基因研究的一个亮点,而纳米载体转化法容量大,一次可将多个不同的质粒导入细胞内,并可在细胞内源因素和外源因素的作用下实现基因的可控释放,这些特点为植物基因功能的研究提供了一条新的途径。
[HS2][HT8.5H]参考文献:
[1] Herrera-Estrella L,van den Broeck G,Maenhaut R,et al. Light-inducible and chloroplast-associated expression of a chimaeric gene introduced into Nicotiana tabacum using a Ti plasmid vector[J]. Nature,1984,310(5973):115-120.
[2]James C,Teng P,Arujanan M,et al. Global status of commercialized biotech/GM crops:2015[R]. New York:ISAAA,2015.
[3]Chilton M D. Adding diversity to plant transformation[J]. Nature Biotechnology,2005,23(3):309-310.
[4]Medintz I L,Tirrell M. Editorial overview:nanobiotechnology:a time-stamped cross-sectional analysis[J]. Current Opinion in Biotechnology,2015,34:vii-ix.
[5]Mulligan R C,Howard B H,Berg P. Synthesis of rabbit β-globin in cultured monkey kidney cells following infection with a SV40 β-globin recombinant genome[J]. Nature,1979,277(5692):108-114.
[6]Buschmann M D,Merzouki A,Lavertu M,et al. Chitosans for delivery of nucleic acids[J]. Advanced Drug Delivery Reviews,2013,65(9):1234-1270.
[7]宋 瑜,李 颖,崔海信,等. 两种阳离子纳米基因载体及植物基因介导效果的研究[J]. 生物技术通报,2009(6):75-80.
[8]王凤华,刘 俊,唐冬英,等. 基于壳聚糖纳米颗粒的基因枪法转化洋葱细胞研究[J]. 湖南大学学报(自然科学版),2009,36(5):67-70.
[9]Wang Q,Chen J N,Zhang H Y,et al. Synthesis of water soluble quantum dots for monitoring carrier-DNA nanoparticles in plant cells[J]. Journal of Nanoscience and Nanotechnology,2011,11(3):2208-2214.
[10] Xiao S Y,Liu X M,Tong C Y,et al. Studies of poly-L-lysine-starch nanoparticle preparation and its application as gene carrier[J]. Science in China Series B:Chemistry,2005,48(2):162-166.
[11]Liu J,Liu X M,Xiao S Y,et al. Bioconjugated nanoparticle for DNA protection from ultrasound damage[J]. Analytical Sciences,2005,21(3):193-195.
[12]Liu J,Wang F H,Wang L L,et al. Preparation of fluorescence starch-nanoparticle and its application as plant transgenic vehicle[J]. Journal of Central South University of Technology,2008,15(6):768-773.
[13]Wang F H,Liu J,Tang D Y,et al. Synthesis and biochemical properties of fluorescent/magnetic bifunctional starch particles[J]. Journal of Central South University of Technology,2010,17(2):211-217.
[14]Chugh A,Eudes F,Shim Y S. Cell-penetrating peptides:nanocarrier for macromolecule delivery in living cells[J]. Iubmb Life,2010,62(3):183-193.
[15]Farkhani S M,Valizadeh A,Karami H,et al. Cell penetrating peptides:efficient vectors for delivery of nanoparticles,nanocarriers,therapeutic and diagnostic molecules[J]. Peptides,2014,57:78-94.endprint
[16]Lakshmanan M,Kodama Y,Yoshizumi T,et al. Rapid and efficient gene delivery into plant cells using designed peptide carriers[J]. Biomacromolecules,2012,14(1):10-16.
[17]Numata K,Ohtani M,Yoshizumi T,et al. Local gene silencing in plants via synthetic dsRNA and carrier peptide[J]. Plant Biotechnology Journal,2014,12(8):1027-1034.
[18]Lakshmanan M,Yoshizumi T,Sudesh K,et al. Double-stranded DNA introduction into intact plants using peptide-DNA complexes[J]. Plant Biotechnology,2015,32(1):39-45.
[19]Chuah J A,Yoshizumi T,Kodama Y,et al. Gene introduction into the mitochondria of Arabidopsis thaliana via peptide-based carriers[J]. Scientific Reports,2015,5:7751.[HJ1.78mm]
[20]Boussif O,Lezoualch F,Zanta M A,et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo:polyethylenimine[J]. Proceedings of the National Academy of Sciences,1995,92(16):7297-7301.
[21]Godbey W T,Wu K K,Mikos A G. Poly (ethylenimine) and its role in gene delivery[J]. Journal of Controlled Release,1999,60(2):149-160.
[22]Godbey W T,Wu K K,Mikos A G. Poly (ethylenimine)-mediated gene delivery affects endothelial cell function and viability[J]. Biomaterials,2001,22(5):471-480.
[23]Taranejoo S,Liu J,Verma P,et al. A review of the developments of characteristics of PEI derivatives for gene delivery applications[J]. Journal of Applied Polymer Science,2015,132(25):1-8.
[24]Ying L I,Cui H,Yu S,et al. Transient expression of exogenous gene into plant cell mediated by PEI nanovector[J]. Agricultural Sciences in China,2011,10(6):820-826.
[25]Park S,Healy K E. Nanoparticulate DNA packaging using terpolymers of poly (lysine-g-(lactide-b-ethylene glycol))[J]. Bioconjugate Chemistry,2003,14(2):311-319.
[26]孔倩倩. 麻瘋树高效再生体系的建立及纳米载体转基因技术研究[D]. 长沙:中南林业科技大学,2010:29-37.
[27]Shcharbin D G,Klajnert B,Bryszewska M. Dendrimers in gene transfection[J]. Biochemistry (Moscow),2009,74(10):1070-1079.
[28]Pasupathy K,Lin S,Hu Q,et al. Direct plant gene delivery with a poly (amidoamine) dendrimer[J]. Biotechnology Journal,2008,3(8):1078-1082.
[29]余增亮. 离子束生物技术引论[M]. 合肥:安徽科学技术出版社,1998:250-267.
[30]Ghosh P,Han G,De M,et al. Gold nanoparticles in delivery applications[J]. Advanced Drug Delivery Reviews,2008,60(11):1307-1315.
[31]Miller G,van Schaik D. Nanotechnology in food and agriculture [M]. Switzerland:Springer International Publishing,2008:209-240.endprint
