新疆维吾尔族与汉族溃疡性结肠炎患者肠黏膜组织炎性细胞因子及信号传导蛋白和转录激活物3表达差异研究*
2018-01-05谭庆华
杨 涛,周 禾,崔 旻,姚 萍,谭庆华
(新疆医科大学第一附属医院消化科,乌鲁木齐 830000)
论著·临床研究
新疆维吾尔族与汉族溃疡性结肠炎患者肠黏膜组织炎性细胞因子及信号传导蛋白和转录激活物3表达差异研究*
杨 涛,周 禾,崔 旻,姚 萍△,谭庆华
(新疆医科大学第一附属医院消化科,乌鲁木齐 830000)
目的探讨新疆维吾尔自治区维吾尔族溃疡性结肠炎(UC)患者肠黏膜组织中炎性细胞因子及信号转导蛋白和转录激活因子3(STAT3)表达与汉族UC患者的差异。方法选取2015年6月至2016年10月该院住院UC患者30例(维吾尔族15例,汉族15例)作为UC组,另选取同期健康检查者26例(维吾尔族13例,汉族13例)作为对照组,取受试者肠黏膜组织采用反转录PCR检测干扰素-γ(IFN-γ)、白细胞介素(IL)-22、IL-17A、IL-17F mRNA表达水平,并采用免疫组织化学法进行STAT3的检测。结果与维吾尔族对照组相比,维吾尔族UC组患者IFN-γ、IL-22、IL-17A、IL-17F mRNA表达水平都上调,差异均有统计学意义(P<0.05);与汉族对照组相比,汉族UC组患者上述炎性因子mRNA表达水平都上调,差异均有统计学意义(P<0.05);而汉族UC组与维吾尔族UC组患者上述炎性因子mRNA表达水平比较,差异均无统计学意义(P>0.05)。通过免疫组织化学法,STAT3在肠黏膜上皮细胞细胞质中着色,汉族、维吾尔族UC组阳性表达率均高于相应对照组,差异均有统计学意义(P<0.05);而维吾尔族UC组与汉族UC组相比,差异无统计学意义(P>0.05)。结论在新疆维吾尔自治区,维吾尔族和汉族UC患者肠黏膜IFN-γ、IL-22、IL-17A、IL-17F及STAT3表达明显增高,但上述因子在维吾尔族与汉族患者UC的发生、发展中可能无明显差异。
结肠炎,溃疡性;干扰素-γ;白细胞介素22;白细胞介素17A;白细胞介素17F;信号转导蛋白和转录激活因子3
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性、非特异性的肠道炎症性疾病。目前认为该病是在一定的遗传背景下,人体免疫系统对肠道微生物出现局部免疫高反应所致[1-2]。特定的遗传变异是炎症性肠病发病的一个直接原因。辅助性T淋巴细胞(Th)17是一类CD4+T淋巴细胞亚群,其分泌的细胞因子白细胞介素(IL)-17A、IL-17F与炎症表达密切相关,IL-22的表达受信号转导蛋白和转录激活因子3(STAT3)调控,释放干扰素-γ(IFN-γ)等促炎因子,引起炎性反应。此外,UC的发病存在一定的种族和地区差异,这可能与患者居住的环境、卫生条件、生活水平、饮食习惯等相关[3]。新疆是一个多民族聚集地,由于独特的地理环境、气候、饮食结构等,使许多疾病的发病情况和临床特点表现出独特之处。相关调查显示,新疆汉族与维吾尔族UC的发病情况及临床特点不同,维吾尔族UC的发病率高于汉族,且中、重度患者明显多于汉族,但导致这种差异的原因目前尚不清楚[4]。本研究旨在通过检测新疆维吾尔族及汉族UC患者及对照组肠黏膜组织中IFN-γ、IL-22、IL-17A、IL-17F及STAT3的表达,分析上述因子在维吾尔族与汉族患者间有无差异。
1 资料与方法
1.1一般资料 收集2015年6月至2016年10月本院消化科住院的UC患者30例(UC组),UC的诊断采用2001年中华医学会消化病学分会《对炎症性肠病诊断治疗规范的建议》[5]。UC患者中维吾尔族患者15例(维吾尔族UC组),其中男8例,女7例,发病年龄(47.46±8.27)岁;汉族患者15例(汉族UC组),其中男6例,女9例,发病年龄(52.13±6.87)岁。所有UC患者均接受肠镜检查并随访半年以上。另选取同期在本院行结肠镜检查者26例作为健康对照组,其中维吾尔族13例(维吾尔族对照组),男5例,女8例,平均年龄(43.52±5.28)岁;汉族13例(汉族对照组),男6例,女7例,平均年龄(49.37±7.92)岁。临床数据从患者的病历和问卷调查中收集,分析、总结并研究受试者的主要临床特征:所有受试者的性别、年龄等经Hardy-Weinberg平衡检验显示处于遗传平衡状态。该研究通过本院伦理审批经(伦理号:20140818-03),所有标本的获取均获得研究对象的知情同意。
1.2主要仪器与试剂 (1)试剂:TRIzol®Reagent RNA提取试剂(美国Invitrogen公司);6×上样缓冲液(日本Takara公司);溴化乙啶(美国Sigma公司);FastQuant RT Kit (With gDNase)试剂盒(北京天根生化科技有限公司);SYBR Select Master Mix(美国ABI公司);异丙醇、无水乙醇(天津市富宇精细化工有限公司);Agarose(美国Sangon Biotech公司);RPMI 1640(含10%小牛血清)(美国Gibco BRL公司);兔抗STAT3抗体(美国Sangon Biotech公司,货号:D220083-0025);磷酸盐缓冲液(PBS)粉剂:pH 7.4~7.6(福州迈新生物技术开发有限公司)。(2)仪器:GL-88B漩涡混合器(海门市其林贝尔仪器制造有限公司);Neofuge 15R台式高速冷冻离心机(上海力新公司);K5500核酸蛋白定量仪(北京凯奥公司);DYCP-31DN及DYY-6C型水平电泳仪及电源(北京六一电泳仪厂);凝胶成像系统(美国UVP公司);移液器(德国Eppendorf公司);梯度PCR仪(美国Bio-Rad公司);实时荧光PCR仪(美国ABI公司);-80 ℃超低温冰箱(海尔公司)。
1.3方法
1.3.1RNA提取 取肠黏膜组织标本于-80 ℃超低温冰箱中保存,用液氮研磨组织,取100 mg肠黏膜组织至1.5 mL离心管中,加入1 mL Trizol,涡旋混匀,室温静置15 min;加入200 μL氯仿,颠倒混匀,室温静置5 min;4 ℃ 12 000 r/min离心15 min;取上清液至另一新的1.5 mL离心管,加入等体积异丙醇,颠倒混匀,-20 ℃静置30 min;4 ℃ 12 000 r/min离心15 min,弃上清液;加入1 mL 75%乙醇[75%乙醇用焦碳酸二乙酯(DEPC)水配制]清洗RNA沉淀,混匀;4 ℃,12 000 r/min离心3 min,弃上清液保留沉淀,室温干燥2~3 min;RNase-free H2O溶解RNA;核酸蛋白定量仪检测RNA水平、260 nm与280 nm处吸光度值比值(A260/A280),电泳检测RNA完整性。确保RNA样品的A260/A280值在1.8~2.1之间。将标本保存在-80 ℃环境下备用。
1.3.2反转录 质检合格的RNA样品按[5×gDNA缓冲液取2 μL+ RNase-Free 双蒸水(ddH2O)补足到10 μL]体系配制基因组去除体系,彻底混匀。简短离心,并置于42 ℃,孵育3 min;然后置于冰上放置。将其配制成反转录体,加到gDNA去除步骤的反应液中,充分混匀,42 ℃,孵育15 min;95 ℃,孵育3 min之后放于冰上,得到的cDNA可用于后续试验或低温保存。
1.3.3反转录PCR 将cDNA加入引物、SYBRR Select Master Mix、RNase-free ddH2O配成体系,对IFN-γ、IL-22、IL-17A、IL-17F基因进行扩增,2%琼脂糖凝胶电泳、拍照,切胶回收纯化DNA,用标准曲线法测IFN-γ,IL-22、IL-17A、IL-17F mRNA表达水平,结果以待测基因(IFN-γ、IL-22、IL-17A和IL-17F)与β-actin的比值表示。引物序列见表1。PCR反应条件:DNA激活50 ℃ 2 min,95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火1 min,60 ℃延伸1 min,40个循环,之后用2%琼脂糖凝胶电泳,以凝胶成像系统(美国Bio-Rad公司)分析PCR产物量。

表1 基因PCR扩增引物序列
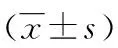
表2 维吾尔族UC组与维吾尔族对照组各炎性因子mRNA表达水平比较
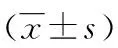
表3 汉族UC组与汉族对照组各炎性因子mRNA表达水平比较
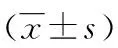
表4 汉族UC组与维吾尔族UC组各炎性因子mRNA表达水平比较
1.3.4免疫组织化学检测STAT3的表达 将石蜡切片脱蜡脱水,3%过氧化氢(H2O2)溶液孵育10 min,高压热修复,滴加一抗(兔抗STAT3抗体,稀释比例1∶50)50 μL,4 ℃过夜,PBS洗3次各3 min,滴加生物素化二抗,二甲基联苯胺(DAB)显色5~10 min,在显微镜下掌握染色程度,苏木精复染3 min,盐酸乙醇分化,逐步脱水,二甲苯透明,中性树胶封片。每张片子随机拍5个视野(×400)计数阳性细胞率。评分标准:(1)染色强度判断,与背景一致判为0分,轻度染色判为1分,深度染色判为2分;(2)阳性细胞百分比,≤5%判为0分,>5%~<26%判为1分,26%~<50%判为2分,≥50%判为3分。评分结束后将两项数值相乘,得分0~1分判为(-),2分判为(+),3~4分判为(++),5~6分判为(+++)。使用Image-pro plus 6.0软件计算积分吸光度值(IA值)。以GraphPad Prism 5.0软件作图。

2 结 果
2.1维吾尔族UC组与维吾尔族对照组肠黏膜各炎性因子mRNA表达水平比较 与维吾尔族对照组相比,维吾尔族UC组肠黏膜IFN-γ、IL-22、IL-17A、IL-17F mRNA表达水平都上调,差异均有统计学意义(P<0.05),见表2。
2.2汉族UC组与汉族对照组肠黏膜各炎性因子mRNA表达水平比较 与汉族对照组相比,汉族UC组肠黏膜IFN-γ、IL-22、IL-17A、IL-17F mRNA表达水平都上调,差异均有统计学意义(P<0.05),见表3。
2.3汉族UC组与维吾尔族UC组肠黏膜各炎性因子mRNA表达水平比较 汉族UC组与维吾尔族UC组肠黏膜IFN-γ、IL-22、IL-17A、IL-17F mRNA表达水平比较,差异均无统计学意义(P>0.05),见表4。

A:汉族对照组;B:汉族UC组;C:维吾尔族对照组;D:维吾尔族UC组
图1各组肠黏膜STAT3表达(×400)
2.4肠黏膜STAT3蛋白的表达 镜下观察:(1)肠黏膜间质见数量不等的急、慢性炎性细胞(中性粒细胞、淋巴细胞、浆细胞、单核细胞等)聚集、浸润,部分间质见淋巴滤泡形成;UC组部分可见黏膜腺上皮组织增生、隐窝脓肿形成,间质纤维组织增生等。(2)STAT3染色:可见腺上皮细胞及黏膜间质内中性粒细胞、浆细胞、单核细胞、部分淋巴细胞及淋巴滤泡生发中心细胞群着色。(3)镜下观察UC组与对照组STAT3染色对比(汉、维两组):UC组阳性表达率均高于对照组(P<0.05);维吾尔族UC组与汉族UC组镜下观察对比显示,阳性表达率未见明显差异(P>0.05),见图1。各组IA值比较:维吾尔族UC组较维吾尔族对照组(10 834.769±2 223.562vs. 7 895.642±998.740,t=-4.67,P=0.000)、汉族UC组较汉族对照组IA值均明显升高(11 899.884±2 488.163vs. 6 921.265±2 881.709,t=-5.355,P=0.000);维吾尔族UC组与汉族UC组IA值比较,差异无统计学意义(10 834.769±2 223.562vs. 11 899.884±2 488.163,t=1.236,P=0.227)。
3 讨 论
UC是炎症性肠病的一种,其病因及机制尚不明确,目前认为主要与环境、遗传和免疫因素相关。最近的研究证实了UC的发病具有家族聚集性的特点[6],这提示遗传因素在UC的发生、发展过程中起着重要作用。相关调查显示,新疆汉族与维吾尔族UC的发病情况及临床特点不同,维吾尔族UC的发病率高于汉族,且中、重度患者明显多于汉族[4];但导致这种差异的原因目前尚不清楚,可能与炎性因子及信号通路密切相关。本研究通过比较汉族与维吾尔族患者炎症相关的IFN-γ、IL-22、IL-17A、IL-17F、STAT3的表达,分析在维吾尔族与汉族患者间有无差异,以及与疾病发展有无关联。
有研究发现,T淋巴细胞亚群及其释放的细胞因子之间的相互作用参与了UC的发病过程[7],其中又以CD4+T淋巴细胞与UC的发病最为密切。初始CD4+T淋巴细胞在IFN-γ、IL-12、IL-4的诱导下分化成Treg、Th1、Th2和Th17 4个主要的细胞亚群。近年来研究发现,Th1与Th2细胞的比例失衡可引起多种自身免疫性疾病,在UC的发生过程中起着重要作用。IFN-γ是一种二聚体糖蛋白,由Th1细胞分泌,它的免疫调节活性强,是强有力的吞噬细胞和中性粒细胞激活物[8-9]。IFN-γ可激活各类细胞表面抗原,提高抗原抗体的呈递能力,促进一氧化氮(NO)的生成,从而诱导炎症的发生。本研究中,IFN-γ在UC患者肠黏膜的表达中明显高于对照组,考虑其与溃疡性结肠炎的发生密切相关,但该因子在维吾尔族与汉族UC患者中的表达无明细差异。
IL-22是IL-10家族成员之一,参与多种自身免疫性疾病,研究证实IL-22在类风湿性关节炎、克隆恩病、银屑病等疾病中高表达,在结节病、系统性红斑狼疮等疾病中低表达[10],这说明IL-22可能在自身免疫性疾病中起着双重作用。UC患者肠黏膜中IL-22水平上升,这与刘雪平等[11]、Hanash等[12]报道一致。李莉等[13]在研究中提出,UC患者外周血IL-22水平、Th17与Th22细胞比例明显升高,且与疾病活动度密切相关,提示IL-22与UC的发病密切相关。考虑IL-22与促炎因子的表达相关而具有致病作用,近期研究逐渐表明其对肠黏膜损伤具有保护作用。IL-22与转录激活的STAT3通路密切相关,通过IL-22的活化,STAT3可促进炎性因子如IL-8和IFN-γ的表达,加重炎性反应,IL-22/STAT3通路可以活化诱导型一氧化氮合酶(iNOS)、DMBT1和REGα,进而参与UC的发生过程[14-17]。而IL-22诱导的磷酸化STAT3被认为对肠黏膜起着保护作用,其通过促进黏液产生、增强黏蛋白和杯状细胞修复,促进肠黏膜上皮细胞屏障的形成,起到了抑制炎性反应的作用[18-21]。本研究中,IL-22在UC患者肠黏膜的表达中明显高于对照组,考虑其与溃疡性结肠炎的发生密切相关,可能通过导致肠道炎性反应与促进肠黏膜上皮细胞屏障形成双向调节,但该因子在维吾尔族与汉族UC患者中的表达无明显差异,考虑可能与民族差异无关联。
STAT3与UC的发病密切相关,STAT3信号是T淋巴细胞表达IL-22和IL-17必不可少的,STAT3是介导细胞因子信号通路的重要转录因子,可与多种细胞因子相结合并通过Janus蛋白酪氨酸激酶(JAK)/STAT途径发挥诱导细胞信号转导作用,促进肠上皮细胞编码多种促炎因子[22-23]。STAT3信号通路可能通过影响肠黏膜上皮细胞间紧密连接蛋白Occludin和Claudin-1的表达引起UC肠黏膜机械屏障损伤[24-25]。本研究中,STAT3在UC组阳性表达率高于对照组,考虑其参与诱发信号转导引起肠道炎症,对于STAT3基因的干预可能成为治疗UC的一个潜在靶点。
Th17是炎症性肠病发病的关键因子,在有关UC的临床试验中,UC患者的Treg细胞数量减少或者功能异常,Th17细胞数量的增加,炎性因子刺激Th17细胞产生特异性转录因子维A酸相关孤儿受体γt(ROR-γt),分泌IL-17A、IL-17F、IL-17A、IL-17F动员中性粒细胞兴奋,激活前炎性反应,促进炎性因子、趋化因子及金属蛋白酶的释放,从而造成肠黏膜组织破坏[19,26-28]。本研究中UC患者肠黏膜IL-17A、IL-17F表达水平明显升高,考虑其与UC的炎性反应密切相关,但该指标在维吾尔族与汉族患者中未见明显差异。
综上所述,新疆地区维吾尔族和汉族UC患者IFN-γ、IL-22、IL-17A、IL-17F mRNA水平及STAT3表达较对照组明显升高,考虑上述指标均参与UC的发病,而维吾尔族与汉族UC患者之间IFN-γ、IL-22、IL-17A、IL-17F mRNA水平及STAT3无明显差异,提示以上细胞因子在汉族患者及维吾尔族患者中表达可能无差异。此外,新疆是一个多民族聚集地,本研究仅初步、小规模地探讨维吾尔族与汉族UC患者肠黏膜IFN-γ、IL-22、IL-17A、IL-17F及STAT3表达的差异,还需进一步进行大样本、多民族之间的临床与实验室研究,以探讨UC发生、发展的炎症通路,并探讨该疾病有无民族遗传特异性,为今后UC的治疗提供新思路。
[1]Andoh A,Yagi Y,Shioya M,et al.Mucosal cytokine network in inflammatory bowel disease[J].World J Gastroenterol,2008,14(33):5154-5161.
[2]Schreiber F,Arasteh JM,Lawley TD.Pathogen resistance mediated by IL-22 signaling at the Epithelial-Microbiota interface[J].J Mol Biol,2015,427(23):3676-3682.
[3]Aheman A,Gao F,Kuerbanjiang A,et al.Difference in DRB1* gene polymorphisms between Han and Uyghur ulcerative colitis patients in China[J].World J Gastroenterol,2013,19(17):2709-2713.
[4]高峰,刘兴,丁努,等.新疆地区汉族及维吾尔族溃疡性结肠炎临床特点分析[J].中华消化内镜杂志,2007,24(6):423-426.
[5]中华医学会消化病学分会.对炎症性肠病诊断治疗规范的建议[J].胃肠病学,2001,6(1):56-59.
[6]Wallace KL,Zheng LB,Kanazawa Y,et al.Immunopathology of inflammatory bowel disease[J].World J Gastroenterol,2014,20(1):6-21.
[7]Liu ZJ,Yadav PK,Su JL,et al.Potential role of Th17 cells in the pathogenesis of inflammatory bowel disease[J].World J Gastroenterol,2009,15(46):5784-5788.
[8]Eastaff-Leung N,Mabarrack N,Barbour A,et al.Foxp3+regulatory T cells,Th17 effector cells,and cytokine environment in inflammatory bowel disease[J].J Clin Immunol,2010,30(1):80-89.
[9]Cromer WE,Mathis JM,Granger DN,et al.Role of the endothelium in inflammatory bowel diseases[J].World J Gastroenterol,2011,17(5):578-593.
[10]Liang SC,Tan XY,Luxenberg DP,et al.Interleukin (IL)-22 and IL-17 are coexpressed by Th17 cells and cooperatively enhance expression of antimicrobial peptides[J].J Exp Med,2006,203(10):2271-2279.
[11]刘雪平,王轶,赵治彬,等.炎症性肠病患者外周血Th17细胞的变化及其临床意义[J].胃肠病学,2010,15(5):284-287.
[12]Hanash AM,Dudakov JA,Hua GQ,et al.Interleukin-22 protects intestinal stem cells from Immune-Mediated tissue damage and regulates sensitivity to graft versus host disease[J].Immunity,2012,37(2):339-350.
[13]李莉,曹江,刘玲,等.溃疡性结肠炎患者外周血IL-22及相关CD4+T细胞亚群的表达[J].中华微生物学和免疫学杂志,2012,32(4):323-325.
[14]Xu AT,Li Y,Zhao D,et al.High suppressor of cytokine signaling-3 expression impairs STAT3-dependent protective effects of interleukin-22 in ulcerative colitis in remission[J].Inflamm Bowel Dis,2015,21(2):241-250.
[15]Andoh A,Zhang Z,Inatomi O,et al.Interleukin-22,a member of the IL-10 subfamily,induces inflammatory responses in colonic subepithelial myofibroblasts[J].Gastroenterology,2005,129(3):969-984.
[16]Yu LZ,Wang HY,Yang SP,et al.Expression of interleukin-22/STAT3 signaling pathway in ulcerative colitis and related carcinogenesis[J].World J Gastroenterol,2013,19(17):2638-2649.
[17]Kannappan R,Yadav VR,Aggarwal BB.γ-Tocotrienol but not gamma-tocopherol blocks STAT3 cell signaling pathway through induction of protein-tyrosine phosphatase SHP-1 and sensitizes tumor cells to chemotherapeutic agents[J].J Biol Chem,2010,285(43):33520-33528.
[18]Mudter J,Weigmann B,Bartsch B,et al.Activation pattern of signal transducers and activators of transcription(STAT) factors in inflammatory bowel diseases[J].2005,100(1):64-72.
[19]Petanidis S,Anestakis D,Argyraki M,et al.Differential expression of IL-17,22 and 23 in the progression of colorectal cancer in patients with K-ras mutation:ras signal inhibition and crosstalk with GM-CSF and IFN-γ[J].PLoS One,2013,8(9):e73616.
[20]Boulton TG,Zhong Z,Wen Z,et al.STAT3 activation by cytokines utilizing gp130 and related transducers involves a secondary modification requiring an H7-sensitive kinase[J].Proc Natl Acad Sci U S A,1995,92(15):6915-6919.
[21]刘晓,仲人前.白细胞介素-2在炎症性肠病中的免疫调节作用[J].临床军医杂志,2011,39(4):798-800.
[22]Murano T,Okamoto R,Ito G,et al.Hes1 promotes the IL-22-mediated antimicrobial response by enhancing STAT3-dependent transcription in human intestinal epithelial cells[J].Biochem Biophys Res Commun,2014,443(3):840-846.
[23]Morikawa T,Baba Y,Yamauchi M,et al.STAT3 expression,molecular features,inflammation patterns,and prognosis in a database of 724 colorectal cancers[J].Clin Cancer Res,2011,17(6):1452-1462.
[24]Cénit MC,Alcina A,Márquez A,et al.STAT3 locus in inflammatory bowel disease and multiple sclerosis susceptibility[J].Genes Immun,2010,11(3):264-268.
[25]卫江鹏,刘刚,张霆,等.溃疡性结肠炎患者肠道机械屏障变化与STAT3信号通路关系的研究[J].胃肠病学和肝病学杂志,2016,25(1):47-50.
[26]Sutton C,Brereton C,Keogh B,et al.A crucial role for interleukin (IL)-1 in the induction of IL-17-producing T cells that mediate autoimmune encephalomyelitis[J].J Exp Med,2006,203(7):1685-1691.
[27]Yao J,Wei C,Wang JY,et al.Effect of resveratrol on Treg/Th17 signaling and ulcerative colitis treatment in mice[J].World J Gastroenterol,2015,21(21):6572-6581.
[28]Ueno A,Jijon H,Chan R,et al.Increased prevalence of circulating novel IL-17 secreting Foxp3 expressing CD4+T cells and defective suppressive function of circulating Foxp3+ regulatory cells support plasticity between Th17 and regulatory T cells in inflammatory bowel disease patients[J].Inflamm Bowel Dis,2013,19(12):2522-2534.
StudyondifferenceofinflammatorycytokinesandSTAT3expressionsinintestinalmucosaltissuebetweenUyghurandHanpatientswithulcerativecolitisinXinjiangregion*
YangTao,ZhouHe,CuiMin,YaoPing△,TanQinghua
(DepartmentofGastroenterology,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi,Xinjiang830000,China)
ObjectiveTo explore the difference of inflammatory cytokines and STAT3 expressions in intestinal mucosal tissue between Uyghur and Han patients with ulcerative colitis (UC) in Xinjiang Uyghur Autonomous Region.MethodsThirty inpatients (15 Uyghur cases and 15 Han cases) with UC in this hospital from June 2015 to October 2016 were selected as the UC group.Contemporaneous 26 individuals (13 Uyghur cases and 13 Han cases ) undergoing physical examination served as the control group.The colonic mucosa tissue were taken for detecting the mRNA expression of IFN-γ,IL-22,IL-17A and IL-17F by reversal transcription-polymerase chain reaction (RT-PCR).The expression of STAT3 was detected by using the immunohistochemical staining technique.ResultsCompared with the Uyghur control group,the mRNA levels of IFN-γ,IL-22,IL-17A and IL-17F in the Uyghur UC group were up-regulated,the differences were statistically significant (P<0.05);compared with the Han healthy control group,the mRNA levels of above inflammatory cytokines in the Han UC group were up-regulated,the differences were statistically significant (P<0.05);but the mRNA levels of above inflammatory cytokines had no statistical difference between the Uyghur UC group and Han UC group (P>0.05).The immunohistochemical method found that the STAT3 was found to be colored in the cytoplasm of intestinal mucosal epithelial cells.The positive expression rate of STAT3 in Han and Uyghur UC groups was higher than that in the corresponding control group,the differences were statistically significant (P<0.05),however there was no statistically significant difference between Uyghur UC group and Han UC group,the difference was not statistically significant (P>0.05).ConclusionIn Xinjiang Uyghur Autonomous Region,the expressions of intestinal mucosal IFN-γ,IL-22,IL-17A,IL-17F and STAT3 in Uyghur and Han patients with UC are significantly increased,but the above cytokines may has no obvious difference in UC occurrence and development between Uyghur and Han patients.
colitis,ulcerative;interferon-γ;interleukin-22;interleukin-17A;interleukin-17F;signal transduction and activators of transcription-3
10.3969/j.issn.1671-8348.2017.35.013
新疆维吾尔自治区自然科学基金资助项目(2014211C033)。
杨涛(1984-),住院医师,硕士,主要从事消化系统常见疾病研究。△
,E-mail:pingyaozh@sina.com。
R574.62
A
1671-8348(2017)35-4938-05
2017-07-11
2017-09-15)
《重庆医学》对临床研究论文医学伦理学要求
凡投本刊的涉及人的生物医学研究论文,作者应说明所在用的试验程序是否经过伦理审查委员会(单位性的、地区性的或国家性的)评估,注明批准号。涉及患者(受试者)的应签订知情同意书。
《重庆医学》编辑部
