聚乙烯醇-卟啉新型纳米颗粒的制备及其光热特性*
2018-01-05李军果王全晖史海江宋宗昌
李军果,王全晖,史海江,宋宗昌,罗 焱△
(1.解放军陆军总医院生殖中心,北京 100700;2.解放军第153中心医院普外科,郑州450042;3.解放军第153中心医院肿瘤科,郑州 450042;4.解放军第155中心医院血液肿瘤科,河南开封,475003)
·论著·
聚乙烯醇-卟啉新型纳米颗粒的制备及其光热特性*
李军果1,王全晖2,史海江3,宋宗昌4,罗 焱3△
(1.解放军陆军总医院生殖中心,北京 100700;2.解放军第153中心医院普外科,郑州450042;3.解放军第153中心医院肿瘤科,郑州 450042;4.解放军第155中心医院血液肿瘤科,河南开封,475003)
目的将一定比例的脱镁叶绿酸引入聚乙烯醇-硫辛酸聚合物中,分析其理化性质及光热特性。方法采用“一步法”合成聚乙烯醇-硫辛酸-脱镁叶绿酸(PLP)聚合物,激光粒径测定仪测定PLP纳米颗粒(PLPN)的粒径、多分散系数和ζ电位,电镜下观察形态,分光光度法和热成像仪初步探索其体外荧光和光热特性;建立卵巢癌裸鼠模型,行初步的体内实验评价。结果合成的PLP聚合物在水相中自组装形成规则的球状纳米颗粒,电镜下呈紧密的球状结构,平均粒径、多分散系数和ζ电位分别为(22.92±9.00)nm、0.117±0.056和(-25.43±0.77)mV;PLPN在磷酸盐缓冲液(PBS)中的荧光强度明显低于十二烷基硫酸钠(SDS)溶液(P<0.05),而近红外光照后温度明显高于SDS溶液(P<0.05);在荷瘤裸鼠模型中,PLPN可靶向聚集在肿瘤部位,近红外光激发后能明显提高肿瘤部位的温度,并能杀伤肿瘤细胞。结论PLPN发射红色荧光,能靶向聚集在肿瘤部位并行活体显像,且在体内外均具有显著的光热转换特性,在体内能有效抑制肿瘤的生长。
聚乙烯醇;脱镁叶绿酸;纳米粒子;光热转换;卵巢肿瘤
纳米技术在医学领域的运用为细胞毒性药物的靶向运送等提供了临床解决方案[1-2]。随着医学的进一步发展,单一功能的载药纳米颗粒不能完全满足临床实践的需求。因此,开发额外具有光、热、电、磁等特性的多功能纳米材料更具实用价值。到目前为止,具备上述特性的纳米颗粒如半导体量子点、金纳米颗粒、氧化铁等均为无机材料,在生物安全性等方面存在顾虑[3-4]。虽已有文献报道了几种基于胶束、脂质体的新型有机多功能纳米颗粒[5-6],然而开发具有相似功能的新的有机纳米颗粒显得尤为困难。在前期实验中,笔者合成的聚乙烯醇-硫辛酸(PVA27K-4%LA)聚合物在水相中能自组装形成不规则的纳米结构,具有良好的载药性能,但不具备光、热等特性。脱镁叶绿酸是血卟啉类似物,不溶于水,具有良好的光敏活性。因此,笔者拟在PVA27K-4%LA聚合物中引入一定比例的脱镁叶绿酸基团,在进一步增加聚合物中疏水基团比例的同时,提供光、热等特性。在本研究中,聚乙烯醇-硫辛酸-脱镁叶绿酸(PVA27K-4%LA-10% Pheide,PLP)聚合物的合成采用“一步法”,对PLP纳米颗粒(PLPN)的粒径、电镜下形态等进行初步鉴定,再进一步研究其体内外的光、热转换等特性。
1 材料与方法
1.1仪器与试剂 FD-1型台式冻干机(巩义市英峪予华仪器厂),Zetasizer 3000 HS激光粒径测定仪(英国Malvern公司),透射电镜(荷兰Philips公司),超净工作台(苏州宏瑞净化科技有限公司),磁力搅拌器(山东威海新元化工机械有限公司),NanoDrop 2000超微量分光光度计(美国ThermoFisher科技公司),激光共聚焦显微镜(德国Leica公司),小动物活体成像系统[柯达电子(上海)有限公司 ],Nanodrop 2000分光光度计(北京科尔德科贸有限公司),红外热像仪(广州赛默信息科技有限公司),Diode Laser系统(北京敏光科技有限公司)。聚乙烯醇(美国Sigma公司,相对分子质量27×103),硫辛酸(上海抚生试剂公司),脱镁叶绿酸盐(美国Sigma公司),十二烷基硫酸钠(SDS,美国Sigma公司),N,N′-二环己基碳酰亚胺(DCC,厦门博欣生物技术有限公司),1-羟基苯并三唑(HOBT,厦门博欣生物技术有限公司),4-二甲氨基吡啶(DMAP,厦门博欣生物技术有限公司)。
1.2方法
1.2.1PLP聚合物的合成方法 使用相对分子质量为27×103的聚乙烯醇,按4%的比例连接硫辛酸、10%的比例连接脱镁叶绿酸。首先,DCC先和硫辛酸和脱镁叶绿酸盐上的羧基通过缩合反应生成活化酯(DMSO作偶联剂),然后在HOBT及DMAP的催化下与聚乙烯醇上的醇基形成酯,整个反应在室温下进行48 h。反应结束后用5倍体积预冷的乙醇沉淀,再用乙醇洗涤3次,溶解在DMSO里,在双蒸水里透析去掉小分子物质,最后冻干。
1.2.2PLPN基本性质的鉴定 (1)粒径、多分散系数及ζ电位测定:使用Zetasizer 3000 HS激光粒径测定仪测定粒径、多分散系数及ζ电位。将PLP聚合物溶解在水相中,调整聚合物浓度为1 mg/mL后进行检测。(2)形态观察:磷钨酸负染法染色,取1滴待测溶液滴于瓷板的凹槽内,并将喷碳铜网放于溶液上,1~2 min后取出铜网,用滤纸小片从铜网边缘吸去残余液体;将该铜网放在染液(4%磷钨酸溶液,pH 7.0)上约30 s,吸干多余染液、干燥,透射电镜观察形态。
1.2.3PLPN体外荧光和光热转换实验 (1)荧光特性:分别制备PLPN的磷酸盐缓冲液(PBS)溶液和SDS溶液,将聚合物浓度调整为20 mg/mL,取0.5 mL加入到EP管中,使用Kodak多模式显像系统IS2000MM进行显像(设置激发波长625 nm,发射波长700 nm);同时使用Nanodrop 2000测定两种溶液的吸收光谱(设置波段500~750 nm,间隔5 nm)。(2)光热转换特性:分别制备PLPN的PBS和SDS两种溶液,调整聚合物浓度为0.30、0.15、0.08、0.04、0.02 mg/mL,另设立空白对照,各取20 μL置于蜡纸上,使用Laser Diode系统分别照射30 s(激光波长690 nm,照射直径5 mm,功率1.25 W),照射的同时使用红外热像仪测量溶液温度,记录最高温度并绘制曲线。
1.2.4PLPN细胞摄取实验 选择卵巢癌细胞系SKOV-3,接种至6孔板,待细胞生长至合适密度后加入PLPN的PBS溶液中,调整PLP聚合物终浓度为0.5 mg/mL,共培养6 h后在激光共聚焦下观察。
1.2.5PLPN体内荧光和光热转换实验 (1)荧光特性:动物模型使用荷卵巢癌SKOV-3细胞的皮下异种移植裸鼠模型,肿瘤体积约500 mm3,尾静脉注射PLPN的PBS溶液200 μL,聚合物浓度为10 mg/mL,在注射后24 h行活体动物显像,显像结束后处死裸鼠,取出主要器官,行荧光显像。(2)光热转换实验:尾静脉注射PLPN的PBS溶液,注射的PLPN剂量按脱镁叶绿酸2 mg/kg计算,注射结束24 h后使用Laser Diode系统照射肿瘤部位180 s(激光波长690 nm,照射直径5 mm,功率1.25 W),照射的同时使用红外热像仪测量照射点温度,记录温度并绘制曲线,以注射PBS的荷瘤裸鼠作为对照。按前述方法建立荷瘤裸鼠模型,待肿瘤体积生长至80~100 mm3时分成两组(n=6),在第0、5、10、15天分别从尾静脉注射相同体积的PBS和PLPN溶液(脱镁叶绿酸2 mg/kg),注射完24 h后激光照射肿瘤部位120 s(激光波长690 nm,照射直径5 mm,功率1.25 W),每周测量肿瘤体积2次,肿瘤体积按(长×宽2)/2计算,当肿瘤体积达到1 000 mm3时处死裸鼠,绘制肿瘤生长曲线。另设一组作为空白对照。

2 结 果
2.1PLP聚合物的合成及基本性质的鉴定 PLP聚合物的制备采用“一步法”,冻干后得到墨绿色粉末,加热后可溶于水和DMSO。将PLP聚合物溶解于PBS,为墨绿色透明溶液,调整浓度为1 mg/mL,测定其平均粒径为(22.92±9.00)nm,可见分布范围窄(图1A),多分散系数和ζ电位分别为(0.117±0.056)和(-25.43±0.77)mV。电镜下PLPN呈规则球状结构,分布及大小均匀一致(图1B)。
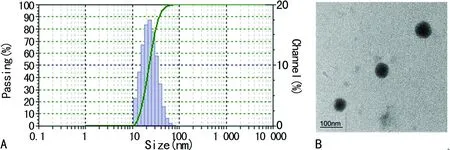
A:PLPN的粒径分布;B:PLPN电镜下形态
图1 PLPN基本性质的鉴定
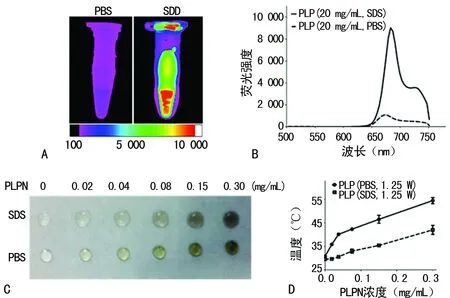
A:PLPN荧光显像;B:分光光度法测定PLPN的吸收光谱;C:制备不同浓度的PLPN溶液;D:不同PLPN溶液的浓度-温度曲线图
图2 PLPN的体外荧光和光热转换特性
2.2PLPN的体外荧光和光热转换特性 PLP聚合物能发射荧光,最大吸收峰在665 nm,将PLP聚合物浓度为20 mg/mL的PBS和SDS溶液进行荧光显像,可见在SDS溶液中的荧光强度明显高于PBS中的荧光强度(P<0.05),见图2A。进一步用分光光度法进行定量分析,得出相同的结果,即PLPN的SDS溶液其荧光强度明显高于PLPN的PBS溶液荧光强度(P<0.05),见图2B。分别将不同浓度PLPN的PBS和SDS溶液置于蜡纸上(图2C),690 nm的激光照射后,热成像相机检测到相同PLPN浓度下,PBS溶液的温度明显高于SDS溶液(P<0.05),见图2D。
2.3PLPN的细胞摄取和荷瘤裸鼠活体成像 将终浓度为0.5 mg/mL的PLPN溶液与卵巢癌细胞SKOV-3共培养6 h,激光共聚焦下观察到PLPN能快速被卵巢癌细胞摄取,红色荧光的PLPN主要分布在细胞质中(图3A)。在荷瘤裸鼠体内,尾静脉注射的PLPN在24 h时主要分布在肿瘤组织,同时肺、肝脏、皮肤也有一定量的分布(图3B)。
2.4PLPN的体内光热转换特性 在荷瘤裸鼠尾静脉注射PBS,激光照射肿瘤部位后可见最高温度升至37.1 ℃(图4A);而注射PLPN溶液肿瘤部位激光照射后最高温度可升至58.5 ℃(图4B)。将两组裸鼠肿瘤部位共照射180 s,热成像仪持续监测肿瘤部位温度,绘制时间-温度曲线,可见注射PLPN溶液的肿瘤部位温度明显高于PBS组(P<0.05),见图4C。另建立荷瘤裸鼠模型,分别给予4次剂量的PBS及PLPN溶液,每次注射后24 h激光照射瘤体120 s,绘制瘤体生长曲线,可见空白对照组肿瘤生长最快,PBS组照射后肿瘤生长方式与其空白对照组一致,而PLPN组在照射4次后肿瘤基本消退,但随后肿瘤即恢复生长(图4D)。
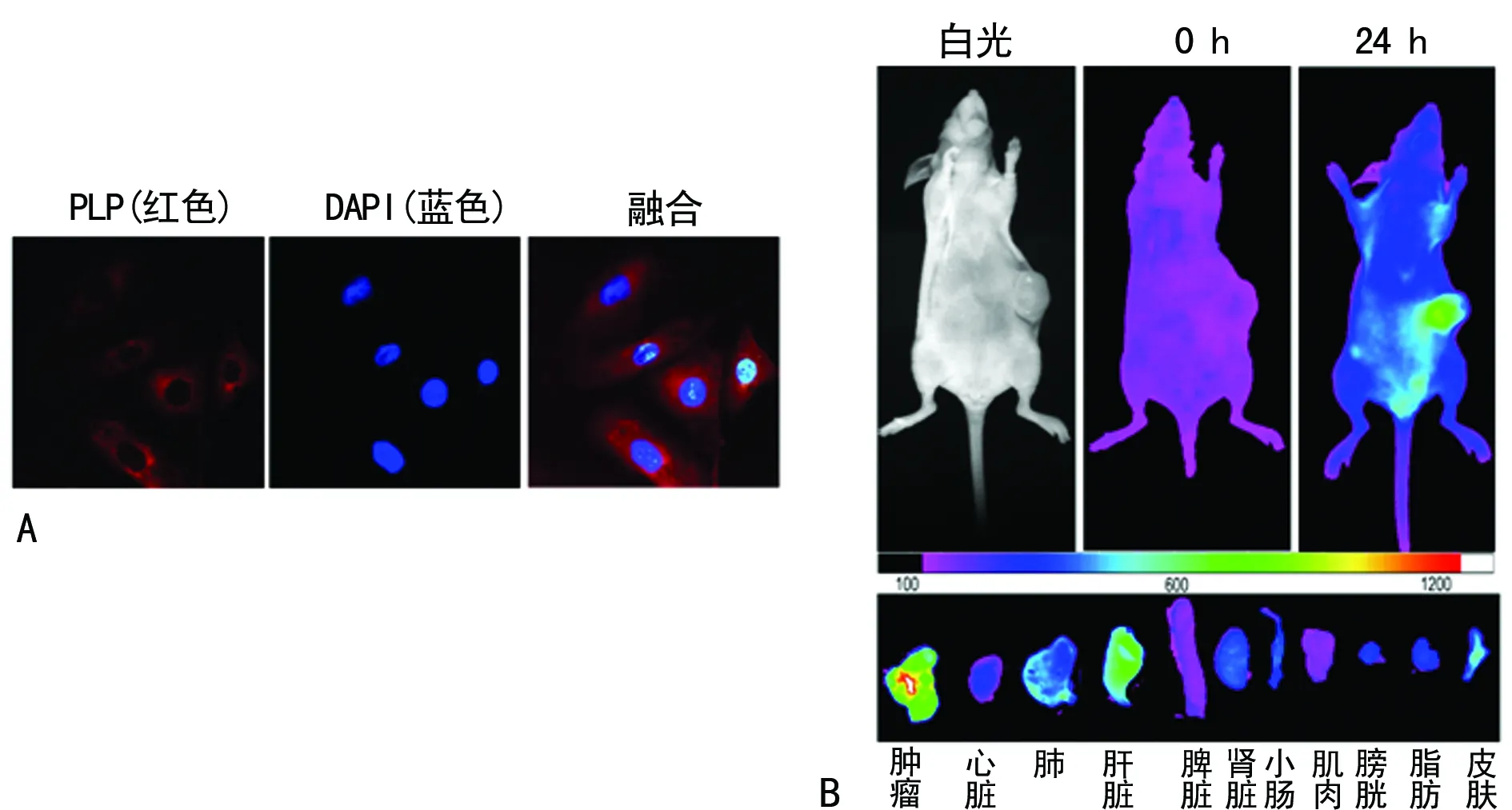
A:PLPN的细胞摄取;B:PLPN在荷瘤裸鼠体内的分布
图3 PLPN的细胞摄取和荷瘤裸鼠活体成像

A:荷瘤裸鼠注射PBS后的热影像图;B:荷瘤裸鼠注射PLPN后的热影像图;C:荷瘤裸鼠肿瘤部位的时间-温度曲线;D:荷瘤裸鼠肿瘤生长时间曲线
图4 PLPN的体内光热转换特性
3 讨 论
整合多模式显像和治疗功能的纳米颗粒是未来医学纳米领域的发展趋势。这些纳米颗粒包括有机的、无机的和混合性的,根据不同的结构组成可提供独特的物理和化学特性。以无机纳米颗粒为例,通过嵌入多功能单元,可提供荧光、磁或者光热特性,具有开发成多模式显像和治疗功能纳米颗粒的潜能[7]。但是,此类无机材料的水溶性问题、载药效率问题和生物安全性问题等限制其应用[8],尽管通过表面化学或表面修饰技术能改变其部分理化性质。另一类具有良好的单分散性、生物相容性和高载药率的有机纳米颗粒显然更具有临床应用前景。在前期实验中,笔者合成的PVA27K-4%LA纳米颗粒显示出良好的肿瘤靶向性和载药性能,具有二次开发的潜能。卟啉类似物脱镁叶绿酸为含羧基疏水化合物,具有良好的生物安全性。在本文研究中,笔者在PVA27K-4%LA的侧链醇基上引入比例为10%的脱镁叶绿酸,得到聚合物PLP。PLP聚合物加热后具有良好的水溶性,而20 nm左右的粒径能有效利用纳米颗粒的高通透性和滞留效应(enhanced permeability and retention effect,EPR),实现PLPN的肿瘤靶向聚集。
拥有光学特性是多功能纳米颗粒的特征之一。一般来说,红光在动物体内的穿透性显著优于蓝绿光,随着发光信号在体内深度的增加,波长越接近900 nm的光线穿透能力越强,同时可消减背景噪音的干扰,因此近红外荧光是活体动物成像的最佳选择。PLPN中引入的脱镁叶绿酸含有四吡咯环状结构,具有理想的作用光谱、高红光区吸收系数及在体内快速消除等特点,是行细胞和活体动物荧光显像的材料之一[9-10]。初步的实验结果显示,PLPN可发射红色荧光,波长在665 nm,具有良好的穿透性。此外,PLPN相比PVA27K-4%LA纳米颗粒,从电镜下形态来看,呈规则的球状结构,结构更加紧密,表明可能具有更好的体外和体内稳定性。重要的是,PLPN的PBS显示出较弱的荧光信号,当SDS破坏PLPN结构后,荧光信号显著增强,表明PLPN在水溶液中具有荧光猝灭现象,这在行体内显像时具有优势。
光热治疗是肿瘤治疗中一种新方法和新技术,主要是通过将吸收的光能转换成热能,提高肿瘤部位的温度,利用局部过热引起的热杀伤作用及继发效应来治疗肿瘤,而光热转换材料在光热治疗中起着决定性的作用[11]。目前对近红外光热转换材料研究较多的是金纳米材料[12-13],虽然这些金纳米材料在光热治疗应用中被寄予厚望,但是其在光热产生效率和靶向定位精确度方面还有上升空间。本文研究的PLPN首先具有良好的肿瘤靶向性,体内外实验研究均表明其有良好的光热转换特性,通过吸收近红外光后肿瘤部位最高温度可达58.5 ℃,显著高于肿瘤细胞的最大耐受温度,在体内能有效抑制肿瘤生长。从PLP聚合物的结构来看,其在水相中通过疏水作用自组装可能导致脱镁叶绿酸在纳米结构内形成特定的结构,从而产生光热转换,具有开发成光热转换材料的潜能。综上所述,在PVA27K-4%LA基础上改造的PLP聚合物在水相中可自组装成结构更紧密的纳米颗粒,由于脱镁叶绿酸的引入,可额外提供荧光特性和光热转换特性,具有开发成新型的有机多功能纳米颗粒的潜能。
[1]ChowdhuryS,YusofF,SalimWW,etal.Anoverviewofdrugdeliveryvehiclesforcancertreatment:Nanocarriersandnanoparticlesincludingphotovoltaicnanoparticles[J].J Photochem Photobiol B,2016,164:151-159.
[2]Bao G,Mitragotri S,Tong S,et al.Multifunctional nanoparticles for drug delivery and molecular imaging[J].Annu Rev Biomed Eng,2013,15:253-282.
[3]Zhao Z,Zhou Z,Bao J,et al.Octapod iron oxide nanoparticles as high-performance T2 contrast agents for magnetic resonance imaging[J].Nat Commun,2013,4:2266.
[4]Manshian BB,Abdelmonem AM,Kantner K,et al.Evaluation of quantum dot cytotoxicity:Interpretation of nanoparticle concentrations versus intracellular nanoparticle numbers[J].Nanotoxicology,2016,10(9):1318-1328.
[5]Du B,Tian L,Gu X,et al.Anionic lipid,pH-sensitive liposome-gold nanoparticle hybrids for gene delivery - quantitative research of the mechanism[J].Small,2015,11(29):2333-2340.
[6]Huang Y,Hemmer E,Rosei F,et al.Multifunctional liposome nanocarriers combining upconverting nanoparticles and anticancer drugs[J].J Phys Chem B,2016,120(22):4992-5001.
[7]Jia HZ,Wang W,Zheng DW.Multifunctional nanotherapeutics with all-in-one nanoentrapment of drug/gene/inorganic nanoparticle[J].ACS Appl Mater Interfaces,2016,8(11):6784-6789.
[8]Sharma VK,Filip J,Zboril R,et al.Natural inorganic nanoparticles--formation,fate,and toxicity in the environment[J].Chem Soc Rev,2015,44(23):8410-8423.
[9]Lovell JF,Jin CS,Huynh E,et al.Porphysome nanovesicles generated by porphyrin bilayers for use as multimodal biophotonic contrast agents[J].Nat Mater,2011,10(4):324-332.
[10]Wu T,Kaur S,Branda NR.Energy transfer between amphiphilic porphyrin polymer shells and upconverting nanoparticle cores in water-dispersible nano-assemblies[J].Org Biomol Chem,2015,13(8):2317-2322.
[11]Zhang H,Chen HJ,Du X,et al.Dependence of photothermal conversion characteristics on different nanoparticle dispersions[J].J Nanosci Nanotechnol,2015,15(4):3055-3060.
[12]Mocan L,Matea CT,Bartos D,et al.Advances in cancer research using gold nanoparticles mediated photothermal ablation[J].Clujul Med,2016,89(2):199-202.
[13]Song J,Wang F,Yang X,et al.Gold nanoparticle coated carbon nanotube ring with enhanced raman scattering and photothermal conversion property for theranostic applications[J].J Am Chem Soc,2016,138(22):7005-7015.
Preparationofnewtypepolyvinylalcohol-porphyrinnanoparticlesanditsphotothermalproperties*
LiJunguo1,WangQuanhui2,ShiHaijiang3,SongZongchang4,LuoYan3△
(1.ReproductiveCenter,ArmyGeneralHospitalofPLA,Beijing100700,China;2.DepartmentofGeneralSurgery,153CentralHospitalofPLA,Zhengzhou,Henan450042,China;3.DepartmentofOncology,153CentralHospitalofPLA,Zhengzhou,Henan450042,China;4.DepartmentofHematologyOncology,155CentralHospitalofPLA,Kaifeng,Henan475003,China)
ObjectiveTo analyze the physicochemical properties and photothermal properties after introducing a certain proportion of phaeophorbide into polyvinyl alcohol-lipoic acid polymer.MethodsThe "one-step" method was adopted to synthesize the PVA27K-4%LA-10% Pheide (PLP) polymer.The laser particle diameter tester was used to detect the particle size,polydispersity index and ζ potential of PLP nanoparticle (PLPN);the morphology was observed under transmission electron microscope (TEM);the in vitro fluorescent and photothermal properties were investigated by using spectrophotometric method and infrared thermal imager;the ovarian-cancer nude mice models were established and the preliminary in vivo experiment evaluation was performed.ResultsThe synthetic PLP polymer could self-assembly form spherical PLPN in aqueous environment,which showed the tightly spherical structure under TEM.The average particle diameter,polydispersity index and ζ potential were (22.92±9.00)nm,(0.117±0.056) and (-25.43±0.77)mV respectively.The fluorescence intensity of PLPN in PBS solution was significantly lower than that in SDS solution (P<0.05).However,the temperature of the PBS solution of PLPN was significantly higher than that of the SDS solution after exposure to the near infrared light (P<0.05).In the model of tumor-bearing nude mice,PLPN could target-accumulated in the tumor site.The temperature in the tumor site was significantly increased after exposure to the near infrared light,which could kill tumor cells.ConclusionPLPN could emit red fluorescence,and could target-accumulated in tumor site and conduct the in vivo image,which has significant photothermal conversion properties in vivo and in vitro,and can effectively inhibit the tumor growth in vivo.
polyvinyl alcohol;pheophorbide;nanoparticles;photothermal conversion;ovarian neoplasms
10.3969/j.issn.1671-8348.2017.35.002
总后卫生部青年培育项目(14QNP030)。
李军果(1970-),主治医师,博士,主要从事生殖、生殖系肿瘤研究。△
,E-mail:fisherman-702@163.com。
R730.53
A
1671-8348(2017)35-4901-03
2017-07-12
2017-09-15)
