白细胞介素32通过5′-LTR抑制HIV复制
2017-12-26司晓棠
张 蕊,司晓棠,白 兰,何 辉,覃 瑞
(1 中南民族大学 生命科学学院,武汉430074;2 武汉大学 生命科学学院,武汉 430072)
白细胞介素32通过5′-LTR抑制HIV复制
张 蕊1,司晓棠1,白 兰2,何 辉2,覃 瑞1
(1 中南民族大学 生命科学学院,武汉430074;2 武汉大学 生命科学学院,武汉 430072)
目的:探讨白细胞介素32(IL-32)抑制HIV病毒复制的机制.方法:利用荧光色素酶活性测定筛选抑制HIV复制最显著的IL-32亚型,通过构建HIV的LTR系列截断质粒和TAR茎环结构的系列点突变质粒,确定IL-32抑制HIV复制作用的位点.结果:在Hela、Jurkat、293T三个细胞系中,IL-32γ和IL-32ε两种亚型对HIV的抑制作用最显著.在Hela细胞系中证实IL-32可通过抑制HIV 5′-LTR的活性抑制HIV复制,确定TAR形成的茎环结构在此过程中起重要作用.IL-32与TAR结构相互作用的位点定位在TAR的环状和半环状处.结论:IL-32能抑制HIV复制,可作为HIV治疗的潜在手段.
白细胞介素32;人免疫缺陷病毒 ;长末端重复序列
白细胞介素32(简称IL-32),因在自然杀伤细胞(NK)内大量表达而被命名为自然杀伤细胞转录本4(NK4)[1].由美国科罗拉多大学健康科学中心医学部的Kim等[2]于2005年在用基因芯片方法筛选IL-18可诱导基因时鉴定的一种白细胞介素.IL-32 为前炎症细胞因子,可介导胞内炎症反应[3].在多种病毒感染性疾病中IL-32表达水平都相应增高,而IL-32可抑制流感病毒和乙肝病毒的复制[4].IL-32基因含有8个小外显子,由外显子的选择性拼接产生7类剪切亚型:IL-32α、IL-32β、IL-32γ、IL-32δ、IL-32ε、IL-32ζ和IL-32η[5](见图1).各种剪接异构体中只有IL-32γ具有一个长度为31个氨基酸的信号肽序列,为一种分泌型蛋白,与NK4的特征一致.多项研究均表明,IL-32γ在诱导细胞因子表达和抗病毒方面具有比其他亚型更高的活性.
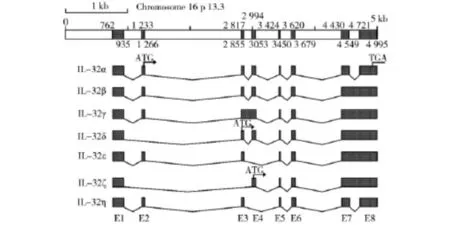
图1 白细胞介素-32各亚型的基因结构Fig.1 Gene structure of IL-32 subtypes
人免疫缺陷病毒(HIV)是一种可以感染CD4细胞从而导致获得性免疫功能丧失综合症(AIDS)的逆转录病毒. HIV 的5′端和3′端的长末端重复序列(LTRs)帮助病毒整合至宿主基因组,对病毒基因的表达和病毒的复制具有调节作用,结构为U3-R-U5(见图2).5′LTR区域从-454到+181,U3和R区包括4个功能域:远距离调节单位从-454到-104,其中包含负调节区(NRE)从-340到-184;增强子单位从-105到-79;核心启动子单位从-78到-1;Tat反应元件(TAR)从+1到+59.U5之后为gag引导序列(GLS).TAR反应元件具有稳定的茎环二级结构,包括4段茎区,1个半环和1个环状区,这样的结构对与病毒反式因子Tat蛋白结合非常关键.半环部被认为是与Tat蛋白的结合部位,而环状部结合其他细胞转录因子,茎区也可结合少数细胞因子[6].
感染HIV后会引起感染人群的多种免疫缺陷,同时多种重要的免疫因子表达水平也发生了变化,这些细胞因子会引发体内进行自身免疫调节,导致自身的分泌增多、减少甚至于不分泌,如很多促炎症因子TNF-α/IL-1、IL-6、IFN-α/β、INF-γ的表达均随之升高[7-9].
1 实验部分
1.1 材料、试剂和仪器
人宫颈癌细胞系Hela、人肾上皮细胞系293T和人急性T细胞白血病细胞系Jurkat均来源于武汉大学典型培养物保藏中心.IL-32各亚型质粒由武汉大学医学病毒学实验室构建并保存.HIV突变型克隆PNL-4-3-
R-E-和HIV长末端重复序列pGL3-LTR-luc为Sahibzada T. Rasool博士馈赠.Renilla luciferase报告基因质粒(Promega),KOD-plus polymerase(TOYOBO),Lipofectamine2000(Invitrogen), 荧光素酶报告基因检测试剂盒(Roche),MluI和Hind III(TAKARA),DMEM和RPMI-1640培养基(GIBCO). 荧光测定仪(Chemi Doc MP System, Bio-Rad),电转仪(4D/II Nucleofector型, LONZA).
1.2 细胞培养
Hela与293T细胞均采用含有10%FBS的DMEM培养基在37℃,5%CO2培养箱中贴壁培养[10].Jurkat细胞采用含有10%FBS的1640培养基在37℃,5%CO2培养箱中悬浮培养.
1.3 质粒的构建
HIV-LTR系列截断质粒均以pGL3-LTR-luc质粒为模板,依据长度递减通过以下引物进行扩增,转化和鉴定方法参考文献[11],再利用引入的MluI和Hind III构建而来,具体设计见图2和表1.
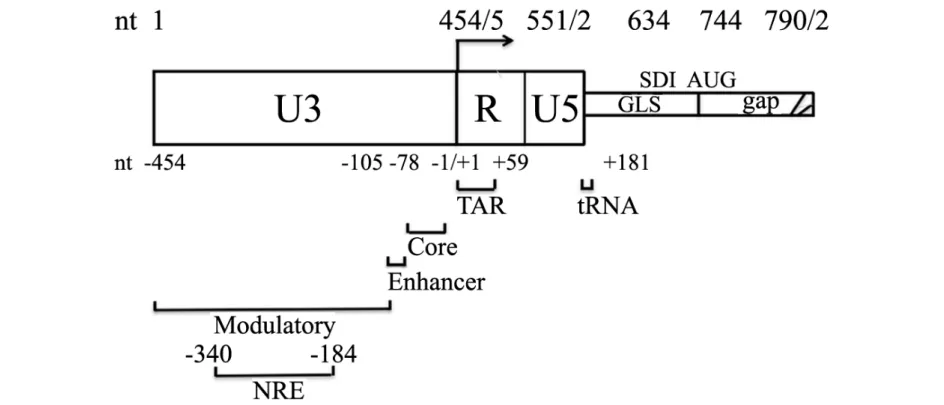
图2 HIV的5′-LTR结构图Fig.2 Structure of 5′-LTR of HIV

目的基因上游(5'-3')下游(5'-3')LTR-T1(-340~+60)5'-TCAACGCGTATCCACTGACCTTTG-3'5'-GCGAAGCTTTTTATTGAGGCTTAAG-3'LTR-T2(-184~+60)5'-CATACGCGTGCCTCCTAGCATTTCG-3'5'-GCGAAGCTTTTTATTGAGGCTTAAG-3'LTR-T3(-105~+60)5'-TATACGCGTGGGACTTTCCGCTGGG-3'5'-GCGAAGCTTTTTATTGAGGCTTAAG-3'LTR-T4(-78~+60)5'-TATACGCGTGAGGTGTGGCCTGGGC-3'5'-GCGAAGCTTTTTATTGAGGCTTAAG-3'LTR-T5(-1~+60)5'-CATACGCGTGGTCTCTCTGGTTAG-3'5'-GGGAGGTGTGGCCTGGGCGGGACTG-3'LTR-AC(-454~-1)5'-GCGAAGCTTTTTATTGAGGCTTAAG-3'5'-ACCAGAGTCACACAACAGACGGGCA-3'
HIV-LTR中TAR茎环状结构系列突变质粒均以pGL3-LTR-luc质粒为模板,利用保真度高的KOD-plus polymerase通过以下引物采用一步法进行扩增,具体设计见表2和图3.
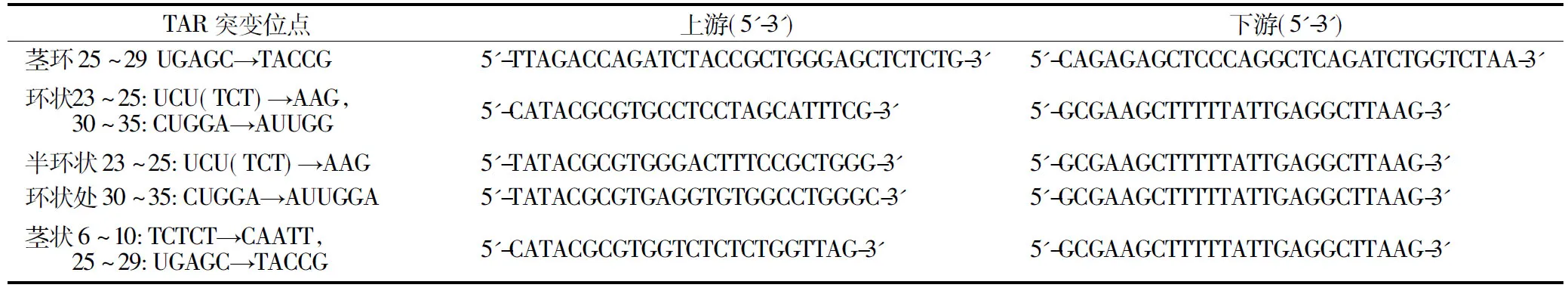
表2 TAR系列突变质粒引物序列
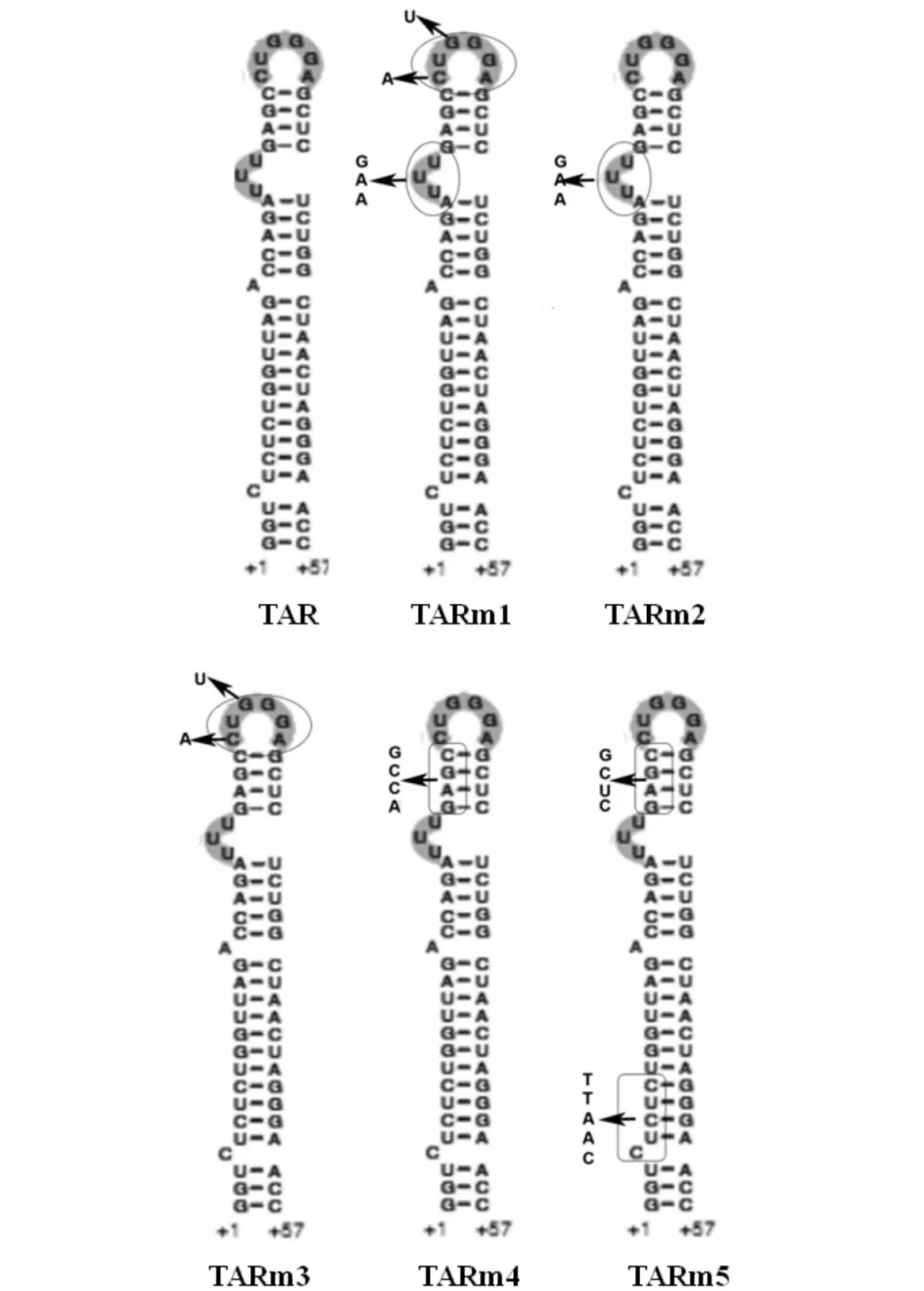
图3 HIV 5′-LTR中TAR茎环结构的系列突变 Fig.3 A series of mutations in TAR hairpin structure in 5′-LTR of HIV
1.4 细胞转染及荧光素酶活性检测
Hela与293T采用转染试剂Lipofectamine2000进行转染.转染前1 d按40%~60%的密度接种到24孔板中,37℃培养,使转染前细胞密度达到80%~95%.每个24孔板的孔中转染0.8 μg质粒.转染后将培养板放置于37℃培养箱中培养4~6 h,弃培养板中的液体,加入含血清和抗生素的全培养基,37℃继续培养,48~72 h后检测.Jurkat采用电转仪进行电穿孔转染.荧光素酶活性采用荧光素酶报告基因检测试剂盒通过荧光测定仪进行检测,并以Renilla luciferase的报告基因质粒作为内参基因保证实验的可靠性.
2 结果
2.1 IL-32各亚型对HIV复制的抑制作用
PNL-4-3-E-R-质粒是HIV突变型质粒,不具有感染性但保持了HIV复制的特性.本文利用PNL-4-3-E-R-在3种人源细胞系内,对IL-32与HIV复制的关系进行了观察,结果见图4.由图4a、4c、4e可见,大部分IL-32亚型能抑制PNL-4-3-E-R-复制,但在不同细胞系抑制作用有差异.在Hela细胞系中IL-32γ和IL-32ε两种亚型对HIV复制的抑制作用最为突出.在293T细胞系中抑制作用最显著的是IL-32γ、IL-32ε和IL32-α.在Jurkat细胞中IL-32γ、IL-32ε和IL32-β三种亚型的作用非常显著.综上,IL-32亚型中活性最显著的两个亚型:IL-32γ和IL-32ε对HIV复制的抑制作用最为显著.
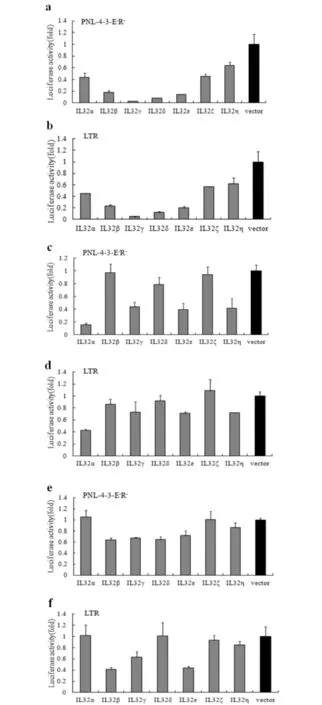
a,b) Hela细胞;c,d) 293T细胞;e,f) Jurkat细胞图4 IL-32各亚型对HIV PNL-4-3-E-R- 和5′-LTR活性的抑制作用Fig.4 Suppression effect of IL-32 subtypes on the activity of PNL-4-3-E-R- and 5′-LTR in HIV
HIV的LTR区在HIV复制过程中的作用与启动子类似,主要是各种转录因子与之结合形成特殊结构的复合物.推测IL-32可能通过抑制转录因子与LTR的相关作用来抑制HIV复制.用IL-32各亚型与pGL3-LTR-luc共转染后,得到了与共转染PNL-4-3-E-R-相类似的结果(见图4b、4d、4f),即IL-32各亚型均可抑制HIV的LTR活性,尤以IL-32γ和IL-32ε两种亚型作用明显.而IL-32γ是IL-32各亚型中活性最强的亚型[5].综上,选取IL-32γ为研究对象,由于IL-32γ在Hela细胞系中抑制作用最为明显,而Jurkat细胞的特性导致转染质粒的效率特别低,后续试验均在Hela细胞系中进行.
2.2 IL-32剂量对HIV5′-LTR活性的影响
选择抗病毒活性最强的IL-32γ为研究对象的代表,在Hela细胞系中,在共转染的pGL3-LTR-luc保持一定的情况下,依次增加IL-32的浓度,检测其对HIV 5′-LTR活性的影响,结果见图5.由图5可见,随着IL-32剂量的增加, HIV 5′-LTR活性依次降低,说明IL-32对HIV 5′-LTR 活性的抑制作用呈现剂量依赖性.
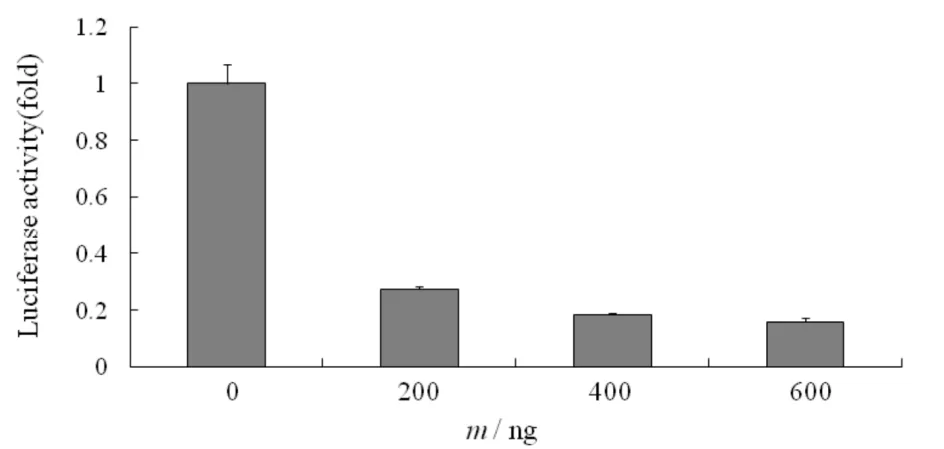
图5 Hela细胞系中不同剂量IL-32对HIV 5′-LTR活性的抑制作用Fig.5 Inhibition of HIV 5′-LTR activity by IL-32 with various doses in Hela cell lines
2.3 IL-32与5′-LTR的相互作用位点分析
HIV的5′-LTR结构非常复杂,有多个功能区,如Modulatory,Enhancer,Core和TAR区(见图2).先确认IL-32对LTR作用的主要区域,再根据LTR的功能分区,依次对LTR进行了截断,构建了一系列的截断质粒. IL-32对HIV 系列截断5′-LTR片断活性的影响结果见图6.由图6可见,与IL-32γ共转染之后,每个区域在这个过程中都可能起到了一定的作用,但当将TAR的茎环结构截断后,IL-32对LTR的抑制作用获得了极大的回复,提示在IL-32与LTR相互作用的过程中,TAR的茎环结构起到了极为关键的作用.
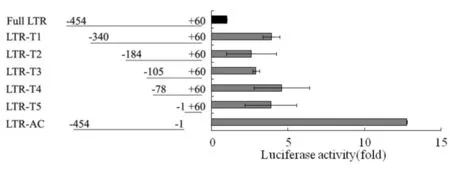
图6 IL-32对HIV 系列截断5′-LTR片断活性的影响Fig.6 Effect of IL-32 on truncated mutants of HIV′ 5′-LTR
2.4 IL-32与TAR作用位点为环状处和半环处
TAR的序列及形成的相应的茎环结构,这个结构的形成是由其中茎状处的几段互补序列的配对互补形成(见图3).Vrolijk等[12]的研究确认环状处和半环处的几个点突变对TAR的活性影响不大. IL-32对HIV的TAR结构的各突变体活性的影响结果见图7.由图7可见,在同等的活性情况下,在环状和半环状处同时进行点突变(TARm1),IL-32对LTR的抑制作用得到了极大的回复,而仅仅在环状处(TARm2)或者半环状处(TARm3)进行点突变,并不能削弱IL-32的抑制作用.同样,在茎状部位进行一处或多处点突变也不能削弱IL-32对LTR的抑制作用.因此得到结论,IL-32作用于LTR时,TAR的环状处和半环状处在IL-32抑制HIV复制过程中不可缺少.而TAR的半环部是与Tat蛋白的结合部位,而环状部结合其他细胞转录因子[6],提示IL-32抑制HIV复制与抑制Tat蛋白与TAR的结合有关.
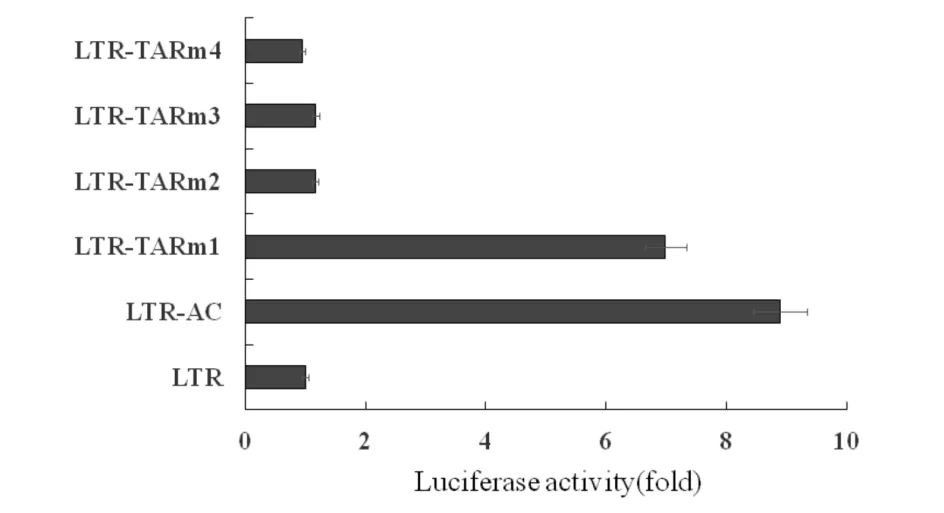
图7 IL-32对HIV的TAR结构的各突变体活性的影响Fig.7 Effect of IL-32 on mutants of TAR structure in HIV
3 讨论
Rasool等[13]发现HIV病人血清中IL-32表达水平明显高于健康人群,平均高出78%,并且初步观察到在用si-RNA将内源性的IL-32表达水平降低后,HIV的复制水平显著上升.提示IL-32与HIV复制有着密切相关性. IL-32具有抗流感病毒、乙肝病毒等多种病毒的作用,因此IL-32对HIV的抑制作用及其机理正是本文探讨的方向.
IL-32具有多种亚型,本文先在三种人源细胞系中证实IL-32具有活性的亚型均能够降低HIV的复制水平,而活性最强的IL-32γ和IL-32ε抑制作用最为显著.同时,IL-32对HIV的5′-LTR活性的降低趋势与IL-32抑制HIV复制的趋势保持一致,推断IL-32抑制HIV复制的一条途径是通过抑制LTR活性.由于LTR结构复杂,功能多样,通过对每个功能区的截断实验,发现LTR中TAR 形成的茎环结构在此过程中起重要作用,没有TAR结构的存在,IL-32对LTR的活性增强了接近10倍.
进一步对TAR结构的不同部位进行点突变时,证实是TAR的环状和半环状在IL-32抑制LTR活性中起着不可或缺的作用,且当两个部位同时进行突变时才能将IL-32的抑制作用遏止,依然没有TAR整个缺失的影响大,故推断其他部位也参与了整个过程.所以IL-32通过与LTR的TAR的环状和半环状的相互作用抑制了LTR活性进而降低了HIV复制水平.最近El-Far等[14]报道,在HIV慢性感染人群中IL-32可作为慢性感染控制失败的标志物,即IL-32的增多并不能抑制HIV复制,提示IL-32不直接抑制HIV复制,而是通过刺激合成更多的免疫细胞因子去抵抗HIV.在IL-32 与HIV的相互作用的过程中可能存在多种机制,在不同的情况下,两者之间的关系甚至还会逆转,这也是后续研究的方向.但IL-32在此进程的作用不容置疑,也将是不容忽视的一个标志物.
[1] Dahl C A,Schall R P,He H L,et al. Identification of a novel gene expressed in activated natural killer cells and T cells [J]. J Immunol,1992,148(2):597-603.
[2] Kim S H,Han S Y,Azam T,et al.Interleukin-32:a cytokine and inducer of TNFα[J]. Immunity,2005,22(1):131-142.
[3] Joosten L A,Netea M G,Kim S H,et al. IL-32,a proin-
flammatory cytokine in rheumatoid arthritis [J]. Proc Natl Acad Sci USA,2006,103(9):3298-3303.
[4] 王 婧,路慧丽,韩 伟. 白细胞介素-32免疫学特征及与HIV的相关性研究[J]. 现代生物医学进展,2008,8(12):2586-2588.
[5] 孙 伟,李 群,冯金荣,等. 1个新的白介素-32剪接异构体的克隆与表达[J]. 免疫学杂志,2013,29(9):792-795.
[6] 沈 弢. HIV-1 LTR区转录功能研究进展[J]. 国外医学·病毒学分册,2003,10(5):158-160.
[7] Graziosi C,Gantt K R,Vaccarezza M,et al. Kinetics of cytokine expression during primary human immunodeficiency virus type 1 infection [J]. Proc Natl Acad Sci USA,1996,93(9):4386-4391.
[8] Rinaldo C R Jr,Armstrong J A,Kingsley L A,et al. Relation of alpha and gamma interferon levels to development of AIDS in homosexual men [J]. J Exp Pathol,1990,5(3):127-132.
[9] Birx D L,Redfield R R,Tencer K,et al.Induction of interleukin-6 during human immunodeficiency virus infection [J]. Blood,1990,76(11):2303-2310.
[10] 王朝元, 刘亮亮.bHGA 对体外培养成骨细胞活性的影响[J].中南民族大学学报(自然科学版),2016,35(2):31-35.
[11] 陈思礼,吴汇兰,陈 洁.鱼腥藻PCC7120质粒上毒素-抗毒素基因对alr9029/asr9028 的初步研究[J].中南民族大学学报(自然科学版),2016,35(2):26-30.
[12] Vrolijk M M,Ooms M,Harwig A,et al. Destabilization of the TAR hairpin affects the structure and function of the HIV-1 leader RNA [J]. Nucleic Acids Res,2008,36(13):4352-4363.
[13] Rasool S T,Tang H,Wu J,et al. Increased level of IL-32 during human immunodeficiency virus infection suppresses HIV replication [J]. Immunol Lett,2008,117(2):161-167.
[14] El-Far M,Kouassi P,Sylla M,et al. Proinflammatory isoforms of IL-32 as novel and robust biomarkers for control failure in HIV-infected slow progressors [J]. Sci Rep,2016,6:22902.
SuppressionofHIVReplicatonbyInterleukin-32via5′-LTR
ZhangRui1,SiXiaotang1,BaiLan2,HeHui2,QinRui1
(1 College of Life Sciences,South-Central University for Nationalities,Wuhan 430074,China;2 College of Life Sciences,Wuhan University,Wuhan 430074,China)
Objective: To investigate the mechanism of interleukin 32 (IL-32) inhibition of HIV replication. Methods: The most significant IL-32 subtype of HIV replication was screened by luciferase activity assays. By constructing a series of HIV plasmids containing LTR truncated mutations and point mutations of TAR hairpin,the site of IL-32 inhibition on HIV replication was determined. Results: In the three cell lines of Hela, Jurkat and 293T, IL-32γ and IL-32ε subtypes had the most significant inhibitory effects on HIV. In Hela cell line, it was confirmed that IL-32 could suppress HIV replication by inhibiting the activity of HIV 5′-LTR, with the hairpin structure formed by TAR playing an important role in this process. The action site of IL-32 interaction with TAR structure was located at the ring and the half ring of TAR. Conclusion: IL-32 can inhibit HIV replication as a potential means of HIV treatment.
interleukin-32(IL-32);human immunodeficiency virus(HIV);long terminal repeat(LTR)
2017-06-05
张 蕊(1982-),女,工程师,博士,研究方向:微生物学、营养学,E-mail:Zhangrui@mail.scuec.edu.cn
国家自然科学基金资助项目(81402668)
Q932
A
1672-4321(2017)04-0040-05
