热预适应对大鼠中枢疲劳后体温及脑神经递质5-HT分泌的影响研究
2017-12-16曹庆雷赵海涛李小兰
曹庆雷,赵海涛,李小兰
热预适应对大鼠中枢疲劳后体温及脑神经递质5-HT分泌的影响研究
曹庆雷,赵海涛,李小兰
北京科技大学体育部,北京,100083。
目的:观察热预适应通过调节中枢神经递质对大鼠运动诱导的中枢疲劳的作用。方法:12只成年雄性SD大鼠,随机分为2组,6只为预热组,6只为对照组。运动疲劳模型通过力竭跑步模型建立,热预处理组是42℃热处理15min,每天3次,连续5天,对照组不做任何处理。记录最后运动力竭时间及运动前后体内核心温度,同时用液相色谱测量脑组织中5羟色胺(5-HT)的水平。结果:(1)热预处理组的平均力竭时间为178.24±42.43 min,显著高于对照组318.49±37.25min,热预适应显著增加了运动的耐受时间(P<0.05);(2)热预处理组运动前后肛温差0.382±0.396℃显著低于对照组(1.954±0.603)℃,热预适应显著降低了运动后体温(P<0.05);结论:热预适应可以有效的降低运动前后体温差,并且可能是通过减少5-HT含量来起到延缓中枢运动疲劳的作用。
热预适应;神经递质;运动疲劳
运动性疲劳是因为运动引起的肌肉运动及做功能力下降的现象,其中长时间中等强度的运动所产生的疲劳主要由中枢神经系统发出的抑制信号而引起的,称之为运动中枢性疲劳[1-3],是目前运动疲劳机制研究的热点之一。缓解疲劳对提高运动能力有重要作用,是运动领域重要的研究课题。运动性中枢疲劳机制研究提出多种假说,涉及中枢神经递质失衡,内稳态失调,氨基酸、离子代谢紊乱,自由基增多,能源衰竭,神经内分泌、免疫系统的平衡打破等诸多变化[4]。随着神经生物学相关技术方法在运动医学研究中应用,运动性中枢疲劳机制的研究取得了一些进展,长时间运动时中枢神经递质的变化是导致疲劳产生的重要原因[1,3]。
有关神经递质分泌失衡导致中枢性疲劳的研究发现,运动过程中体温升高可能是诱导神经递质分泌的主要原因之一。热应激条件下,体温升高的热敏信号,传递至下丘脑视前区等脑区域,脑区域内热敏神经元接受并整合形成反馈信号作用于下丘脑、延髓中缝区等不同脑区,影响脑内神经递质的释放和相应受体的表达,从而产生一系列反应,调整各种机能以适应环境温度的改变,并可影响机体长时间的运动能力,并从而在运动性中枢疲劳的产生和恢复中发挥特定的作用[5-7]。神经网络调节是多重而复杂的过程,递质的分泌受内外环境影响,并且可因环境的改变而进行适应性调节,保持身体稳态。那么过量运动引起的递质变化,也可能通过全身性调节引起自身适应性改变,从而使失衡的神经递质分泌趋于正常。那么,预适应后达到的新的递质平衡就有可能适应机体的应激状态,从而在过量运动过程中推迟疲劳出现的时间、延长运动时间,减轻疲劳程度。在自身适应调节机制研究中,预适应是目前常用且安全有效的方法之一,常用于减轻机体损伤,如缺血预适应保护脑组织、肌肉组织等[8-9]。热预适应是指通过反复暴露在高热的条件下,使得体内和皮肤温度升高并且大量出汗[10-13]。热预适应的研究也应用于诸多领域,如热预适应对保护和改善心肌细胞的损伤,对神经系统及小鼠的学习行为也有积极的影响[14-15]。已有研究显示,在热应激条件下,可通过提高DA、NE的活性抑制机体温度升高导致的中枢疲劳,改善热应激下运动能力[16-17]。同时也有研究显示,DA能提高神经元活性也能使受试者在高热环境中运动时有更高的耐受性[18]。由此可见,人体对热应激的调节反应与神经递质分泌有密切的关系。调节神经递质的活性,达到自身在高温环境中新的平衡,有利于维持机体的稳态。
因此,我们的研究拟通过热预适应调节中枢神经递质的平衡,研究并阐明运动时重要神经递质的变化规律,明确其与运动性中枢疲劳的关系,并且寻找中枢性疲劳的有效的预防与恢复方法。
1 材料和方法
1.1 实验动物和分组
成年雄性SD大鼠(8周龄)12只,体重230g—260g之间(购自北京维通利华实验动物公司)。大鼠饲养在首都医科大学实验动物中心大鼠饲养房。大鼠正常分组(3只/笼子),自由饮水,饮食,温度为18—24℃,空气相对湿度40%—60%,正常昼夜节律。
1.2 实验方法
1.2.1 高温预热处理 预热组动物用6%水合氯醛0.6ml/100g腹腔注射麻醉,置于60℃恒温水浴箱,保持大鼠呼吸通畅,直至肛温升至42℃,维持肛温42℃ 15min,再置于常温环境下恢复体温,1小时后,再升高体温42℃ 15min,反复3次,连续5天。对照组不做任何处理。
1.2.2 急性力竭疲劳模型建立 采用Bedford[19]建立的一次性平板跑台力竭跑步模型,两组动物测试前进行适应性跑台训练一次/天(共3天),低于力竭程度。恢复2天后进行一次性力竭跑步实验,采用treadmill平板跑台法,测试由15cm/s开始,持续15min,增加至25cm/s,持续15min,最后保持在35 cm/s跑步直至力竭,记录每只动物三阶段跑步时间。
1.2.3 核心体温测定 采用体温计测量肛温表示核心体温,跑步前测定初始肛温,力竭跑步完成后立即测肛温,用运动前后核心体温的变化观察体温变化的差异。
1.2.4 脑内神经递质检测 两组力竭跑步实验结束后,采用断头法获取脑组织,置于冰上并迅速分离皮质、下丘脑、海马、纹状体。高氯酸提取法充分匀浆后,4 000g/min离心5min,离心取上清液,-80℃冻存。采用高效液相色谱法分析各部脑组织内5-HT含量。
1.3 统计分析
所有结果采用均数±标准差表示,组间差异采用t检验分析,< 0.05为显著性差异,P < 0.01 为极显著性差异。
2 实验结果
2.1 一次性力竭跑步时间
两组动物经水平跑台三阶段力竭跑步后,测定各阶段跑步时间,结果显示预热组动物较对照组跑步持续时间明显延长,疲劳出现时间延后。其中一、二阶段跑步时间和动物体能状态无差别,两组动物均能按跑台速度匀速跑步,无疲劳表现;而在第三阶段后,尤其进入跑步后期,两组动物出现疲劳的时间、体能表现差异明显,对照组动物首先出现疲劳症状,如,速度下降,跑步暂停等,跑步至力竭平均时长为178.24±42.43min,而预热组动物在第三阶段,特别是跑步后期,耐力明显提高,能长时间保持匀速跑步,延迟疲劳出现,力竭时间较对照组平均时长显著延长,力竭时间为318.49±37.25min(P<0.05)。(如图1)
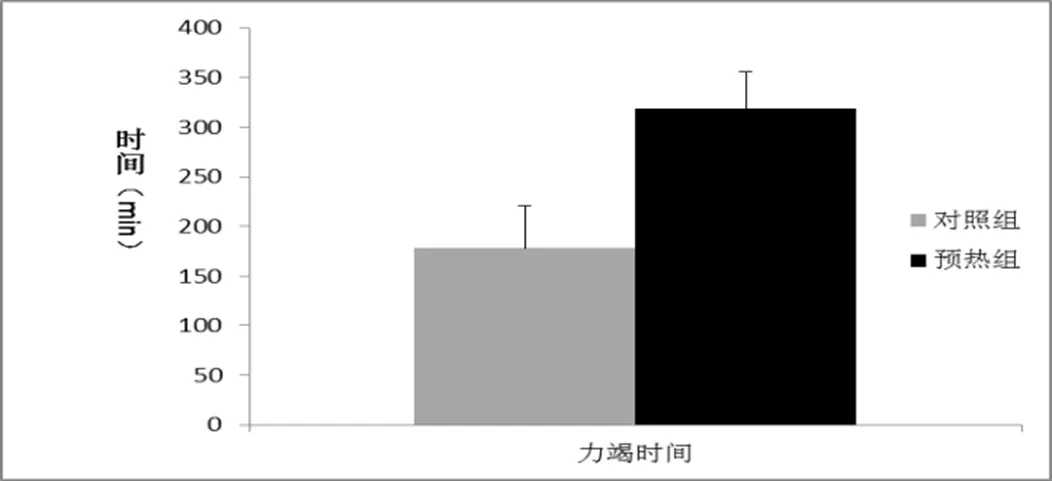
图1 第三阶段力竭时间
2.2 一次性力竭跑步肛温
随着运动过程的进行,体温会逐步升高,温度升高时是中枢疲劳的诱因之一。两组动物力竭跑步后均即刻检测肛温,结果显示对照组动物平均肛温,升高幅度,预热组动物平均肛温较跑步前升高0.382±0.396℃(p<0.05),较对照组(1.954±0.603℃)肛温升高幅度较小。(如图2)
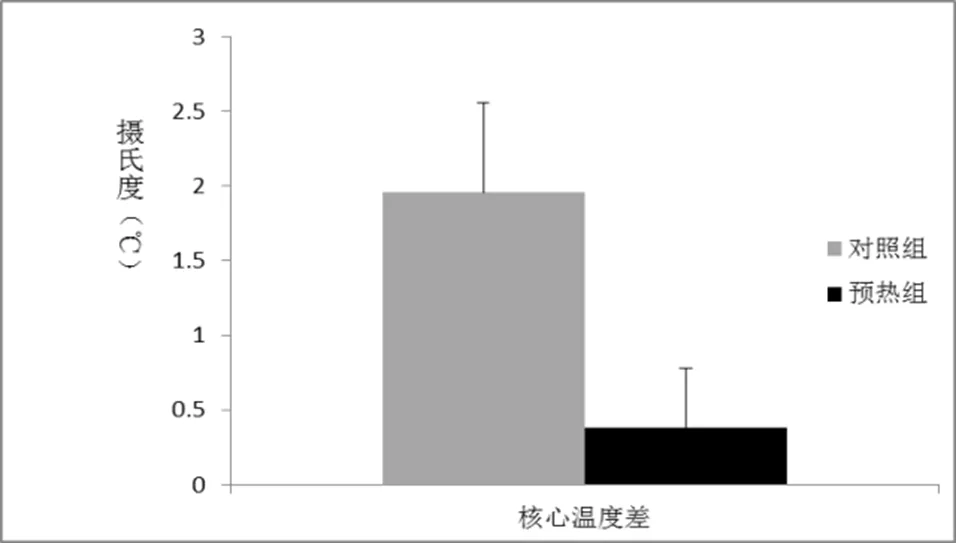
图2 力竭前后肛温差
2.3 神经递质变化
5-HT色氨是重要的中枢疲劳的标志物之一,在热适应组中5-HT色氨的含量显著低于对照组(p<0.01),热预适应处理后5-HT下降了接近50%。(见图3)
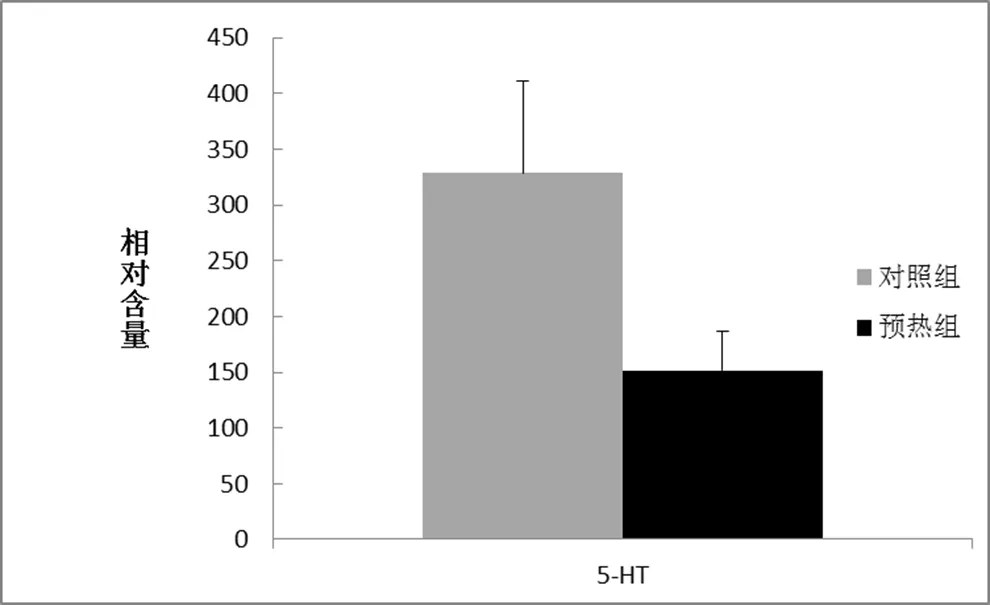
图3 神经递质5-HT的变化
3 分析及讨论
3.1 热预适应延缓运动疲劳的出现
热预适应在运动损伤以及脑保护研究中已经有较为深入的研究。实验发现热预适应可提高动物热休克蛋白(Hsp)和抗氧化剂表达水平,对大鼠骨骼肌运动损伤具有保护作用[20]。另外,热预适应产生热休克蛋白,在多种中枢性疾病或损伤中被发现具有有效的保护作用[21-23]。此外,在缺氧及低能量条件下培养的大脑海马细胞,其损害程度也可因热休克蛋白而减轻[24]。这些研究表明,热预适应对运动中机体和脑有保护作用。我们测量了热预适应组跟对照组大鼠跑台的平均力竭时间。结果表明,热预适应后,大鼠的平均力竭时间为320min 而对照组的平均力竭时间约为180min,说明经过热预适应后大鼠的力竭时间提高了约75%。说明了热预适应可以延缓运动性疲劳的出现时间。
3.2 热预适应降低运动前后机体温差
机体在运动后,体温会有升高的现象,与正常的体温相比,机体在高温下的运动能力会有所下降。热预适应是经常被作为减少这种损伤的措施之一。热预适应可以诱导机体生理上对高温的适应,从而可以用来提高运动成绩。人们已经对热适应进行了大量的研究,例如,Patterson等人研究表明健康机体在经过8天和22天的热预适应后体内核心温度分别下降了0.20℃与0.32℃[25]。热休克反应通常是经过改善的耐热性的标志之一,有研究表明,热预适应诱导的细胞内热休克蛋白(Hsp72)浓度增加[26]。这些数据表明,细胞内的热休克蛋白可能对热预适应更为敏感。通过测量实验组跟对照组力竭运动前后体温表明,热预处理组的运动前后的温差变化显著小于对照组。先前研究表明,运动过程中体温的升高可能是诱发神经递质分泌失衡的主要原因之一。运动过程中会引起体温升高,运动员机体核心温度随时间与运动负荷的增加而平稳的、缓慢的升高[27]。已经有证据表明,正是过量运动时体温的升高引起了多种递质分泌,例如,体温升高后脑内视前区和下丘脑前部区域中5-HT含量上升[28];DA、NE伴随大脑和机体核心温度的升高而增加,该类递质参与调节降温过程[29-30]。
3.3 热预适应对神经递质的影响
研究证实多种神经递质与中枢性运动疲劳产生有密切关系并起到重要的调节作用,因而成为疲劳产生机制、缓解疲劳方法研究中的重要内容。目前已经发现多种神经递质参与了运动疲劳的发生,主要包括多巴胺、γ-氨基丁酸(GABA)、5-HT和NE等;也有兴奋性递质谷氨酸(Glu)和天冬氨酸(Asp)等及其他类型神经递质如乙酰胆碱等参与[4]。过量运动可引起多种神经递质分泌失衡,并导致递质之间相互作用的平衡失调,因而引起脑内代谢紊乱,引起中枢性疲劳,这可能是运动疲劳发生的重要原因。
5-HT是研究最多的的中枢疲劳的标志物之一[31-33]。研究发现,长时间大强度运动使血浆游离的氨基酸浓度上升,氨基酸和色氨酸争夺结合位点从而增加了血浆中游离色氨酸的浓度和色氨酸/支链氨基酸的比值,促使更多的色氨酸等递质穿过血脑屏障,使脑内特定区域抑制性递质5-HT的合成增加,同时会引起多种酶活性下降,ATP再合成下降,继而使肌肉运动能力下降[34]。5-HT是最明显的中枢疲劳的衡量物。我们测量了热预适应组和对照组的5-HT的含量(图3),结果发现,热预处理组5-HT在脑中的含量显著低于对照组,这表明,热预适应抑制了由运动疲劳导致的5-HT浓度的上升。
3.4 热预适应通过改善神经递质延缓运动疲劳的机制推测
综上所述,本研究观察到热预处理干预后导致大鼠运动至力竭的时间缩短,运动前后体温差减小,中枢神经递质5-HT的含量下降,我们推测通过热应激预适应,诱导并激活神经递质网络的活动,适应温度变化,使脑内神经递质分泌预先进入调节机制,尤其是提高抑制性递质的活性,使神经递质分泌与身体机能趋于平衡,达到高温环境中的稳态,调节机体适应高温环境,将有效延缓因神经递质失调造成代谢失衡、中枢性疲劳的出现。研究中,我们通过热预处理使得机体适应了5-HT的下降,从而在运动力竭实验中,大鼠的5-HT的水平相应的下降。这无疑对改善锻炼机能,提高疲劳运动耐受力有重要意义。
4 结 论
经过热预适应处理后,大鼠运动力竭时间明显延长,肛温的运动前后温差显著变小,5-HT的含量明显下降,说明热预处理通过对神经递质的调控从而改善了运动中枢疲劳的发生。
[1] Fernstrom J D, Fernstrom M H. Exercise, serum free tryptophan, and central fatigue.[J]. Journal of Nutrition, 2006, 136(02): 553~559.
[2] Meeusen R, Watson P, Hasegawa H, Roelands B, Piacentini MF. Brain neurotransmitters in fatigue and overtraining. Appl Physiol Nutr Metab. 2007; 32(05): 857~864.
[3] Newsholme E A, Blomstrand E. Branched-chain amino acids and central fatigue.[J]. Journal of Nutrition, 2006, 136(136): 274~276.
[4] Zając A, Chalimoniuk M, Maszczyk A, et al. Central and Peripheral Fatigue During Resistance Exercise - A Critical Review.[J]. Journal of Human Kinetics, 2015, 49(01): 519~522.
[5] Fuller A, Carter R N, Mitchell D. Brain and abdominal temperatures at fatigue in rats exercising in the heat.[J]. Journal of Applied Physiology, 1998, 84(03): 877~883.
[6] Rodrigues LO, Oliveira A, Lima NR, Machado-Moreira CA. Heat storage rate and acute fatigue in rats. Braz J Med Biol Res. 2003; 36(1): 131~135.
[7] Walters TJ, Ryan KL, Tate LM, Mason PA. Exercise in the heatis limited by a critical internal temperature. J Appl Physiol. 2000; 89(02): 799~806.
[8] Jensen H A, Loukogeorgakis S, Yannopoulos F, et al. Remote ischemic preconditioning protects the brain against injury after hypothermic circulatory arrest.[J]. Circulation, 2011, 123(123): 714~721.
[9] 刘 亮,吕国蔚. 缺氧预适应小鼠脑匀浆去蛋白液对缺氧突触体膜的保护作用[J]. 神经科学通报(英文版),2001,17(04):373~375.
[10] Tyler C J, Reeve T, Hodges G J, et al. Erratum to: The Effects of Heat Adaptation on Physiology, Perception and Exercise Performance in the Heat: A Meta-Analysis[J]. Sports Medicine, 2016, 46(11): 1~1.
[11] Nielsen B, Hales J R, Strange S, et al. Human circulatory and thermoregulatory adaptations with heat acclimation and exercise in a hot, dry environment.[J]. Journal of Physiology, 1993, 460(01): 467~485.
[12] Weller AS, Linnane DM, Jonkman AG, et al. Quantification of the decay and re-induction of heat acclimation in dry-heat following 12 and 26 days without exposure to heat stress. Eur J Appl Physiol. 2007; 102:57~66.
[13] Guy JH, Deakin GB, Edwards AM, et al. Adaptation to hot environmental conditions: an exploration of the performancebasis, procedures and future directions to optimise opportunities for elite athletes. Sports Med. 2015; 45(03): 303~311.
[14] 王丽娜,张伟华,李全凤,等. 热应激预适应对H_2O_2诱发乳鼠心肌细胞损伤的保护作用[J]. 哈尔滨医科大学学报,2003,37(01):28~30.
[15] 周国兴,王春旭,刘正清. 热应激预适应对小鼠学习记忆的影响[J]. 解剖学研究,2004,26(04):268~271.
[16] Takatsu S, Ishiwata T R, Sarre S, et al. Serotonin release in the preoptic area and anterior hypothalamus is not involved in thermoregulation during low-intensity exercise in a warm environment.[J]. Neuroscience Letters, 2010, 482(01): 7~11.
[17] Hasegawa H, Piacentini M F, Sarre S, et al. Influence of brain catecholamines on the development of fatigue in exercising rats in the heat.[J]. Journal of Physiology, 2008, 586(01): 141~149.
[18] BRIDGE M,WELLER A,RAYSON M,et al.Responses to ex-ercise in the heat related to measures of hypothalamic serotoner-gic and dopaminergic function[J].Eur J Appl Physiol, 2003,89:451~459
[19] Bedford T G, Tipton C M, Wilson N C, et al. Maximum oxygen consumption of rats and its changes with various experimental procedures.[J]. Journal of Applied Physiology Respiratory Environmental & Exercise Physiology, 1979, 47(06): 1278~1283.
[20] 高前进,李爱君,马新东,等. 热应激对骨骼肌离心运动损伤的保护作用及机制[J]. 成都体育学院学报,2007,33(02):86~91.
[21] Turturici G, Sconzo G, Geraci F. Hsp70 and its molecular role in nervous system diseases.[J]. Biochemistry Research International, 2011, 2011(4096): 618 127~618 127.
[22] Gibson O R, Tuttle J A, Watt P W, et al. Hsp72 and Hsp90α mRNA transcription is characterised by large, sustained changes in core temperature during heat acclimation.[J]. Cell Stress & Chaperones, 2016, 21(06): 1~15.
[23] Duncan R F. Inhibition of Hsp90 function delays and impairs recovery from heat shock[J]. Febs Journal, 2005, 272(20):5 244~5 256.
[24] Geyer A B, Horn A P, Tavares A, et al. Changes in heat shock protein 27 phosphorylation and immunocontent in response to preconditioning to oxygen and glucose deprivation in organotypic hippocampal cultures[J]. Neuroscience, 2003, 118(02): 379~386.
[25] Patterson MJ, Stocks JM, Taylor NA. Humid heat acclimationdoes not elicit a preferential sweat redistribution toward thelimbs. Am J Physiol Regul Integr Comp Physiol. 2004;286(03): R512~8.
[26] Armstrong LE, Maresh CM, Keith NR, et al. Heat acclimationand physical training adaptations of young women using different contraceptive hormones. Am J Physiol Endocrinol Metab. 2005; 288(05): 868~875.
[27] 李洪涛. 辽宁省女子自行车运动员递增负荷运动中体核温度及相关生理生化指标变化的研究[D]. 沈阳体育学院,2014.
[28]Leite L H, Rodrigues A G, Soares D D, et al. Central fatigue induced by losartan involves brain serotonin and dopamine content.[J]. Medicine & Science in Sports & Exercise, 2010, 42(08): 1469~1476.
[29] 王 斌,张蕴琨,李 靖,等. 力竭运动对大鼠纹状体、中脑及下丘脑单胺类神经递质含量的影响[J]. 中国运动医学杂志,2002,21(03):248~252.
[30] Stefano G B, Hiripi L, Catapane E J. The effects of short and long term temperature stress on serotonin, dopamine and norepinephrine concentrations in molluscan ganglia[J]. Journal of Thermal Biology, 1978, 3(02): 79~83.
[31] Blomstrand E. A role for branched-chain amino acids in reducing central fatigue. J Nutr. 2006;136(02): 544~547.
[32] Davis J M, Bailey S P. Possible mechanisms of central nervous system fatigue during exercise[J]. Medicine & Science in Sports & Exercise, 1997, 29(01): 45~57.
[33] Maughan R J. Chapter 12. Nutrition, Neurotransmitters and Central Nervous System Fatigue[M]// Nutrition in Sport. Blackwell Science Ltd, 2008:171~183.
[34] Hoffmann P, Elam M, Thorén P, et al. Effects of long-lasting voluntary running on the cerebral levels of dopamine, serotonin and their metabolites in the spontaneously hypertensive rat[J]. Life Sciences, 1994, 54(13): 855~861.
Heat Preconditioning Reduce Exercise Induced Central Fatigue by Neurotransmitters DA, 5-HT, NE Manipulation
CAO Qinglei, ZHAO Haitao, LI Xiaolan
P.E. Department of University of Science and Technology Beijing, 100083, China.
objective: To observe the effect of heat preconditioning on exercise induced central fatigue by regulate theneurotransmitters manipulation. Methods: Twelve male adult SD rats were randomly divided into 2 control group(n=6), heat preconditioning model group(n=6). Sports fatigue model was established by treadmill running. Heat preconditioning was applied by 42℃, per times for 15min, three times per day for 5 days. The exhausted exercise time and body core temperature were recorded. The 5 hydroxytryptamine(5-HT)levels in the brain tissue were measured by HPLC. Results: 1)The duration of exhausted exercise in heat preconditioning group and control group were(56.00 ± 12.27)min and(70.88 ± 13.74)min respectively, significant increase in exercise tolerance(P<0.05); 2)The duration of exhausted exercise in heat preconditioning group and control group were(0.382 ± 0.396)℃ and(1.954 ± 0.603)℃respectively, significant increase in exercise tolerance(P<0.05); Conclusions: Heat preconditioning can effectively reduce the temperature difference before and after exercise, and may be through the reduction of 5-HT content to play a role in delaying the movement of fatigue.
Heat preconditioning; Neurotransmitters; Exercise fatigue
1007―6891(2017)06―0024―04
10.13932/j.cnki.sctykx.2017.06.06
G804.7
A
2017-06-14
2017-07-29
中央高校基本科研业务费资助项目,项目编号:FRF-BR -16-003B。
