BimS 慢病毒RNA干扰载体的构建及其感染效率和干扰效果的实验研究
2017-11-29姚佳饶国洲李旭奎
姚佳 饶国洲 李旭奎
BimS慢病毒RNA干扰载体的构建及其感染效率和干扰效果的实验研究
姚佳 饶国洲 李旭奎
目的应用RNA干扰技术构建BimS慢病毒RNA干扰载体,探讨其感染效率和干扰效果。方法针对人BimS设计3 个干扰靶点,将单链引物退火成双链oligo序列,连接入Age I和EcoR I双酶切线性化载体中。将重组质粒进行病毒包装、并且通过感染ACC-2细胞观察其感染效率,定量PCR检测其对BimS mRNA干扰效果。结果PCR产物经扩增电泳后阳性克隆得到337bp条带,插入序列片段与DNA测序结果完全相符。重组慢病毒载体在293T细胞中包装获得滴度为2×108TU/ml的病毒颗粒,MOI=20,转染效率为85%。转染pFU-GV-BmS-1组、pFU-GV-BmS-2组及对照组BmS mRNA相对表达水平分别为:0.743±0.025、 0.466±0.023、 1.266±0.042(组间两两比较,Plt;0.05)。结论BimS慢病毒RNA干扰载体构建成功,并能高效感染ACC-2细胞及下调BmS mRNA表达。
RNA干扰;BimS基因; 慢病毒表达载体
癌症的发生、发展与凋亡相关基因的调控细胞增殖与凋亡作用有关[1-2]。Bim(Bcl-2 inferacting mediator of cell death)是BH3-only蛋白家族中促凋亡成员及线粒体凋亡途径主要凋亡蛋白[3],Bim前体mRNA选择性剪接形成编码蛋白分别为110、140和196个氨基酸,及相对分子质量15、19、23(×103)的3 种异构体,即BimS、BimL和BimEL。研究表明3 个异构体中BimS促凋亡活性最高[4],基于Bim蛋白在药物诱导细胞凋亡中的作用,本研究采用分子克隆技术构建BimS慢病毒RNA干扰载体,拟转染腺样囊性癌细胞下调BimS mRNA及蛋白表达,旨在研究促凋亡蛋白Bim的表达活化对不同化疗药物诱导的腺样囊性癌细胞线粒体凋亡途径的影响及分子机制,探讨其成为化疗药物治疗的作用靶点的可行性。
1 材料与方法
1.1 材料
主要试剂: Age I, EcoR I, T4DNAligase(Promega);质粒DNA提取试剂盒(Omga);GV248慢病毒载体(吉凯基因公司);E.coli DH5α感受态细胞(由本院中心实验室提供);polybrene感染添加剂, Eni.S溶液, pHelper 1.0、pHelper 2.0(吉凯公司); RPMI-1640, 小牛血清(Gibco)。 主要仪器:低温高速离心机, 台式离心机(Sigma);恒温培养箱, 恒温摇床(Thermo);荧光倒置显微镜(Nikon)。
1.2 方法
1.2.1 siRNA靶序列设计 根据NCBI数据库中人BimS序列,选取2 个长度为19 bp的特异性寡核苷酸作为靶序列,编号为RNAi-33906(TGATGTAAGTTCTGAGTGT); RNAi-33907(CCCTACAGACAGAGCCACA);阴性干扰序列:RNAi-NC(TTCTCCGAACGTGTCACGT)。
1.2.2 病毒载体构建框架 以特异性寡核苷酸序列作为模板,按碱基互补配对原理,在两互补链之间设CTCGAG为Loop区,后接TTTTTTG转录终止信号,5′端引入Age I酶切位点, 3′端引入EcoR I酶切位点,按每个靶序列设计合成正反2 条链组成特异性寡核苷酸链。 编号:RNAi-33906-a: 5′-CCAATCTGATGTAAGTTCTGAGTGTCTCGAGACACTCAGAACTTACATCAGA T
TTTTg-3′; RNAi-33906-b:5′-AATTCAAAAATC TGATGTAAGTTCTGAGTGTCTCGAGA CACTCAGAACTTACA
TCAGA-3′,RNAi-33907-a:CCAACT CCCTACAGACAG
AGCCACACTCG AGTGTGGCTCTGTCTGTAGGGAG TT
TTTg-3′; RNAi-33907-b:AATT CAAAAACTCCCTACA GACAGAGCCACACTCGAGTGTGGCTCTGTCTGTAGGG
AG-3′。阴性序列:GV112-NC-15′-CCG GTTCTCCGAACGTGTCACGTTTCAAGAGAACGTGACACGTTCG
GAGAATTTTTG-3′GV112-NC-25′-AATTCAAAAATTC
TCCGAACGTGTCACGTTCTCTTGAAACGTGACACGTT
CGGAGAA-3′。
1.2.3 DNA片段合成及连接入载体 将oligo用oligo annealing buffer溶解成20 μmol/L互补单链,各取30 μl混合,置95 ℃水浴中加热15 min,取出自然冷却至室温形成双链oligo片段,取1 μl用于后续的连接反应。 用Age I和EcoR I双酶切GV112质粒载体回收7.4 kb片段。将退火的双链oligo与线性化载体连接,连接反应体系设阳性对照组,自链组和连接组。
1.2.4 重组质粒载体转化 用冷却的无菌吸头从感受态细胞悬液中取200 μl转移到无菌的微量离心管中,每管加2 μl连接液,轻轻旋转以混匀内容物,在冰中放置30 min,将EP管放置欲加温到42 ℃水浴中热激90 s,迅速转入到冰浴中冷却2 min。 加800 μl SOC液体培养基,置37 ℃摇床温育45 min使细菌复苏。将150 μl已转化的感受态细胞转移到20 mmol/L MgSO4和Amp抗性(100 μg/ml)的LB固体琼脂平板上,置于37 ℃培养箱16 h。
1.2.5 阳性克隆鉴定 挑取平板上生长出的转化子重悬于10 μl LB培养液中,从中取1 μl做模板进行菌落PCR鉴定。PCR引物为primer(+):5′-CCTATT-TCCCATGATTCCTTCATA-3′;primer(-):5′-ATGTCCTTCTGCTGATACTGGG-3′。 10×buffer 2 μl; dNTPs(2.5 mmol/L)0.8 μl; primer(+)0.4 μl; primer(-)0.4 μl;Taq polymerase 0.2 μl; Template 1 μl; dd H2O补至20 μl。 94 ℃ 5 min, 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 30 s, 30 cycle,72 ℃ 6 min。
1.2.6 重组载体测序鉴定 将构建的重组载体阳性克隆保种并分装100 μl送北京华大基因公司进行DNA测序分析。
1.2.7 重组慢病毒包装及滴度检测 分别提取pFU-GV-RNAi、pHelper 1.0、 pHelper 2.0 3 种质粒,按Lipofectamin-2000说明书进行转染293T细胞。
1.2.8 ACC-2细胞感染预实验 实验前1 d,以每毫升3×104个目的细胞接种96 孔培养板,体积90 μl, 细胞融合至50%,实验分为4 组,每组4 个不同梯度MOI。配制1×108TU/ml, 2×107TU/ml, 1×107TU/ml, 1×106TU/ml病毒液。取5 μl病毒液稀释到45 μl的Eni.S中,再进行1 次10 倍稀释即可。 取2 μl 10 mg/ml polybrene 稀释到400 μl备用。将10 μl 4 个不同梯度的病毒加到各组的相应孔中。(加入的病毒量分别为1×106TU, 2×105TU, 1×105TU, 1×104TU,细胞数为1×104个, MOI分别为100、 20、 10、 1),在polybrene孔中加10 μl polybrene稀释液(终浓度为5 μg/ml),混匀后继续培养, 8~12 h后观察细胞状态,并更换新鲜培养基。感染3~4 d后观察荧光表达情况。
1.2.9 BimS mRNA PCR检测 收集转染后细胞提取RNA反转录 cDNA,BimS上游引物5′-GCAATGGTAGTCATCCTAGAGG-3′;下游引物5′-ATCCTTGTGGTTGAGTTGTTCT-3′;GAPDH上游引物 5′- TGACTTCAACAGCGACACCCA-3′;下游引物5′- CACCCTGTTGCTGTAGCCAAA-3,(上海生工合成)。SYBR premix extaq 10.0 μl,上游引物(2.5 μmol/L)0.5 μl, 下游引物(2.5 μmol/L)0.5μl,cDNA 1.0 μl, RNase-free H2O 8.0 μl。 95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 30 s, 45 cycle; 95 ℃15 s, 55 ℃ 30 s, 95 ℃ 15 s, 1 cycle。
1.3 统计学分析

2 结 果
2.1 PCR产物鉴定
连接入vshRNA片段的阳性克隆PCR片段大小为508 bp条带,空载体克隆PCR片段大小为543 bp条带,表明目的片段已插入载体中(图 1~2)。
2.2 阳性克隆测序分析
测序结果中显示有与设计相同的靶序列,表明BimS慢病毒表达载体构建成功,并命名编号33906为pFU-GV-BimS-1;编号33907为pFU-GV-BimS-2;阴性干扰序列为pFU-GV-RNAi NC(图 3~4)。

1: 阴性对照; 2: 自连对照; 3: Marker(5、 3、 2、 1.5、 1 kb、 750、 500、 250、 100 bp); 4~8: 挑取的转化子
图 1 RNAi-33906菌落PCR扩增电泳鉴定
1: Negative control; 2: Self even control; 3: Marker(5, 3, 2, 1.5, 1 kb, 750, 500, 250, 100 bp); 4-8: Selected transformants
Fig 1 PCR amplification electrophoresis identification map of RNAi-33906 colony

1: 阴性对照; 2: 自连对照; 3: Marker(5、3、2、1.5、1 kb、750、500、250、100 bp); 4~8: 挑取的转化子
图 2 RNAi-33907菌落PCR扩增电泳鉴定图
1: Negative control; 2: Self even control; 3: Marker(5, 3, 2, 1.5, 1 kb, 750, 500, 250, 100 bp) ; 4-8: Selected transformants
Fig 2 PCR amplification electrophoresis identification map of RNAi-33907 colony

图 3 RNAi-33906-a测序图 图 4 RNAi-33907-a测序图
Fig 3 Sequencing graph of RNAi-33906-a Fig 4 Sequencing graph of RNAi-33907-a
2.3 重组慢病毒滴度及荧光照片
重组慢病毒感染293T细胞96 h后观察荧光表达,数出最后2 孔中荧光细胞数,将得到的荧光细胞数除以相应的稀释倍数,得到病毒原液的滴度值。结果获得重组慢病毒颗粒滴度为2×108TU/ml(图 5)。
2.4 重组慢病毒感染效率
重组慢病毒感染ACC-2细胞在感染增强溶液Eni.S和5 μg/ml polybrene感染添加剂条件下易被感染, MOI为20时可以达到80%以上的感染效率。结果表明重组慢病毒能有效感染ACC-2细胞(图 6)。
2.5 BmS mRNA表达
采用定量RT-PCR检测BimS mRNA,以2-ΔΔct法计算基因相对表达量,转染pFU-GV-BmS-1组、pFU-GV-BmS-2组和对照组BmS mRNA相对表达水平分别为: 0.743±0.025、 0.466±0.023、 1.266±0.042。

A:10-1; B: 10-2; C: 10-3; D: 10-4; E: 10-5; F: 10-6; G: 10-7; H: 10-8
图 5 2×108TU/ml病毒(GFP)滴度检测图片
Fig 5 Detection picture of 2×108TU/ml virus (GFP) titer
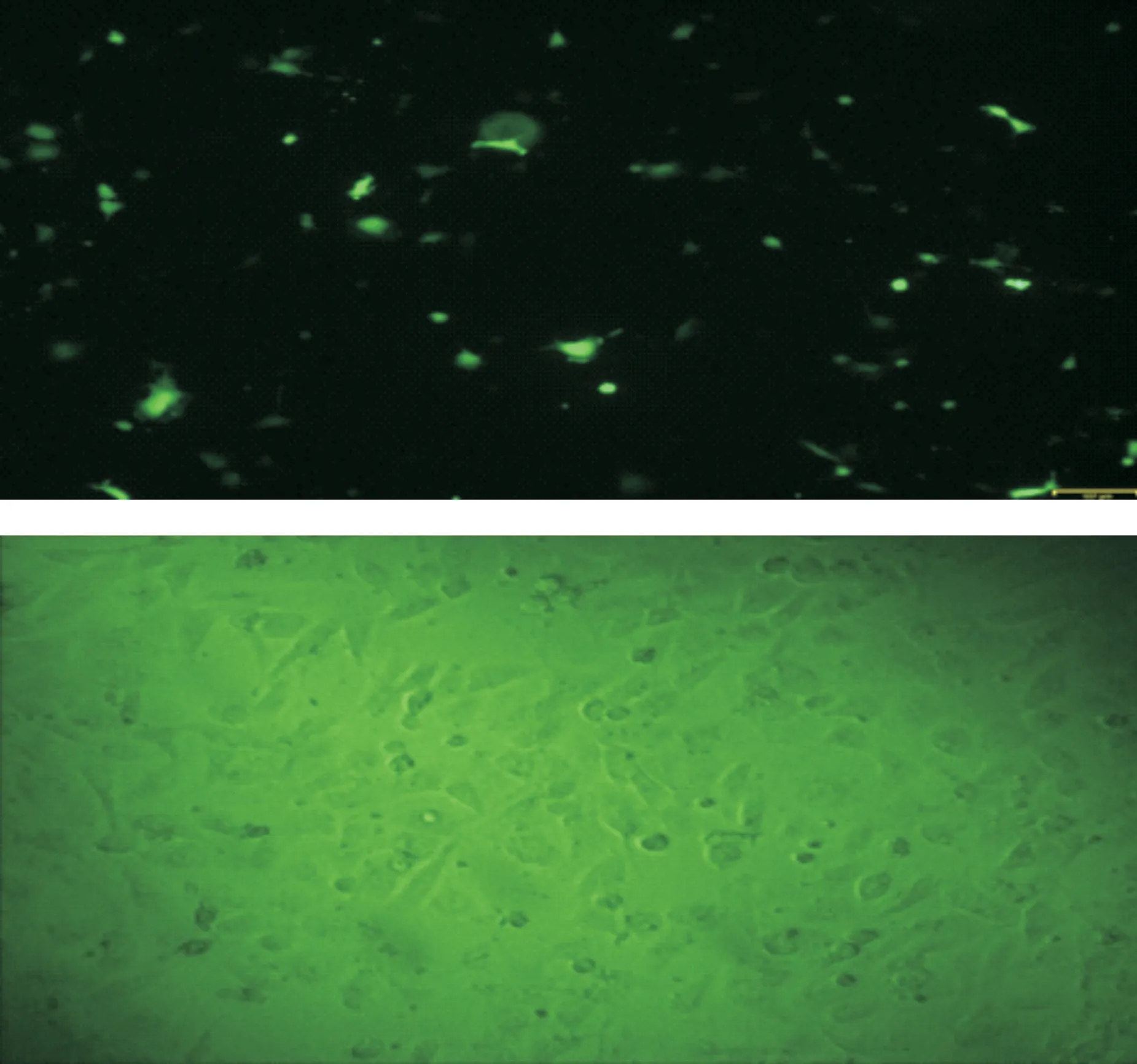
A: Fluorescence-field(GFP); B: Bright-field
Fig 6 The infection efficiency of the recombinant lentivirus into ACC-2 cells(MOI=20)
pFU-GV-BmS-1组与对照组比较差异有统计学意义(Plt;0.05); pFU-GV-BmS-2组与对照组比较差异有统计学意义(Plt;0.01); 2 个干扰组比较差异有统计学意义(Plt;0.05)。
3 讨 论
RNA干扰(RNA interference,RNAi),又称转录后基因沉默(post-transcriptional gene silencing,PTGS),由Fire等[3-4]1998 年首次向秀丽线虫注射双链RNA时发现。是将特异性同源双链RNA(dsRNA)导入细胞内,使目的基因不表达或表达水平下降。由于使用RNAi技术可以特异性敲除或关闭特定基因的表达,所以该技术已被广泛应用于探索基因功能及肿瘤的基因治疗领域[5-6]。
涎腺腺样囊性癌(adenoid cvstic carcinoma,ACC)是口腔常见的涎腺恶性肿瘤之一,目前针对ACC主要采取外科手术为主,放疗和化疗为辅的治疗方式。手术后常有局部复发和远处转移,其远期治疗效果不佳。对于晚期或复发转移的患者,化疗仍然是一种重要的治疗手段,但目前临床上应用的常规化疗药物效果并不理想。因此,开发新的化疗药物、探索新的化疗药物作用靶点、提高肿瘤对化疗药物的敏感性、增加化疗药物的疗效,是腺样囊性癌治疗的重要研究方向。
研究认为Bcl-2家族分子在药物诱导的肿瘤细胞凋亡过程中起着决定性的作用, Bim可促进肿瘤细胞的死亡,很多化疗药物通过调节Bim表达来发挥杀灭肿瘤细胞的功能[7-8]。Bcl-2家族包括3 个亚家族:抗凋亡的Bcl-2亚家族,如Bcl-2、Bcl-XL和Mcl-1等;促凋亡的Bax亚家族,如Bax、Bak;仅具有BH3结构域的促凋亡亚家族,如Bid、 Bim、 Bad、 Bik、 PUMA等,这些蛋白多定位于线粒体膜上,在线粒体凋亡途径中起着重要作用。据报道人类Bim基因定位的染色体区域位于很多肿瘤的染色体区域内,Bim 基因的缺失可导致多种肿瘤的发生,并和一些化疗药物的敏感性有关[9-11]。Bouillet等[12]实验表明,紫杉醇作用于肾上皮癌细胞时,缺失Bim则产生凋亡抵抗。不同的细胞类型Bim的功能和调节方式各异,下调Bim基因及蛋白表达有助于深入探讨其促凋亡的分子机制及对化疗药物的抵抗作用。目前在涎腺腺样囊性癌基因治疗研究中还没有针对沉默BimS基因的报道。因此,本课题根据BimS序列选取2 个长度为19 bp的特异性寡核苷酸作为靶序列构建慢病毒RNA干扰载体,通过PCR扩增和DNA测序鉴定证明测序结果中显示有与设计相同的靶序列,表明BimS慢病毒表达载体构建成功,并命名为pFU-GV-BimS-1, pFU-GV-BimS-2, 阴性干扰序列为pFU-GV-RNAi NC。
目前,常用的病毒载体包括逆转录病毒、腺病毒和慢病毒,逆转录病毒载体只能感染分裂期细胞,腺病毒一般不能整合到染色体上只能瞬时转染,与其相比慢病毒具有可以感染非分裂期细胞且容纳外源基因片段, 可进行长期表达等优点,采用第3 代慢病毒载体不产生任何有效的细胞免疫应答,具有较高的安全性。本实验重组慢病毒载体在293T细胞中包装,获得滴度为2×108TU/ml的病毒颗粒,Eni.S溶液是一种感染增强溶液,polybrene感染添加剂能提高病毒的感染效率,在重组慢病毒感染ACC-2细胞时应用Eni.S和5 μg/ml polybrene条件下易被感染, MOI为20时可以达到80%以上的感染效率。实验表明重组慢病毒能有效感染ACC-2细胞,转染pFU-GV-BmS-1组、pFU-GV-BmS-2组和对照组, BmS mRNA相对表达水平分别为0.743±0.025、 0.466±0.023、 1.266±0.042。 pFU-GV-BmS-1组与对照组比较差异有统计学意义(Plt;0.05);pFU-GV-BmS-2组与对照组比较差异有统计学意义(Plt;0.01); 2 个干扰组比较差异有统计学意义(Plt;0.05)。结果显示,构建的2 个RNA干扰载体均能下调BmS mRNA表达,pFU-GV-BmS-2的干扰作用强于pFU-GV-BmS-1。为下一步的实验研究打下了良好基础。
[1] 曲贝贝, 左金华, 朱玉红, 等. Survivin和PDCD5在黏液表皮样癌组织中的表达及临床意义[J]. 实用口腔医学杂志, 2016, 32(2): 225-229.
[2] 岳增文, 曹选平, 刘进忠, 等. 口腔鳞癌中LATS2基因mRNA与蛋白表达及其相关性[J]. 实用口腔医学杂志, 2016, 32(3): 432-433.
[3] Sunters A, Madureira PA, Pomeranz KM, et al. Paclitaxel-induced nuclear translocation of FOXO3a in breast Cancer cells is mediated by c-Jun NH2-terninal kinase and Akt[J]. Cancer Res, 2006, 66(1):212-220.
[4] Marani M, Tenev T, Hancock D, et al.Identification of novel isoforms of the BH3 domain protein Bim which directly activate Bax to trigger apoptosis[J]. Mol Cell Biol, 2002, 22(11):3577-3589.
[5] Fire A, Xu S, Montgomery MK, et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J]. Nature, 1998, 391(6669):806-811.
[6] Hammond SM, Bernstein E, Beach D, et al. An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells[J]. Nature, 2000, 404(6775):293-296.
[7] Hemann MT, Fridman JS, Zilfou JT, et al. An epi-allelic series of p53 hypomorphs created by stable RNAi produces distinct tumor phenotypesinvivo[J]. Nat Genet, 2003, 33(3):396-400.
[8] Jiang M, Milner J. Bcl-2 constitutively suppresses p53-dependent apoptosis in colorectal cancer cells[J]. Genes Dev, 2003, 17(7):832-837.
[9] Wang J, Zhou JY, Wu GS. Bim protein degradation contributes to cisplatin resistance[J]. J Biol Chem, 2011, 286(25):22384-22392.
[10]Yan HJ, Liu WS, Sun WH, et al. miR-17-5p inhibitor enhances chemosensitivity to gemcitabine via upregulating Bim expression in pancreatic cancer cells[J]. Dig Dis Sci, 2012, 57(12):3160-3167.
[11]张芳, 李洋, 吴蘅, 等. MiR-192靶向负调控Bim表达诱导肺癌顺铂耐药[J]. 中国肺癌杂志, 2014, 17(5):384-390.
[12]Bouillet P, Metcalf D, Huang DC, et al. Proapoptotic Bcl-2 relative Bim required for certain apoptotic responses, leukocyte homeostasis, and to preclude autoimmunity[J]. Science, 1999, 286(5445):1735-1738.
(收稿: 2016-10-06 修回: 2016-12-04)


① 上颌前部单颗牙缺失——引导骨再生、同期种植术定价: 210.00元
② 上颌前部单颗牙缺失——拔牙位点保存、延期种植术定价: 210.00元
③ 上颌前部单颗牙缺失——牙槽嵴骨劈开、同期种植术定价: 210.00元
④ 上颌后部单颗牙缺失——穿牙槽嵴上颌窦底提升、同期种植术定价: 210.00元
⑤ 上颌后部多颗牙缺失——侧壁开窗上颌窦底提升、同期种植术定价: 210.00元
⑥ 下颌后部单颗牙缺失——不翻瓣的种植体植入技术定价: 210.00元
需购者, 1、 请直接汇款至: 西安市长乐西路145号第四军医大学口腔医学院《实用口腔医学杂志》编辑部 收, 邮编: 710032。
2、 登陆《实用口腔医学杂志》网站主页, 扫描杂志微信二维码, 加微信好友后,可通过微信钱包支付。
电 话: 029-83224470/84776213 网 址: sykqyxzz.paperopen.com E-mail: j-pr-s@fmmu.edu.cn
ConstructionandtheinfectionefficiencyofBimSlentivirusRNAinterferencevector
YAOJia,RAOGuozhou,LIXukui.
710004,DepartmentofOralandMaxillofacialSurgery,StomalogicalHospitalofMedicalCollege;Xi'anJiaotongUniversity,China
Objective: To construct BimS lentivirus RNA interference(RNAi) vector and to study its infection efficiency by using RNAi technique.MethodsThree interference targets were designed according to the BimS sequence. The single chain primer was annealed into double-stranded oligo sequences, and then connected with vector linearized with Age I and EcoR I enzyme. The recombinant plasmid was packaged, and the infection efficiency was observed by infecting ACC-2 cells.ResultsAfter amplification, a 337 bp band was appeared in the electrophoresis results of positive clones. Sequence of inserted fragments were identical with the result of DNA sequencing. Restructuring lentivirus was packed in 293T cells, the virus titer was 2×108TU/ml, MOI=20, and the transfection efficiency was 85%. The BmS mRNA relative expression of pFU-GV-BmS-1, pFU-GV-BMS-2 and control group was 0.743±0.025, 0.466±0.023 and 1.266±0.042 respectively(between each 2 groups,Plt;0.05).ConclusionBimS lentivirus virus RNA interference vectors can be constructed, and can efficiently infect ACC- 2 cells.
RNAinterference;BimSgene;Lentivirusvector
陕西省社发攻关资助项目(编号: 2013k12-03-21)
710004, 西安交通大学口腔医院口腔颌面外科
李旭奎 E-mail: lixukui@mail.xjtu.edu.cn
Q786
A
10.3969/j.issn.1001-3733.2017.01.008
