流式细胞仪检测技术在食源性致病菌检测中的应用
2017-11-27梅仕良张娜娜郑亦舟周昱曦
梅仕良, 姜 凯, 张娜娜, 郑亦舟, 王 杰, 周昱曦, 赵 渝*
(1.上海师范大学 生命与环境科学学院 植物种质资源开发协同创新中心,上海 200234;2.贝克曼库尔特商贸(中国)有限公司,上海 200122)
流式细胞仪检测技术在食源性致病菌检测中的应用
梅仕良1, 姜 凯1, 张娜娜1, 郑亦舟1, 王 杰1, 周昱曦2, 赵 渝1*
(1.上海师范大学 生命与环境科学学院 植物种质资源开发协同创新中心,上海 200234;2.贝克曼库尔特商贸(中国)有限公司,上海 200122)
流式细胞术是一种灵敏度高,耗时短,程序简便的定量细胞分析分选方法,广泛应用于微生物检测、环境监测、临床医学等领域,尤其在微生物检测中表现突出.流式细胞术正逐步应用于食源性致病菌的检测,研究并介绍了流式细胞术在几种食源性致病菌检测中的应用,该方法具有广阔的发展前景.
流式细胞术; 微生物; 食源性致病菌; 快速检测
食品安全问题主要源于食物细菌性中毒,其中大多为食源性致病菌,已成为全球公共安全问题,必须得到有效解决[1].检测食源性致病菌的传统方法包括:显色培养基培养法、平板计数法;现代快速检测方法包括:免疫层析试纸条技术、基于免疫学的ELISA技术、基因芯片技术、三磷酸腺苷(ATP)生物发光技术、聚合酶链式反应(PCR)技术等[2].虽然以上检测技术准确性高,但耗时长,不能满足现场快速检测的需求[3].
流式细胞术(FCM)是一种能检测并分析细胞或微生物颗粒理化特征的定量方法[4],可同时分析多个参数,既快速高效,又可大量收集并较为全面地分析数据,灵活性很强,主要应用于临床医学的细胞分析[5].流式细胞仪的工作原理是待测液颗粒依次通过检测区,被荧光染色标记的细胞在激光照射下激发光信号,光信号转换成电信号被计算机识别,最后由软件分析[6].目前,这一技术正向微生物检测,食品安全监测领域发展[7].
随着荧光染料、免疫磁珠等的发展,FCM在食源性致病菌,如金黄色葡萄球菌、大肠杆菌、沙门氏菌、单核增生李斯特菌等的特异性检测中已经取得了丰富的研究成果[8].本文作者综述了流式细胞术在食源性致病菌检测中的研究近况.
1 金黄色葡萄球菌检测
金黄色葡萄球菌是很典型的一种食源性致病菌[9],由于国家卫生部严格限制其在食品中的含量,需要快速有效、准确度高的方法[10].检测金黄色葡萄球菌的传统方法有:平板计数法、显色培养基培养法,耗时都较长,前者需要5~7 d;现代快速检测方法包括免疫磁珠富集法、ELISA技术、PCR技术、核酸探针技术等.周莉等[11]运用PCR法快速检测食品中的金黄色葡萄球菌,检测时间为24 h,检出限为10 CFU/g.Kim等[12]利用免疫磁珠富集法对牛奶中的金黄色葡萄球菌进行检测,检测灵敏度为2.8×102CFU/mL,检测限达到5.0 CFU/mL.董晓林等[13]利用流式细胞术,建立基于适配体识别的金黄色葡萄球菌的检测方法,对金黄色葡萄球菌和大肠杆菌(O157:H7)共同进行实验,利用羟基荧光素(FAM)荧光素标记的特异性适配体FAM-SA17对金黄色葡萄球菌进行特异性检测,检测时长为40 min,该方法检测限较高,与适配体亲和力有关.
2 沙门氏菌检测
沙门氏菌是食源性致病菌中极为普遍的一种,由其引起的食物中毒事件居世界首位[14].沙门氏菌的检测方法有多种,较为传统的国标法,需要前增菌、增菌、分离、生化试验和血清学鉴定,整个过程需4~7 d完成,耗时较长,步骤繁杂;现代快速检测方法有:PCR技术、免疫磁珠富集技术、流式细胞术等.韩四海等[14]利用荧光定量PCR方法对肉类和奶制品中沙门氏菌进行检测,检测灵敏度达100 CFU/mL.以上方法均有较明显的缺点,比如技术成本较高,因此难以广泛应用.王周平等[15]建立了一种利用适配体识别量子点标记结合流式细胞术检测鼠伤寒沙门氏菌的方法,其中需要制备用于量子点标记的适配体探针,识别元件为适配体,荧光标记物为量子点,检测限为103CFU/mL,检测时长少于40 min.该方法快速、准确、灵敏,为流式细胞术的应用开辟了一个新的方向.
3 大肠杆菌检测
大肠杆菌是人类肠道的正常寄居菌,也存在于多种食物和饮用水中[16].大肠杆菌的常见检测方法为多管发酵法和滤膜法,这两种方法能够检测大部分食品样品,但存在明显的缺点,如检测周期较长,操作过程繁杂,不能满足快速检测大肠杆菌的需求.流式细胞术在大肠杆菌检测中早有应用,王宁等[17]利用流式细胞术对经过前处理的牛乳中的大肠杆菌进行检测,利用经碘化丙啶(PI)染色的特异性荧光抗体,对大肠杆菌进行特异性捕获,检测结果准确可靠[18],检测用时60 min,检测限为103CFU/mL.Xue等[19]基于16S rRNA探针,利用流式细胞术检测大肠杆菌,在大量其他菌存在情况下检测到少许大肠杆菌细胞,所得结果准确可靠,检测时间相较传统方法短.检测限达到103CFU/mL.由此可见,流式细胞术可用于快速检测食品中的大肠杆菌.
4 单核增生李斯特菌
单增李斯特菌在生活中多处存在,是常见的食源性致病菌,也是唯一能引起人体疾病的李斯特菌[20-21].其检测方法有包括传统检测方法、免疫学方法、分子生物学方法等.传统检测方法过程繁杂,步骤多,耗时长,无法做到快速检测单增李斯特菌[22].闻一名等[23]利用免疫磁珠结合选择性培养基的方法检测牛奶样品中的单增李斯特菌,检测时间为30 h,检测限为0.7 CFU/mL,该法具有较高的检测灵敏度,但检测时间过长.Rodriquez-Lazaro等[24]用实时荧光PCR法检测肉中的单增李斯特菌,检测时间为27 h,检测限为0.08~0.16 CFU/g,此法前期富集时间过长,因此也不符合快速检测要求.黄生权等[25]利用流式细胞术对经过核酸染料染色的单增李斯特菌进行检测,此方法检测限低(1.2×104cell/mL),同时也缩短了增菌时间,省略了复杂的增菌过程.Kyoko等[26]将免疫磁与流式细胞术结合检测食品中的单增李斯特菌,检测限达102~108CFU/mL,完成检测的时间仅为1 min,很符合快速检测单增李斯特菌的要求[27],今后流式细胞术在单增李斯特菌检测中的应用将会更加广泛[28].表1为所叙述的几种食源性致病菌的流式细胞术检测参数.

表1 几种食源性致病菌的流式细胞术检测相关参数
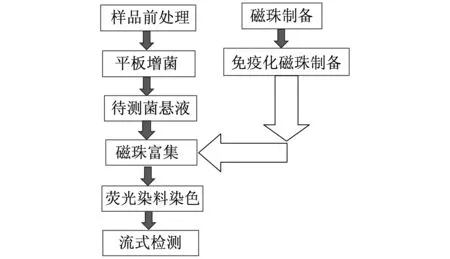
图1 流式检测技术流程简图
流式细胞仪技术检测食源性致病菌流程图如图1所示.
5 结论与展望
因食源性致病菌导致的食物中毒事件频繁发生,应在第一时间内快速检测食源性致病菌[29].传统以及其他现代快速检测方法在检测过程中表现出众多不足[30],如重复性不够好,分析某些化合物不够清晰,对试剂有较高选择性[31].流式细胞术表现出耗时短,低检测限,高灵敏度等优点[32].但是在流式细胞术发展过程中,也会产生一些不足[33],包括科研人员技术素质要求,仪器设备的要求与价格,检测样品的广度[34],以及现在还未应用到各基层领域的检测当中等问题[35].如今,流式细胞术在各大领域如医学临床,食品安全微生物,药物学等有众多发现与研究成果[37].在检测食源性致病菌领域尚且不够成熟[38],对于其他方向,此为较新领域[39],未来流式细胞术用于食源性致病菌的检测会更加快速,定量更加准确,范围越来越广,具有很大的前景与发展空间[40].
[1] 张峻峰,刘道亮,赵占民,等.流式细胞术在微生物快速检测领域的研究进展 [J].食品工程,2010(3):19-22.
Zhang J F,Liu D L,Zhao Z M,et al.Research development on Flow Cytometry in the rapid detection of microorganisms [J].Food Engineering,2010(3):19-22.
[2] 罗琳,卢任杰,胡宏灿.食品中大肠杆菌快速检测方法的研究综述 [J].科技信息,2012(11):98.
[3] 刘晓.多种食源性致病菌快速检测方法 [J].食品界,2016(8):73.
Liu X.Rapid detection method for multiple foodborne pathogens [J].Food Sector,2016(8):73.
[4] Arora D,Sharma N,Sharma V,et al.Rapid methods for the detection offood borne pathogens [M].New York:Nova Publishers,2016.
[5] 肖剑,陈娟丽,张彬彬,等.大肠杆菌O157快速检测板在肉与肉制品检测中的应用 [J].食品安全质量检测学报,2017,8(1):331-335.
[6] 杨莉婷,何丽,何海宁,等.流式细胞术对生乳中微生物检测的应用研究 [J].广西师范大学学报(自然科学版),2017,35(2):112-117.
Yang L T,He L,He H N,et al.Application of Flow Cytometry in testing bacteria in raw milk [J].Journal of Guangxi Normal University (Natural Science Edition),2017,35(2):112-117.
[7] 雷星雲,吴军.流式细胞术的原理及其临床应用 [J].检验医学与临床,2016(s1):307-311.
[8] Hibi K,Abe A,Ohashi E,et al.Combination of immunomagnetic separation with Flow Cytometry for detection ofListeriamonocytogenes[J].Analytica Chimica Acta,2007,573-574(1):158.
[9] 章钢刚,赖卫华.食源性致病菌免疫学检测方法研究进展 [J].食品安全质量检测学报,2015(9):3414-3419.
Zhang G G,Lai W H.Research progress of immunological detection methods of foodborne pathogen [J].Journal of Food Safety and Quality,2015(9):3414-3419.
[10] 魏昭,梁勃,吴蕊,等.荧光定量PCR检测食品中沙门氏菌研究 [J].食品安全导刊,2016(5Z):63-64.
[11] 周莉,王永,王法云,等.食品中金黄色葡萄球菌概况及新型检测技术研究进展 [J].中国酿造,2016,35(2):1-4.
Zhou L,Wang Y,Wang F Y,et al.Recent advance of general situation and novel detection technology ofStaphylococcusaureusin food [J].China Brewing,2016,35(2):1-4.
[12] Kim J H,Yoon J S,Lee D Y,et al.Detection and quantitation ofBacilluscereus,Staphylococcusaureus,SalmonellatyphimuriumandEscherichiacoliO157:H7 by droplet digital PCR [J].Korean Journal of Food Science & Technology,2016,48(5):454-460.
[13] 董晓琳.金黄色葡萄球菌的流式细胞术检测方法研究 [D].北京:中国人民解放军军事医学科学院,2016.
[14] 韩四海,张卫卫,李璇,等.基于量子点的食源性致病菌快速检测方法研究进展 [J].食品安全质量检测学报,2015(12):4767-4774.
Han S H,Zhang W W,Li X,et al.Advances of quantum dots based rapid detection methods of foodborne pathogens [J].Journal of Food Safety and Quality Testing,2015(12):4767-4774.
[15] 王周平,段诺,吴世嘉,等.一种利用适配体识别量子点标记结合流式细胞术同时检测两种致病菌的方法:103033463 A [P].2013-01-10.
[16] 姚勇.关于食品中大肠杆菌检测方法的研究 [J].食品安全导刊,2014(9):74-76.
[17] 王宁.流式细胞术检测牛乳中大肠杆菌数及细菌总数的研究 [D].哈尔滨:东北农业大学,2009.
[18] Bensch G,Rüger M,Wassermann M,et al.Flow Cytometric viability assessment of lactic acid bacteria starter cultures produced by fluidized bed drying [J].Applied Microbiology & Biotechnology,2014,98(11):4897-4909.
[19] Xue Y,Wilkes J G,Moskal T J,et al.Flow-cytometry-based method to detectEscherichiacoliandShigellaSpp.Using 16S rRNA-based probe [J].Current Protocols in Toxicology,2017,71(25):2-9.
[20] Dan A B,Moskal T J,Williams A J,et al.An integrated Flow Cytometry-based system for real-time,high sensitivity bacterial detection and identification [J].Plos One,2014,9(4):e94254.
[21] Baker C A,Si H P,Sun A K,et al.Formalin-fixed cells as an internal standard approach for the detection and quantitative assessment of Shiga toxin-producingEscherichiacoli,(STEC) [J].Food Control,2016,63:76-82.
[22] Bloemen M,Denis C,Peeters M,et al.Antibody-modified iron oxide nanoparticles for efficient magnetic isolation and flow cytometric determination of L.pneumophila [J].Microchimica Acta,2015,182(7-8):1439-1446.
[23] 闻一鸣,李志清,童吉宇,等.免疫磁珠富集技术联合选择性培养基快速检测单增李斯特菌 [J].生物工程学报,2013,29(5):672-680.
Wen Y M,Li Z Q,Tong J N,et al.Rapid detection ofListeriamonocytogenesby immunomagnetic separation combined with selective medium [J].Journal of Biotechnology,2013,29(5):672-680.
[24] Rodriguez-Lazaro D,Gonzalez-García P,Valero A,et al.Application of the SureTect detection Methods forListeriamonocytogenes,andListeriaspp.in Meat,Dairy,Fish,and Vegetable Products [J].Food Analytical Methods,2015,8(1):1-6.
[25] 黄生权,付萌,唐青涛,等.流式细胞术检测单增李斯特菌与酿酒酵母 [J].现代食品科技,2014(3):195-200.
Huang S Q,Fu M,Tang Q T,et al.Detection ofListeriamonocytogenesandSaccharomycescerevisiaeby Flow Cytometry [J].Modern Food Science and Technology,2014(3):195-200.
[26] KYoko,Foladori P,Ferrentino G,et al.Accurate flow cytometric monitoring ofEscherichiacolisubpopulations on solid food treated with high pressure carbon dioxide [J].Journal of Applied Microbiology,2014,117(2):440-450.
[27] Kim S S,Choi W,Kang D H.Application of low frequency pulsed ohmic heating for inactivation of foodborne pathogens and MS-2 phage in buffered peptone water and tomato juice [J].Food Microbiology,2017,63:22-27.
[28] Langemann T,Mayr U B,Meitz A,et al.Multi-parameter Flow Cytometry as a process analytical technology (PAT) approach for the assessment of bacterial ghost production [J].Applied Microbiology and Biotechnology,2015,100(1):1-10.
[29] Longin C,Petitgonnet C,Guilloux-Benatier M,et al.Application of Flow Cytometry to winemicroorganisms [J].Food Microbiology,2017,62:221-231.
[31] Meng X,Yang G,Li F,et al.Sensitive detection ofStaphylococcusaureuswith vancomycin-conjugated magnetic beads as enrichment carriers combined with Flow Cytometry [J].Acs Applied Materials and Interfaces,2017,9(25):21464-21472.
[32] Van Nevek S,Buysschaert B,De R K,et al.Flow Cytometry for immediate follow-up of drinking water networks after maintenance [J].Water Research,2017,111:66-73.
[33] Otto G,Lamote A,Deckers E,et al.A flow-cytometry-based method for detecting simultaneously five allergens in a complex foodmatrix [J].Journal of Food Science and Technology,2016,53(12):4179-4186.
[34] Ozawa S,Okabe S,Ishii S.Specific single-cell isolation ofEscherichiacoliO157 from environmental water samples by using Flow Cytometry and fluorescence-activated cell Sorting [J].Foodborne Pathogens & Disease,2016,13(8):456-461.
[35] Paparella A,Serio A,Chaves L C.Flow Cytometry applications in food safety studies [M/OL]// Schmid I.Flow Cytometry-recent perspectives.InTech,2012 [2017-06-13].http://www.intechopen.com/books/flow-cytometry-recent-perspectives.
[36] Saint-Ruf C,Crussard S,Franceschi C,et al.Antibiotic susceptibility testing of the Gram-Negative bacteria based on Flow Cytometry [J].Frontiers in Microbiology,2016(7):1-13
[37] Tamburini S,Foladori P,Ferrentino G,et al.Accurate flow cytometric monitoring ofEscherichiacolisubpopulations on solid food treated with high pressure carbon dioxide [J].Journal of Applied Microbiology,2014,117(2):440-450.
[38] Anvarian A H,Smith M P,Overton T W.The effects of orange juice clarification on the physiology ofEscherichiacoli;growth-based and flow cytometric analysis [J].International Journal of Food Microbiology,2015,219:38-43.
[39] Xue Y,Wilkes J G,Moskal T J,et al.Development of a Flow Cytometry-based method for rapid detection ofEscherichiacoliand Shigella Spp.Using an Oligonucleotide Probe [J].Plos One,2016,11(2):e0150038.
[40] Zhao Y,Li Y,Jiang K,et al.Rapid detection ofListeriamonocytogenes,in food by biofunctionalized magnetic nanoparticle based on nuclear magnetic resonance [J].Food Control,2017,71:110-116.
(责任编辑:顾浩然,冯珍珍)
ApplicationofFlowCytometrytechniqueindetectionoffoodbornepathogens
Mei Shiliang1, Jiang Kai1, Zhang Nana1, Zheng Yizhou1, Wang Jie1, Zhou Yuxi2, Zhao Yu1*
(1.Development Center of Plant Germplasm Resources,College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China;2.Beckman Coulter Trading (China) Limited,Shanghai 200122,China)
Flow Cytometry technique is a quantitative cell analysis method with characteristics such as high sensitivity,time-saving,simple procedure,which is widely applied in microbial detection,environmental monitoring,clinical medicine and other fields,especially in microbial detection.Flow Cytometry is being gradually applied in the detection of foodborne pathogens.This study introduced the application situation of Flow Cytometry technique on several foodborne pathogenic bacteria.It shows the technology has many advantages and a vast development future.
Flow Cytometry; microorganism; foodborne pathogens; quick analysis
Q 93-338
A
1000-5137(2017)05-0757-05
2017-08-31
上海市2017年度“科技创新行动计划”(1714220300);上海植物种质资源工程技术研究中心项目(17DZ2252700)
梅仕良(1994-),男,硕士研究生,主要从事食品微生物及应用方面的研究.E-mail:18297309020@163.com
导师简介: 赵 渝(1973-),男,博士,副教授,主要从事食品质量安全控制方面的研究.E-mail:zhaoyu@shnu.edu.cn
*
