真藓(Bryum argenteum)ISSR-PCR反应体系优化及引物筛选
2017-11-27马晓英
马晓英, 韦 伟, 臧 程, 于 晶
(上海师范大学 生命与环境科学学院 植物种质资源开发协同创新中心,上海 200234)
真藓(Bryumargenteum)ISSR-PCR反应体系优化及引物筛选
马晓英, 韦 伟, 臧 程, 于 晶*
(上海师范大学 生命与环境科学学院 植物种质资源开发协同创新中心,上海 200234)
为了确定真藓最佳ISSR-PCR反应体系,采用PCR正交实验设计方法,对影响ISSR-PCR试验的模板DNA、引物、dNTPs、Mg2+、和TaqDNA聚合酶5个因素在4个水平上进行优化,并对100条引物逐一进行温度梯度PCR,筛选合适的引物并确定每个引物的最佳退火温度.结果显示优化的20 μL ISSR-PCR反应体系中包括20 ng /20 μL DNA模板、0.45 μmol/L引物、2.65 mmol/L Mg2+、0.4 U/20 μL Taq DNA聚合酶、0.45 mmol/LdNTPs.利用该体系最终筛选出50条扩增条带清晰,重复性好,多态性高的引物并确定其退火温度.这一体系的建立、引物的筛选及退火温度的确立为进一步利用ISSR分子标记技术对苔藓遗传多样性的研究提供理论基础.
真藓; ISSR; 正交设计; 引物筛选; 退火温度
0 引 言
真藓(BryumargenteumHedw.)为真藓科真藓属植物,属世界广布种,中国各地均有分布,在薄土岩面,石缝,屋顶,以及阴沟边缘等多种生境下均可生长[1].具有清热解毒,止血,治疗鼻窦炎、细菌性痢疾、灼伤、心绞痛等功效[2-4].
目前,国内外用于苔藓植物遗传关系的分子标记技术,主要有inter-simple sequence repeat(ISSR)和random amplified polymorphic DNA(RAPD)两种.ISSR是一种简单序列重复区间扩增多态性DNA分子标记技术,是1994年由加拿大蒙特利尔大学的Zietkiewicz等[5-6]基于微卫星技术上创建起来的.该技术具有操作简单,成本低,有较好的重复性和稳定性的优点[7-10],但其结果易受反应体系中各个因素的影响[11-13],因此要建立适合研究材料,条带清晰,重复性好的反应体系.不同种植物适用不同的ISSR引物,且相同引物应用于不同种植物退火温度也会有差异,ISSR引物退火温度对扩增结果影响较大,且与其退火温度(Tm)值没有明显的规律性[14],根据目前国内已发表的相关报道可知,苔藓植物相对于其他很多植物筛得的ISSR引物数目较少,且退火温度多集中于48~55 ℃之间[15-20].
本研究采用正交试验法对反应体系中的5种因素进行优化以得到最优的ISSR-PCR反应体系,并利用最佳PCR扩增体系对哥伦比亚大学公布的100条引物进行筛选,对已筛得引物的退火温度进行总结,旨在为进一步利用ISSR分子标记技术对苔藓遗传多样性研究提供理论基础.
1 材料和方法
1.1实验材料
所用的10×LA PCR Buffer II(Mg2+free)、MgCl2、dNTP Mixture、LA Taq聚合酶购自宝生物工程(大连)有限公司;所用的哥伦比亚大学公布的100条引物由上海生工生物工程技术服务有限公司合成.
1.2实验方法
1.2.1 DNA提取
采用改良的十六烷基三甲基溴化铵(CTAB)法提取真藓基因组DNA.采用岛津Uv1800微量分光光度计测定所提DNA的浓度和纯度,OD260/OD280比值皆在1.9左右,说明DNA样品纯度较高,适合进一步PCR扩增反应.样品DNA存于-20 ℃作为后续的PCR扩增反应模板.
1.2.2 ISSR-PCR反应体系优化
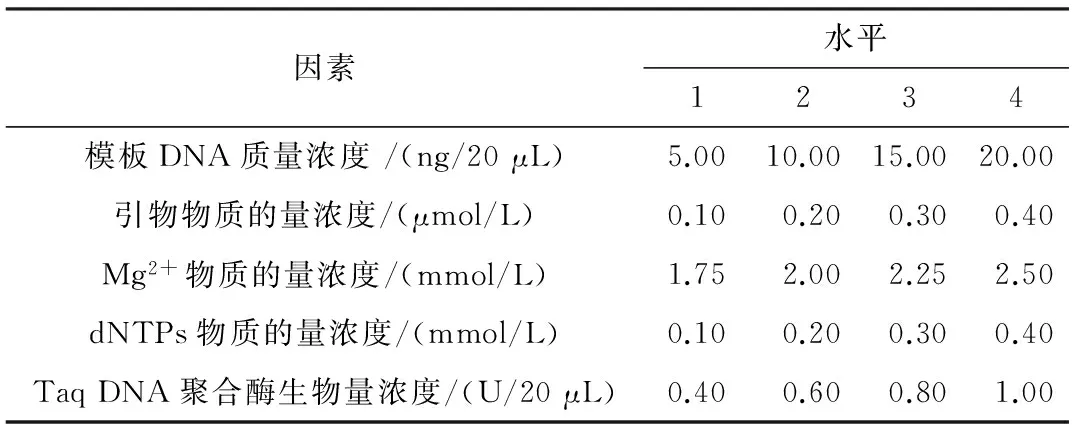
表1 真藓ISSR-PCR 反应的因素和水平
用L16(45)正交试验设计方法,选择引物UBC825,在20 μL的反应体系中,参照汪琛颖等[20]的研究报道,对影响ISSR-PCR试验的模板DNA质量浓度,引物、dNTPs、Mg2+的物质的量浓度,和Taq DNA聚合酶生物量浓度5个因素在4个水平上进行优化(表1),共16个处理(表2)每个处理包含2 μL10×LA PCR Buffer II(Mg2+free),用ddH2O补足.扩增反应程序94 ℃预变性4 min;94 ℃变性1 min,退火2 min,72 ℃延伸1 min,40个循环;最后72 ℃延伸7 min;4 ℃保存.PCR扩增产物用含有溴化乙锭(EB)核酸染料的2%琼脂糖凝胶电泳分离,电压100 V,60 min.并用全自动数码凝胶成像分析系统(Tanon 2500)进行观察和拍照.
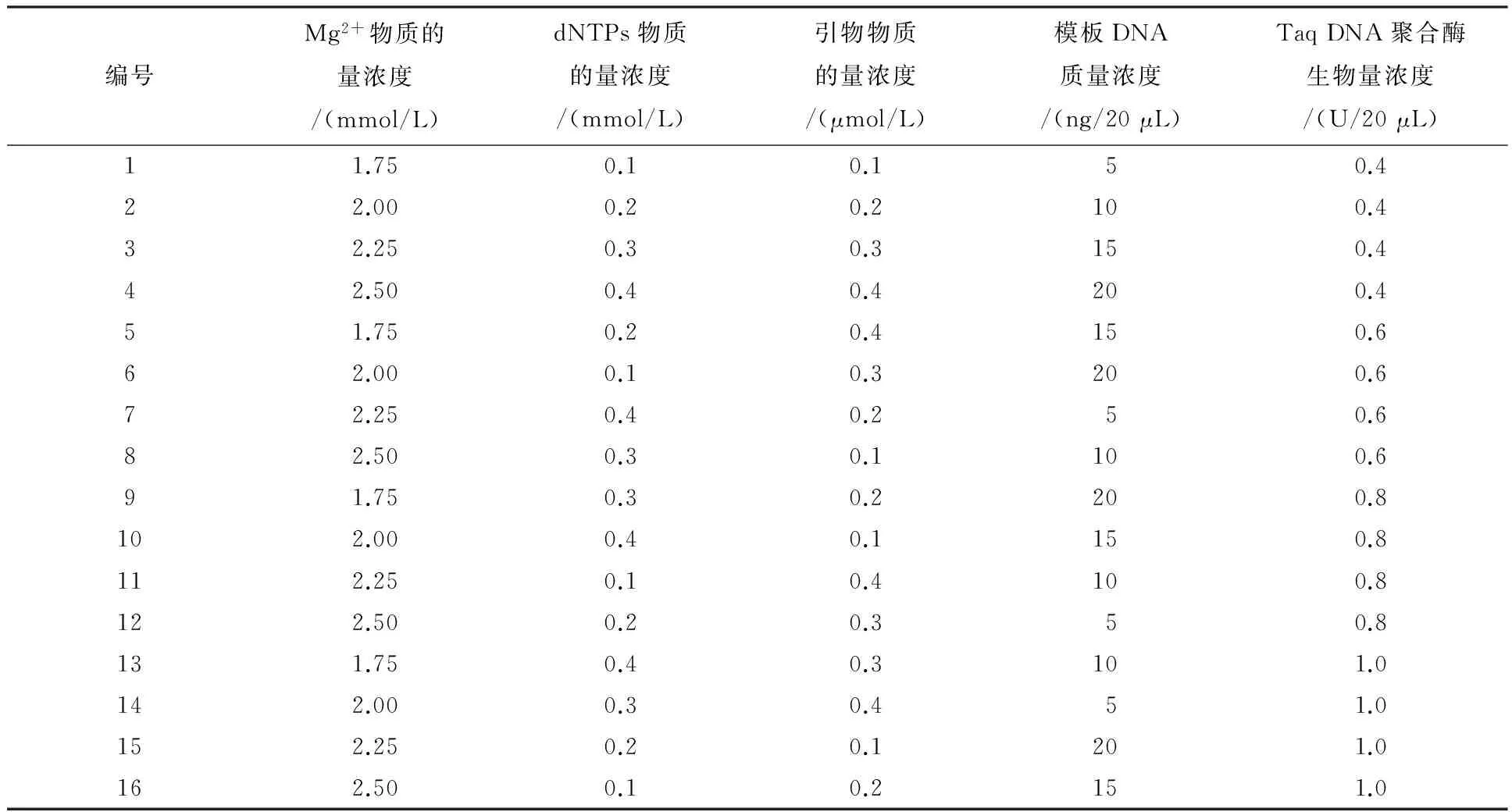
表2 L16(45)正交试验设计
1.2.3 细调性正交试验
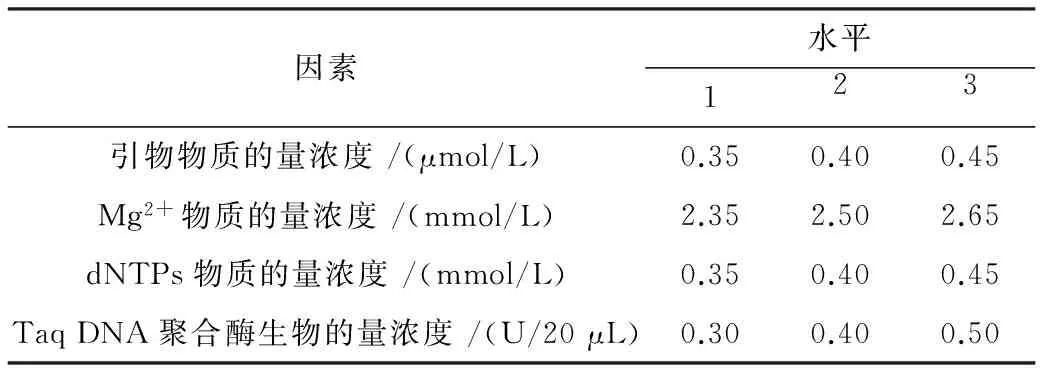
表3 细调性真藓ISSR-PCR反应的因素和水平
为了最终获得清晰,可重复性好,亮度适宜,条带多态性丰富的扩增条带,在L16(45)正交试验结果的基础上,缩小各个因素的浓度梯度进行细调性正交试验.对影响ISSR-PCR试验的引物、Mg2+、dNTPs和Taq DNA聚合酶4个因素在3个水平上进行筛选(表3),共9个处理(表4).
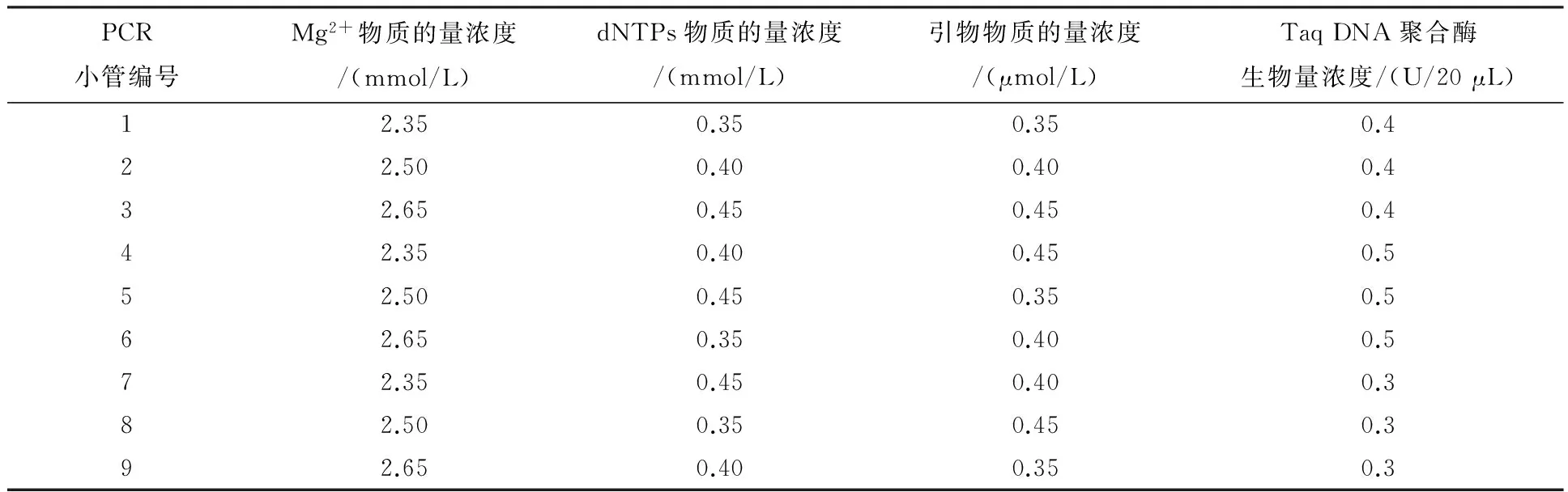
表4 L9(34)细调性正交试验设计
1.2.4 引物及其最佳退火温度筛选
试验所用的哥伦比亚大学公布的100条引物,扩增条带稳定性且多态性各有不同,所以为选取背景清晰,条带稳定性好且多态性丰富的引物,对100条引物进行筛选.退火温度对扩增结果有十分关键的影响[21],在最佳反应体系基础上,利用PCR仪自动生成10个温度梯度,对所有引物逐一进行温度梯度PCR,以确定每个引物的最佳退火温度.
2 结果与分析
2.1L16(45)ISSR-PCR反应体系的正交试验结果分析
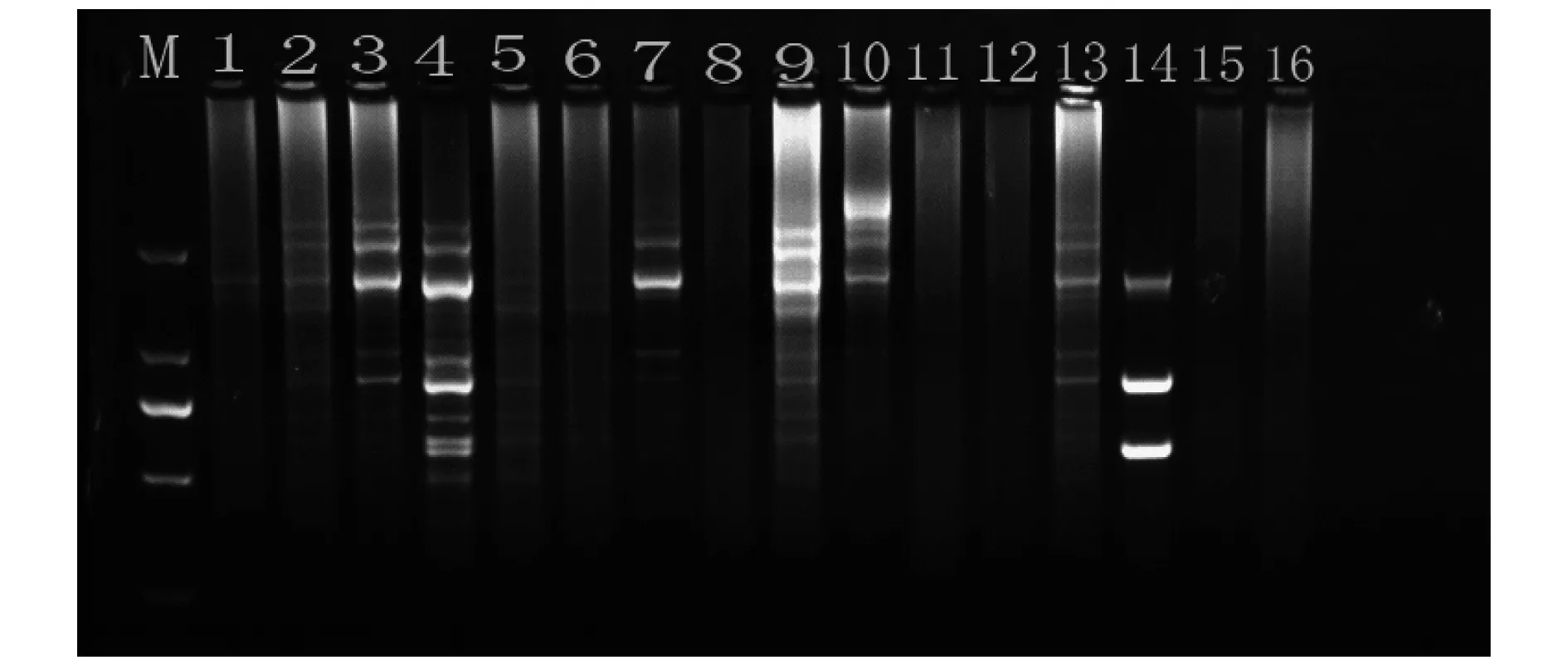
图1 L16(45)正交试验电泳结果
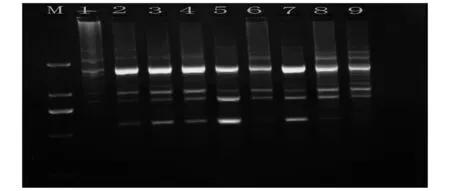
图2 L9(34)细调性正交试验电泳结果
图1为L16(45)正交试验电泳结果.由图1可知,16个处理的扩增产物凝胶电泳结果具有一定的差异性.其中6、8、11、12、15、16无扩增条带,1、2、5有微弱条带,9、10、13背景较亮条带模糊,7、14条带清晰但条带数较少,3、4条带清晰丰富且4较3扩增结果更好.说明最优组合偏差不大,为得到最适扩增体系,以此为基点,缩小各因素的浓度梯度进行细调正交试验.
2.2L9(34)细调性正交试验电泳结果
图2为L9(34)细调性正交试验电泳结果.由图2可知,由于在L16(45)正交试验的基础上进行细调,所以各条带之间差异不大,除了1号处理之外均有明显条带,其中6号处理条带数较其他处理少,8、9号处理虽然条带数较多但条带模糊,亮度较弱,其余2、3、4、5、7扩增效果差异不大,综合条带数、亮度、清晰度、扩增特异性等方面,确定组合3为最优反应体系.即20 μL最优反应体系中,五因素最佳水平为:20 ng/20 μLDNA 模板,0.45 μmol/L引物,2.65 mmol/L Mg2+,0.4 U/20 μL Taq DNA 聚合酶,0.45 mmol/L dNTPs.
2.3引物的筛选和退火温度的确立
利用梯度PCR仪自动生成10个温度梯度,根据不同退火温度下各引物的扩增效果确定退火温度,从而对100条ISSR引物进行筛选和各引物最佳退火温度的确立.图3为引物840的退火温度梯度优化结果.图4为引物888、890、834退火温度梯度优化结果.由图3、4可知,4、16、23、32泳道的PCR扩增条带数量多且清晰.因此引物840、888、890、834的最佳退火温度分别为49.1、53.9、51.6、51.0 ℃.已筛得ISSR引物及其退火温度见表5.
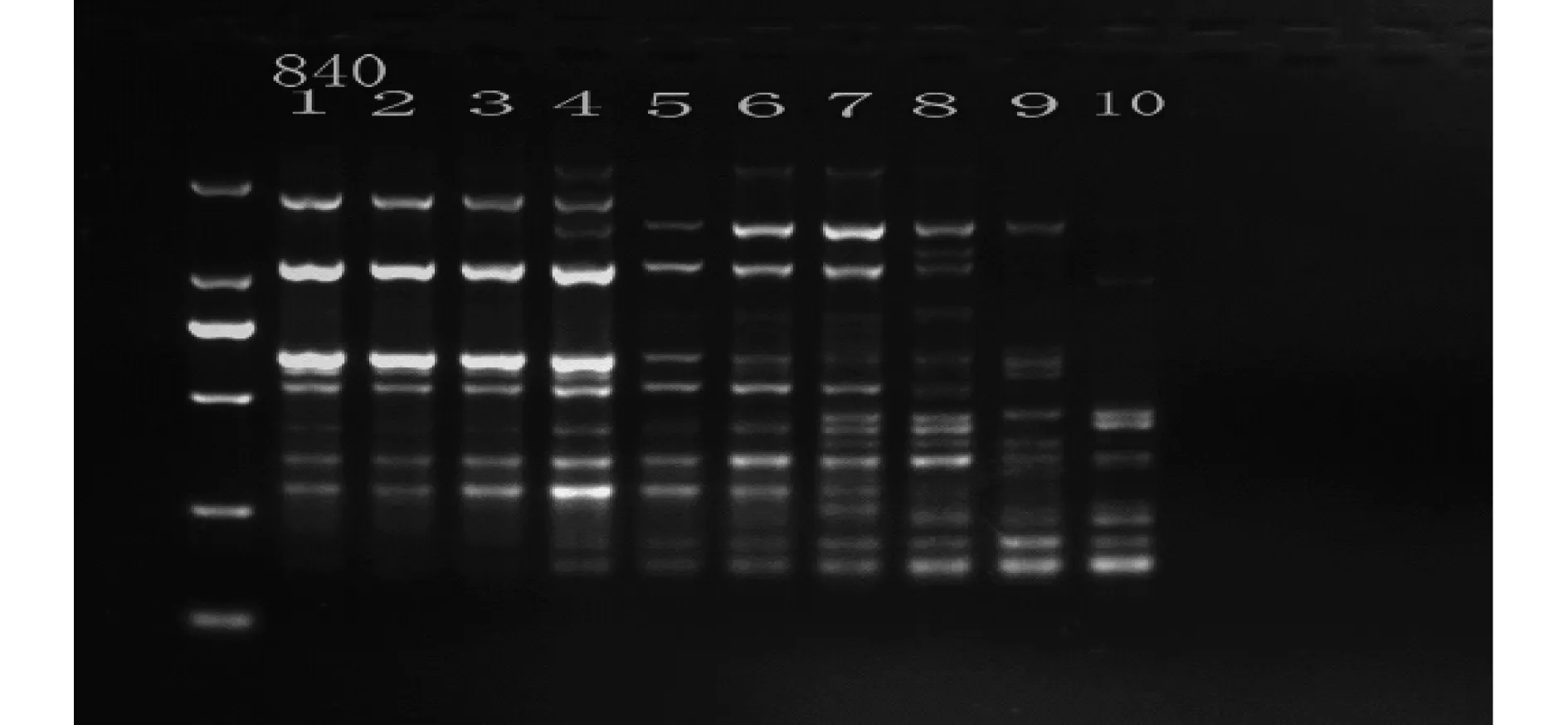
图3 引物840退火温度梯度优化

图4 引物888、890、834退火温度梯度优化.泳道11~20对应引物888;泳道21~30对应引物890;泳道31~40对应引物834
由表5可知,不同引物的最适退火温度差异较大,为验证所筛得引物可以区分不同地区真藓的差异性以及引物的有效性,选择来自云南省大理州剑川县(N26°32′29.784″,E99°53′12.905″)、云南省丽江市玉龙县白沙镇文海村(N27°00′48.24″,E100°09′23.92″)和浙江省杭州市龙岗镇仙人塘村(N30°17′32″,E119°2′47″)、舟山市岱山蓬莱公园(N30°14′40.465″,E122°12′17.238″)4个地点的8份真藓标本,提取DNA,对已筛得的引物进行PCR扩增(图5),不同地点的真藓DNA扩增结果有明显差异,且条带清晰明亮.说明所筛得的引物和优化的体系可用于不同地区真藓的遗传多样性的研究.
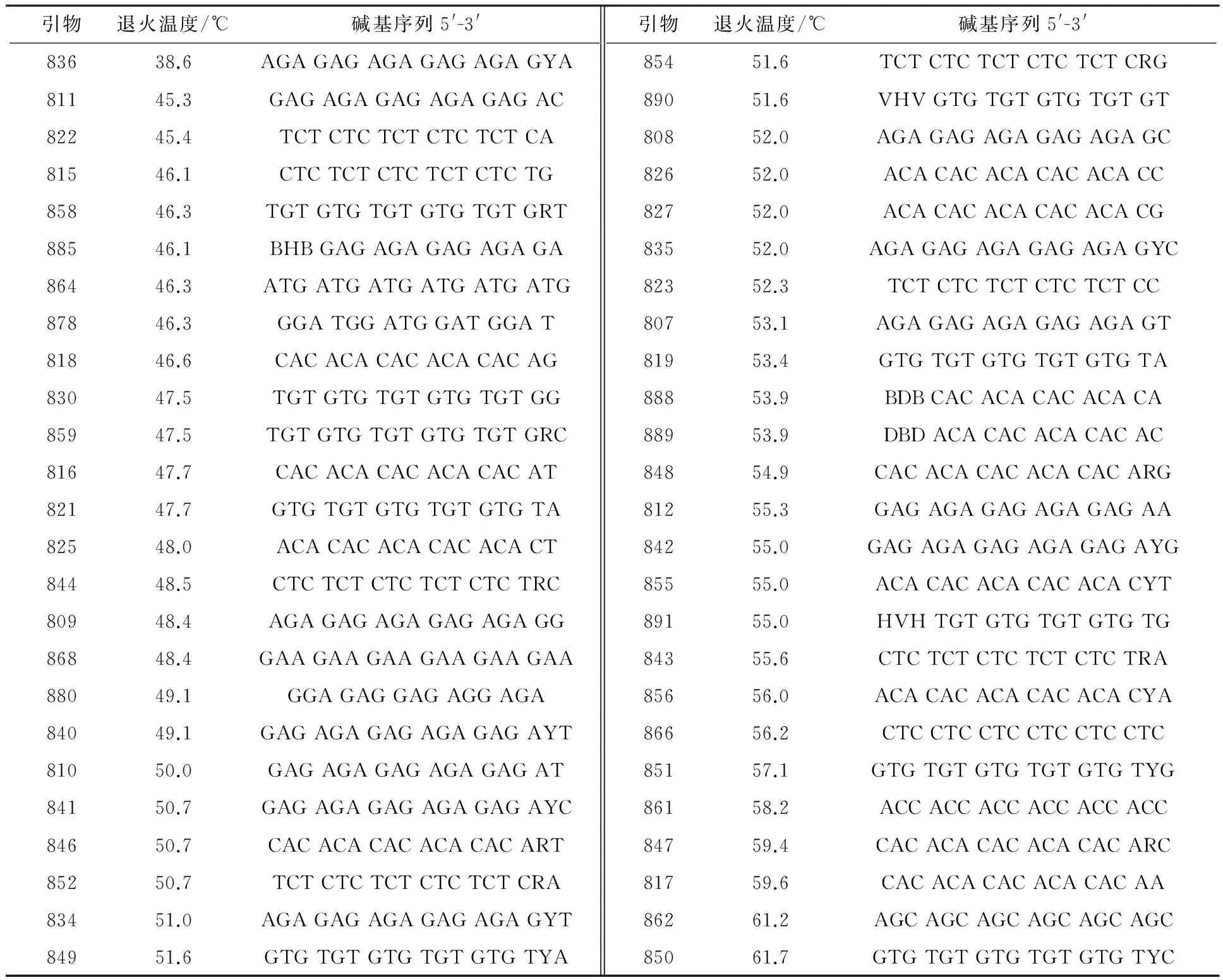
表5 筛得的有效ISSR引物及其退火温度
3 结论与讨论
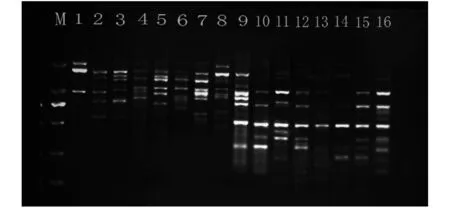
图5 引物825、835对来自不同地点的8份真藓标本的扩增结果.泳道1~8对应引物825模板为来自4个不同地区的真藓DNA;泳道9~16对应引物835模板为来自4个不同地区的真藓DNA
ISSR-PCR扩增体系中的模板DNA、引物、dNTPs、Mg2+、和Taq DNA聚合酶的浓度均会对扩增结果产生影响,引物的浓度与条带清晰度和背景亮度有关,引物浓度过高会导致背景明亮条带模糊,引物浓度过低则会导致扩增不充分[20].Mg2+的浓度会影响聚合酶的活性,从而影响扩增效果[21],dNTPs浓度过高会影响聚合酶活性,过低会使扩增量降低,Taq DNA聚合酶与扩增的条带数目有关[22],模板DNA对扩增结果影响较小,一般仅需微量的模板DNA,模板DNA浓度过大会使条带变得弥散[20].所以通过正交实验法检测各个因素的同时找到最优反应体系,正交试验结果表明,在20 μL ISSR-PCR反应体系中包括20 ng/20 μL DNA模板、0.45 μmol/L引物、2.65 mmol/L Mg2+、0.4 U /20 μLTaq DNA聚合酶、0.45 mmol/L dNTPs.
对于不同植物,适用的ISSR引物不同,同一ISSR引物应用于不同植物,其退火温度不同,退火温度对扩增效果起着至关重要的作用,退火温度会影响扩增条带的清晰度[22-23].所以本实验对引物设置温度梯度进行最适退火温度的筛选,从100条ISSR引物中筛选出50条条带清晰,多态性丰富,稳定性好的ISSR引物.说明真藓具有丰富的遗传背景,可为今后真藓科植物遗传多样性及分类学研究提供科学依据.
[1] 黎兴江.中国苔藓志(第四卷) [M].北京:科学出版社,2006:72.
Li X J.Flora bryophytorum sinicorum (Vol.4) [M].Beijing:Science Press,2006:72.
[2] 衣艳君.中国药用苔藓植物资源 [J].中草药,2000,31(8):624-628.
Yi Y J.Resource of medicinal bryophytes in China [J].Chinese Traditional and Herbal Drugs,2000,31(8):624-628.
[3] 袁志良,叶永忠,李孝伟.河南省药用苔藓植物的初步研究 [J].河南科学,2003,21(2):176-178.
Yuan Z L,Ye Y Z,Li X W.The study of medicinal bryophytes in Henan Province [J].Henan Science,2003,21(2):176-178.
[4] 吴玉环,杨海英,罗昊,等.东北地区药用苔藓植物资源及其开发利用前景 [J].生态学杂志,2004,23(5):218-223.
Wu Y H,Yang H Y,Luo H,et al.Resources of medicinal bryophytes in north-eastern China and their exploitation [J].Chinese Journal of Ecology,2004,23(5):218-223.
[5] Vos P,Hogers R,Bleeker M,et al.AFLP:A new technique for DNA finger-printing [J].Nucleic Acids Research,1995,23(21):4407-4417.
[6] Zietkiewicz E,Rafalski A,Labuda D.Genome finger-printing by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification [J].Genomics,1994,20(2):176-183.
[7] Lian C L,Zhou Z H,Hogetsu T.A simple method for developing microsatellite markers using amplified fragments of inter-simple sequence repeat(ISSR) [J].Journal of Plant Research,2001,114(1115):381-385.
[8] Zhou Y Q,Du P L,FU P,et al.Optimization of ISSR-PCR system for Nerviliae fordii (Hance) Schltr.and its primer screening [J].Medicinal Plant,2015(6):33-39.
[9] 王明明,宋振巧,王建华.ISSR标记技术及其在药用植物遗传育种中的应用 [J].中草药,2007,38(1):134-137.
Wang M M,Song Z Q,Wang J H.Inter-simple sequence repeat and its application in medicinal plant genetic breeding [J].Chinese Traditional and Herbal Drugs,2007,38(1):134-137.
[10] 欧立军,颜旺,廖亚西,等.天门冬ISSR分子标记技术的建立与体系优化 [J].中草药,2011,42( 2):353-357.
Ou L J,Yan W,Liao Y X,et al.Establishment and optimization of ISSR-PCR reaction system in asparaguscochinchinensis[J].Chinese Traditional and Herbal Drugs,2011,42(2):353-357.
[11] 代培红,周贵玲,苏秀娟,等.大赖草ISSR-PCR反应体系的优化及引物筛选 [J].分子植物育种,2016,14(10):2732-2738.
Dai P H,Zhou G L,Su X J,et al.Optimization of ISSR-PCR system and primers screening of Leymus racemosus [J].Molecular Plant Breeding,2016,14(10):2732-2738.
[12] 李硕,李敏,卢道会,等.当归ISSR-PCR反应体系的建立优化及引物筛选 [J].李时珍国医国药.2015,26(2):373-376.
Li S,Li M,Lu D H,et al.Optimization of ISSR-PCR system and primers screening ofangelicasinensis[J].Lishizhen Medicine and Materia Medica Research,2015,26(2):373-376.
[13] 狄魁颖,白志军,杨书祥,等.杠柳ISSR引物的筛选及PCR反应体系的优化 [J].河北林果研究.2016,31(2):140-145.
Di K Y,Bai Z J,Yang S X,et al.Optimization of ISSR primer and PCR reaction system forPeriplocasepium[J].Hebei Journal of Forestry and Orchard Research,2016,31(2):140-145.
[14] 郭秀霞,李灵芝,马太光,等.西葫芦ISSR-PCR反应体系优化及引物筛选 [J].山西农业科学,2017,45(3):325-327,331.
Guo X X,Li L Z,Ma T G,et al.Optimization of ISSR-PCR reaction system and selection of primers in Cucurbita pepo [J].Journal of Shaanxi Agricultural Sciences,2017,45(3):325-327,331.
[15] 王莹莹.浙江千岛湖生境片断化对苔藓植物物种及遗传多样性的影响 [D].上海:华东师范大学,2011.
Wang Y Y.Effects of habitat fragmentation on bryophytes richness and genetic diversity in Thousand-Island Lake region,Zhejiang [D].Shanghai:East China Normal University,2011.
[16] 石蕾.R语言在藓类形态与遗传变异研究中的应用 [D].上海:上海师范大学,2015.
Shi L.Application of R in studies of morphological and genetic variation of plant population:A case ofHypnumplumaeformeWilson [D].Shanghai:Shanghai Normal University,2015.
[17] Hassel K,Gunnarsson U.The use of inter simple sequence repeats (ISSR) in bryophyte population studies [J].Lindbergia,2003,28(3):152-157.
[18] 魏青永,郭水良,曹同,等.基于ISSR数据探讨卷叶凤尾藓(FissidensdubiusP.Beauv.)遗传多样 [J].植物科学学报,2016,34(2):238-245.
Wei Q Y,Guo S L,Cao T,et al.Diversity and geographical distribution ofFissidensin eastern subtropical region,China [J].Plant Science Journal,2016,34(2):238-245.
[19] 刘小慧.三种蓑藓属植物的形态变异与遗传结构研究 [D].上海:上海师范大学,2016.
Liu X H.Research on morphological variations and genetic structure of threemacromitriumspecies [D].Shanghai:Shanghai Normal University,2016.
[20] 汪琛颖,赵建成.真藓科植物ISSR-PCR反应体系的优化及ISSR指纹图谱的初步构建 [J].安徽农业科学,2011,39(27):16490-16493.
Wang C Y,Zhao J C.Optimization of ISSR-PCR reaction system and preliminary construction of ISSR fingerprinting of some species in Bryaceae [J].Journal of Anhui Agricultural Sciences,2011,39(27):16490-16493.
[21] 刘德好,陆永良,娄玉霞.正交试验优化稗属植物ISSR-PCR反应体系 [J].上海农业学报,2016,32(4):17-21.
Liu D H,Lu Y L,Lou Y X.Optimization of ISSR-PCR reaction system ofEchinochloaby orthogonal design [J].Acta Agriculturae Shanghai,2016,32(4):17-21.
[22] 林萍,张含国,谢运海.正交设计优化落叶松ISSR-PCR反应体系 [J].生物技术,2005,15(5):34-37.
Lin P,Zhang H G,Xie Y H.Study on optimization for ISSR reaction system of larix using orthogonal design [J].Biotechnology,2005,15(5):34-37.
[23] 刘威生,冯晨静,杨建民,等.杏ISSR反应体系的优化和指纹图谱的构建 [J].果树学报,2005,22(6):30-33.
Liu W S,Feng C J,Yang J M,et al.Optimization of ISSR reaction system and construction of cultivar finger-print inApricot[J].Journal of Fruit Science,2005,22(6):30-33.
(责任编辑:顾浩然,包震宇)
OptimizationofISSR-PCRreactionsystemandselectionofprimersinBryumargenteum
Ma Xiaoying, Wei Wei, Zang Cheng, Yu Jing*
(Development Center of Plant Germplasm Resources,College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China)
In order to determine optimum ISSR-PCR reaction system for mossBryumargenteum,the concentrations of template DNA primers,dNTPs,Mg2+and Taq DNA polymerase were optimized in four levels by PCR orthogonal experimental method.The appropriate primers were screened from 100 primers by temperature gradient PCR,and the optimal anneal temperature of the screened primers were determined.The results showed that the optimized 20 μL ISSR-PCR reaction system was as follows:template DNA 20 ng/20 μL,primers 0.45 μmol/L,Mg2+2.65 mmol/L,Taq DNA polymerase 0.4 U/20 μL,dNTPs 0.45 mmol/L.Using this system,50 primers with clear bands,repeatability well and polymorphism highly were selected from 100 primers.The establishment of this system,the screened primers and the annealing temperature could provide a theoretical basis for further research on the genetic diversity of bryophytes using ISSR molecular markers.
Bryumargenteum; ISSR; orthogonal design; primer screening; annealing temperature
Q 949
A
1000-5137(2017)05-0668-07
2017-08-27
国家自然科学基金(31570208);上海植物种质资源工程技术研究中心项目(17DZ2252700);上海师范大学校前瞻性预研项目(DYL201503)
马晓英(1992-),女,硕士研究生,主要从事苔藓植物分类学方面的研究.E-mail:1977805338@qq.com
导师简介: 于 晶(1972-),女,副教授,主要从事苔藓植物生态学、分子遗传学等方面的研究.E-mail:yujing@shnu.edu.cn
*
