钼对白消安致小鼠不孕不育症模型繁殖障碍的影响
2017-11-14毛贻玺刘凤军张玉玲付晓森董文亚
毛贻玺,刘凤军,张玉玲,付晓森,董文亚
(河南科技大学 动物科技学院,河南 洛阳 471003)
钼对白消安致小鼠不孕不育症模型繁殖障碍的影响
毛贻玺,刘凤军,张玉玲,付晓森,董文亚
(河南科技大学 动物科技学院,河南 洛阳 471003)
为了研究钼对白消安致小鼠不孕不育症模型繁殖障碍的影响,通过单次腹腔注射30 mg/kg白消安构建昆明白小鼠不孕不育症模型。将不孕不育症的雄鼠和雌鼠随机各分为4组,雄鼠饮用水中钼质量浓度为0 mg/L、12.5 mg/L、25.0 mg/L和50.0 mg/L,雌鼠饮用水中钼质量浓度为0 mg/L、2.5 mg/L、5.0 mg/L和10.0 mg/L。饮钼后第1~4周剖取雄鼠睾丸、附睾及雌鼠卵巢,计算附睾及卵巢系数,同时对睾丸及卵巢切片用苏木精-伊红(HE)染色法染色。研究结果表明:雄鼠12.5 mg/L钼组的睾丸形态结构恢复速度较快,附睾系数显著提高,各级精原细胞的层数增多,排列紧密有序;雌鼠2.5 mg/L钼组的卵巢形态结构恢复较好,卵巢内率先出现卵母细胞。钼在适宜剂量12.5 mg/L(雄鼠)或2.5 mg/L(雌鼠)时,对不孕不育小鼠睾丸或卵巢功能有明显恢复作用。
钼;繁殖障碍;白消安;不孕不育;睾丸;卵巢
0 引言
随着社会的发展,不孕不育症的发病率越来越高[1],全世界约有15%的夫妇患有不孕不育症[2]。这可能是由于环境、食物或其他消费品中存在的一些物质,干扰了与机体正常生殖机能有关的激素合成与代谢[3]。导致不孕不育的原因包括生精障碍、排卵障碍、子宫畸形、输卵管阻塞、腹膜因素和宫颈因素等[4]。迄今为止,许多技术已被应用于治疗不孕不育症,如辅助生殖技术[5]、体外受精技术、胚胎移植技术[6]和精原干细胞移植技术[7-8]等。尽管治疗不孕不育症的研究取得了很大的进展,但总体治愈率(<41%)仍然较低。因此,仍需进一步探索高效的治疗方法。
钼(Mo)是机体必需的微量元素之一,对人类及动物保持正常代谢有重要作用[9-10]。钼可以通过催化羟基化、氧原子转移和其他氧化还原反应,促进机体内物质的新陈代谢和某些代谢产物的排出[11-12],能对机体的多种组织或器官产生影响。在本课题组前期的研究中发现:钼对小鼠雌性及雄性生殖器官(卵巢和睾丸)具有正反两方面的作用[13-14]。文献[13]报道:小鼠饮用钼质量浓度高于20 mg/L后,卵巢充血,并伴有MII期卵母细胞形态异常及卵巢质量减轻;然而,饮用钼质量浓度为5 mg/L时,能够显著提高排卵数量和MII期卵母细胞质量。文献[14]的研究表明:小鼠饮用钼质量浓度为25 mg/L时,能够显著提高雄性小鼠的多个生殖参数。上述研究表明:适当剂量的钼可以改善哺乳动物雌性及雄性的生殖功能。据此,可以推测:钼有可能有治疗不孕不育症的功效,但目前尚未见到相关研究。
本文用白消安[15-16]制作了不孕不育症的小鼠试验动物模型,然后,对模型小鼠实施饮钼处理,通过观察雄性和雌性生殖器官组织形态结构及其参数的变化,探索了钼对小鼠不孕不育症模型繁殖障碍的影响。
1 材料和方法
1.1试验动物
试验动物为5~6周龄、体质量25~30 g的雌性和雄性昆明白小鼠,购自山东鲁抗医药股份有限公司实验动物室(生产许可证号SCXK鲁20130001、SPF级昆明种小鼠)。小鼠自由采食饮水,饲养环境温度(25±2) ℃,湿度40%~70%。每天光照时间10~12 h。
1.2主要试剂
白消安(C6H14O6S2)、二甲基亚砜(DMSO,购自郑州鼎国生物公司)、钼酸钠(Na2MoO4·2H2O,购自天津化学试剂四厂)、透明质酸酶、孕马血清促性腺激素(PMSG 1 000 UI/支,购自宁波市三生药业有限公司)、人绒毛膜促性腺激素(HCG 1 000 UI/支,购自宁波市三生药业有限公司),其他试剂均购自Sigma公司。
1.3试验方法
通过单次腹腔注射30 mg/kg的白消安构建昆明白小鼠不孕不育症模型,注射白消安后的第30 天,将雄鼠和雌鼠随机各分为4组,每组140只。雄鼠饮水中分别添加0 mg/L、12.5 mg/L、25.0 mg/L和50.0 mg/L的钼,雌鼠饮水中分别添加0 mg/L、2.5 mg/L、5.0 mg/L和10.0 mg/L的钼,开始持续饮钼试验。在饮钼开始后的第1周、第2周、第3周和第4周,剖取雄鼠睾丸、附睾及雌鼠卵巢,计算附睾及卵巢系数,同时对睾丸及卵巢切片用苏木精-伊红(hematoxylinand eosin,HE)染色法染色。与对照组相比,试验组相关生殖参数的恢复程度为生殖功能恢复的判定依据。
1.4数据分析
试验采用SPSS 17.0 统计软件进行单因素方差分析(ANOVA),用Duncan法进行多重比较,P<0.01表明差异极显著,P<0.05表明差异显著,P>0.05表明差异不显著,数据以均数±标准差的形式表示。
2 结果
2.1白消安对雄性小鼠生殖参数的影响
白消安对雄性小鼠生殖参数的影响见表1,对睾丸形态的影响见图1。由表1可知:注射30 mg/kg白消安30 d后,与对照组相比,试验组附睾系数极显著降低(P<0.01);附睾中无可见精子,精子密度和精子活力为0,无精子畸形率。与对照组睾丸形态(见图1a)相比,注射白消安后第10天,睾丸内基底膜生殖细胞开始减少,精子未受影响(见图1b)。注射白消安后第20天,睾丸内基底膜的生精细胞几乎消失,曲细精管内有脱落的生殖细胞,精子数量明显减少(见图1c)。注白消安后第30天,睾丸曲细精管呈薄空管状,基底膜的生殖细胞消失,无精子(见图1d)。

表1 白消安对雄性小鼠生殖参数的影响
注:同列上标字母不同表示差异极显著(P< 0.01)。

图1 白消安对睾丸形态的影响
2.2白消安对雌性小鼠生殖参数的影响
白消安对雌性小鼠生殖参数的影响见表2,对卵巢形态的影响见图2。由表2可知:注射 30 mg/kg

表2 白消安对雌性小鼠生殖参数的影响
注:同列上标字母不同表示差异极显著(P<0.01)。
白消安30 d后,卵巢系数、排卵数和畸形率情况均有显著变化。与对照组相比,试验组卵巢系数明显降低,差异极显著(P<0.01),此时卵巢中无卵子。与对照组的卵巢形态(见图2a)相比,注射白消安后第10天,卵巢内出现空洞,卵细胞有受损迹象(见图2b);第20天,卵巢内的空洞面积显著增大,无卵细胞(见图2c);第30天,卵巢内空洞充满整个卵巢,无卵细胞(见图2d)。
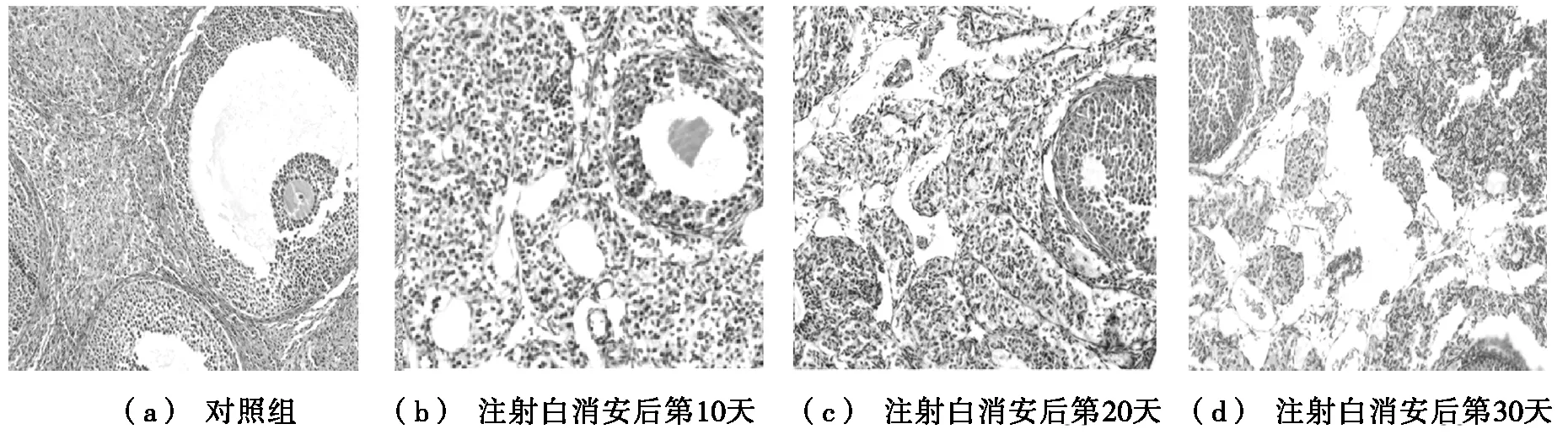
图2 白消安对卵巢形态的影响
2.3钼对不育雄鼠附睾系数的影响
钼对不育雄鼠附睾系数的影响见表3。由表3可看出:饮钼后的第1周和第2周,与对照组相比,50 mg/L组的附睾系数明显降低(P<0.01),12.5 mg/L组和25.0 mg/L组的附睾系数虽有升高,但无显著变化。第3周试验各组与对照组相比差异不显著。第4周与对照组相比,12.5 mg/L 组附睾系数极显著升高(P<0.01),25.0 mg/L组和50.0 mg/L组无显著差异。
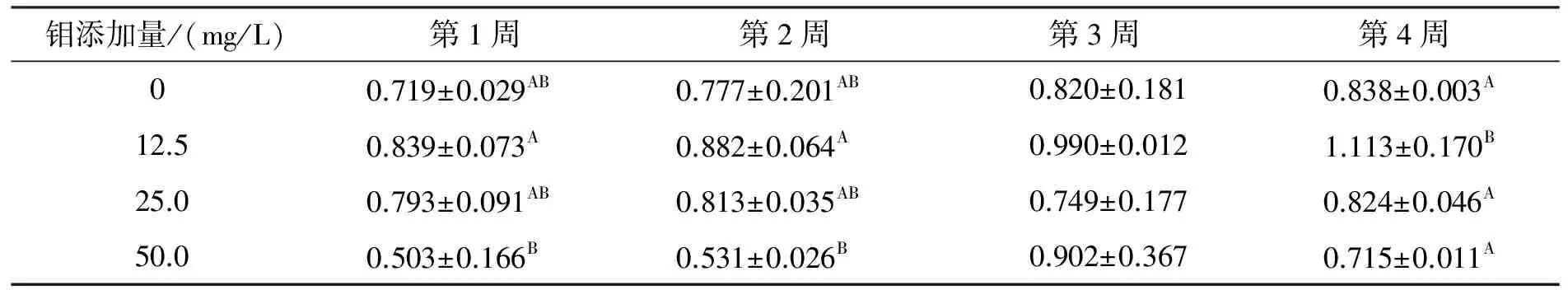
表3 钼对不育雄鼠附睾系数的影响
注:同列上标字母不同表示差异极显著(P<0.01)。
2.4钼对不育雄鼠睾丸组织的影响
不育雄鼠饮钼后,睾丸曲细精管变化见图3。图3中:第1组钼质量浓度为0 mg/L;第2组钼质量浓度为12.5 mg/L;第3组钼质量浓度为25.0 mg/L;第4组钼质量浓度为50.0 mg/L。第1组:第1~2周睾丸曲细精管呈薄空管状(见图3中a1和a2);第3周曲细精管内部分生精细胞开始增殖(见图3中a3);第4周,管腔中出现生精细胞层(见图3 中a4)。第2组:第1周,曲细精管呈薄的空管状,曲细精管内无生精细胞(见图3 中b1);第2周,管腔内生殖细胞开始增殖(见图3中 b2);第3周,生精细胞增殖缓慢,为1~2层(见图3中b3);第4周,生殖细胞层数增加到3~5层(见图3中b4),排列紧密,整齐有序。第3组:第1周,管腔呈薄空管状,曲细精管内无生殖细胞(见图3 中c1);第2~3周,管腔中见1~2层生殖细胞,排列紊乱松散(见图3中c2和c3);第4周,生殖细胞增殖0~4层,排列不均匀、紊乱松散(见图3中 c4);第4组:第1~3周管腔呈薄空管状,生精细胞层无恢复,睾丸曲细精管内无生精细胞层(见图3 中d1~d3);第4周,生殖细胞增殖1~2层,层数分列不均,稀疏散乱(见图3中d4)。
2.5钼对不孕雌鼠卵巢系数的影响
钼对不孕雌鼠卵巢系数的影响见表4。由表4可看出:第1~3周,0 mg/L、2.5 mg/L、5.0 mg/L和10.0 mg/L组间卵巢系数差异不显著;第4周,2.5 mg/L、5.0 mg/L和10.0 mg/L组对卵巢系数均有恢复作用,5.0 mg/L组的卵巢系数极显著高于对照组(P<0.01)。
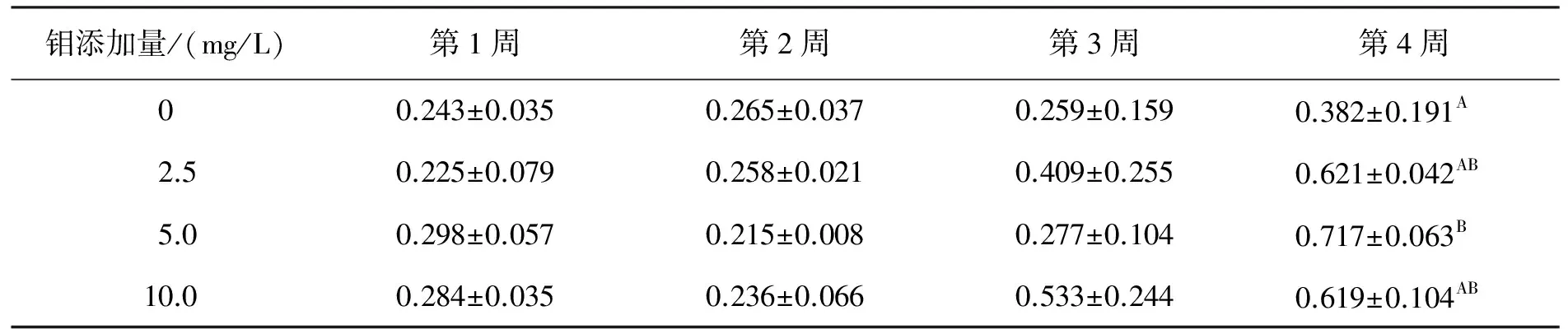
表4 钼对不孕雌鼠卵巢系数的影响
注:同列上标字母不同表示差异极显著(P<0.01)。
2.6钼对不孕雌鼠卵巢组织的影响
不孕雌鼠饮钼后第1~4周,卵巢组织HE染色结果如下:第1组质量浓度为0 mg/L;第2组质量浓度为2.5 mg/L;第3组质量浓度为5.0 mg/L;第4组质量浓度为10.0 mg/L。第1组:第1~3周,卵巢组织的空洞逐渐减少,卵巢组织逐渐恢复,但无卵泡细胞;第4周,卵巢组织大面积恢复,仍无卵泡细胞。第2组:第1~3周卵巢组织的空洞逐渐减少,卵巢组织慢慢恢复,无卵泡细胞;第4周,卵巢组织中有少许空洞,几乎全部恢复且可见卵泡细胞。第3组和第4组:恢复程度与第1组类似,空洞减少,卵巢组织渐渐恢复,无卵泡细胞。
3 讨论
本文研究结果显示:适宜剂量的钼对不孕不育症模型小鼠的生殖功能有治疗作用。对雄性不育小鼠,在本文研究的4个质量浓度中,12.5 mg/L的钼附睾系数显著高于对照组,这表明附睾损伤得到了明显的恢复,精子成熟场所在逐步改善。12.5 mg/L 钼增加了睾丸生精功能,管腔中各级生精细胞也有所增加,从基底膜开始恢复,增殖到3~5层,排列整齐有序。文献[14]的研究结果显示:给健康小鼠饮用质量浓度为 25.0 mg/L 的钼,降低了睾丸过氧化损伤程度,睾丸质量得到明显改善,这与本文研究结果一致。
钼是人与动物所需的微量营养元素,有重要的生物学作用。适量钼能提高机体内细胞免疫力,增加细胞对病毒的抵抗力,对生殖系统有积极作用,可以提高生殖参数。文献[17]饲喂小鼠钼后发现:可以提高睾丸中超氧化物歧化酶的活性,显著降低丙二醛含量,使睾丸组织氧化程度下降,睾丸功能增强。
对雌性不孕小鼠,饮钼质量浓度在2.5 mg/L时显著增加了卵巢系数,这表明卵巢组织功能得到了明显的恢复。卵巢组织切片结果表明,2.5 mg/L组卵巢组织恢复显著比其他组的卵巢组织恢复快,至第4周,卵巢组织中剩余少许空洞,卵巢内率先出现卵泡细胞。这有可能是由于钼降低了不孕症小鼠卵巢的氧化损伤,恢复了卵巢的功能。氧化应激是造成卵巢损伤,卵母细胞畸形,最终导致雌性不孕的原因之一。文献[13]研究发现:5 μg/mL的钼能够降低小鼠卵巢的氧化损伤,改善卵巢的功能,显著提高排卵的数量并降低卵母细胞畸形率,这与本研究结果接近。
综上所述,钼在适宜的剂量(雄鼠12.5 mg/L,雌鼠2.5 mg/L)时,对不孕不育症小鼠的生殖机能障碍有明显的治疗作用,有可能成为治疗不孕不育症的一种新的候选药物。
[1]DIAMANTI-KANDARAKIS E,BOURGUIGNON J P,GIUDICE L C,et al.Endocrine-disrupting chemicals:an endocrine society scientific statement[J].Endocrine reviews,2009,30(4):293-342.
[2]AGARWAL A,MULGUND A,HAMADA A,et al.A unique view on male infertility around the globe[J].Reprod biology and endocrinology,2015,13(1):37-45.
[3]MARQUES-PINTO A,CARBVALHO D.Human infertility are endocrine disruptors to blame[J].Endocrine connections,2013,2(3):15-29.
[4]LINDSAY T J,VITRIKAS K R.Evaluation and treatment of infertility[J].Am fam physician,2015,91(5):308-414.
[5]LUKE B,BROWN M B,NAGENT C,et al.Risk factors for adverse outcomes in spontaneous versus assisted conception twin pregnancies[J].Fertil steril,2004,81(2):315-319.
[6]BELOOSEKY R,KOL S.LIGHTMAN A,et al.Ovarian stimulation in in vitro fertilization with or without the “long” gonadotropin re-leasing hormone agonist protocol:effect on cycle duration and outcome[J].Fertil and steril,2000,74(1):166-168.
[7]HEM S,VON S V,SCHLATT S.Spermatogonia:stem cells with a great perspective[J].Reproduction,2001,121(6):825-834.
[8]ORWIG K E,SHINOHARA T,AVARBOCK M R,et al.Functional analysis of stem cells in the adult rat testis[J].Biology of reproduction,2002,66(4):944-949.
[9]王佳炜.微量元素钼的生理作用及其对机体功能的影响研究进展[J].医学综述,2013,19(19):3460-3463.
[10]王宏伟,赵静,杜祥月,等.钼对雌性小鼠骨骼形态结构的影响[J].河南科技大学学报(自然科学版),2014,35(6):71-74.
[11]SHERKHOV Z,KURDANOV K A,SHERKHOVA L K.Effects of molybdenum and hypoxia on the cardiovascular system of experimental animals[J].Aviakosm ekolog med,2012,46(5):51-54.
[12]TURNLUND J R,KEYED W R,PEIFFER G L,et al.Molybdenum absorption,excretion and retention studied with stable isotopes in young men at five intakes of dietary molybdenum[J].American journal of clinical nutrition,1995,62:790-796.
[13]ZHANG Y L,LIU F J,CHEN X L,et al.Dual effects of molybdenum on mouse oocyte quality and ovarian oxidative stress[J].Systems biology in reproductive medicine,2013,59(6):312-318.
[14]ZHAI X W,ZHANG Y L,QI Q,et al.Effects of molybdenum on sperm quality and testis oxidative stress[J].Systems biology in reproductive medicine,2013,59(5):251-255.
[15]BISHOP J B,WASSOM J S.Toxicological review of busulfan (Myleran)[J].Mutation research/reviews in genetic toxicology,1986,168(1):15-45.
[16]WANG J,XUE X,FAN C,et al.Establishment of recipient model for spermatogonial stem cells transplantation in Kunming mice[J].Tissue & cell,2014,46(4):249-254.
[17]李建喜,王学智,杨志强.钼和铜对小鼠抗氧化机能的影响[J].中国兽医科技,2004,34(11):22-26.
国家自然科学基金项目(30901026);河南省高等学校青年骨干教师基金项目(2010GGJS-071)
毛贻玺(1988-),女,河南新乡人,硕士生;刘凤军(1979-),男,通信作者,内蒙古赤峰人,副教授,博士,硕士生导师,主要研究方向为动物生殖疾病与生殖调控.
2015-10-20
1672-6871(2017)01-0073-05
10.15926/j.cnki.issn1672-6871.2017.01.015
S854
A
