钾矿区海金沙内生真菌多样性及生态分布研究
2017-11-10张红芳甘会云钱旭陈晔
张红芳, 甘会云, 钱旭, 陈晔,2,*
1.九江学院药学与生命科学学院, 九江 332000 2.九江市区域产业与城市生态重点实验室, 九江 332000
钾矿区海金沙内生真菌多样性及生态分布研究
张红芳1, 甘会云1, 钱旭1, 陈晔1,2,*
1.九江学院药学与生命科学学院, 九江 332000 2.九江市区域产业与城市生态重点实验室, 九江 332000
为探明不同钾矿区同种植物内生真菌的物种多样性、群落组成以及生态分布规律, 运用传统组织分离方法与分子生物学方法相结合, 对3个不同钾矿区(龙南安基山、南京小龙山、黎川龙安)的海金沙居群地采样, 进行了海金沙内生真菌的分离频率、种类组成、多样性和生态分布分析, 同时与非钾矿区(庐山莲花洞)海金沙内生真菌进行对比分析。结果表明: 从海金沙1200个组织块中分离出477 株内生真菌, 其中产孢菌株229株, 占总数48 %, 不产孢菌248株, 占52%。根据形态学特征和形态型菌株的rDNA的18S基因和ITS序列的相似性比较和分子系统发育分析确定477菌株中438 菌株鉴定隶属于Alternaria、Colletotrichum、Fusarium、Peniccillium等75个分类单元, 还有39 株不产孢类群无法鉴定。在真菌属的水平, 以Colletotrichum(20.96%)、Fusarium(11.32%)和Alternaria(8.81%)为优势菌群。从分离频率来看, 不同钾矿区内生真菌出现频率存在差异, 各矿区内生真菌菌群之间的相似性低, 相似性系数(Cs)在0.07—0.30之间。钾矿区海金沙内生真菌出现频率高于非钾矿区, 非钾矿区(莲花洞)菌株分离频率为19.08%, 而在钾矿区中南京分离频率最高(33.33%)。在宿主组织中, 海金沙叶片、叶柄和根状茎等不同组织部位内生真菌在数量、种群分布以及优势种群等方面存在较大差异, 叶柄(44.44%)>叶片(39.41%)>根状茎(16.15%), 在各个组织部位的优势类群分布也存在一定的差异。形成内生真菌分布差异性与不同地理位置、气候因素、土壤理化性质和宿主植物组织的生理状况以及化学组成变化等密切相关。
海金沙; 钾矿区; 优势菌群; 多样性; 相似性系数
1 前言
自1866年Heinrich Anton de Bary提出植物中存在有“内生生物体(Endophyte)”至今, 国内外学者在不断地拓宽内生真菌宿主植物研究, 已开展了从藻类、地衣、苔藓、蕨类植物和种子植物等植物内生真菌多样性研究, 并对不同气候和生境的植物内生真菌资源进行了发掘, 取得了丰硕的研究成果[1-7]。研究表明内生真菌普遍存在植物组织中, 具有丰富多样性, 受宿主植物组织、环境等多种因素影响, 体现出一定组织、宿主差异性, 并与宿主植物之间建立了长期稳定的互惠共生关系(Mutualistic symbiosis)[8-9];此外, 这种共生关系在相对极端的环境中也普遍存在, 赋予植物优良生长性状, 能提高宿主植物抗逆性、促进宿主对营养物质的吸收从而增强宿主植物对此类环境的适应性[10-20]。
蕨类植物是地球上最早出现的陆生植物类群,在世界各地均有分布, 具有丰富的物种多样性。蕨类植物在适应特殊环境(如干旱环境、污染环境、矿区环境等)方面具有独特的适应机制[21-22]。这种独特适应机制是否与内生真菌之间建立了一种特殊关系是值得深入探究的问题。
为探明钾矿区蕨类植物内生真菌的物种多样性、群落组成以及生态分布规律。以海金沙Lygodium japonicum(海金沙系海金沙科海金沙属多年生蕨类植物, 分布广泛, 具有抗逆境能力强、生长迅速、繁殖能力强等特点)为材料[23-25], 系统地研究不同钾矿区海金沙内生真菌类群多样性及生态分布特点, 探讨不同钾矿区与植物内生真菌群落组成及多样性变化的关系, 并进一步分析矿区与非矿区植物内生真菌分布特点。研究结果将有助于全面了解钾矿区植物内生真菌的类群组成和生态分布规律, 为探究植物内生真菌对宿主植物在矿区适应机制提供理论依据。
2 材料与方法
2.1 材料
2.1.1标本采集处理 2014年6月下旬分别在3个不同钾矿区(龙南安基山、南京小龙山、黎川龙安)和 1个非钾矿区(庐山莲花洞)等地进行了海金沙L.japonicum样本采集(样地基本概况, 见表1)。材料采集处理方法参照文献[26]。
2.1.2培养基 麦芽汁琼脂(2%)培养基为分离、纯化培养基, 其配比: 麦芽汁 750 mL, 琼脂 15 g,10%海金沙叶水提液100 mL, 加蒸馏水定容至1000 mL, 自然pH(使用前在培养基中加80 U·mL-1链霉素1 mL); PDA培养基为保种培养基。
2.2 内生真菌的分离及纯化
内生真菌的分离采用常规的组织分离法, 地上部分从每种植物样品中随机选取 20段带有叶片的小段片, 自来水冲洗干净, 按文献进行表面消毒[26-30]。纯化已鉴定菌种后, 接入 PDA斜面, 4 ℃冰箱中保藏。分离纯化获得的菌株保存于九江学院药学与生命科学学院真菌研究室(JJTU)。
2.3 内生真菌的鉴定
2.3.1内生真菌的鉴定 根据菌落的颜色、形态、菌丝和产孢结构的形态特征鉴定到属。将不产孢菌株在促孢培养基上进行促孢培养, 并检查其产孢情况, 产孢后按上述方法进行鉴定。经促孢培养后仍不产孢的菌株则根据菌落表面特征、菌丝颜色、菌丝生长速率等分为无孢类群(Mycelia Sterilia)的形态型[9]。通过rDNA中的5.8SITS序列的分子系统学分析方法进行鉴定。真菌属的鉴定主要依据 Barnett& Hunter(1998)、Dictionary of fungi(10 版, 2008)、Keith Seifer(2011)的分类系统和《真菌鉴定手册》,并参考国内外相关期刊发表的文献资料[31-33]。

表1 采集样地基本概况Tab.1 Basic general situation of sampling sites
2.3.2不产孢内生真菌菌株分子生物学鉴定[8,30]
运用CTAB法进行内生真菌DNA的提取, 利用真菌通用引物 Primer1 (ITS1: 5’- TCCGTAGGTG AACCTGCGG-3’正向)和 Primer4(ITS4: 5’-TCCTCC GCTTATRGATATGC-3’反向)对内生真菌 DNA 的ITS1、ITS2 和 5.8S rRNA 区间进行扩增; PCR 产物用纯化试剂盒(QiaQuick PCR purification Kit;Qiagen)进行纯化, 琼脂糖凝胶电泳进行检测。PCR产物的序列测定: 由北京华大基因有限公司完成。
通过对分子数据库 GenBank中的序列 BLAST进行同源序列的检索, 分子序列相似性超过 98%的序列被选作是同源序列。同时, 相似性较低的序列被选作为外源序列(Outgroup)。
用软件 MAFFT 7.0 运算实现分子序列比对,软件的设置为 Scoring Matrix: 1PAM/κ=2; Gap opening penalty=1.53; Offset value=0.0。比对完的序列用BioEdit 软件进行剪切编辑。利用 MEGA 4.0软件进行系统发育树的构建, 该软件采用的方法是邻接法(Neighbour-joining, NJ), 树的可靠性通过Bootstrap1000次来检验。
2.4 土壤和植株中主要成分测定
用TPY-6PC土壤养分化验仪测定样品中的速效氮、有效磷、速效钾、有机质含量、土壤酸碱度, 植株中的主要元素K、P、Si、 Al等[34]。
2.5 数据统计分析[25]
采用分离率(Isolation rate,IR)衡量组织中内生真菌的丰富程度。分离率: 分离到的某一指定类型内生真菌的菌株数占样品组织块总数比值。
采用分离频率(Isolation frequency,IF)比较判断内生真菌的优势菌群。分离频率: 某一指定类型内生真菌的菌株数占获得总内生真菌菌株数比值。
采用最为常用Shannon-Weiner多样性指数(He)进行内生真菌种群的多样性水平分析。He=-∑[ni/NLn(ni/N)], 其中ni为第i个内生真菌菌株数目,N为全部内生真菌菌株数。用Pielou均匀度指数分析菌群分布的均匀程度,E=He/Ln(S)式中:He为Shannon-Wiener 指数,S为物种数。 Margalef丰富度指数:R=(S-1)/lnN。Berger-Parker优势度指数(D),D=Nmax/N式中:Nmax为优势种的个体数;N为功能团全部物种的个体数。
采用Jaccard相似性指数(Cj)对不同植物间内生真菌组成的相似程度进行比较和分析。Cj=c/(a + b-c)。式中:a是一种植物内生真菌的种类数,b是另一种植物内生真菌的种类数,c是两种植物共同具有的内生真菌种类数, 比较两种植物之间内生真菌种类组成的相似程度。
3 结果与分析
3.1 海金沙内生真菌主要类群组成
从4个居群地的海金沙1200个组织块中共分离获得内生真菌477株, 其中产孢菌株229株, 占总菌株数48%, 不产孢菌248株, 占52%。根据菌落、菌丝形态学特征进行鉴定, 不产孢类群根据培养特征(生长速度、颜色以及质地等)将248菌株划分26个形态型。通过对产孢类群的形态学鉴定和形态型菌株的5.8SrDNA、ITS序列的相似性比较和分子系统发育分析, 将分离获得 477株内生真菌中 438 菌株鉴定为Alternaria、Colletotrichum、Fusarium、Peniccillium等75 个分类单元, 此外 39株不产孢类群 DNA序列在GenBank中无相近参考菌株信息, 作为无法鉴定的内生真菌, 它们分别为Fungal endophytesp.(9株)、Fungalsp.(22 株)、Uncultured fungus(8株), 这些菌群是否是新的类群有待进一步分析(见表2, 图1)。在属的水平以Colletotrichum、Fusarium、Alternaria为优势菌群, 其分离频率分别为20.96%、11.32%、8.81%。

表2 海金沙内生真菌的菌群组成Tab.2 Composition of endophytic fungi from L.japonicum (Thunb.) Sw.
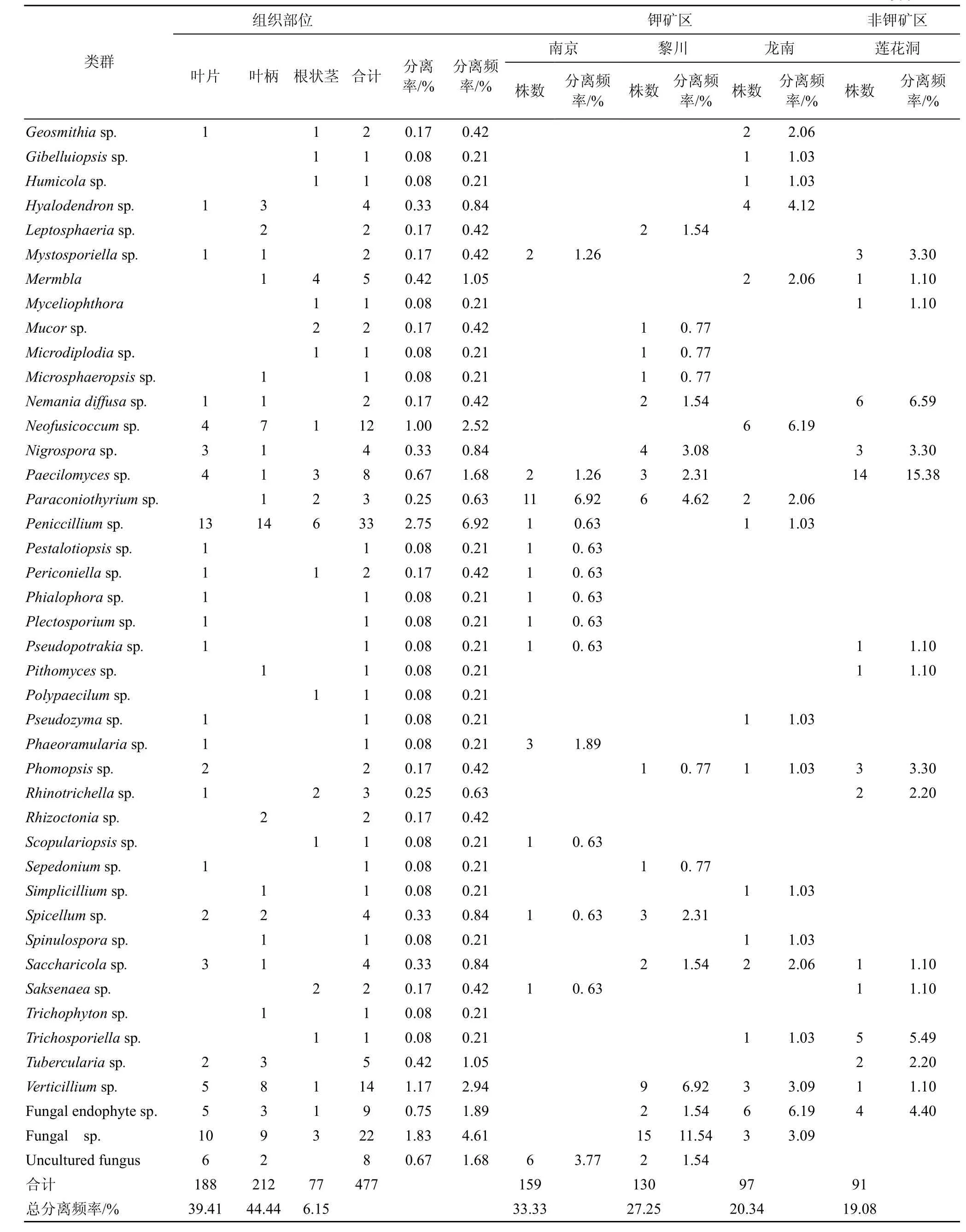
续表
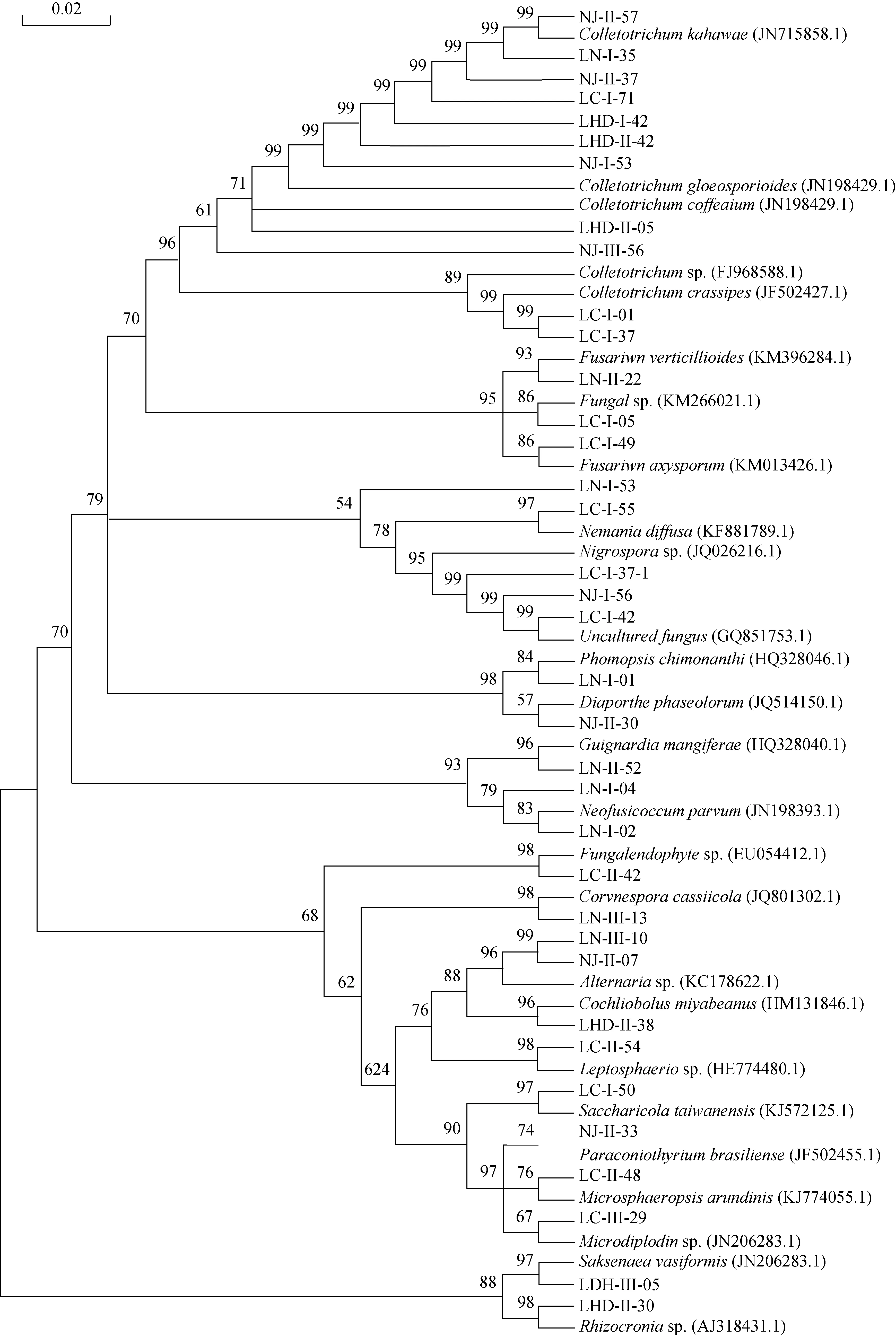
图1 基于 5.8S rDNA 构建的形态型菌株邻接法系统发育树Fig.1 Neighbour-Joining phylogenetic tree of mycelia sterilia based on 5.8S rDNA gene sequences
3.2 内生真菌相似性及多样性分析
3.2.1 海金沙内生真菌菌群组成的相似性
相似性系数是反映两个不同生境中真菌菌群组成相似程度的重要参数。从内生真菌菌群的相似性来看(表3), 各样地之间内生真菌类群相似性较低,相似性系数在0.07—0.30之间, 均小于0.5。从钾矿区海金沙内生真菌菌群组成之间相似性来看, 龙南和黎川的相似性最高(Cs=0.2553), 南京与龙南的相似性最低(Cs=0.0690); 从钾矿区与非钾矿区海金沙内生真菌菌群组成之间相似性来看, 黎川和莲花洞的相似性最高(Cs=0.3023), 南京和莲花洞最低(Cs=0.1568)。
3.2.2 海金沙内生真菌菌群组成的多样性
从Pielou均匀度指数(E)来看, 3个钾矿区海金沙组织的内生真菌菌群的均匀度指数在 0.7015—0.8552 之间(表4), 龙南采样地点均匀度指数为 0.8552, 南京采样地点均匀度指数为 0.7015, 而非钾矿区(莲花洞)海金沙内生真菌均匀度指数最高为0.8726, 从而体现出各采样地点的海金沙内生真菌的多样性是比较稳定的。从 Shannon-Wiener 多样性指数(He)来看, 龙南采样地点的最高,He为2.9086, 南京的最低,He为 2.4313。从Berger-Parker优势度指数来看, 莲花洞采样地点的最高, 为6.5000, 南京的最低, 为2.8909。从Margalef 丰富度指数(R)来看, 龙南采集点最高, 为 6.3392, 黎川最低, 为5.7524。
由表4可知, 海金沙内生真菌菌群的Shannon-Wiener 多样性指数(He)、Margalef 丰富度指数(R)、Berger-Parker优势度指数和均匀度指数(E)在海金沙不同组织部位之间的变化趋势一致, 即: 叶片>叶柄>根状茎, 表明海金沙叶片中内生真菌的多样性最高。
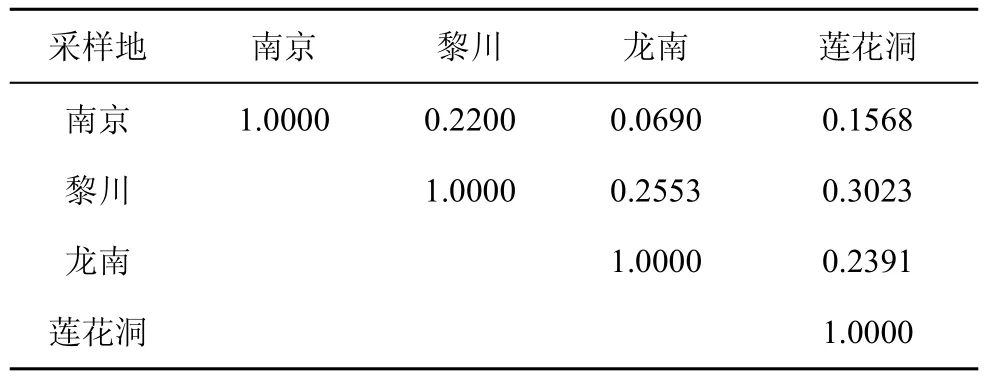
表3 不同地点海金沙内生真菌相似性系数Tab.3 Similarity coefficients of endophytic fungi from L.japonicum in different sampling locations
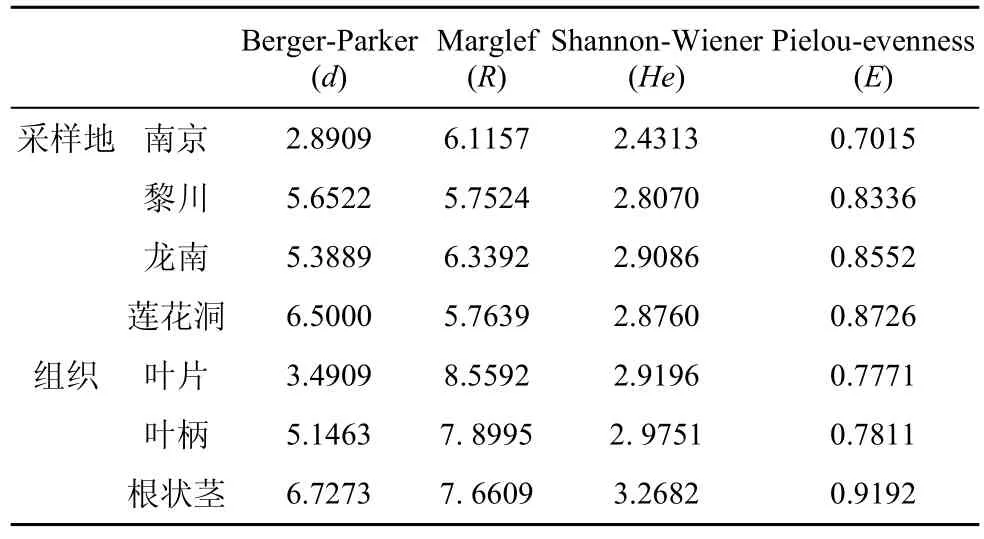
表4 不同地点海金沙内生真菌多样性指数Tab.4 Diversity indices of endophytic fungi from L.japonicum in different sampling locations
3.3 海金沙内生真菌生态分布
3.3.1 不同钾矿区海金沙内生真菌菌群的分布
在 3个钾矿区之间, 海金沙植物中内生真菌的菌群组成存在着明显差异, 在分离频率上表现为南京>黎川>龙南的规律, 南京钾矿区分离频率最高,为 33.33%。除共有的优势菌群以外, 海金沙植物中内生真菌还具有其各自地区的优势菌群存在差异,南京以Alternaria(17.61%)、Colletotrichum(34.59%)为优势菌群, 黎川以Fusarium(13.85%)、Colletotrichum(17.69%)、Fungalsp.(11.54%)为优势菌群, 龙南以Colletotrichum(14.43%)、Fusarium(18.56%)为优势菌群。钾矿区部分内生真菌类群在同一植物中分布具有特定的地理分布特性, 如Aegerita(0.21%)、Entylomella(0.63%)、Botrytis(3.14%)等仅在南京矿区分离获得出现,Antromycopsis(0.77%)、Catenulifera(1.54%)、Nigrospora(3.08%)等仅分布在黎川矿区,Fusicladium(2.06%)、Acremonium(0.63%)、Beltrania(1.03%)等仅分布在龙南矿区。
同时, 研究发现从钾矿区海金沙植物中分离获得内生真菌在数量、种群分布以及优势种群等与非钾矿区之间存在较大差异。从数量来看, 钾矿区分离获得菌株数>非钾矿区; 非钾矿区优势菌群为Peniccillium(15.38%)、Guignardia(11%)、Fusarium(11%)。Alternaria、Colletotrichum、Fusarium、Peniccillium等在钾矿区和非钾矿区均有分布。Rhinotrichella(3.30%)等仅分布非钾矿区。
3.3.2 海金沙不同组织中内生真菌菌群的分布
从总分离频率来看, 海金沙叶片、叶柄和根状茎等不同组织部位内生真菌在数量、种群分布以及优势种群等方面存在较大差异, 叶柄(44.44%)>叶片(39.41%)>根状茎(16.15%)(表2), 尤其叶柄、叶片中的内生真菌在种类与数量上较为丰富, 根状茎最少;同时, 在各个组织部位的优势类群分布也存在一定的差异, 在叶片、叶柄中以Colletotrichum分离频率为较高, 分别 29.26%、19.34%,Fusarium在根状茎中的分离频率较高, 为14.29%。除2—3个明显较重要的属外(IF>10), 分离频率较低(IF<5)的属构成了海金沙内生真菌的主要组成。一些内生真菌类群表现出一定组织专一性, 如Arthroboyryum、Blastomyces、Curvularia等仅分布在叶片中,Acroolictys、Aegerita、Beauveria等仅在叶柄中分离得到,Antromycopsis、Cladobotryum、Gibelluiopsis等仅分布在根状茎中。
4 讨论
从分离纯化结果显示: 不产生孢子的菌株的分离率达到 20.67%, 分离频率更达到 52%, 与其他学者研究植物内生真菌的结果相似[11-19], 其原因可能是由于内生真菌与宿主在长期协同进化中形成的适应关系使得内生真菌不仅在宿主体内不产子实体及孢子, 而且在体外培养时也已不易产生子实体[35]。
研究结果表明: 钾矿区常见蕨类植物海金沙内生真菌在叶片、叶柄和根状茎中的分布和分离频率存在差异, 以叶柄的分离频率为最高, 根状茎的分离频率最低, 这可能与内生真菌的来源及其萌发、生长和扩展有关。蕨类植物茎为根状茎, 其内部结构为表皮、皮层和中柱, 表皮无气孔, 蕨类植物根状茎的内生真菌是通过茎表皮细胞间穿过皮层机械组织细胞间隙侵入到根状茎的皮层薄壁细胞[29]; 也可能与矿区土壤环境有关, 因为矿区土壤贫瘠, 有些真菌难以在这种环境中生存, 故侵入蕨类植物根状茎内生真菌数量较少, 而地上部分叶可以接受空气中大量真菌孢子, 孢子通过不同途径侵入叶内定植[25]。具体影响内生真菌在蕨类植物不同组织部位分布差异的因素需要进一步探究。
从分离频率看, 海金沙内生真菌在不同钾矿区出现的频率存在较大的差异, 南京小龙山钾矿区(33.33%)>江西黎川龙安钾矿区(27.25%)>江西龙南安基山钾矿区(20.34%); 海金沙植物中内生真菌优势菌群在不同钾矿区也存在明显差异。形成这种差异可能与其所处地理位置的气候因素、土壤因素和海金沙植物组织生理状况以及化学组成的明显变化等因素有关。从气候因素来看, 南京小龙山钾矿区、黎川龙安钾矿区、龙南安基山钾矿区分别位于北、中、南不同的亚热带季风气候区, 它们年平均气温、降雨量和光照等均存在差异(见表1)。温度、湿度、光照等气候条件的差异, 一方面影响内生真菌对宿主植物的感染、定殖和生长, 从而使得同一植物内生真菌的分布在不同钾矿区发生明显变化[14]; 另一方面导致植物组织的生理状况以及化学组成的明显变化, 从而影响海金沙内生真菌的类群和分布[14,19]。从测定不同钾矿区海金沙植株体内元素含量来看(见表5), 不同钾矿区海金沙植株P、K、Si、A l等含量存在差异, 进一步说明不同气候条件下导致植物自身化学组成的变化, 影响植物内生真菌的分布。
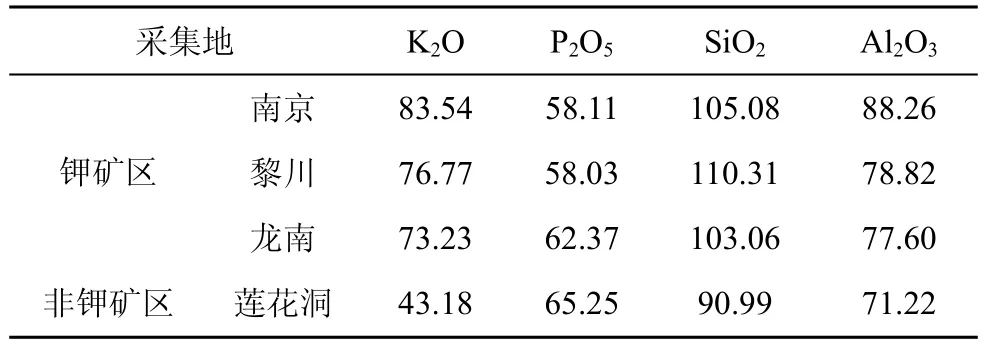
表5 不同采集地海金沙所含主要矿质元素(mg·kg-1)Tab.5 The main mineral elements from L.japonicum in different sampling locations
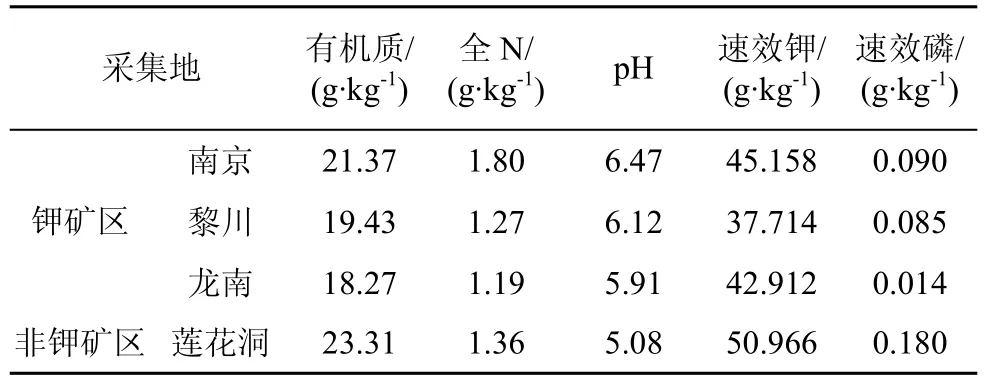
表6 不同采集地土壤的主要理化性状Tab.6 Basic properties of soils used in different sampling locations
为了深入探讨地理因素对于海金沙内生真菌分离频率的影响, 对三个钾矿区的土壤理化指标(pH、有机质、全N、速效P 和速效K)进行了测定, 结果显示三个钾矿区的土壤理化性质差异较明显(表6),土壤理化性质对内生真菌的菌群结构产生一定的影响。说明地理因素会导致植物内生真菌群结构产生差异, 这与有的学者研究地理因素对植物中内生真菌群落结构影响的结果一致[9,11]。可见, 植物、内生真菌双方由于受到周围微环境变化的选择压力, 具有选择性地改变另一方的能力[14,16,19]。这可能是一种跳跃式的协同进化方式, 一方面某些内生真菌可能通过极端环境的筛选作用具备了溶磷解钾功能,另一方面, 宿主植物组织中的某些基因选择性表达,从而增强了对P、K等物质的吸收, 使共生体快速适应钾矿区环境胁迫[5-6]。
同时研究发现, 钾矿区海金沙内生真菌出现的频率高于非钾矿区。一方面可能由于莲花洞森林公园植被类型丰富, 乔灌木层发达, 郁闭度大,影响内生真菌孢子在垂直方向的传播, 而钾矿区植被类型单一可能有利于内生真菌的定殖; 另一方面, 可能由于莲花洞森林公园位于市郊, 交通便捷, 游客众多, 人类活动频繁和森林管理实践在一定程度上影响了内生真菌孢子在水平方向的传播, 例如 Sieber Canavesi等研究发现植物在被砍伐之后比在自然建立的情况下内生真菌出现的频率更高, 即同种植物中内生真菌出现的频率差异性与管理实践有关[36]。不过影响植物内生真菌菌群分布、组成特征和演替变化的因素和作用机制既是多方面的又可能是较为复杂的, 需进一步探究。
致谢:感谢中国科学院微生物研究所真菌学国家重点实验郭良栋研究员给予的帮助和指导。
[1]ZHOU Wenqing , WHEELER T A, STARR J L.et al.A fungal endophyte defensive symbiosis affects plant-nematode interactions in cotton[J].Plant and Soil, 2016: 1–16.
[2]VEGA F E, POSADA F, AIME.M.C, et al.Entomopathogenic fungal endophytes[J].Biological Control, 2008, 46(1): 72–82.
[3]郭良栋.内生真菌研究进展[J].菌物系统, 2001, 20(1):148–152.
[4]孙剑秋, 郭良栋, 臧威, 等.药用植物内生真菌及活性物质多样性研究进展[J].西北植物学报, 2006(26): 1505–1519.
[5]黄贵修, 刘先宝.植物内生菌[M].北京: 中国农业科学技术出版社, 2013: 1–424.
[6]张君诚, 王铮敏, 张杭颖, 等.蕨类植物内生菌研究进展[J].中国农学通报, 2010, 26(20): 70–72.
[7]邹文欣, 谭仁祥.植物内生菌研究新进展[J].植物学报,2001, 43(9): 881–892.
[8]石晶盈, 陈维信, 刘爱媛.植物内生菌及其防治植物病害的研究进展[J].生态学报, 2006, 26(7): 2395–2401.
[9]高剑.内生真菌多样性及其生态分布[D].湛江: 广东海洋大学, 2013.
[10]BANERJEE D.Endophytic fungal diversity in tropical and subtropical plants[J].Research Journal of Microbiology,2011(6): 54–62.
[11]KRISTIN M,CHEN Qing,DANIEL M,YUEN S, et al.Culturable Endophytes of Medicinal Plants and the Genetic Basis for Their Bioactivity[J].Microb Ecol, 2012, 64(4):431–449.
[12]AMAL H, ALYC A D, JULIA K J, et al.Fungal endophytes from higher plants: a prolific source of phytochemicals and other bioactive natural products[J].Fungal diversity, 2010,41(1): 1–6.
[13]FISHER P J, PETRINI O, SUTTON B C.A comparative study of fungal endophytes in leaves, xylem and bark ofEucalyptus nitensin Australia and England[J].Sydowia,1993(45): 338–345.
[14]RODRIGUE R J, WLLITE J F, ARNOLD A E, et al.Fungal endophytes diversity and functional roles[J].New Phytol, 2009: l–17
[15]JYOTI B, AMARJEET K, MADHUNIKA S, et al.Molecular and functional characterization of endophytic fungi from traditional medicinal plants[J].World Microbiol Biotechnol, 2012(28): 963–971.
[16]CAMIL A R.CARVAL H O, VIVIAN G S, et al.The diversity, antimicrobial and anticancer activity of endophytic fungi associated with the medicinal plantStryphnodendron adstringens(Mart.) Coville (Fabaceae) from the Brazilian savannah[J].Symbiosis, 2012(57): 95–107.
[17]DEBDULAL BANERJEE.Endophytic Fungal Diversity in Tropical and Subtropical Plants [J].Research Journal of Microbiology, 2011(6): 54–62.
[18]GABEL A, STUDT R, METZ S.Effect ofCryptomycina pteridisonPteridium aquilinum[J].Mycologia,1996(88):635–641.
[19]TEJESVI M V, KAJULA M, MATTIL A S, et al.Bioactivity and genetic diversity of endophytic fungi inRhododendron tomentosumHarmaja[J].Fungal Diversity,2011, 47(1): 97–107.
[20]吴国芳, 冯志坚, 马炜梁, 等.植物学(下)[M].北京: 高等教育出版社, 2010: 1–402.
[21]褚磊, 于小丽, 李影, 等.矿业废弃地中耐重金属蕨类植物的研究进展 [J].安徽师范大学学报, 2007, 30(5): 587–592.
[22]王辉, 吴娇, 赵婷婷, 等.海金沙的化学成分和药理活性研究进展[J].中国野生植物资源, 2011, 30(2): 1–4.
[23]国家中医药管理局中华本草编委会.中华本草(第一卷)[M].上海: 上海科技出版社, 1999: 443.
[24]张雷红, 殷志琦, 叶文才, 等.海金沙草化学成分的研究[J].中国中药杂志, 2005, 30(19): 1522–1524
[25]钱旭, 甘会云, 杜勇涛, 等.龙南钾矿区常见蕨类植物可培养内生真菌的多样性[J].广西植物, 2016, 35(3): 342–348.
[26]甘金莲, 彭琴, 詹寿发, 等.海金沙内生真菌的多样性研究[J].湖北农业科学, 2013, 52(4):865–866.
[27]樊有赋, 甘金莲, 陈晔, 等.药用蕨类植物狗脊内生真菌的初步研究[J].安徽农业科学, 2008, 36(9): 3737, 3375.
[28]巫婷玉, 杨丽, 许明敏, 等.槲蕨根际真菌与内生真菌的多样性及相关性分析[J].广东农业科学, 2012, 39(17):157–159.
[29]詹寿发, 彭琴, 陈晔, 等.庐山石韦内生真菌多样性及地下部分显微结构观察[J].南方农业学报, 2012, 43(9): 1 320–1 324.
[30]张宇, 郭良栋.真菌 DNA 条形码研究进展[J].菌物学报, 2012, 31(6): 809–820.
[31]魏景超.真菌鉴定手册[M].上海: 上海科学出版社,1979: 1–802.
[32]KEITH SEIFERT, GARETH M J,WALTER G, et al.The Genera of Hyphomycetes [M].CBS-KNAW Fungal Biodiversity Centre, PO, 2011: 1–997.
[33]ELLIS M B.More Dematiaceous Hyphomycetes[M].CMI,Kew, Surrey, England.1976: 1–507.
[34]姚槐应, 黄昌勇, 吕镇海, 等.土壤微生物生态学及其实验技术[M].北京: 科学出版社, 2006: 129–190.
[35]柴新义, 陈双林.青檀内生真菌菌群多样性的研究[J].菌物学报, 2010, 30(1): 18–26.
[36]SIEBER T N, SIEBER C F, DORWORTH C E.Endophytic fungi of red alder (Alnus rubra) leaves and twigs in British Columbip[J].Canadian Journal of Botany, 1991, 69(2):407–411.
Diversity and ecological distribution of endophytic fungi associated withLygodium japonicum in potassium mining areas
ZHANG Hongfang1, GAN Huiyun1, QIAN Xu1, CHEN Ye1,2,*
1.School of Pharmacy and Life Sciences,Jiujiang University,Jiujiang332000,China2.Jiujiang Key Laboratory of Regional Industry and Urban Ecology,Jiujiang332000,China
In order to make clear the species diversity, community composition and ecological distribution of the endophytic fungi isolated from the fern in different potassium mining areas, the study tookLygodium japonicumin three different potassium mining areas (Longnan Anjishan, Nanjing dragon mountain, Lichuan longan) as experimental material.The isolation frequency, species composition, diversity and ecological distribution of the strains fromL.japonicumwere analyzed by the combination of traditional tissue isolation method and molecular biological method.And the endophytic fungi isolated fromL.japonicuminnon-potassium mining areas (Lianhua Hole, Lushan), were applied as a comparative control.The results showed that 477 strains were isolated from the 1200 tissue blocks.Among them, 229 strains were spore producing strains, accounting for 48%, while 248 strains were non spore producing strains, accounting for 52 %.According to morphological identification of the spore producing groups and comparison of the similarity of 5.8 S rDNA and ITS sequences of non spore producing strains, 438 strains were identified asAlternaria, Colletotrichum,Fusarium, Peniccilliumand other 75 genera, the remaining 39 strains of non spore groups could not be identified.The isolation rate ofColletotrichum, FusariumandAlternariawere 20.96%, 11.32%, 8.81%, respectively, indicating they were dominant.The total separation frequency of the endophytic fungi in the potassium mining areas was generally higher than that in the non potassium mining area, and the separation frequency of the non potassium mining area (Lianhuadong) was 19.08%, while the highest frequency was 33.33% in Nanjing.Generally speaking, the similarity coefficient between each mining area was low, ranging from 0.07 to 0.30.There were significant differences in the number, population distribution and dominant species of endophytic fungi in different tissues.The colonization rate of endophytic fungi from petioles (44.44 %) was generally greater than that from leaves(39.41 %) and then was that from rhizomes (16.15 %).The distribution of endophytic fungi was closely related to the geographical location, climatic factors, physical and chemical properties of soil, and the changes of physiological condition and chemical composition of host plant tissues.
Lygodium japonicum; potassium mining areas; dominant strains; diversity; similarity coefficient; ecological distribution
10.14108/j.cnki.1008-8873.2017.05.021
Q939.5
A
1008-8873(2017)05-160-10
张红芳, 甘会云, 钱旭, 等.钾矿区海金沙内生真菌多样性及生态分布研究[J].生态科学, 2017, 36(5): 160-169.
ZHANG Hongfang, GAN Huiyun, QIAN Xu, et al.Diversity and ecological distribution of endophytic fungi associated withLygodium japonicumin potassium mining areas[J].Ecological Science, 2017, 36(5): 160-169.
2016-11-19;
2017-04-21
国家自然科学基金项目(31360064)
张红芳(1971-), 女, 硕士, 讲师, 研究方向为真菌多样性, E-mail: 939044612@qq.com
*通信作者:陈晔, 硕士, 教授, 研究方向为植物内生真菌多样性, E-mail:chenyejjtc@126.com
