小反刍兽疫病毒P蛋白及非结构蛋白V表达特性研究
2017-10-23马玉馨信爱国高华峰
严 欢 , 马玉馨 , 信爱国 , 高华峰
(1. 云南省热带亚热带动物病毒病重点实验室 , 云南 昆明 650024 ; 2. 云南农业大学动物医学院 , 云南 昆明 650201)
小反刍兽疫病毒P蛋白及非结构蛋白V表达特性研究
严 欢1,2, 马玉馨1,2, 信爱国1, 高华峰1
(1. 云南省热带亚热带动物病毒病重点实验室 , 云南 昆明 650024 ; 2. 云南农业大学动物医学院 , 云南 昆明 650201)
从小反刍兽疫病毒全长cDNA中对磷酸化蛋白P及其编码的非结构蛋白V基因进行特异扩增,PCR产物回收后分别连接于T载体酶切及测序分析后,将其亚克隆至真核载体pEGFP-N2及原核表达载体pET32a, 获得的真核表达质料命名为pEGFP-P、 pEGFP-RV与空载体对照转染Vero细胞, 经浓度为800 μg/μL G418筛选后获得均一表达,荧光定位观察表明P蛋白与V蛋白的表达并不相同,P蛋白严格定位于细胞浆,而V蛋白则能在胞浆及胞核内观察到;获得原核表达质粒pET32a-P 和pET32a-RV在37 ℃通过条件优化后以1.0 mmol/L IPTG诱导后分别收获细胞上清及沉淀用于SDS-PAGE及Western Blot对重组P、V蛋白的检测,结果表明,重组P蛋白为90 ku,重组V蛋白为55 ku的可溶性融合蛋白,可溶性表达产物经500 mmol/L 咪唑两次纯化后获得80%以上纯度的表达,纯化得到的蛋白免疫兔子后能产生特异性抗体。
小反刍兽疫病毒 ; P/V蛋白 ; 细胞定位 ; 原核表达
小反刍兽疫病毒(Pestedespetitsruminantsvirus, PPRV)是副黏病毒科、麻疹病毒属的成员,山羊高度易感。该病主要在非洲及中东地区流行,近年来在中国周边国家频繁发生,自2007年西藏自治区首次报道该病疫情[1-3]。2013年11月新疆再次暴发该病,由于山羊和绵羊的大面积流动,该病在国内迅速传播,至2014年9月不到一年的时间,全国共有22个省或自治区的256个县暴发疫情。该病现已成为对养羊业危害较大的疫病,小反刍兽疫病毒磷酸化蛋白基因(P)及非结构蛋白V在病毒天然免疫过程中起到关键作用,对这两种蛋白的特性及功能研究对研究病毒的特性有重要意义[4-5]。本试验通过真核及原核两种不同方式表达了病毒P及非结构蛋白V,研究其细胞定位及蛋白部分特性。
1 材料与方法
1.1 材料 大肠埃希菌DH5a、真核载体pEGFP-N2及原核表达载体pET32a、小反刍兽疫病毒N75/1弱毒疫苗株及全长cDNA文库由云南省热带亚热带动物病毒病重点实验室保存、Vero细胞系为云南省热带亚热带动物病毒病重点实验室保存。
1.2 酶及试剂 各种工具酶,均购自TaKaRa公司,宝生物工程(大连)有限公司;蛋白质分子量标准,购自晶美公司;PCR产物回收试剂盒及凝胶回收试剂盒为上海生工生物工程技术服务有限公司产品;IPTG(异丙基-β-D-硫代半乳糖苷)为Promega公司产品;组氨酸His单抗、碱性磷酸酶标记的羊抗鼠二抗,购自上海碧云天生物技术有限公司;引物合成及DNA测序由上海生工生物工程技术服务有限公司完成。
1.3 小反刍兽疫病毒的PCR扩增 根据小反刍兽疫病毒N75/1毒株序列,合成如下表1引物用于目的基因的扩增。参考全长文库基因序列信息,用Primer Premier5.0设计用于扩增用于连接报告质粒pEGFP-N2的结构蛋白P及V:用primer mutation设计点突变引物。

表1 扩增病毒结构蛋白P及其编码的非结构蛋白V及基因点突变的引物
注:斜体下划线大写字母为用于连接载体的酶切位点,黑体大写字母为保护性碱基
1.4 重组表达载体的构建 序列测定正确的P、V基因双酶切阳性片段分别与双酶切的pEGFPN2载体在T4连接酶作用下16 ℃连接16 h,构建真核表达载体pEGFP-P、 pEGFP-RV及原核表达载体pET32a-P 和pET32a-V然后转化DH5a感受态细胞,涂板后培养14 h挑选构建pEGFP-V,进行点突变及双酶切鉴定。鉴定出的阳性克隆提取质测序验证并命名为pEGFP-RV。
1.5 重组质粒转染与筛选 将提取的重组质粒pEGFP-P、 pEGFP-RV与脂质体混匀,加入无血清及抗生素细胞培养基混匀后于5% CO2培养24 h,通过梯度试验加入终浓度为800 μg/μL的G418,培养8 d后进行细胞消化培养,经两代筛选培养后观察重组蛋白的细胞定位。
1.6 融合蛋白的诱导表达及纯化 将测序正确的重组质粒pET32a-P 和pET32a-RV 转化E.coliBL21(DE3),在含有10 mg/L 氨苄青霉素的LB培养基中37 ℃摇菌过夜,后以1∶100 转接到20 mL新鲜的含10 mg/L 氨苄青霉素的LB培养基。37 ℃摇菌2 h,A600 nm值 约为0.6时,加入IPTG至终浓度分别为0.01、0.10、1.0 mmol/L,37 ℃摇菌诱导4 h,6 000 r/min (4℃)低温离心10 min 收菌。对上清液和沉淀均进行聚丙烯酰胺凝胶电泳(SDS‐PAGE)分析,判定表达形式。诱导表达的融合蛋白包含有6X His 片段,适用Ni‐NTA 树脂亲和层析法纯化目的蛋白。
1.7 多抗血清的制备 分别用二次纯化的蛋白20 mg P/V免疫兔子,以10 mg的剂量免疫二次免疫,加强免疫后7 d采血检测。
1.8 SDS-PAGE电泳及Western Blot检测 重组原核表达质粒pET32a-P 和pET32a-RV分别加入IPTG 37 ℃诱导后收集细胞及血清,进行SDS-PAGE电泳,分析表达量大小及表达产物的可溶性,将SDS-PAGE电泳产物转移至硝酸纤维膜上,重组蛋白用含5%脱脂乳的TBST封闭4 ℃过夜,以抗6His标鉴蛋白的单抗结合1 h后,显色观察其特异性条带。
2 结果
2.1 小反刍兽疫病毒N75/1结构蛋白P与非结构蛋白V基因的克隆与鉴定 从全长文库质粒中用特异引物扩增P、V基因,PCR产物经1%琼脂糖凝胶电泳检测得到与预期相符的大小分别为1 536 bp、895 bp的条带,扩增的目的片断胶回收后连接到pMD19-T载体上,转化到感受态细胞DH5α,筛选阳性克隆,提取的重组质粒经PCR鉴定和限制性内切酶鉴定得到了与预期相符的核酸片段,将载体 pEGFP-N2与pMD19-T载体上目的基因进行双酶切或单酶切,酶切产物经胶回收后连接,酶切检测构建克隆的正确性,所构建的融合表达载体分别命名为pEGFP-P及pEGFP-V, pEGFP-V通过在体外突变插入鸟嘌磷G,得到一个大小为896 bp的基因片段,获得的重组质粒经PCR鉴定及序列测定分析后命名为pEGFP-RV(见图1)。
2.2 小反刍兽疫病毒结构蛋白P与非结构蛋白V重组质粒的转染 提取重组质粒pEGFP-N2、pEGFP-P、pEGFP-RV,经脂质体转染非洲绿猴肾细胞Vero,转染后于48 h后可观察到大量表达,通过梯度试验加入深度分别500 mg/mL~1 200 mg/mL的G418, 在深度为1 000 mg/mL时,能完全抑制未表达目的蛋白的Vero细胞,经连续筛选4代后,建立稳定表达P、V蛋白的重组细胞系, 通过荧光显微镜可观察到小反刍兽疫磷酸化蛋白在转染早期及稳定表达后均严格定位于细胞浆内,而空载体及非结构蛋白V在细胞核在胞核及胞浆内均有分步。见中插彩版图2。
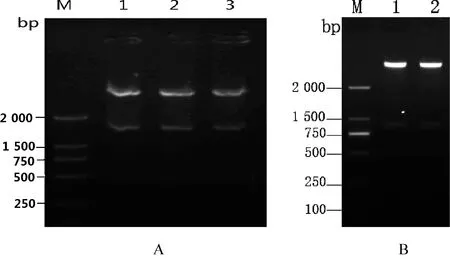
图1 结构蛋白基因P双酶切电泳
2.3 小反刍兽疫病毒结构蛋白P与非结构蛋白V重组质粒的原核表达 将表达菌E.coliBL21(DE3)于37 ℃振荡培养至A600 nm值为0.6时,在诱导温度为37 ℃、诱导时间为4 h、IPTG 浓度依次0.01、0.1、1.0 mmol/L,在IPTG 浓度为1.0 mmol/L 时,目的蛋白的表达最高。在大肠杆菌DE3菌株中的诱导表达的蛋白部分以包涵体形式存在,大部分蛋白以可溶形式表达于上清中,目的蛋白P和V均获得表达。见图3。
2.4 小反刍兽疫病毒结构蛋白P与非结构蛋白V重组质粒的原核表达纯化 将构建的原核表达载体转化大肠杆菌DE3菌株,在37 ℃下,经1 mmol/L的IPTG诱导培养,使蛋白充分表达。沉淀重悬于后进行超声破碎,取上清加入1 mL 50%Ni-NTA树脂。将结合有目的蛋白的Ni-NTA树脂装柱。用不同浓度的咪唑漂洗液(10、 20、 50、 100、 250、500 mmol/L)选择漂洗条件。最终用500 mmol/L咪唑溶液洗脱目的蛋白。利用Ni-NTA树脂进行纯化,用高浓度的咪唑溶液洗脱,收集不同时间组分发现,第1次洗脱的蛋白产量较高,但所含杂志较多,第2次洗脱后SDS-PAGE胶显示在55 ku处有一条明显的条带,但仍有少量杂质,第3次则很少收到蛋白质,因而选择二次洗脱,浓缩后500 mmol/L咪唑洗脱液中蛋白V浓度约1.4 mg/mL, 纯度约80%。见图4。
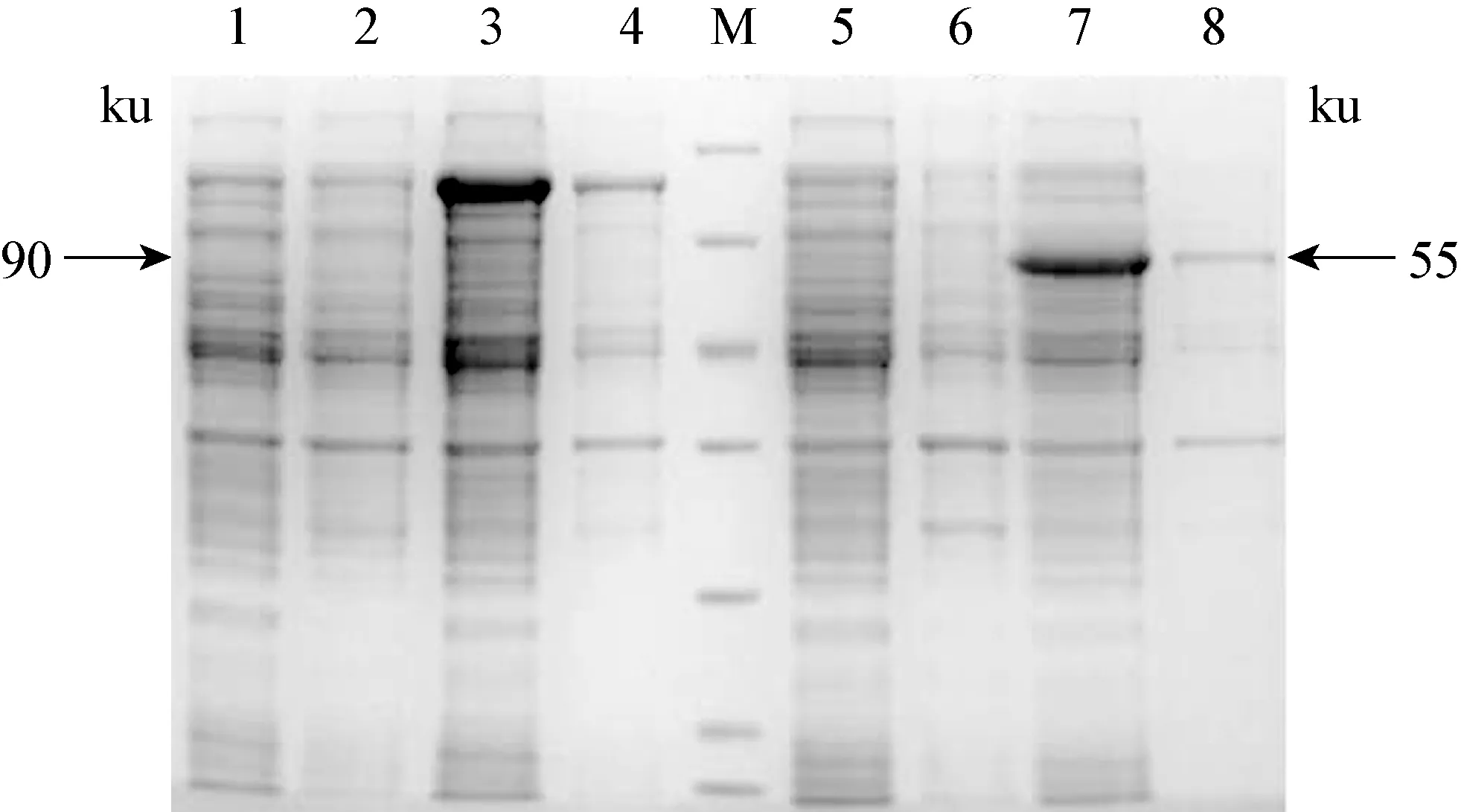
图3 蛋白质电泳结果
M: 非预染蛋白分子量标准,从上到下分别是116、 66.2,45、 35、 25、 18.4、 14.4 kD; 1~4: BL21(pET32a-P) 分别为未诱导前上清、沉淀和0.1 mmol/L IPTG诱导后上清、沉淀; 5~8:BL21(pET32a-RV) 分别为未诱导前上清、沉淀和1 mmol/LIPTG诱导后上清、沉淀
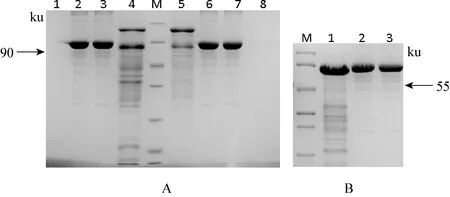
图4 蛋白纯化电泳结果
A M: 非预染蛋白分子量标准, 从上到下分别是 116、 66.2、 45、 35、 25、 18.4、 14.4 ku; 1,8:分别为浓缩滤液; 2,6: 1mg/mL BSA3; 7: 0.8 mg/mL BSA: 3: 50 mmol/L咪唑洗脱液浓缩 5: 500-1mmol/L咪唑洗脱液浓缩 B M:中分子量蛋白Marker,从上到下依次为90、 66、 45、 35、 29、 20、 14.4 Ku; 1: V蛋白; 2,3: 分别为1.2, 1 mg/mL BSA标准品
2.5 表达产物的SDS-PAGE和Western Blot检测 收集培养物,纯化重组蛋白进行Western Blot 鉴定,抗体为抗6X His 单克隆抗体,表明融合基因在E.coliBL21(DE3)中正确表达,通过间接法分析融合蛋白的表达可见P/V基因在表达,表达产物的分子质量约为90 ku 及55 ku,P/V蛋白抗6His(祖蛋白)标鉴蛋白的单抗进行检测,检测出特异性条带(图5A)。P/V纯化蛋白免疫的兔血清,经抗体为HRP标记的山羊抗兔血清检测出大小在90 ku 及55 ku的相应蛋白,表明P/V两种蛋白在细胞中均得到正确表达,并能被表达的重组蛋白识别,初步具备了生物学活性。

图5 融合蛋白的Western Blot检测
A: 融合蛋白的P/V基因两次纯化后的重组蛋白鉴定;B: 两次纯化的融合蛋白P/V免疫兔子后制备血清抗体的Western Blot检测
3 讨论
小反刍兽疫病毒属麻疹病毒科的一个成员,P基因编码-含507个氨基酸、分子量为55 ku的蛋白。这样的分子量远比根据聚丙烯酰胺凝胶电泳估计的75 ku,这是因为在P蛋白合成后,大量的磷酸盐残基加到蛋白上,造成蛋白的异常迁移[10]。V蛋白是mRNA转录过程中由加到其751位点的额外G残基合成的,加上残基就导致了原阅读框的改变,新形成的ORF比先前的短,编码一个含299个氨基酸、C端富含半胱氨酸、N端序列与P蛋白N端相同的蛋白V。对麻疹病毒的研究中,研究人员发现,病毒的体内感染能导致先天免疫的尚失,深入的研究表明,麻疹病毒V蛋白通过与mda-5结合从而阻止干扰素的产生,通过反向遗传技术将C基因突变而V基因仍然表达的毒株能诱导更高水平的干扰素,表明基因在干扰素抑制过程中起到重要作用[6-7]。本次通过原核表达的两种融合蛋白一个大小为90 ku,另一个大小55 ku,均比预期的蛋白偏大,非结构蛋白V预计大小为35 ku左右,结果表明,该蛋白也存在一定的修饰加工,由于经磷酸化基因编辑而来,存在磷酸化效应。
结构蛋白P及其编码的非结构的表达,本研究采用两种方式得到所研究的非结构蛋白,一种方式是通过定点突变得到编码完整读码框的非结构蛋白P,然后与含报告基因的真核表达质粒pEGFP-N2连接,经测序验证后转染研究所需的细胞,本研究中构建后的载体通过脂质体转染Vero细胞,利用荧光蛋白的细胞定位可观察到这两种尚未充分研究的蛋白的亚细胞定位,本研究中磷酸化蛋白及其编码的非结构蛋白V均定位于胞浆内,这种定位方式也与预期一致,由于RNA病毒不进入细胞核复制,因此,即使负责与核蛋白结合并使后者处于可溶状态,增强核蛋白转录效率的磷酸化蛋白,其在胞内定位均位于胞浆内,而非结构蛋白也只在胞浆内进行表达。
病毒的结构蛋白在原核表达系统中多以包涵体形式存在,尤其是对于分子质量较大的蛋白,可溶性表达的几率很低,本研究表明,小反刍兽疫磷酸化基因P及非结构蛋白V在细菌BL21中能得到高效表达,并可用镍柱高效纯化。纯化蛋白免疫兔子后,免疫血清能被纯化的蛋白识别,表明蛋白具有生物学活性,血清中和实验则表明两种蛋白均不能产生中和抗体,这与现有文献报道相一致,这也为更多蛋白功能研究奠定了基础。
[1] Li J, Li L, Wu X,etal. Diagnosis of Peste des Petits Ruminants in Wild and Domestic Animals in Xinjiang, China, 2013-2016[J]. Transboundary & Emerging Diseases, 2017.
[2] Shaila M S, Shamaki D, Forsyth M A,etal. Geographic distribution and epidemiology of peste des petits ruminants viruses[J]. Virus Res, 1996,43:149-153.
[3] Wang Z, Bao J, Wu X,etal. Peste des petits ruminants virus in Tibet, China[J]. Emerg Infect Dis, 2009, 15(2): 299-301.
[4] Muthuchelvan D, Sanyal A, Sarkar J,etal. Comparative nucleotide sequence analysis of the phosphoprotein gene of peste des petits ruminants vaccine virus of Indian origin[J]. Res Vet Sci, 2006, 81(1):158-164.
[5] Devaux P, Cattaneo R. Measles virus phosphoprotein gene products: conformational flexibility of the P/V protein amino-terminal domain and C protein infectivity factor function[J]. J Virol, 2004, 78(21):11 632-11 640.
[6] Young D F, Didcock L, Goodbourn S,etal. Paramyxoviridae use distinct virus-specific mechanisms to circumvent the interferon response[J]. Virology, 2000, 269(2):383-390.
[7] Nanda S K, Baron M D. Rinderpest virus blocks type I and type II interferon action: role of structural and nonstructural proteins[J]. J Virol, 2006, 80(15):7 555-7 568.
ExpressionofP/VGeneofPestedesPetitsRuminantsVirusandtheStudiesoftheBiologicalCharacteristics
YAN Huan1,2, MA Yu-xin1,2, XIN Ai-guo1, GAO Hua-feng1
(1. Yunnan Tropical and Subtropical Animal Viral Disease Laboratory, Kunming 650224, China;2. College of Veterinary Medicine,Yunnan Agricultural University, Kunming 650201, China)
The P/V gene fragment of peste des petits ruminants vaccine strain N75/1 was amplified by PCR from cDNA library, and the purified products were cloned into pMD19-T vector. Confirmed with enzyme digestion and sequence analysis, P and V gene was subcloned into vector pEGFP-N2 and pET32a. The eukaryotic expression vector with p/v gene was constructured and finally named pEGFP-P,and pEGFP-RV, respectively. The recombinant plasmid with P/V gene and the empty vector control was transfected into Vero cells and the cells were selected with G418. The PPRV P gene was expressed only in cytoplasm. Prokaryotic Expression vector of pET32a with P/V gene was constructed and named as pET32a-P and pET32a-RV respectively. The fusion protein was induced by IPTG with the final titer 1.0 mmol/L at 37℃. Fusion protein mainly expressed in the supernatant was purified with NI-NTA spin with 500 mmol/L imidazole twice and used to immunize the rabbits to prepare polyclonal antibodies. The results showed that the molecular weight of recombinant protein was about 90ku and 55ku.The antiserum of rabbits analyzed by western blotting showed that the bands at 90ku and 55ku molecular weights were detected. It shows that the two purified proteins have biological functions.
Peste des petits ruminants virus ; P/V protein ; cellar location ; expression
GAO Hua-feng
S855.3
A
0529-6005(2017)08-0003-04
2017-01-18
国家自然科学基金项目(31160499)
严欢(1993-),女,硕士,主要从事动物病毒学研究,E-mail:huanzai920@sina.com
高华峰,E-mail:kmghf@hotmail.com
