海藻糖、山梨糖醇、柠檬酸钠对大黄花鱼肌原蛋白抗冷冻变性的影响
2017-10-16,,,,
, , , ,
(锦州医科大学食品科学与工程学院,辽宁锦州 121000)
海藻糖、山梨糖醇、柠檬酸钠对大黄花鱼肌原蛋白抗冷冻变性的影响
王宁,李亮,李敏,齐文,尚宏丽*
(锦州医科大学食品科学与工程学院,辽宁锦州121000)
以大黄花鱼为实验材料,将海藻糖、山梨糖醇、柠檬酸钠组成不同的混合抗冻剂,比较添加不同抗冻剂时冻藏各阶段的大黄花鱼肉的硬度和持水性以及大黄花鱼肌原蛋白盐溶性、Ca2+-ATPase活性、巯基含量、总巯基含量、表面疏水性的变化规律,并在冻藏35 d后进行SDS-PAGE凝胶电泳,分析不同抗冻剂下鱼糜蛋白的变性程度。结果表明,不同抗冻剂均能抑制大黄花鱼蛋白的冷冻变性,海藻糖、山梨糖醇、柠檬酸钠三者的混合对大黄花鱼肌原蛋白抗冷冻变性效果优于山梨糖醇、柠檬酸钠混合抗冻剂和海藻糖的单独使用。加入海藻糖、山梨糖醇、柠檬酸钠混合抗冻剂的鱼肉品质下降较慢,肌原蛋白理化特性较稳定且其鱼肉蛋白结构变化缓慢。
海藻糖,山梨糖醇,柠檬酸钠,抗冷冻变性
Abstract:The experiment was carried out with large yellow croaker,making trehalose,sorbitol and sodium into different mixed antifreezing agents and then compare the large yellow croaker’s hardness and water holding capacity and soluble protein,Ca2+-ATPase’s activity,sulfhydryl content,total sulfhydryl content,variation regularity of surface hydrophobicity. In addition,SDS-PAGE gel electrophoresis was performed after frozen storage of 35 d and then the degree of denaturation of surimi protein under different antifreeze agents was analyzed. The results showed that different cryoprotectants could inhibit the protein denaturation of large yellow croaker. Mixed trehalose,sorbitol,sodium citrate three anti freeze denaturation was better than sorbitol,sodium citrate used alone on large yellow croaker myofibrillar protein. The quality of fish meat was decreased slowly with the addition of trehalose,sorbitol and sodium citrate. The physicochemical properties of the protein were stable and the structure of fish protein changed slowly.
Keywords:trehalose;sorbitol;sodium citrate;anti-freeze denaturation
黄花鱼又名黄鱼,由于其肉质鲜嫩、营养丰富并含有丰富的微量矿物元素,促进人体代谢,延缓衰老,对各种癌症有预防功效,富含氨基酸具有防止动脉硬化、健脾开胃等多种保健功效,因此成为我国人民喜爱的食用鱼类之一[1-2]。冷冻保藏可以最大限度地保持水产品的营养价值[3],黄花鱼肉多以冰鲜方式流通于市场,但由于在冻藏过程中,鱼肉蛋白质容易发生冷冻变性,导致鱼肉品质下降以及肌原蛋白功能性降低,如鱼肉硬度的下降,持水性、胶凝性、Ca2+-ATPase活性、巯基含量的降低,表面疏水性的升高等,营养价值大幅下降以至于发生腐败变质而无法食用,造成大范围的浪费和经济损失。因此如何在冻藏过程中延缓其肉制品的品质下降,最大程度地保持其食用价值,是极有意义的研究。
目前为止,专家学者对很多的抗冷冻变性剂都进行了研究,其中磷酸盐、海藻糖、变性淀粉、山梨糖醇、柠檬酸钠等都已成功地应用于肉制品的持水和肉蛋白的抗冷冻变性中[4-9]。蒙健宗等人研究发现海藻糖可有效防止罗非鱼片在冷冻过程中的蛋白质变性[10],李勤等人研究发现海藻糖可以提高冷冻猪肉持水性及改善冷冻猪肉品质[11]。闫晓蕾研究发现山梨糖醇可提高发酵香肠持水性[12],朱圣刚等人研究发现山梨糖醇可以改善肉糜品质[13],邹明辉研究发现山梨醇影响蛋白的冷冻变性[14]。李莎莎等人研究发现柠檬酸钠可提高冷冻鱼糜持水性[15],胡铁军等人研究发现柠檬酸钠有利于重组牛肉的持水性[16]。从以上的多个研究可以看出,海藻糖、山梨糖醇、柠檬酸钠三者对于肉类贮藏都有着相类似的作用,有助于提高鱼肉持水性,保持鱼肉品质,延缓鱼肉肌原蛋白的冷冻变性。
本文以大黄花鱼为研究对象,将海藻糖、山梨糖醇、柠檬酸钠三种抗冻剂进行配比形成不同的抗冻剂。首先进行持水性测定和质构硬度测定来研究鱼肉品质变化;然后对大黄花鱼进行肌原蛋白盐溶性、Ca2+-ATPase活性、巯基含量和总巯基含量等肌原蛋白理化特性方面的测定;最后进行表面疏水性的测定,并进行SDS-PAGE凝胶电泳分析不同抗冻剂下蛋白的变性程度。通过参数测定和数据分析,来观测不同抗冻剂对大黄花鱼肌原蛋白抗冷冻变性的影响。
1 材料与方法
1.1 材料与仪器
大黄花鱼 购于锦州海鲜市场;海藻糖 食品级,德州汇洋生物科技有限公司;山梨糖醇 食品级,武汉万荣生物科技有限公司;柠檬酸钠 分析纯,郑州超凡化工有限公司。
BSM型分析天平 上海卓精电子科技有限公司;TMS-PRO型质构仪 北京盈盛恒泰科技有限责任公司;GL-21M型高速冷冻离心机 湖南湘仪实验室仪器开发有限公司。
1.2 实验设计
1.2.1 样品的制备及实验参数设计 把新鲜的大黄花鱼进行活杀,去鳞,去内脏,去皮,清洗,沥干等前处理。将处理后的大黄花鱼肉分为四组,每组50 g,分别添加100 mL蒸馏水做空白对照组,100 mL的10%(W/V)海藻糖,100 mL质量比为1∶1的10%(W/V)山梨糖醇和柠檬酸钠混合液,100 mL质量比为1∶1∶1的10%(W/V)海藻糖、山梨糖醇、柠檬酸钠混合液。立即将四组加入不同抗冻剂的鱼肉置于-18 ℃恒温冻藏35 d,在0、7、14、21、28、35 d六个冻藏阶段分别取样测定其硬度及持水性。
取一定质量的大黄花鱼,加10倍体积20 mmoL Tris-maleate缓冲液(50 mmol KCl-20 mmol Tris-maleate,pH7),充分匀浆1 min,离心10 min(9000×g,4 ℃),弃去上清液,重复洗涤2次。在沉淀中加入Tris-maleate 缓冲液(0.6 mol KCl-20 mmol Tris-maleate,pH7),充分匀浆1 min后在4 ℃提取盐溶性蛋白质60 min,低温离心30 min(9000×g,4 ℃),所得即为实验用肌原蛋白溶液[17]。将所得肌原蛋白溶液等分为四组,每组200 mL,按照四组大黄花鱼肉添加抗冻剂的方法给四组肌原蛋白溶液添加抗冻剂。立即将四组加入不同抗冻剂的大黄花鱼肌原蛋白溶液置于-18 ℃恒温冻藏35 d,在0、7、14、21、28、35 d六个冻藏阶段分别取样测定其蛋白盐溶性、Ca2+-ATPase活性、巯基含量、总巯基含量、表面疏水性。
1.2.2 大黄花鱼肉持水性和硬度的测定 鱼肉的持水性以压出水分来表示。大黄花鱼肉的持水性按下式计算:
式中,W1为鱼肉质量、W2为除水后的质量、w为大黄花鱼肉水分含量,以79%[18]计。每个冻藏阶段重复测量3次取均值,作为每阶段的持水性指标。
使用质构仪测定大黄花鱼肉的硬度,每个冻藏阶段做6次平行测定,使用质构仪配套的数据处理软件对数据进行处理显示。以此来对空白对照组和加入不同抗冻剂的三组样品的硬度进行统计对比。
1.2.3 盐溶性蛋白含量的测定 从四组肌原蛋白溶液中各取等量样品,每组都加入2倍体积(g∶mL)的0.1 mol/L pH7.0磷酸盐缓冲液,4 ℃下10000 r/min离心20 min后收集上清液即为盐溶性蛋白。再采用凯氏定氮法[19]分别测定四组溶液在不同冻藏阶段的蛋白含量。
1.2.4 肌原蛋白Ca2+-ATPase活性的测定 参考万建荣等[20]的方法测定四组肌原蛋白溶液的肌原蛋白Ca2+-ATPase活性。每组溶液的每个冻藏阶段各做3次测定取平均值。
1.2.5 肌原蛋白的活性巯基和活性总巯基含量的测定 参考Suvanich[21]的方法制备反应混合液,在不同的条件下对反应混合液进行测定便可以得到疏基含量和总疏基含量。总疏基含量的测定是在波长412 nm处测定吸光度,摩尔吸光系数为13600 mol·cm/L,而疏基含量的测定是将反应混合液在不存在尿素的情况下4 ℃反应1 h,再进行测定。按以下公式计算疏基含量和总疏基含量:-SH=A×D/ε·C。式中-SH表示不同条件下测定的总疏基含量和疏基含量,单位为mol/g,A表示吸光度,D表示稀释倍数,ε表示分子吸光系数,C表示蛋白质浓度mg/mL。每个冻藏阶段的样品做4次测定,并取其平均值作为最后的疏基含量指标。
1.2.6 肌原蛋白的表面疏水性的测定 表面疏水性测定参考Benjakul等[22]的方法。以荧光吸收值为横坐标,蛋白浓度为纵坐标作图,以该曲线初始阶段的斜率作为肌原蛋白的表面疏水性指数。
1.2.7 SDS-PAGE凝胶电泳 称取四组抗冻剂处理过鱼肉各2 g,切碎后加入5%的SDS溶液(W/V=1∶9),用高速分散器匀浆1 min,匀浆液置于85 ℃水浴锅中保温1 h以充分溶液蛋白质,之后将浆液在10000 r/m 下离心10 min,去除不溶部分。取上清液与样品缓冲液(pH6.8,1 mol/L的Tris-HCl,10%的SDS,50%的甘油,10%的β-巯基乙醇,1%的溴酚蓝)按照1∶1混合,沸水浴4 min。参照Laemmli[23]的方法,采用垂直板电泳,上样量为10 μL,5%的浓缩胶和10%的分离胶,进行100 V恒压电泳。电泳后凝胶用0.1%的考马斯亮蓝染色,用10%甲醇和10%冰醋酸的混合液脱色,最后在扫描仪上扫描成像。
1.3 数据分析
每组数据记录作图均采用Origin 8.0、所有数据用SPSS 19.0进行统计分析,显著性水平设置为p<0.05。
2 结果与分析
2.1 冻藏过程中大黄花鱼肉的持水性
鱼肉持水性的降低,会使鱼肉嫩度差、口感粗糙、肉质较硬,可接受程度降低。如图1所示,四组样品的持水性均呈现下降趋势,其中空白对照组持水性下降幅度最大,但是空白对照组和山梨糖醇与柠檬酸钠混合组组间变化差异不显著(p>0.05),海藻糖、山梨糖醇、柠檬酸钠混合组大黄花鱼肉的持水性下降率显著低于其他3组(p<0.05)。Siddaiah等认为鱼肉蛋白质冷冻变性导致肌肉持水性下降[24]。Farouk等指出冻藏时肌肉中蛋白质变性使肌球蛋白与肌动蛋白的结合增加,引起肌原收缩,从而引起肌肉持水性的下降[25],即随着冻藏时间的增长,鱼肉的汁液流失率会持续增加,持水性不断降低。海藻糖具有较好吸湿性能,山梨糖醇不含醛基,不易被氧化,同时也具有保湿性有关[26],这样双重保护,有利于大黄花鱼肉制品持水作用。因此海藻糖、山梨糖醇、柠檬酸钠混合液组成的抗冻剂有更好的抗冷冻变性效果,使大黄花样品具有更好的持水性。
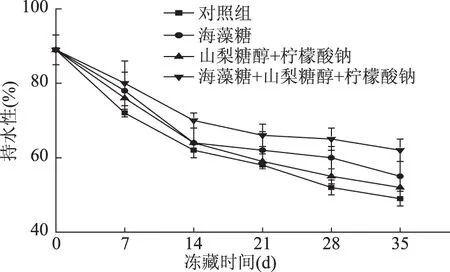
图1 冻藏过程中大黄花鱼肉的持水性变化曲线Fig.1 Water retention curve of large yellow croaker meat during frozen storage
2.2 冻藏过程中大黄花鱼肉硬度变化
在冻藏的不同阶段,大黄鱼硬度变化曲线如图2所示。在冻藏的14 d里,大黄花鱼肉的硬度下降很快,之后下降较为平缓。空白对照组的初始硬度为1800 N,14 d时为1202 N,而在冻藏35 d后硬度降至970 N,下降了46%;海藻糖组的样品硬度则由1800 N降至1188 N,下降了34%;山梨糖醇和柠檬酸钠混合组的硬度下降了39%;海藻糖、山梨糖醇和柠檬酸钠混合组的硬度下降了22%。总体看来,后三组的硬度下降率低于空白对照组,且海藻糖、山梨糖醇和柠檬酸钠混合组的硬度下降率显著低于海藻糖组和山梨糖醇与柠檬酸钠混合组(p<0.05)。
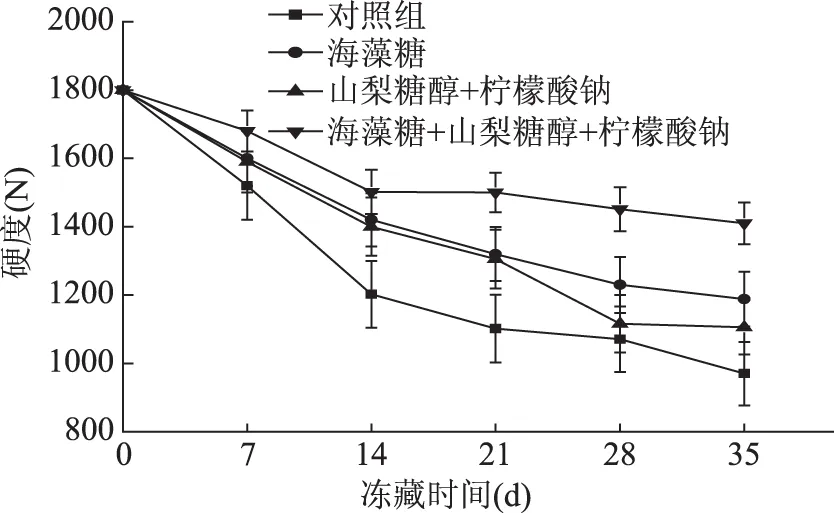
图2 冻藏过程中大黄花鱼肉硬度变化曲线Fig.2 Meat hardness curve of large yellow croaker meat during frozen storage
冻藏过程中鱼肉持水性与硬度存在相关关系,当鱼肉持水性越低时,其硬度越小,即质地越软。由图1、图2可说明,在冷冻贮藏过程中,大黄花鱼肉硬度和持水性的变化有着相似的趋势。表明在冻藏过程中加入海藻糖、山梨糖醇和柠檬酸钠混合抗冻剂的大黄花鱼肉的持水性较好,硬度下降最平缓,即海藻糖、山梨糖醇和柠檬酸钠混合抗冻剂的效果最优。
2.3 冻藏过程大黄花鱼盐溶性蛋白含量变化
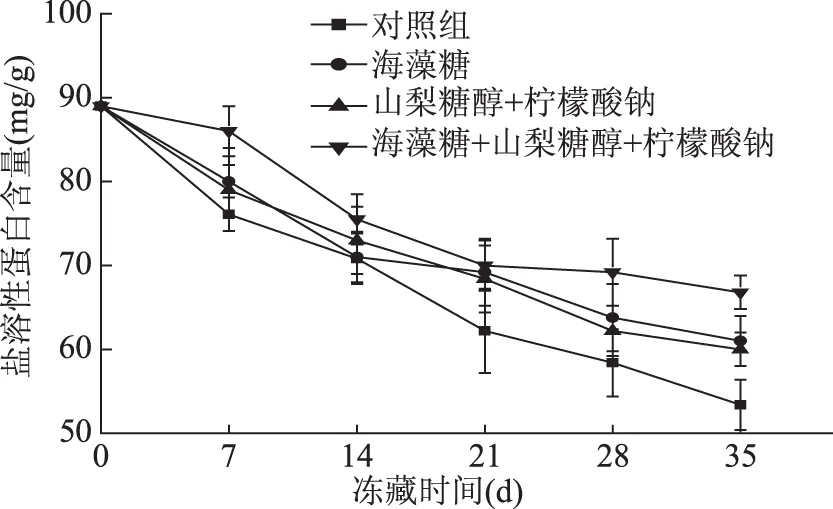
图3 冻藏过程中盐溶性蛋白含量变化曲线Fig.3 Salt-soluble protein content changing curve during frozen storage
如图3所示,在冻藏开始阶段,空白对照组的盐溶性蛋白含量下降迅速,7 d后盐溶性蛋白下降到76.1%,之后下降速度减缓,35 d后下降至53.4%,表现为较明显的两端变性模式。加入海藻糖的肌原蛋白样品中的盐溶性蛋白含量在冻藏7 d后下降为80.1%,35 d后下降为61.2%。加入山梨糖醇和柠檬酸钠混合溶液的肌原蛋白样品中的盐溶性蛋白含量在冻藏7 d后为79.0%,冻藏35 d后的盐溶性蛋白含量为60.0%。加入海藻糖、山梨糖醇和柠檬酸钠混合抗冻剂的肌原蛋白样品中的盐溶性蛋白含量在冻藏7 d后为86.1%,21 d后的盐溶性蛋白含量为70.7%,35 d后为66.8%。经显著性分析可知,经过三种不同抗冻剂处理的三组肌原蛋白盐溶性含量下降率低于空白对照组。在冻藏35 d后三组加入不同抗冻剂的肌原蛋白样品的盐溶性蛋白含量比对照组分别提高8.5%、6.4%和15.1%,但空白对照组与山梨糖醇和柠檬酸钠混合组组间差异不显著(p>0.05),加入海藻糖、山梨糖醇和柠檬酸钠混合液的肌原蛋白样品中的盐溶性蛋白含量下降率显著低于其他三组(p<0.05)。鱼肉主要组分为肌原蛋白,在冻藏中其氢键、疏水作用、二硫键、盐键的形成常会导致蛋白质盐溶性的下降[27]。随着冻藏的进行,鱼肉肌原蛋白会出现蛋白聚集析出的现象,导致肌原蛋白盐溶性含量下降。鲁耀彬等[28]人研究葡聚糖延缓草鱼肌原蛋白冷冻变性的机理分析中阐明,糖类抗冻剂的添加可以减缓肌原蛋白冻藏过程中盐溶性蛋白含量的下降程度。以上分析可以得出,三种抗冻剂都延缓了冻藏过程中肌原蛋白盐溶性含量的下降,但海藻糖、山梨糖醇和柠檬酸钠混合抗冻剂延缓大黄花鱼肌原蛋白盐溶性下降的效果优于海藻糖更优于山梨糖醇和柠檬酸钠混合抗冻剂。
2.4 冻藏过程中大黄花鱼肌原蛋白Ca2+-ATPase活性变化
大黄花鱼肌原蛋白Ca2+-ATPase活性的变化如图4所示。冻藏开始时,四组样品的肌原蛋白Ca2+-ATPase活性下降迅速,冻藏14 d后,下降速度变缓,35 d后,对照组的肌原蛋白Ca2+-ATPase活性由0.45 μmol(pi)·mg-1·min-1下降到0.19 μmol(pi)·mg-1·min-1,下降率为57.8%。而其他三组的肌原蛋白溶液的Ca2+-ATPase活性降低速度受到抗冻剂不同程度的抑制,三组样品的肌原蛋白Ca2+-ATPase活性分别由0.45 μmol(pi)·mg-1·min-1下降为0.22、0.21、0.28 μmol(pi)·mg-1·min-1,下降率分别为51.1%、53.3%、37.8%,相对于对照组另三组肌原蛋白Ca2+-ATPase活性分别少下降了6.3%、4.5%和20%。经过比较知海藻糖组和海藻糖、山梨糖醇和柠檬酸钠混合组的样品肌原蛋白Ca2+-ATPase活性下降率显著低于空白对照组(p<0.05),海藻糖组相对海藻糖、山梨糖醇和柠檬酸钠混合组变化也显著(p<0.05)。肌原蛋白是鱼肉的主要成分。在ATP的存在下生成肌动球蛋白,肌球蛋白可以分解ATP的酶活性,在蛋白质发生变性时,将导致酶活性的降低或者消失。那么Ca2+-ATPase活性值越高,说明鱼肉蛋白质性质越稳定,变性程度越小[29]。结合数据分析可知,海藻糖、山梨糖醇和柠檬酸钠混合液比海藻糖单独使用时在抑制肌原蛋白Ca2+-ATPase活性的降低方面有更为显著的效果。
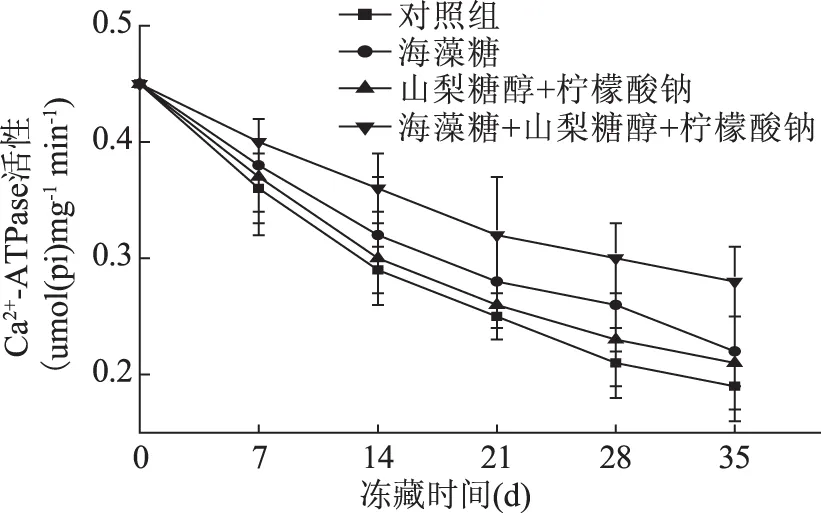
图4 冻藏过程中肌原蛋白Ca2+-ATPase活性变化曲线Fig.4 Myofibrillar protein Ca2+-ATPase activity curve during frozen storage
2.5 冻藏过程中大黄花鱼肌原蛋白活性巯基含量和活性总巯基含量变化
肌原蛋白活性疏基影响大黄花鱼的肌原蛋白结构。随着冻藏的进行,活性疏基含量不断下降。如图5所示,14 d时加入不同抗冻剂的四组肌原蛋白溶液的活性疏基含量分别从5.8×10-5mol·g-1下降到4.4×10-5、4.6×10-5、4.5×10-5、5.2×10-5mol·g-1,下降率为24.1%、20.6%、22.4%、10.3%;冻藏35 d时,分别下降到3.1×10-5、3.9×10-5、3.7×10-5、4.6×10-5mol·g-1,下降率为46.6%、32.8%、38.9%和20.7%,如图5所示。空白对照组和山梨糖醇和柠檬酸钠混合组间变化差异不显著(p>0.05),海藻糖、山梨糖醇和柠檬酸钠混合组的蛋白活性疏基含量下降率显著低于空白对照组、海藻糖组和山梨糖醇与柠檬酸钠混合组(p<0.05)。通过对比分析可知,经海藻糖、山梨糖醇和柠檬酸钠混合液处理过的大黄花鱼肉的肌原蛋白活性疏基含量下降率更低。

图5 冻藏过程中肌原蛋白巯基含量变化曲线Fig.5 Myofibrillar protein thiol content curve during frozen storage
随着冻藏时间的延长,活性总疏基含量和疏基含量有相似变化趋势,冻藏7 d后,四组样品的总疏基含量分别从8.4×10-5mol·g-1降低到7.6×10-5、7.8×10-5、7.8×10-5、8.0×10-5mol·g-1。冻藏35 d后,总疏基含量分别为5.8×10-5、6.6×10-5、6.5×10-5和7.3×10-5mol·g-1,下降率分别为31%、21.4%、22.6%、13.1%。如图6所示,空白对照组的活性总疏基含量下降幅度最大,海藻糖组与海藻糖、山梨糖醇、柠檬酸钠混合组对比于空白对照组和山梨糖醇、柠檬酸钠混合组的活性总疏基含量组间差异性显著(p<0.05),但海藻糖组和海藻糖、山梨糖醇、柠檬酸钠混合组的活性总疏基差异性不显著(p>0.05)。在图6中可以看出,14 d后,海藻糖、山梨糖醇和柠檬酸钠混合组抑制活性总疏基下降能力强于海藻糖组,海藻糖、山梨糖醇和柠檬酸钠混合组处理过的大黄花鱼肉的肌原蛋白活性总疏基下降最少。
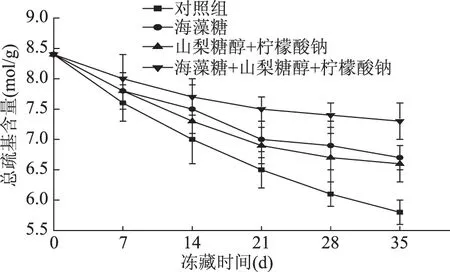
图6 冻藏过程中肌原蛋白总巯基含量变化曲线Fig.6 Total myofibrillar protein thiol content curve during frozen storage
以上两组数据及显著性分析表明,三种抗冻剂对鱼肉肌原蛋白活性疏基和总疏基含量的下降都有抑制效果,但海藻糖、山梨糖醇和柠檬酸钠混合抗冻剂的效果更佳。
2.6 冻藏过程中大黄花鱼肌原蛋白表面疏水性变化
如图7所示,对照组蛋白表面疏水性在冻藏过程中逐渐增加,而添加了不同抗冻剂的三组样品表面疏水性虽也逐渐增加,但比空白对照组上升缓慢。第35 d时,空白对照组的表面疏水性从冻藏前的135上升到183;海藻糖组的表面疏水性值升为178;山梨糖醇、柠檬酸钠混合组的表面疏水性值升为182,而海藻糖、山梨糖醇和柠檬酸钠混合组表面疏水性升为163。表面疏水性上升率分别为35.6%、31.8%、34.8%、20.7%,至35 d实验结束后,三组添加了不同抗冻剂样品的肌原蛋白表面疏水性比对照组分别下降3.8、0.8、14.9个百分点。通过计算知后三组表面疏水性上升率显著低于空白对照组(p<0.05),海藻糖、山梨糖醇和柠檬酸钠混合组与前三组组间变化差异性显著(p<0.05)。海藻糖、山梨糖醇和柠檬酸钠混合组抑制疏水性上升的能力要强于中间两组。蛋白质的表面疏水作用反映了蛋白质表面疏水残基的数量和蛋白质聚集的情况。通常情况下,蛋白质分子由内到外,疏水残基逐渐减少。特别在冻藏过程中,蛋白质的持水性降低,蛋白质分子疏水侧链聚集。三种不同的抗冻剂在不同程度下延缓了大黄花鱼肌原蛋白表面疏水性的增加,但通过数据显著性分析得知海藻糖、山梨糖醇和柠檬酸钠混合抗冻剂较于海藻糖或者山梨糖醇和柠檬酸钠混合液能更显著地延缓肌原蛋白表面疏水性的增加。
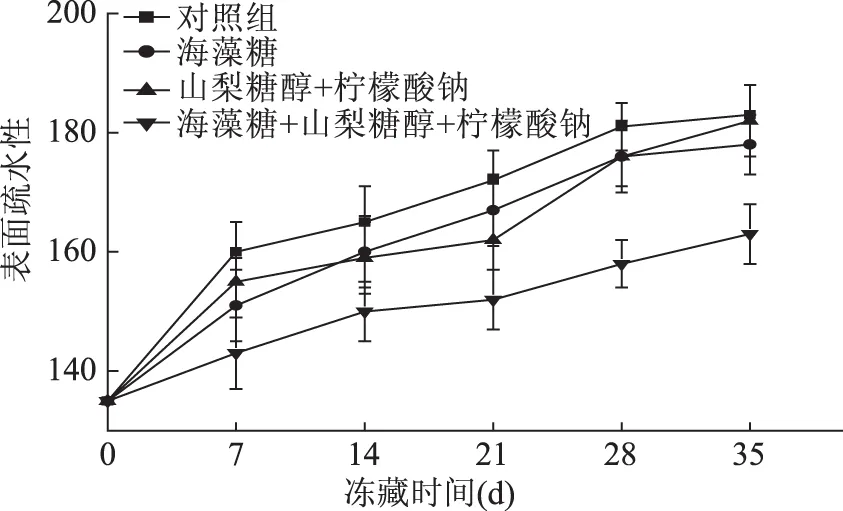
图7 冻藏过程中肌原蛋白表面疏水性变化曲线Fig.7 Myofibrillar protein surface hydrophobicity curve during frozen storage
2.7 SDS-PAGE凝胶电泳分析
鱼类肌肉蛋白质根据其构成,一般分为肌原蛋白质、肌浆蛋白质、肌基质蛋白质和异质组织蛋白质。在鱼糜肌原蛋白中75%的是肌球蛋白和肌动蛋白,其余是由原肌球蛋白、肌钙蛋白和各类微量调节蛋白组成。肌球蛋白重链(由肌球蛋白和肌动蛋白组成)是与鱼糜凝胶化相关的重要蛋白质[30]。本实验采用以黄花鱼为原料进行了SDS-PAGE电泳。从图8可以看出,泳道3、4、5的肌球蛋白重链(MHC)条带均比泳道2深粗,说明添加了抗冻剂能够抑制鱼糜凝胶的肌球蛋白重链浓度的降低,且泳道2新生的小分子形式蛋白也比其他组多,说明冻藏过程中发生了蛋白质的降解现象,抗冻剂的添加不同程度地减少了蛋白质的降解。泳道3、泳道5的肌球蛋白重链差别不明显,表明两种抗冻剂组在冻藏过程中均较好的保护了鱼糜蛋白,肌动蛋白(Actin)的含量较泳道4并没有出现明显的变化。由以上结论可以得出,海藻糖对蛋白质有较好保护效果,抑制蛋白质的降解,减轻对蛋白质结构的破坏。山梨糖醇和柠檬酸钠对蛋白质也有一定的保护作用。
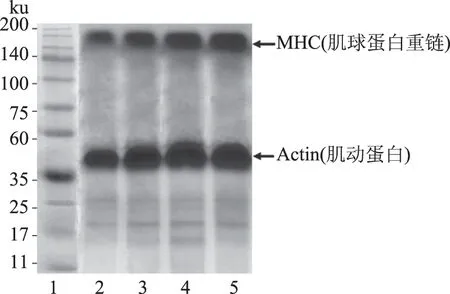
图8 鱼糜凝胶的SDS-PAGE电泳图Fig.8 SDS-PAGE pattern of surimi gels from silver carp注:1-标准蛋白;2-无抗冻剂冻藏35 d后的鱼肌原蛋白;3-添加海藻糖冻藏35 d后的鱼肌原蛋白;4-添加山梨糖醇和柠檬酸钠冻藏35 d后的鱼肌原蛋白;5-添加海藻糖、山梨糖醇和柠檬酸钠冻藏35 d后的鱼肌原蛋白。
3 结论
冻藏过程中,海藻糖、山梨糖醇和柠檬酸钠的三组组合都有延缓大黄花鱼肌原蛋白的冷冻变性的作用,其作用大小排列为:海藻糖、山梨糖醇和柠檬酸钠混合液>海藻糖>山梨糖醇和柠檬酸钠混合液。实验数据表明三种抗冻剂中海藻糖、山梨糖醇和柠檬酸钠三者混合液是更有效的大黄花鱼肌原蛋白抗冷冻变性剂。但通过三组不同抗冻剂与空白对照组的分析对比,可知海藻糖是抗冻剂的主要成分,即海藻糖在抗蛋白冷冻变性中起到关键的作用。但在海藻糖中加入其他辅助抗冻剂,比如山梨糖醇、柠檬酸钠等进行复合配比,则可以进一步加大其抗冷冻变性的效果。本实验中仍需要对不同抗冻剂进行深入研究,可以测定更多参数,以寻求大黄花鱼肌原蛋白抗冷冻变性的最佳效果,并且可以将抗冷冻变性效果最好的抗冻剂应用到其他食品的冷藏保鲜中,以提高食品储藏率,在淡水鱼及相关制品的冷冻贮藏中的应用前景十分广阔。
[1]陈成进.人工养殖大黄鱼主要生长特征观察[J].现代渔业信息,2011,26(3):24-25.
[2]吴靖娜,许永安,刘智禹. 养殖大黄鱼鱼肉营养成分的分析及评价[J]. 营养学报,2013(6):610-612.
[3]胡晓亮,王易芬,郑晓伟,等. 抗冻剂在水产品冻藏中的应用研究[J].中国农学通报,2015,35(31):38-42.
[4]张艳,王圣开. 鱼肉蛋白质冷冻变性及抗冻剂的研究进展[J]. 肉类研究,2008(12):11-14.
[5]Porazogluo,Ertasah. Effect of sodium tripolyphosphate on some physical,chemical and sensorial properties of hamburgers[J]. Turkish Journal of Agriculture and Forestry,1997,21(3):289-293.
[6]马玲. 不同浓度卡拉胶对猪肉品质影响的研究[J]. 肉类工业,2012(9):35-37.
[7]吴立根,王岸娜. 复合变性淀粉提高鸡胸肉保水率的研究[J]. 食品与机械,2006,22(3):25-26.
[8]钟玉虎,郇延军,陈妹,等. 山梨醇对咸肉制品品质的影响[J]. 食品工业科技,2013,34(11):290-293.
[9]李雪姣,马悦培,谌徽,等. 无磷酸盐制剂对牛肉嫩度和保水性的影响[J]. 食品工业科技,2010,31(3):109-111.
[10]蒙健宗,秦小明,赵文报,等. 海藻糖对冷冻罗非鱼片蛋白质变性作用的影响[J]. 食品工业科技2007,28(8):214-216.
[11]李勤,彭亚锋,周家春,等. 海藻糖在冷冻猪肉中的应用研究[J]. 食品工业科技,2009,30(1):126-129.
[12]闫晓蕾. 山梨糖醇在香肠制品中的持水作用研究[D]. 无锡:江南大学,2012:20-28.
[13]朱圣刚,钟玉虎,郇延军. 山梨醇对预调理猪肉糜制品品质的影响[J]. 肉类研究,2012,26(10):9-12.
[14]邹明辉. 无磷保水剂在凡纳滨对虾虾仁冻藏加工中的应用及保水机理研究[D]. 广州:广东海洋大学,2011:16-26.
[15]李莎莎,安玥琦,丁玉琴,等. 碱性盐对冷冻鱼糜保水性的影响[J]. 食品科学,2012,33(21):68-72.
[16]胡铁军,尚祖萍. 重组牛肉保水剂的工艺配方优化[J]. 肉类研究,2011,25(9):25-29.
[17]张静雅. 白鲢鱼糜蛋白的冷冻变性机理及抗冻剂的应用研究[D]. 合肥:合肥工业大学,2012:17-18.
[18]张水华. 食品分析[M].北京:中国轻工业出版社,2007:68-80.
[19]Balange A,Benjakul S. Enhancement of gel strength of bigeye snapper(Priacanthus tayenus)surimi using oxidized phenolic compounds[J]. Food Chemistry,2009,113(1):61-70.
[20]万建荣,洪玉菁,奚印慈,等. 水产食品化学分析手册[M]. 上海:上海科技出版社,1993:89-100.
[21]Suvanich V,Jahncke M L,Marshall D L.Changes in selectedchemical quality characteristics of channel cat fish rame minceduring chill and f rozen storage[J].J Food Sci,2000,65(1):24-29.
[22]Benjakul S,Seymoour T A,Morrissey M T.Physicochemical changes in pacific whiting muscle proteins during iced storage[J].Journal of Food Science,1997,62:729-733.
[23]Laemmli U K. Cleavage of atructural proteins during assembly of head of bacteriophage T4[J]. Nature,1970,227(5259):680-685.
[24]Siddaiah D,Sagar R G V,Raju C V,et al. Changes in lipids,proteins and kamaboko forming ability of silver carp(Hypophthalmichthys molitrix)mince during frozen storage[J]. Food Research International,2001(34):47-53.
[25]Farouk M M,Wieliczko K J. Ultra-fast freezing and low storage temperatures are not necessary to maintain the functional properties of manufacturing beef[J]. Meat Science,2003(66):171-179.
[26]马路凯,张宾,王晓玲,等. 海藻糖、海藻胶及寡糖对蒸煮南美白对虾的抗冻保水作用[J]. 食品科学,2015(16):266-271.
[27]田其英. 复合抗冻剂抑制鲟鱼片冻藏变性的研究[J]. 食品工业,2015,36(4):158-160.
[28]鲁耀彬,熊光权,李新,等. 葡聚糖延缓草鱼肌原纤维蛋白冷冻变性的机理分析[J]. 食品科学,2016(10):289-294.
[29]陈思,李婷婷,李欢,等. 白鲢鱼片在冷藏和微冻条件下的鲜度和品质变化[J]. 食品科学,2015(24):297-301.
[30]刘海梅,严菁,熊善柏,等. 淡水鱼肉蛋白质组成及其在鱼糜制品加工中的变化[J].食品科学,2007,28(2):40-44.
Influenceoftrehalose,sorbitolandsodiumcitrateonanti-freezedenaturationoflargeyellowcroakermuscle’sproprotein
WANGNing,LILiang,LIMin,QIWen,SHANGHong-li*
(College of Food Science and Engineering,Jinzhou Medical University,Jinzhou 121000,China)
TS202.3
A
1002-0306(2017)18-0232-06
2017-02-07
王宁(1992-),女,在读硕士研究生,研究方向:食品科学,E-mail:1285565677@qq.com。
*通讯作者:尚宏丽(1977-),女,硕士,副教授,研究方向:食品科学,E-mail:shanghongli007@126.com。
辽宁省自然科学基金项目(2015020776);辽宁省农业领域创新人才项目(2014037);2016辽宁省大学生创新训练项目(201610160000060)。
10.13386/j.issn1002-0306.2017.18.044
