季节性温度对短程硝化系统微生物群落的影响
2017-10-13赵昕燕侯爱月阚睿哲
赵昕燕,卞 伟,侯爱月,阚睿哲,赵 青,李 军*
季节性温度对短程硝化系统微生物群落的影响
赵昕燕1,卞 伟1,侯爱月2,阚睿哲1,赵 青1,李 军1*
(1.北京工业大学建筑工程学院,北京 100124;2.北京国环清华环境工程设计研究院有限公司,北京 100084)
为了研究季节性温度对短程硝化生物膜系统中微生物群落结构的影响,以平均水温分别为28.3,23.3,21.6,9.6,-0.2℃条件下MBBR反应器的短程硝化生物膜为对象,利用聚合酶链式反应-变性梯度凝胶电泳技术(PCR-DGGE)对比分析上述生物膜中的微生物群落结构,结果表明: 在控制合适的水力停留时间(HRT)条件下,水温降低会影响微生物活性,但不影响短程硝化稳定性,平均水温在21.6~-0.2℃变化过程中总细菌和AOB的多样性及均匀性基本不变,芽孢杆菌、黄杆菌、亚硝化单胞菌等污水处理功能微生物都得到保留.平均水温28.3~-0.2℃条件下生物膜中的优势菌群主要分布于变形菌门(Proteobacteria) 和拟杆菌门(Bacteroidetes).其中AOB均属于β-Proteobacteria的亚硝化单胞菌属().本试验仅调控反应器水力停留时间(HRT)就可以实现低温短程硝化,对于短程硝化工艺广泛应用于工程实践具有重要意义.
低温;短程硝化;PCR-DGGE;微生物群落结构;MBBR
以短程硝化为基础的自养脱氮工艺较传统工艺具有诸多优点,但其目前多用于处理污泥消化液、高氨氮工业废水等,且大部分需要在30~40℃高温下进行[1-3].高温(>30℃)可以维持短程硝化的稳定运行已得到了中外学者的一致认可,而低温条件下短程硝化能否稳定维持尚存在争议.将生活污水加热到较高温度需要消耗大量的能源,对于大型污水处理厂,具体实施的难度以及增加的能耗均不容轻视.因此,探求在常、低温条件下实现并维持稳定短程硝化的方法,建立相应的控制策略,对于短程硝化工艺广泛应用于工程实践具有重要意义.
然而低温环境中应用活性污泥法处理生活污水效果下降,是目前我国北方城市低温生活污水处理所面临的主要问题.生物膜法由于能在生物处理系统中保有较高的生物量而受到广泛关注[4-5].近来各国对生物膜的研究兴趣逐渐向微观方面[6],由原来探索水力条件来获取最佳的处理效果转向生物膜的微观结构等方面[7].聚合酶链式反应-变性梯度凝胶电泳技术(PCR-DGGE),可以同时快速地对多个环境样品的微生物群落结构进行比较分析,提供微生物群落调控方面的理论依据,已成为水处理中微生物检测的常用方法之一.
本试验采用移动床生物膜反应器(MBBR),投加鲍尔环为悬浮填料,在室外水温为32.6~ -3.3℃条件下通过及时控制反应器水力停留时间(HRT)维持短程硝化的稳定运行.为了研究季节性温度对短程硝化生物膜系统中微生物群落结构的影响,以平均水温分别为28.3,23.3,21.6, 9.6,-0.2℃条件下的短程硝化生物膜为研究对象,利用PCR-DGGE技术对比分析不同生物膜中的微生物群落结构的异同,以期从微观方面为低温条件下稳定实现短程硝化提供新的思路和方法.
1 材料与方法
1.1 样品采集
试验采用MBBR反应器,长180mm,宽120mm,高260mm,有效体积约为5.6L,如图1所示,反应器上部进水,蠕动泵控制,下部溢流出水.采用底部曝气盘曝气,曝气量控制和计量采用微电脑曝气装置控制,通过探头精确测量和微调,温度传感器在线监测反应器内水温的变化.实验采用人工配水(自来水中加入12.8mg/L CH3COONa、11mg/L KH2PO4、229mg/L NH4Cl和720mg/L NaHCO3配制而成).反应器内的接种污泥均取自北京某污水处理厂曝气池,其硝化性能良好,值在0.7左右,污泥指数(SVI)值在90mL/g左右,污泥浓度(MLSS)在3500mg/L左右,向反应器内投加鲍尔环作为悬浮填料.实验过程中控制溶解氧(DO)>5mg/L,进水pH值约为7.8,出水pH值约为7.3,整个反应阶段室外水温从32.6℃降低到-3.3℃.
本试验从2015年7月11日启动挂膜,反应器运行半年直至2016年1月14日,分子生物学取样分别在平均水温为28.3,23.3,21.6,9.6,-0.2℃条件下,分别记为R1、R2、R3、R4和R5.
1.2 样品总DNA提取
将包埋菌样品使用研钵研碎,超声波破碎仪(AMPLITUDE 50%)破碎60s,在1.5mL离心管中静沉30min后舍去上清液,之后15000r/min高速离心5min后,去除上层清液,取0.3g污泥用于总DNA提取,剩余污泥冷冻备用.采用上海生工提供的“Ezup柱式基因组DNA抽提试剂盒(土壤)”提取DNA后,取5μL提取的DNA用1.2%琼脂糖凝胶检测.
1.3 聚合酶链式反应(PCR)
针对总细菌的PCR扩增,以提取的总DNA作为模板,采用对大多数细菌16S rRNA基因V3区都具有特异性的引物对[8]F357-GC(5'- CGCCCGCCGCGCCCCGCGCCCGGCCCGCCGCCCCCGCCCCCCTACGGGAGGCAGCAG-3')和R518(5'-ATTACCGCGGCTGCTGG-3').反应体系(50μL)为:10×PCR buffer5μL,dNTP(各2.5mmol/L)4μL,F357-GC(20μmol/L)1μL,R518(20μmol/L)1μL,Taq DNA聚合酶(5U)0.5μL,DNA模板0.25μL,加ddH2O至50μL.反应程序为:94℃预变性5min;94℃变性1min,65℃退火1min,72℃延伸1min,共进行20个循环,每个循环降低0.5℃;94℃变性1min,55℃退火1min,72℃延伸1min,共进行10个循环;72℃延伸8min.
针对亚硝化细菌(AOB)的PCR扩增,采用巢式PCR扩增,第1轮扩增以提取的总DNA作为模板,采用特异性引物对[9]CTO189fA/B/C (CTO189fA:5'-GGAGAAAAGCAGGGGATCG-3'、CTO189fB:5'-GGAGGAAAGCAGGGGATC- G-3'、CTO189fC:5'-GGAGGAAAGTAGGGGA- TCG-3')和CTO654r(5'-CTAGCYTTGTAGTTT-CAAACGC-3');第2轮扩增以第一轮PCR扩增的产物为模板,采用引物对F357-GC和R518.第1轮反应体系(50μL)为:10×PCR buffer5μL, dNTP (各2.5mmol/L)4μL,CTO189fA/B/C(20μmol/L)0.5μL,CTO654r(20μmol/L)0.5μL,Taq DNA聚合酶(5U) 0.5μL,DNA模板1μL,加ddH2O至50μL.反应程序为:94℃预变性5min;94℃变性45s,57℃退火45s,72℃延伸90s,共进行35个循环,72℃延伸10min.第2轮反应体系(50μL)为:10×PCR buffer5μL,dNTP(各2.5mmol/L)2μL, F357-GC (20μmol/L)3μL,R518(20μmol/L)3μL,Taq DNA聚合酶(5U)0.5μL,DNA模板0.25μL,加ddH2O至50μL.反应程序为:94℃预变性5min; 94℃变性1min,65℃退火1min,72℃延伸1min,共进行20个循环,每个循环降低0.5℃;94℃变性1min,55℃退火1min,72℃延伸1min,共进行10个循环;72℃延伸8min.
1.4 变性梯度凝胶电泳(DGGE)
采用DCodeTM基因突变检测系统(Bio- Rad,USA)对PCR扩增产物进行分离.经过预实验,本试验的DGGE电泳使用8%的聚丙烯酰胺凝胶,总细菌和AOB的电泳条件均为:凝胶变性梯度为30%~60%,电压150V,电泳缓冲液为1×TAE,电泳温度60℃,电泳时间7h.电泳结束后,用Gel Red核酸凝胶染料染色30min,在凝胶成像系统(Gel DocTMXR+,Bio-Rad)中进行拍照.
1.5 克隆与测序
对DGGE电泳后图谱上的优势条带进行切胶回收.对于选定的每个条带,只选择其中间部分进行切割.回收的条带转移到1.5mL 离心管中,用枪头挤碎,加入50μL的灭菌超纯水,4℃浸泡过夜,使DNA片段溶解于水中,取其溶液为模板,采用不带GC夹结构的F357和R518引物进行PCR扩增,扩增体系和程序与之前带GC夹的引物对F357-GC和R518相同.PCR产物用1.2%琼脂糖凝胶电泳检测并采用上海生工提供的SanPrep柱式DNA胶回收试剂盒纯化,将纯化后的DNA片段连接至pMD18-T Vector(TaKaRa, Japan) .转化到JM109感受态细胞中,在含有Amp/X- Gal/IPTG的LB平板上进行蓝白斑筛选.挑选白斑做菌落PCR验证,片段大小正确的PCR产物送往上海生工生物公司进行测序.将测序所得基因序列输入到NCBI网站,利用BLAST程序与数据库中已有的序列进行比对鉴定,并利用MEGA5.0软件中的邻接算法构建系统发育树.
1.6 样品的生物多样性分析
采用凝胶分析软件Quantity One对扫描所得的DGGE图谱进行分析.根据DGGE技术原理,图谱中分离出来的条带都是不同种类的微生物16S rDNA基因V3区的DNA片段,每个条带理论上可以代表一个微生物种属,条带的多寡可以反映系统中微生物种群的多样性程度.Shannon多样性指数(SDI)由样品中微生物种属的数量和丰度所决定,SDI 数值越大,种群的多样性越高.Pielou均匀性指数(EI)表示菌种分布的均匀程度.因此可利用Shannon多样性指数(SDI)和Pielou均匀性指数(EI)讨论活性污泥中微生物多样性特征.SDI和EI计算公式[8]如下:
(2)
式中:P为菌种在菌落中所占的百分比,P=n/,n为峰面积,为所有峰的总面积;为是样品中所有菌种的总数,即Patrick丰富度指数.
2 结果与讨论
2.1 温度对短程硝化性能的影响
2.1.1 不同温度条件下系统的短程硝化效果 从图2可以看出,MBBR反应器从7月11日开始运行,此时反应水温为30.3℃,通过逐步缩短反应器HRT为3.7h的方式,反应器中逐渐出现NO2--N的积累,至7月27日,反应器中的NO2--N积累率达到93.3%,出水NH4+-N和NO2--N质量浓度分别为3.48mg/L和56mg/L,氨氮去除率达到94.2%,基本所有NH4+-N都转化为NO2--N,反应器达到稳定的短程硝化.反应器在8月21日~9月11日停止运行,9月11日运行一周后活性恢复到之前的水平.反应器运行这一阶段室外水温从32.6℃降低至-0.2℃,通过调节反应器HRT维持出水氨氮在6~12mg/L.11月24日以后室外水温过低导致连续流出水口堵塞,所以后期采用SBR形式运行,反应器运行至1月14日.选取6d取样测定,11月26日~12月28 日HRT为24h,氨氮去除率为60%左右,12月29日~1月14日 HRT为48h,氨氮去除率为50%左右,但亚氮积累率一直维持在90%以上,SBR形式运行期间最低温度低至-3.3℃.R1~R5阶段平均水温分别为28.3,23.3,21.6,9.6,-0.2℃对应的氨氧化速率分别为22.4,17.7,16.2,7.1,1.9mgNH4+-N/(L·h),可以看出随着温度的降低氨氮氧化速率下降,表明微生物活性下降.
2.1.2 短程硝化实现与稳定的原因 (1)反应器HRT精准的控制是短程硝化实现的主要因素.按照出水氨氮在6~12mg/L来调节反应器HRT,能够灵活、准确的确定曝气时间.这样一方面可以使大部分氨氮被彻底氧化,另一方面防止了过度曝气引起亚硝酸盐氮进一步氧化为硝酸盐氮,从而抑制了亚硝酸氧化菌的生长.
(2)从温度的角度考虑,在实现短程硝化的阶段,温度正处于30~33℃,而这个温度正是实现短程硝化的最佳温度[10],此时AOB的生长速率高于NOB的生长速率,将快速实现短程硝化.
在短程硝化的稳定阶段,通过出水中的FA和FNA协同抑制,进一步增大AOB在硝化菌群中的优势,同时又尽可能减少了NOB的生长机会,使NOB逐渐从系统中被淘汰出去,从而逐渐优化了硝化菌群的结构,为在低温条件下实现短程硝化奠定基础.
2.1.3 低温条件下短程硝化的实现途径与机理 本试验随着温度下降氨氧化速率降低,细菌活性减小,但短程硝化一直很稳定,分析其原因:主要是低温短程硝化的实现要从中温、常温状态入手,通过调节运行方式、控制手段等方法使AOB成为硝化菌群中绝对的优势菌种,并将NOB尽可能多的从系统中淘汰出去[11].
2.2 温度对总细菌的影响
2.2.1 样品总DNA提取和总细菌PCR扩增结果 污泥样品提取的DNA经1.2%的琼脂糖凝胶电泳检测,得到的总DNA片段大小约为23kbp,属于比较完整的细菌总DNA,适合做下一步PCR扩增.针对总细菌16S rRNA基因的PCR扩增结果大约为240bp,符合预期的长度,适合做下一步DGGE.
2.2.2 DGGE指纹图谱结果 如图3所示,显示了样品R1~R5所代表的温度条件分别为28.3, 23.3,21.6,9.6,-0.2℃的短程硝化污泥中微生物群落结构的差异和演替.
图3是总细菌DGGE图谱,将条带对应的微生物可以分为3类,第1类是条带14、15、19代表的微生物,它们在整个实验阶段都存在,能够适应水温从32.6~-3.3℃温度变化大的环境,对反应器的稳定运行起着至关重要的作用;第2类是条带2、3、4、6、7、11、12、17、18对应的微生物,它们随着水温的逐步降低而逐渐减少至最后被淘汰,表明这类细菌在水温低的条件下受到抑制,适合生存于较高温度环境中;第3类是条带5、8、9对应的微生物,它们在水温高的条件下为非优势菌,随着水温逐步降低,这类微生物逐渐增多或出现,适合生存于低水温环境中.
2.2.3 总细菌种群结构多样性特征 如图4所示,样品R1到样品R2的SDI值和EI值均上升,这是反应器从启动到稳定的过程,故微生物种群趋于丰富和分布均匀.R2到R3阶段SDI值和EI值均下降,一方面是这一阶段反应器停止运行,使得DO和营养物质无法供应抑制微生物生长繁殖;另一方面R2到R3平均水温从23.3~ 21.6℃,水温降低微生物表现出生长速度放缓的趋势[12],故R2到R3微生物种群多样性变低,分布趋于集中.

表1 总细菌部分条带 16S rDNA 序列比对结果
本实验中样品R3、R4和R5的平均水温分别为21.6、9.6和-0.2℃,温度跨越比较大,但这3个样品的SDI值和EI值几乎相同.分析原因:一是平均水温从21.6~-0.2℃阶段该污水处理系统中耐冷菌渐渐保留了下来,这部分耐冷菌可以适应温度逐渐降低而不被淘汰;二是本试验采用鲍尔环悬浮填料,对微生物有截留作用,使得大部分细菌不会流失,故上述3个样品的多样性和均匀性几乎相同.
2.2.4 特征条带的回收测序和系统发育分析 将总细菌的DGGE图谱中部分优势条带进行切胶测序,在Genbank中进行比对,获得各条序列的同源性信息,总细菌的部分条带16S rDNA序列比对结果见表1.总细菌的系统发育树见图5.
由表1可以看出,本次试验5个样品中的微生物群落主要分布于变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes).Wagner等[14]对多篇关于废水生物处理反应器中细菌群落结构的研究表明变形菌门和拟杆菌门一直是废水处理系统中的优势菌群.其中5个样品的共有条带中,条带1、13、14、16和19均与Bacillus的同源性达到98%以上,微生物同源性大于97%就可以判断为是同一种属,郝桂玉等[15]认为芽孢杆菌(Bacillus)对硝化阶段氨氮的去除有很明显的作用;条带9与Flavobacterium sp. (HQ000016.1)的同源性达到98%,黄杆菌属(Flavobacterium)和芽孢杆菌(Bacillus)均为生物膜污水处理系统的常见优势细菌,且都是在低温条件下高效降解生活污水的耐冷菌[16].条带2、3、4和5均与Nitrosomonas的同源性达到97%以上,亚硝化单胞菌属(Nitrosomonas)在反应器内将氨氧化为亚硝酸盐,为短程硝化系统中的优势菌群[17-18].
2.3 温度对AOB的影响
2.3.1 AOB PCR扩增结果 针对AOB 16S rRNA基因的PCR扩增结果大约为500bp(第1轮)和250bp(第2轮),符合预期的长度,适合做下一步DGGE.
2.3.2 DGGE指纹图谱结果与分析 图6为针对AOB的16S rRNA基因所得DGGE图谱.将条带对应的微生物可以分为2类,第一类微生物随室外温度逐步降低一直存在,如条带2、3、8、9、10,这部分亚硝酸细菌能够适应短程硝化温度逐渐降低的各个阶段,如果能筛选出这些菌种并加以富集大规模的培养驯化,则稳定的短程硝化系统可以应对低温的恶劣环境.第二类微生物随水温逐步降低而逐渐减少遭到淘汰,如条带1、4、5、6、7代表的微生物,且这几类微生物均只存在于R1和R2阶段,表明这类亚硝酸盐细菌在水温逐渐降低的条件下受到抑制,适合生存于水温较高的环境中.
2.3.3 AOB种群结构多样性特征 如图7所示.可以看出:样品R1~R5的EI值几乎相同,表明在稳定的生物膜短程硝化系统中,水温从32.6~-3.3℃微生物分布的均匀性几乎没有受到影响.对于SDI值,样品RI和样品R2较高且相同,表明平均水温为23.3~28.3℃环境中AOB多样性丰富.
样品R3、R4和R5的SDI值较前2个样品低且几乎相同,即反应平均水温从21.6~-0.2℃系统内AOB的多样性几乎保持不变.在悬浮生长的活性污泥中,硝化细菌在低温条件下生长会受到很大程度上的抑制[19-23],但试验所得结果却是上述3个样品的SDI值几乎不变.分析原因:一是本试验采用MBBR工艺,V. Hoang[13]等认为MBBR反应器有快速适应和快速恢复能力,在温度变化下硝化细菌保持在生物膜中不丢失也不溶解;二是本试验采用鲍尔环悬浮填料,硝化细菌具有强烈的亲和依附固体生长的特性,使得硝化细菌可以依附填料生长和繁殖,不再因其世代时间较长而受制于HRT造成硝化细菌流失[24];三是Jones等[25]认为,如果将AOB从30℃的条件下直接转移到5℃的环境中,会导致它们失活,但若逐步适应,AOB能够根据温度变化逐渐调整细胞膜中的脂肪酸类型,使其中的饱和长链脂肪酸部分转化为短链不饱和脂肪酸以使其在低温条件下不易“冻结”,但这需要一定时间的培养和驯化.
2.3.4 AOB特征条带的回收测序和系统发育分析 将AOB的DGGE图谱中部分优势条带进行切胶测序,在Genbank中进行比对,获得各条序列的同源性信息,AOB的部分条带16S rDNA序列比对结果见表2. AOB的系统发育树见图8.
从表2的AOB部分条带16S rDNA序列比对结果和图8的AOB系统发育树可以看出,本研究中分离到的亚硝化细菌(AOB)均与Proteobacteria的亚硝化单胞菌属()有较高的相似性(90%~99%),而没有与亚硝化螺菌属()有一定相似性的序列,已有研究证实绝大多数的生物反应器里是AOB中的优势菌属,而只出现在个别反应器里[26-28].由表2可以看出,条带2和条带9与sp.的同源性均达到99%,itrosomonas sp.在氨氮转化为羟胺的过程中起主导作用,造成反应器内亚硝酸盐积累,温室气体N2O排放增加[29],是影响系统内含氮污染物转化途径的关键菌属.条带6和条带8分别与(NR_117368.1)和(HM446362.1)的同源性达到98%和99%,可利用氨氧化过程中的电子转移能量,可将CO2固定在植物中,在氮循环中有重要作用.本研究中的优势AOB均属于亚硝化单胞菌属(),且出现在短程硝化稳定时期温度不同阶段的不同菌种,表明该反应器生物膜内部形成的环境条件在温度从32.6~-3.3℃均能够为多种AOB提供生存环境.
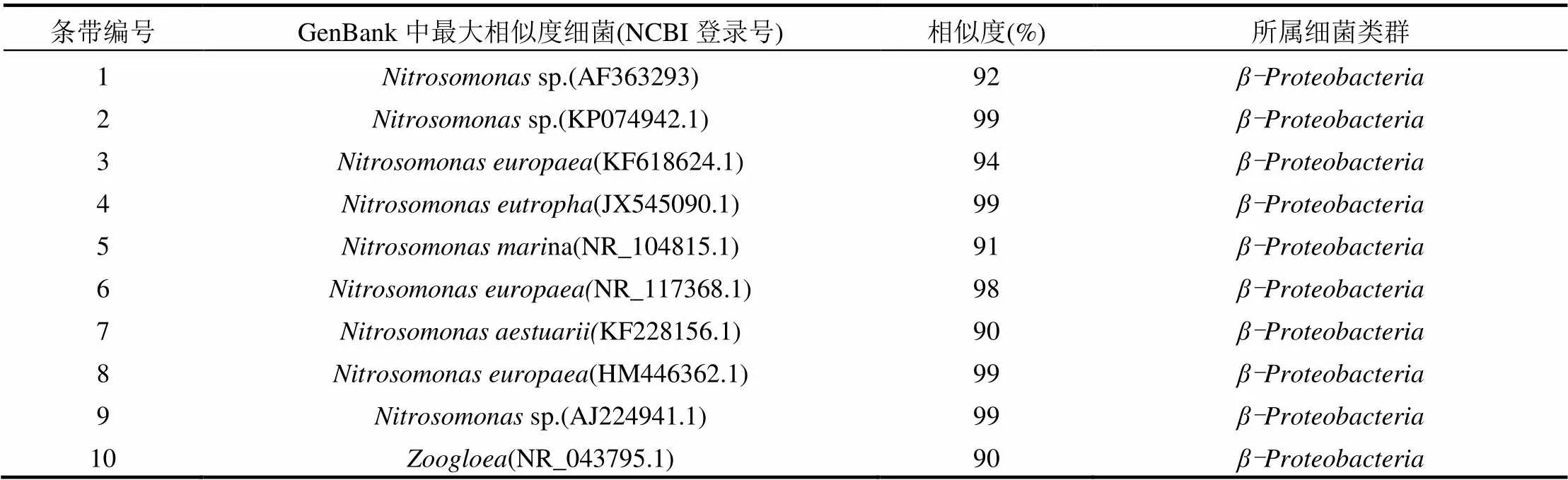
表2 AOB部分条带16S rDNA序列比对结果
3 结论
3.1 在合理HRT控制的前提下,水温降低会影响微生物活性,但不会影响短程硝化稳定性.
3.2 试验平均水温21.6~-0.2℃总细菌的多样性和均匀性没有改变,芽孢杆菌、黄杆菌、亚硝化单胞菌等污水处理功能微生物都得到保留.5个样品中的优势菌群主要分布于变形菌门()和拟杆菌门().
3.3 试验平均水温21.6~-0.2℃ AOB的多样性和均匀性没有改变.AOB种群分析表明优势AOB均属于亚硝化单胞菌属().
[1] 高春娣,王惟肖,李 浩,等.SBR法交替缺氧好氧模式下短程硝化效率的优化 [J]. 中国环境科学, 2015,35(2):403-409.
[2] 孙洪伟,杨 庆,董国日,等.游离氨抑制协同过程控制实现渗滤液短程硝化 [J]. 中国科学:化学, 2010,40(8):1156-1162.
[3] 张功良,李 冬,张肖静,等.低温低氨氮SBR短程硝化稳定性试验研究 [J]. 中国环境科学, 2014,34(3):610-616.
[4] Rivasim, Arvin F. Side stream biofilm for im-proved biofouling control in cooling water system [J]. Water Science & Technology, 2001,41:445-451.
[5] Paul L B, Tong Y.A microelectrode study of redox potential chain biofilms [J]. Water Science & Technology, 1999,39(7):179-185.
[6] Massoldeya A A, Whallon J, Hickey R F, et al. Channel structures in aerobic biofilms of fixed –film reactors treating contaminated groundwater [J]. Applied and Environmental Microbiology, 1995,61(3):769-777.
[7] Chrysi S L, Bruce E R. Modeling the development of biofilm density including active bacteria, inert bio-mass, and extracellular polymeric substances [J]. Water Research, 2004,38:3349-3361.
[8] 侯爱月,李 军,卞 伟,等.不同好氧颗粒污泥中微生物群落结构特点[J]. 中国环境科学, 2016,36(2):428-436.
[9] Kowalchuk G A, Bodelier P L E, Heilig G H J, et al. Community analysis of ammonium-oxidizing bacteria,in relation to oxygen availability in soils and root-oxygenated sediments, using PCR, DGGE and oligonucleotide probe hybridization [J]. FEMS Microbiology Ecology, 1998,24:339-350.
[10] Hellinga C, Schellen A A, Mulder J W, et al. The sharon process: An innovative method for nitrogen removal from ammonium-rich wastewater [J]. Water Science & Technology, 1998,37(9): 135-142.
[11] 杨 庆,彭永臻,王淑莹,等.SBR法低温短程硝化实现与稳定的中试研究[J]. 化工学报, 2007,58(11):2901-2905.
[12] 崔 迪.寒区污水生化处理系统微生物群落结构与功能解析 [D]. 哈尔滨::哈尔滨工业大学, 2014.
[13] Hoang V, Delatolla R, Abujamel R, et al. Nitrifying moving bed biofilm reactor (MBBR) biofilm and biomass response to long term exposure to 1℃ [J]. Water Research, 2014,49:215-224.
[14] Wagner M, Loy A. Bacterial community composition and function in sewage treatment systems [J]. Current Opinion in Biotechnology, 2002,13(3):218-227.
[15] 郝桂玉,徐亚同,黄民生,等.芽孢杆菌脱氮作用的研究[J]. 环境科学与技术, 2004,27(1):20-21,37.
[16] 韩晓云.低温生物膜及其微生物特性研究 [D]. 哈尔滨:哈尔滨工业大学, 2006.
[17] Flores III A, Nisola G M, Cho E, et al. Bioaugmented sulfur- oxidizing denitrification system with Alcaligenes defragrans B21forhigh nitrate containing wastewater treatment [J]. Bioprocess and Biosystems Engineering, 2007,30(3):197-205.
[18] Limpiyakorn T, Kurisu F, Sakamoto Y, et al. Effects of ammonium and nitrite oncommunities and populations of ammonia-oxidizing bacteria in laboratory-scale continuous-flow reactors [J]. Fems Microbiology Ecology, 2007,60(3):501-512.
[19] Van Dyke S, Jones S, Ong S K. Cold weather nitrogen removal deficiencies of aerated lagoons [J]. Environmental Technology, 2003,24(6):767-777.
[20] Buswell A M, Shiota T, Lawrence N, et al. Laboratory studies on the kinetics of the growth of Nitrosomonas with relation to the nitrification phase of the B.O.D test [J]. Applied Microbiology, 1954,2(1):21-25.
[21] Mc Cartney D M, Oleszkiewicz J A. Carbon and nutrient removal in a sequencing batch reactor at low temperatures [J]. Environmental Technology, 1990,11(2):99-112.
[22] Painter H A,Loveless J E. Effect of temperature and pH value on the growth-rate constants of nitrifying bacteria in the activated- sludge process [J]. Water Research, 1983,17(3):237-248.
[23] Delatolla R, Tufenkji N, Comeau Y, et al. Effects of long exposure to low temperatures on nitrifying biofilm and biomass in wastewater treatment [J]. Water Environment Research, 2012, 84(4):328-338.
[24] 张 岩,孙凤侠,谢杭冀,等.四区一体反应器冬季启动脱氮特性及硝化菌群结构分析[J]. 环境科学, 2015,36(9):3339-3344.
[25] Jones R D, Mo ri ta R Y, Koops H P, et al. A new marine am monium-oxidizing bacterium Nitrosomonas cryotolerans sp. nov. [J]. Can. J. Microbiol., 1988,34(10):1122-1128.
[26] Purkhold U, Pommerening-röser A, Juretschko S. Phylogeny of all recognized species of ammonia oxidizers based on comparative 16S rRNA and amo A sequence analysis: implications for molecular diversity surveys [J]. Applied Environmental Microbiology, 2000,66(12):5368–5382.
[27] Wells G F, Park H D, Yeung C H, et al. Ammonia-oxidizing communities in a highly aerated full-scaleactivated sludge bioreactor: betaproteobacterial dynamics and low relative abundance of Crenarchaea [J]. Environmental Microbiology, 2009,11(9):2310–2328.
[28] Zhang T, Ye L, Tong A, et al. Ammonia-oxidizing archaea and ammonia-oxidizing bacteria in six full-scale wastewater treatment bioreactors [J]. Applied Microbiology and Biotechnology, 2011,91(4):1215-7660.
[29] Yu T, He P J, Lü F, et al. Mediating N2O emissions from municipal solid waste landfills: Impacts of landfill operating conditions on community structure of ammonia-oxidizing bacteriain cover soils [J]. Ecological Engineering, 2009,35(5): 882-889.
Characteristics of microbial community structure in the stable operation of the partial cut nitrification system with seasonal temperature.
ZHAO Xin-yan1, BIAN Wei1, HOU Ai-yue2, KAN Rui-zhe1, ZHAO Qing1, LI Jun1*
(1.College of Architecture Engineering, Beijing University of Technology, Beijing 100124, China;2.Beijing Guohuan Tsinghua Environment Engineering Design and Research Institute, Beijing 100084, China).
In order to investigate the effect of seasonal temperature on microbial community structure of nitrification biofilm system, the nitrification biofilm system in MBBR reactor under the temperature of 28.3,23.3,21.6,9.6 and -0.2℃ were studied by using denatures gradient gel electrophoresis polymerase chain reaction(PCR-DGGE) technique. The activity of bacteria affected by loss of the water temperature, but did not affect stability of nitrification. During the change of water temperature(21.6~0.2℃), the total bacteria and AOB stayed stable; and the waste-water treatment of Bacillus, Flavobacterium and Nitrosomonas also stayed stable. The dominant bacteria in biofilm mainly was Proteobacteria and Bacteroidetes under the average temperature of 28.3~-0.2℃, and the AOB was Nitrosomonas that was the part of β-Proteobacteria. The partial nitrification under low temperature was achieved by controlling HRT merely, and it made great sense for the application of shortcut nitrification process.
low temperature;partial nitrification;PCR-DGGE;microbial community structure;MBBR
X172
A
1000-6923(2017)04-1366-09
2016-08-29
水体污染控制与治理科技重大专项2015ZX07202-013
赵昕燕(1992-),女,山西临汾人,北京工业大学硕士研究生,主要从事污水生物处理研究.
* 责任作者, 教授, jglijun@bjut.edu.cn
, 2017,37(4):1366~1374
