Cav1.2钙通道C末端远端片段dDCT重组质粒的构建及蛋白制备
2017-10-12胡慧媛雷帅孙德日孙旋旋晏珊刘世浩王健王莹李越郝丽英
胡慧媛,雷帅,孙德日,孙旋旋,晏珊,刘世浩,王健,王莹,李越,郝丽英
(中国医科大学 1. 药学院药物毒理学教研室,沈阳 110122;2. 附属第四医院骨科,沈阳 110032)
· 论著 ·
Cav1.2钙通道C末端远端片段dDCT重组质粒的构建及蛋白制备
胡慧媛1,雷帅1,孙德日2,孙旋旋1,晏珊1,刘世浩1,王健1,王莹1,李越1,郝丽英1
(中国医科大学 1. 药学院药物毒理学教研室,沈阳 110122;2. 附属第四医院骨科,沈阳 110032)
目的构建Cav1.2钙通道C末端远端片段(dDCT)(2 080~2 169)质粒,表达、提取、纯化蛋白并进行生物学活性鉴定。方法将dDCT的cDNA片段插入pGEX-6p-1质粒载体并转化大肠杆菌,异丙基硫代-β-D-半乳糖苷诱导蛋白表达,超声破碎法提取蛋白。GS-4B beads纯化蛋白后,pull-down方法分析其生物学活性。结果构建的dDCT质粒经限制性内切酶和测序双重鉴定成功,经超声破碎法提取的dDCT蛋白纯度和浓度均较高,并具有能够与GST-CT1融合蛋白浓度依赖性结合的生物学活性。结论本研究成功构建了dDCT重组质粒,为深入探讨Cav1.2钙通道的自身调节机制奠定了重要的物质基础。
Cav1.2钙通道; C末端远端片段; pull-down方法
Abstract ObjectiveTo construct a recombinant plasmid vector containing the distal fragment of the distal C-terminus( dDCT) of the Cav1.2 channel,and express,extract,and purify dDCT protein and characterize its biological activity.MethodsdDCT cDNA was ligated into the pGEX-6p-1 vector to create a recombinant plasmid that was subsequently transformed into Escherichia coli BL21 competent cells.Expression of GST-dDCT fusion protein from this plasmid was induced with isopropy-β-D-thiogalactoside,and the resulting protein was purified using glutathione-sepharose 4B beads. The biological activity of dDCT was analyzed by GST pull-down assay.ResultsThe recombinant plasmid was verified by restriction enzyme digestion and sequencing. The concentration and purity of the dDCT protein,which was extracted by ultrasonication,were high enough to detect dDCT activity. The binding of dDCT to CT1 was determined to be concentration-dependent.ConclusionThe recombinant dDCT plasmid was successfully constructed,providing the fundamental basis for future studies on mechanisms of Cav1.2 channel autoregulation.
KeywordsCav1.2 Channel; distal fragment of the distal C-terminus; pull-down assay
电压依赖性L型钙通道(voltage-dependent L-type calcium channel,VDCC)是可兴奋细胞中将电信号转换成钙离子内流,进而引起细胞内生物学反应的主要途径[1]。VDCC是由多个亚单位构成的蛋白复合体,主要包括孔道形成亚单位α1,辅助亚单位β、α2δ和γ。其中α1亚单位决定钙通道的基础电生理学特性,且根据其编码基因的不同可分为7个亚型(Cav1.1~Cav1.4,Cav2.1~Cav2.3)。心脏主要表达Cav1.2亚型[2-3]。心脏的Cav1.2钙通道主要定位于T管系统,其辅助亚单位Cavβ2b和Cavα2δ-1具有调节钙通道电压门控特性和通道转运的功能[4-5]。
先前的研究表明,Cav1.2钙通道α1C亚单位远端C末端部分(distal C-terminus,DCT)易被蛋白水解酶水解,产生截短的Cav1.2钙通道和水解的C末端片段DCT两部分。正常的心肌细胞中,大约80%的Cav1.2钙通道α1C亚单位DCT被切断,且切断的DCT仍与钙通道近端C末端部分(proximal C-terminus,PCT)具有相互作用。DCT可作为Cav1.2钙通道的自动抑制剂,发挥抑制钙通道电流的作用[6-7]。研究[8-9]发现,仅表达截短的Cav1.2钙通道α1C亚单位的转基因小鼠因心衰在出生前后即死亡,表明Cav1.2钙通道的DCT片段对心脏的发育和正常功能十分必要。然而,DCT的功能特征以及其对Cav1.2钙通道的调控机制目前为止尚未阐明。
本研究首先构建Cav1.2钙通道C末端远端部分的活性片段(distal fragment of DCT,dDCT)的重组质粒,进而制备纯化的dDCT蛋白,同时采用pull-down方法检测dDCT蛋白与GST-CT1融合蛋白的相互作用,最后鉴定dDCT的生物学活性和功能。dDCT的成功构建,为进一步探讨DCT与Cav1.2钙通道相互作用的功能特征及其分子机制提供了重要的物质基础,进而为研究与Cav1.2钙通道相关的心血管疾病的发病机制和防治措施提供了重要的线索。
1 材料与方法
1.1 材料
pGEX-6p-1/dDCT重组质粒由生工生物工程(上海)股份有限公司合成;SanPrep柱式质粒小量抽提试剂盒购自生工生物工程(上海)股份有限公司;BL21(DE3)化学感受态细菌购自北京全式金生物公司;限制性内切酶BamHⅠ和NotⅠ购自美国Thermo Scientific公司;Bradford蛋白定量试剂盒购自碧云天公司;异丙基硫代-β-D-半乳糖苷、氨苄西林、溶菌酶、十二烷基肌氨酸钠、DTT均购自美国Sigma公司;Precission蛋白酶、谷胱甘肽琼脂糖凝胶4B(glutathione-sepharose 4B,GS-4B) beads购自美国GE Healthcare公司,其他试剂均购自美国Biosharp公司。
1.2 重组质粒的提取和鉴定
将生工公司提供的表达有pGEX-6p-1/dDCT重组 质 粒 的TOP10细 菌(100 μ L)于5 mL含50 μ g/mL氨苄西林的LB液体培养基中,37 ℃、120 r/min水浴摇床中振摇培养12~16 h,5 000 r/min离心5 min,收集菌液。按照质粒小提试剂盒说明书抽提质粒,测定质粒DNA浓度,分别取1 μ g质粒进行BamHⅠ和NotⅠ的酶切鉴定并送公司进行测序分析。测序结果经PubMed网站的BLAST程序比对同源性。
1.3 重组质粒的转化
鉴于表达细菌蛋白的需要,按照BL21说明书中的操作步骤,将30 ng重组质粒pGEX-6p-1/dDCT转化至100 μ L大肠杆菌 BL21中,取转化后的菌液(75 μ L)均匀涂布于含有 0.1 mg/mL氨苄西林的LB固体琼脂培养基上,37 ℃恒温细菌培养箱中培养过夜(约16 h)。挑取经氨苄西林筛选后的单克隆菌株,接种于3 mL含50 μ g/mL氨苄西林的LB液体培养基中,37 ℃、120 r/min水浴摇床中振摇培养约16 h。
1.4 蛋白的提取、纯化及鉴定
根据本课题组对Cav1.2钙通道不同片段蛋白提取方法的总结,本研究选用超声破碎法提取dDCT蛋白[10-11]。取100 μ L转化有dDCT质粒并扩增后的BL21菌液,加入到400 mL含50 μ g/mL氨苄西林的LB液体培养基中,振摇过夜。测定菌液的吸光度,待OD600值为0.8~1.0时,加入 1 mmol/L的异丙基硫代-β-D-半乳糖苷诱导融合蛋白表达(37 ℃振摇4 h)。离心收集细菌,然后用含有0.2 mg/mL溶菌酶、10 mmol/L DTT和1.5%十二烷基肌氨酸钠的Tris缓冲液重悬细菌,冰上放置30 min后,冰上超声破碎(200 W,超声3 s停7 s)20 min,结束后加入1% TritonX-100冰上放置30 min。上述裂解液于15 000 g、4 ℃离心10 min后,收集上清。将上清液与GS-4B beads 孵育过夜,结合到beads上的蛋白清洗后,经Precission蛋白酶切除GST。纯化后的dDCT蛋白用Bradford蛋白浓度测定试剂盒测定浓度。用上述同样的方法提取纯化GSTCT1融合蛋白,但不进行Precission蛋白酶切步骤,用于后续dDCT蛋白活性检测。
1.5 dDCT蛋白生物学活性的测定
采用pull-down方法检测dDCT蛋白与GST-CT1融合蛋白的结合情况。将GST-CT1蛋白与GS-4B beads孵育,使其借助GST附着于beads上。然后将上述beads与纯化后不同浓度的dDCT蛋白在1 mmol/L[Ca2+]条件下,4 ℃旋转仪上共同孵育4 h。将孵育好的样品重悬于SDS上样缓冲液中,于15% SDS-PAGE凝胶电泳分离后经考马斯亮蓝染色,拍照、扫描图片,应用Image J软件分析蛋白灰度值。
2 结果
2.1 dDCT重组质粒的鉴定结果
dDCT基因片段(287 bp)于pGEX-6p-1质粒载体(4 984 bp)的BamHⅠ/NotⅠ 酶切位点处插入。其中,BamHⅠ酶切位点位于质粒载体的945 bp处,而NotⅠ 酶切位点位于974 bp处。故重组pGEX-6p-1/dDCT质粒全长为5 242 bp,经BamHⅠ/NotⅠ双酶切后得到2个碱基片段,分别为dDCT片段287 bp和载体片段4 955 bp。如图1所示,1、2、3泳道分别为完整的dDCT重组质粒,经BamHⅠ单酶切和经BamHⅠ/NotⅠ双酶切后的质粒片段。不同片段的分子量大小与计算得的理论值相符合。

图1 重组dDCT质粒的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of recombinant dDCT plasmid
进一步对提取的重组质粒进行测序鉴定分析。在构建重组质粒时,本课题组提供给公司的dDCT碱基序列因GC含量过高,经密码子优化后,GC含量控制在53.7%,其对应氨基酸序列为AQDPKFIEVTTQE LADACDMTIGEMENAADNILSGGAPQSPNGTLLPFV NC RDPGQDRAGGDEDEGCACALGRGWSEEELADS RVHVRSL,经BLAST比对后与豚鼠Cav1.2钙通道蛋白(NP_001166394.1)的C末端远端序列(a.a.2080-2169) 100%同源。
2.2 dDCT蛋白纯度和浓度的鉴定结果
经SMS在线DNA和蛋白序列处理工具预测得的dDCT蛋白的表观分子量是9 520。分别将纯化后的GST-dDCT融合蛋白和经Precission蛋白酶切后的纯dDCT蛋白进行15% SDS-PAGE电泳,并以纯GST蛋白为对照,结果(图2)显示:纯化后的GST蛋白在其预期分子量26 000处可见特异性条带,dDCT蛋白和GST-dDCT融合蛋白条带位置与预期结果一致。dDCT蛋白的杂带较少,即纯度较高;且条带灰度较高,提示蛋白含量较大。进一步采用Bradford法对dDCT纯蛋白进行浓度测定,3次提取蛋白的平均浓度为(0.58±0.10)g/L。经上述实验鉴定,提取纯化的dDCT蛋白纯度和浓度均较高,可以用于生物学活性鉴定。
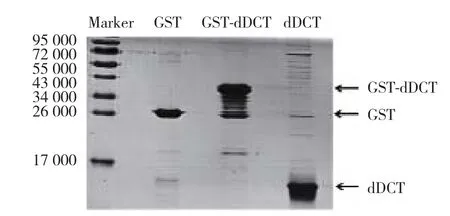
图2 纯化后dDCT蛋白的SDS-PAGE图Fig.2 SDS-PAGE of purified dDCT protein
2.3 dDCT蛋白与GST-CT1蛋白呈浓度依赖性结合
为了考察经超声破碎法提取的dDCT蛋白的生物学活性,将纯化后不同浓度的dDCT蛋白(0.1,0.3,1,3,10,15 μ mol/L)与GST-CT1融合蛋白在1 mmol/L[Ca2+]条件下共同孵育,经pull-down方法检测,结果(图3)显示:dDCT蛋白能够与GST-CT1蛋白结合,并且此结合作用具有浓度依赖性。提示经本研究方法制备、纯化的dDCT蛋白具有较好的生物学活性,能够用于后续钙通道调节机制的相关研究中。
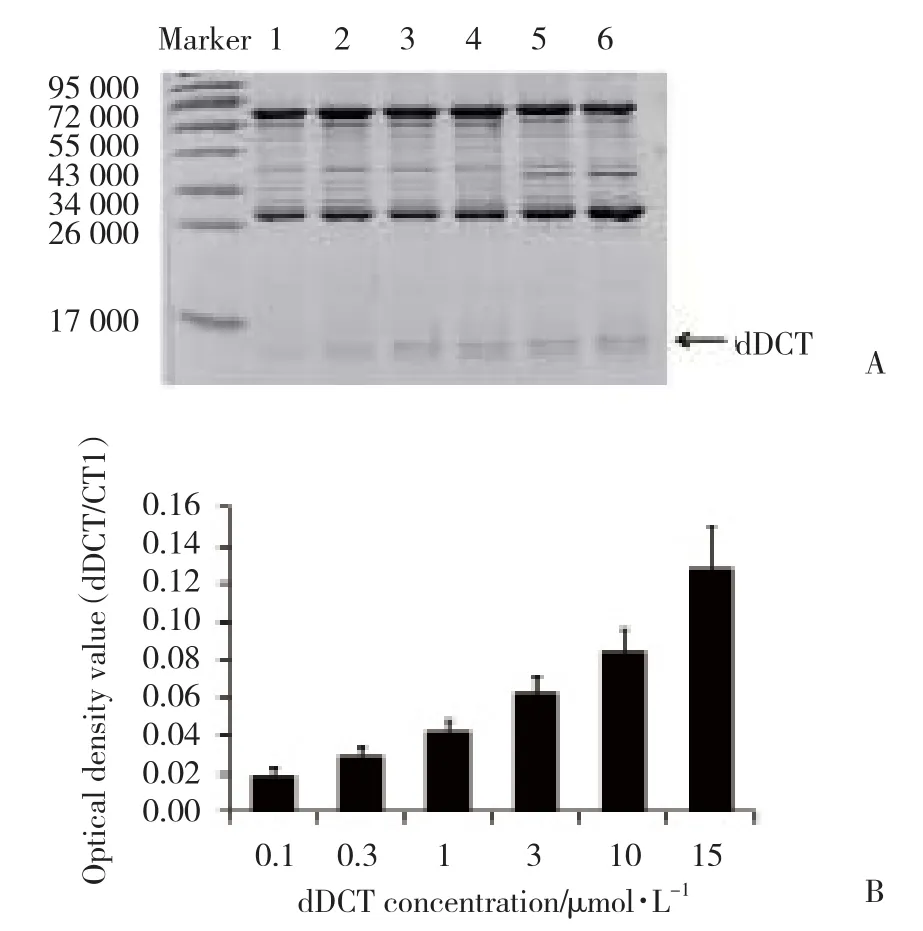
图3 dDCT蛋白与GST-CT1蛋白呈浓度依赖性结合Fig.3 dDCT binds to GST-CT1 in a concentration-dependent manner
3 讨论
随着人们对Cav1.2钙通道研究的不断深入,其自身调控作用越来越受到重视[12]。Cav1.2钙通道α1C亚单位DCT既可作为Cav1.2钙通道的自动抑制剂,通过非共价结合的方式抑制Cav1.2钙通道的电流;亦可作为转录因子与NKX2.5和环磷酸腺苷反应元件启动子直接结合调控基因的表达,参与心肌细胞钙稳态的维持及干细胞的分化和成熟[13-14]。
Cav1.2钙通道α1C亚单位的C末端是其在细胞内最大的结构域,约占α1C亚单位总质量的30%。它作为细胞内一系列信号分子打靶和定位的结构支架发挥重要作用,其中包括钙调蛋白、钙调蛋白依赖性蛋白激酶Ⅱ、抗药蛋白、蛋白磷酸酶ⅡA和PKA以及其锚定蛋白AKAP15。先前的研究[6-7]表明,PCT中包含由氨基酸残基1 694~1 700片段形成短α螺旋结构,它是近端C末端调节域(proximal C-terminal regulatory domain,PCRD)的重要元件,其中R1696和R1697在介导DCT对Cav1.2钙通道电流的调控中十分必要,但对PCT和DCT之间的结合无影响,而E2103、E2106 和 D2110 是远端C末端调节域(distal C-terminal regulatory domain,DCRD)的重要调节氨基酸。SHAW等[2]研究发现,DCT能够与PCT的CB/IQ区域结合,其对Cav1.2钙电流的抑制作用能够被Ca2+-CaM拮抗。最近的一项研究[15]表明,在神经元Cav1.3钙通道C末端介导的抑制中,结构域preIQ-IQ、PCRD和DCRD三者空间上彼此相互靠近是其重要的结构基础。因而,通过基因重组的方式构建不同的DCT功能片段,对于Cav1.2钙通道自身调节机制的研究意义重大。
本研究成功构建了Cav1.2钙通道C末端远端片段 dDCT (2 080~2 169)质粒,它是 CT3(1 942~2 169)的远端部分,且包含了部分DCRD结构域。该质粒能够在大肠杆菌BL21中表达高浓度蛋白,经GS-4B beads纯化后,具有较好的纯度和生物学活性,能够用于后续钙通道调节机制的相关研究中。本研究还发现,dDCT能够与Cav1.2钙通道C末端近端片段CT1蛋白浓度依赖性结合,提示dDCT可能参与调控Cav1.2钙通道的电生理特性以及心肌细胞钙稳态的维持。而深入探讨Cav1.2钙通道自身调节机制将有助于进一步阐明心血管相关疾病的发生机制和防治药物的研发。
[1] BODI I,MIKALA G,KOCH SE,et al. The L-type calcium channel in the heart:the beat goes on [J]. J Clin Invest,2005,115(12):3306-3317. DOI:10.1172/JCI27167.
[2] SHAW RM,COLECRAFT HM. L-type calcium channel targeting and local signalling in cardiac myocytes [J]. Cardiovasc Res,2013,98(2):177-186. DOI:10.1093/cvr/cvt021.
[3] HOFMANN F,FLOCKERZI V,KAHL S,et al. L-type CaV1.2 calcium channels:from in vitro findings to in vivo function[J].Physiol Rev,2014,94(1):303-326. DOI:10.1152/physrev.00016.2013.
[4] FANG K,COLERAFT HM. Mechanism of auxiliary β-subunit-mediated membrane targeting of L-type (Ca(V)1.2) channels [J]. J Physiol,2011,589(Pt 18):4437-4455. DOI:10.1113/ jphysiol.2011.214247.
[5] DOLPHIN AC. Voltage-gated calcium channels and their auxiliary subunits:physiology and pathophysiology and pharmacology [J]. J Physiol,2016,594(19):5369-5390. DOI:10.1113/ JP272262.
[6] HULME JT,YAROV-YAROVOY V,LIN TW,et al. Autoinhibitory control of the CaV1.2 channel by its proteolytically processed distal C-terminal domain[J]. J Physiol,2006,576(Pt 1):87-102. DOI:10.1113/jphysiol.2006.111799.
[7] CRUMP SM,ANDRES DA,SIEVERT G,et al. The cardiac L-type calcium channel distal carboxy terminus autoinhibition is regulated by calcium[J]. Am J Physiol Heart Circ Physiol,2013,304(3):H455-H464. DOI:10.1152/ajpheart.00396.2012.
[8] FU Y,WESTNBROEK RE,YU FH,et al. Deletion of the distal C terminus of CaV1.2 channels leads to loss of beta-adrenergic regulation and heart failure in vivo[J]. J Biol Chem,2011,286(14):12617-12626. DOI:10.1074/jbc.M110.175307.
[9] DOMES K,DING J,LEMKE T,et al. Truncation of murine CaV1.2 at Asp-1904 results in heart failure after birth [J]. J Biol Chem,2011,286(39):33863-33871. DOI:10.1074/jbc.M111.252312.
[10] SHAO D,ZHAO M,XU J. The individual N- and C-lobes of calmodulin tether to the Cav1.2 channel and rescue the channel activity from run-down in ventricular myocytes of guinea-pig heart[J]. FEBS Lett,2014,588(21):3855-3861. DOI:10.1016/j.febslet.2014.09.029.
[11] 何桂林,邵冬雪,印丹丹,等. 体外重组CaV1.2不同蛋白片段纯化及其与CaM相互作用的研究[J]. 中国医科大学学报,2013,42(9):773-776.
[12] SATIN J,SCHRODER EA. Auto-regulation of cardiac L-type calcium channels[J]. Trends Cardiovasc Med,2009,19(8):268-271.DOI:10.1016/j.tcm.2010.02.009.
[13] BANNISTER JP,LEO MD,NARAYANAN D,et al. The voltage-dependent L-type Ca2+(CaV1.2) channel C-terminus fragment is a bi-modal vasodilator[J]. J Physiol,2013,591(12):2987-2998.DOI:10.1113/jphysiol.2013.251926.
[14] GAO Q,GE J,JU Y,et al. Roles of L-type calcium channels (CaV1.2)and the distal C-terminus (DCT) in differentiation and mineralization of rat dental apical papilla stem cells (rSCAPs) [J]. Arch Oral Biol,2017,74:75-81. DOI:10.1016/j.archoralbio.2016.11.004.
[15] LIU N,YANG Y,GE L,et al. Cooperative and acute inhibition by multiple C-terminal motifs of L-type Ca2+channels [J]. Elife,2017,6.pii:e21989. DOI:10.7554/eLife.21989.
(编辑 陈 姜)
Construction of and Protein Preparation from a Recombinant Plasmid Containing the Distal Fragment of the Distal C-terminus of the Cav1.2 Channel
HU Huiyuan1,LEI Shuai1,SUN Deri2,SUN Xuanxuan1,YAN Shan1,LIU Shihao1,WANG Jian1,WANG Ying1,LI Yue1,HAO Liying1
(1. Department of Pharmaceutical Toxicology,School of Pharmacy,China Medical University,Shenyang 110122,China;2. Department of Orthopedics,The Fourth Affiliated Hospital,China Medical University,Shenyang 110032,China)
R96
A
0258-4646(2017)10-0865-04
http://kns.cnki.net/kcms/detail/21.1227.R.20170927.0942.002.html
10.12007/j.issn.0258‐4646.2017.10.001
国家自然科学基金(81100108,31471091);医学电生理学教育部重点实验室开放基金(201605);辽宁省大学生创新创业训练项目(201410159018)
胡慧媛(1978 -),女,副教授,博士.
郝丽英,E-mail:lyhao@cmu.edu.cn
2017-03-28
网络出版时间:2017-09-27 09:42
