miR-542-5p对1-磷酸鞘氨醇诱导的IEC-6细胞增殖的抑制作用*
2017-08-07穆攀伟蒙克嘎勒聂永梅谷晓艳吴桂霞
蒋 萍, 穆攀伟, 李 静, 蒙克嘎勒, 聂永梅, 谷晓艳, 吴桂霞△
(1新疆医科大学基础医学院生理学教研室, 新疆 乌鲁木齐 830011; 2中山大学附属第三医院内分泌科, 广东 广州 510630)
miR-542-5p对1-磷酸鞘氨醇诱导的IEC-6细胞增殖的抑制作用*
蒋 萍1, 穆攀伟2, 李 静1, 蒙克嘎勒1, 聂永梅1, 谷晓艳1, 吴桂霞1△
(1新疆医科大学基础医学院生理学教研室, 新疆 乌鲁木齐 830011;2中山大学附属第三医院内分泌科, 广东 广州 510630)
目的: 观察miR-542-5p对1-磷酸鞘氨醇(S1P)诱导的大鼠小肠隐窝上皮IEC-6细胞增殖的影响。方法: 建立稳定表达鞘氨醇激酶1(SphK1)的IEC-6细胞系(SphK1-IEC-C1和SphK1-IEC-C2),Western blot检测SphK1蛋白表达,放射性同位素示踪法测定SphK1酶活性和S1P分泌,细胞计数绘制生长曲线观察细胞增殖,流式细胞术分析细胞周期变化,实时荧光定量PCR检测miR-542-5p表达。结果: 与对照细胞相比,细胞系SphK1-IEC-C1和SphK1-IEC-C2中SphK1蛋白表达显著升高,SphK1酶活性升高,细胞内外S1P浓度升高,细胞生长速度加快,细胞周期中S期细胞所占比例升高,miR-542-5p的表达量降低;在IEC-6细胞的培养液中加入S1P (0.5~10 μmol/L),能显著抑制miR-542-5p表达;采用siRNA干扰降低IEC-6细胞的SphK1,可明显升高miR-542-5p表达。升高SphK1-IEC-C1和SphK1-IEC-C2细胞中miR-542-5p水平,则可降低S期细胞比例,抑制细胞增殖。结论: S1P通过降低IEC-6细胞中miR-542-5p水平,引起细胞周期由G1期向S期转换,促进IEC-6细胞增殖。
miR-542-5p; 1-磷酸鞘氨醇; 鞘氨醇激酶1; IEC-6细胞; 细胞增殖
神经鞘脂类是一类广泛存在于真核细胞膜上具有鞘氨基醇酰基的脂质,其代谢产物鞘氨醇(sphingosine,Sph)被鞘氨醇激酶(sphingosine kinase, SphK)磷酸化而生成1-磷酸鞘氨醇(sphingosine-1- phosphate,S1P)。目前已经知道SphK有2个亚型:SphK1和SphK2。其中,SphK1/S1P信号通路是调节细胞生长、存活和凋亡的重要途径之一[1-2]。SphK1过表达时,可以增加细胞内S1P的含量,促进细胞增殖[3-5],是肿瘤细胞增殖和迁移的因素[6-7]。但是对其具体机制仍了解不多。
MicroRNA是由19~24个核苷酸组成的高度保守的非编码RNA,参与细胞增殖、迁移和凋亡的调控[8]。miR-542-5p是新近发现的肿瘤抑制因子,在多种肿瘤组织中检测到其表达降低,并且这一抑制效应与肿瘤组织增生加剧、侵袭性升高等不良预后相关[9-12]。目前已经明确microRNA和SphK1/S1P信号通路中的SphK1存在互相调控关系:SphK1是microRNA的作用靶点[13-14],microRNA的活性又受SphK1的调控[15]。这就提示SphK1/S1P信号通路有可能通过miR-542-5p来发挥作用,但对此还未见有相关报道。因此,本研究拟建立稳定表达SphK1的细胞系,增加S1P合成,来观察miR-542-5p在S1P诱导的细胞增殖中的作用。
材 料 和 方 法
1 主要试剂
大鼠小肠隐窝上皮细胞株IEC-6购于广州吉妮欧生物科技有限公司。DMEM培养基、胰蛋白酶和胎牛血清购自HyClone。限制性内切酶NotⅠ和T4 DNA连接酶购自宝生物工程有限公司。Opti-MEM培养基和Lipofectamine 2000购自Invitrogen。RNeasy Mini Kit、miScriptⅡRT Kit、miScript SYBR Green PCR Kit、miR-542-5p、U6引物、mimic-miR-542-5p及阴性对照(scramble)购自QIAGEN。细胞周期检测试剂盒购自贝博生物。c-Myc和GAPDH抗体购自Santa Cruz。SphK1抗体购自Cell Signaling Technology。蛋白定量试剂盒和RIPA裂解液购自武汉博士德生物工程有限公司。SphK1 (NM_021972) cDNA Clone in pCMV6-AC 购自OriGene。阴性对照C-siRNA(5’-GGCUACGUCCAGGAGCGCA-3’)及siSphK1(5’-AUCCUUUAAACUGAUGCUCACCG-3’)购自Invitrogen。其它试剂均为国产分析纯。
2 主要方法
2.1 细胞培养 弃去培养液,PBS洗涤3次,加入0.05%的胰蛋白酶37 ℃消化细胞,倒置显微镜下观察,待细胞收缩变圆,加入含10%胎牛血清的DMEM培养液终止反应,1 500 r/min离心5min,弃去上清液,用含10%胎牛血清的DMEM培养液重悬细胞,1∶3的比例传代,实验用4~6代细胞。
2.2 SphK1重组质粒构建 使用限制性内切酶NotI从pCMV6-AC-SphK1质粒切下SphK1 cDNA,克隆入pCMV6-Neo质粒NotI位点,PCR筛选后用SacI和BamH I双酶切鉴定克隆方向,经双向测序鉴定读框无误后,提取重组质粒,重组质粒结构见图1。SphK1上游引物为5’-TGAACCTGCTGTCTCTGC- AC-3’,下游引物为5’-CAGGTGTCTTGGAACCCACT-3’。PCR条件: 94 ℃ 5 min; 94 ℃ 45 s, 52 ℃ 45 s, 72 ℃ 45 s,共35个循环; 72 ℃ 10 min。引物由上海生工生物技术服务有限公司合成。
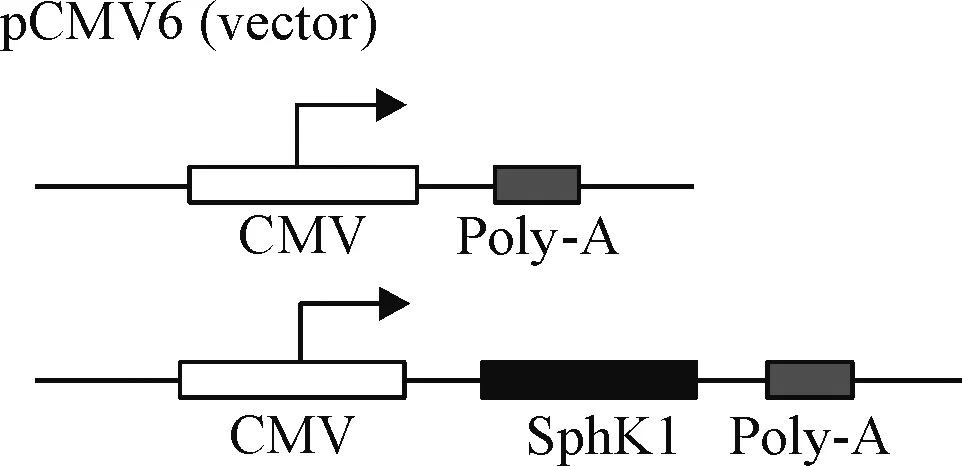
Figure 1.The SphK1 was cloned into an expression vector pCMV6-Neo.
图1 SphK1 cDNA在表达载体pCMV6-Neo中嵌入的模式图
2.3 稳定转染细胞系的建立 转染前1 d,将生长状态良好的IEC-6细胞用胰酶消化,接种于60 mm培养皿,37 ℃、5% CO2恒温培养12~16 h,细胞密度达70%~90%时,按照LipofectamineTM2000使用手册的指示,将pCMV6-Neo-SphK1转染至IEC-6细胞内,按照同样的程序转染pCMV6-Neo空载体(vector)作为空载体对照;再用非筛选性培养基培养48 h后,以600 mg/L的G418选择培养基进行筛选,适时挑选抗性克隆,24孔板、6孔板和25 mL培养瓶逐级扩大培养,获得稳定表达SphK1蛋白的细胞系。Western blot检测SphK1的表达,最终挑出2个稳定表达SphK1的细胞系(SphK1-IEC-C1和SphK1-IEC-C2)及vector细胞系用于实验。
2.4 S1P分泌量及SphK1酶活性分析 据文献[16]的描述,采用放射性同位素示踪法检测SphK1细胞系S1P合成以及SphK1酶活性。简单描述如下: 1.5 μmol/L 0.45 μCi D-erythro-[3-3H]鞘氨醇37 ℃孵育10 min用以标记细胞内鞘氨醇,之后用碱性苯酚-甲醇提取培养液及细胞内的S1P。用每mg蛋白释放多少pmol的S1P为单位计算细胞内外S1P的量,SphK1的酶活性以单位时间S1P的释放量为单位。
2.5 细胞生长曲线的记录 将SphK1-IEC-C1、SphK1-IEC-C2及vector细胞以每孔1.5×104接种于12孔板,每个样本做4个复孔,每天以细胞计数板计算每孔细胞数,直至细胞融合,绘制细胞生长曲线。
2.6 Mimic-miR-542-5p的瞬时转染 将处于对数生长期的SphK1-IEC-C1、SphK1-IEC-C2及vector的细胞接种于60 mm培养皿,根据Lipofectamine 2000转染说明书配制转染液:无血清、无双抗的Opti-MEM培养液中混合适量mimic-miR-542-5p和Lipofectamine 2000,室温放置20 min,每孔转染50 nmoL/L的mimic-miR-542- 5p,置于37 ℃、5%CO2的培养箱中孵育6 h后,更换普通培养基,48 h后进行细胞周期分布分析。同时设立随机序列阴性对照组(scramble组)。
2.7 Western blot法检测蛋白表达 RIPA裂解液冰上裂解细胞,收集提取液,匀浆后4 ℃ 14 000 r/min离心10 min,取上清液,按蛋白定量试剂盒操作说明测定蛋白浓度。蛋白浓度测定后,进行SDS-PAGE,上样量为30 μg,电印迹转移法将凝胶内的蛋白质转至硝酸纤维素膜上,用含5%牛血清白蛋白组分的TBST溶液室温封闭2 h,加入Ⅰ抗4 ℃孵育过夜,TBST 溶液洗脱3次,每次10 min,再与Ⅱ抗室温孵育1 h,TBST 溶液洗脱3次,每次10 min,之后与ECL试剂反应2 min,使用ProteinSimple公司的Flour Chem E型凝胶成像系统曝光、成像,以ImageJ图像处理软件测定感光区带的感光密度。
2.8 细胞周期分布检测 收集细胞,根据细胞周期检测试剂盒说明书所述步骤对DNA进行染色。简述如下:冰PBS冲洗细胞2次,75%乙醇-20 ℃固定1 h,冰PBS冲洗1次,400 μL PBS重悬细胞,加入20 μL溶液A,37 ℃孵育30 min,碘化丙啶(propidium iodide,PI)于4 ℃避光染色1 h后,LSRⅡ流式细胞仪(BD)检测细胞周期分布,每样本获得60 000细胞,Modfit软件分析细胞周期各时期的百分率。
2.9 RT-qPCR 按照RNA提取试剂盒说明书提取总RNA,利用紫外线分光光度计检测RNA浓度与纯度,反转录合成cDNA,定量PCR仪(Applied Biosystems 7500)平台进行定量分析,以U6 snRNA为内参照,miR-542-5p的相对表达量采用2-ΔΔCt计算。每个样本重复3次。
2.10 RNA干扰 进行RNA干扰前1 d,1×105细胞接种于60 mm培养皿。根据Lipofectamine 2000转染说明书配制转染液:无血清、无双抗的Opti-MEM培养液中混合适量siSphK1和Lipofectamine 2000,室温放置20 min,每个培养皿转染20 mmol/L的siSphK1,置于37 ℃、含5%CO2的培养箱中孵育6 h后,更换普通培养基,48 h后收取细胞,提取RNA及蛋白质。同时设立未转染的空白对照组和随机序列阴性对照组(C-siRNA组)。每个样本重复3次。
3 统计学处理
计量数据以均数±标准差(mean±SD)表示,应用SPSS 17.0统计软件分析,均数比较采用t检验或单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 稳定表达SphK1的细胞系中SphK1酶活性及S1P生成的改变
与vector细胞相比,稳定表达SphK1的细胞(SphK1-IEC-C1和SphK1-IEC-C2),SphK1的表达升高约2倍,SphK1的活性增高1.8~2.1倍,细胞内及细胞外S1P的浓度升高(P<0.01),SphK1/S1P信号通路处于激活状态,见图2、3。
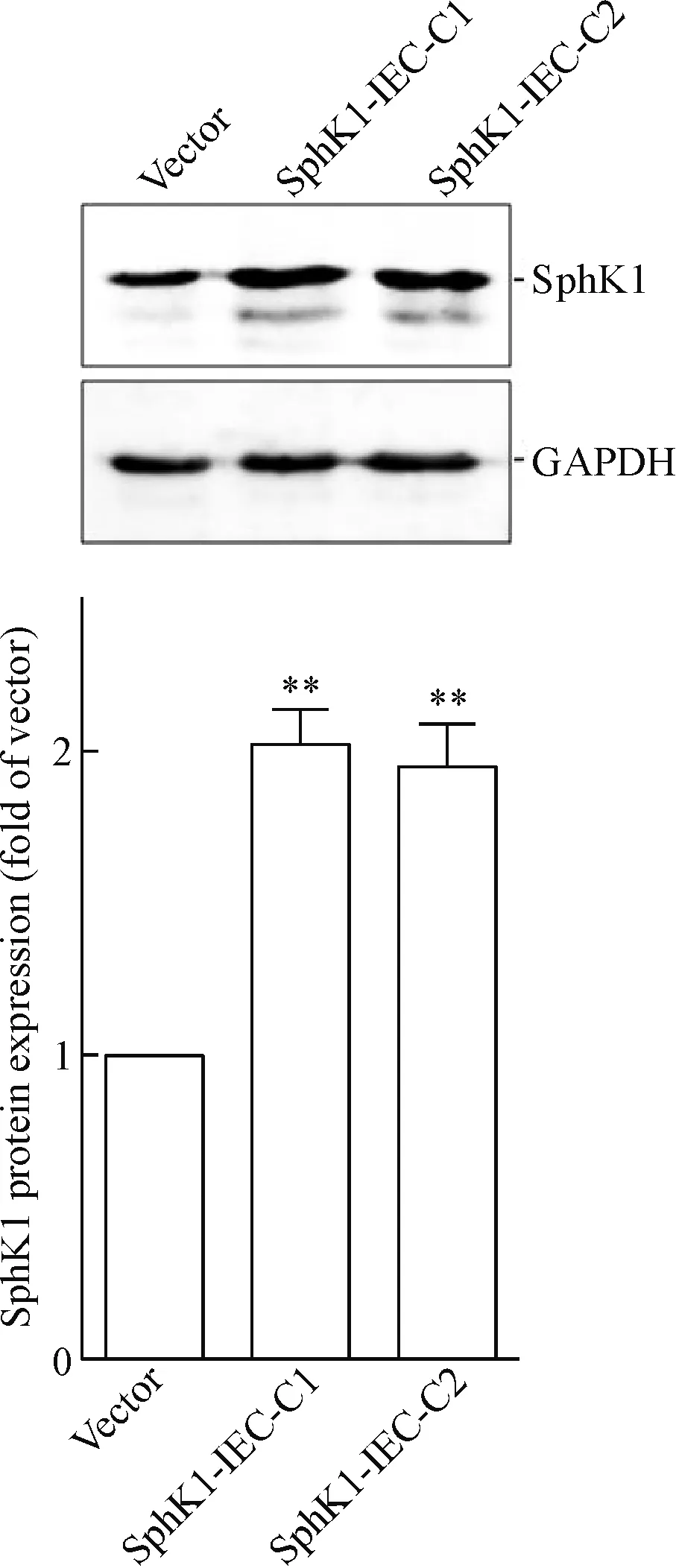
Figure 2.SphK1 protein expression in control vector and stable SphK1-expressing cells. Mean±SD.n=3.**P<0.01vsvector cells.
图2 稳定表达SphK1的细胞系SphK1蛋白表达的测定
2 SphK1/S1P升高对细胞增殖的影响
与vector细胞相比,稳定表达SphK1的细胞系(SphK1-IEC-C1和SphK1-IEC-C2)生长速度加快,更早到达细胞融合阶段,见图4。与vector细胞相比,稳定表达SphK1的细胞系G1期细胞比例明显减少,S期细胞所占的比例升高,见图5。

Figure 3.SphK1 activity (A) and S1P secretion (B) in control vector and stable SphK1-expressing cells. Mean±SD.n=3.**P<0.01vsvector cells.
图3 稳定表达SphK1细胞系SphK1酶活性以及S1P含量的测定
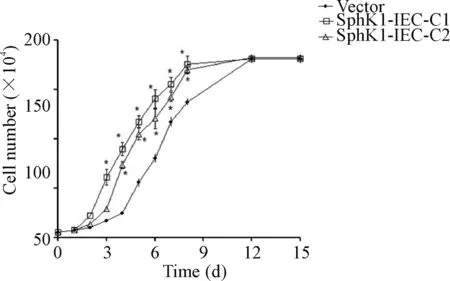
Figure 4.Cell growth curve assay of control vector and stable SphK1-expressing cells cultured for 15 d. Total cell number was counted daily until the cells reached confluence. Mean±SD.n=3.*P<0.05vsvector cells.
图4 稳定表达SphK1细胞系的细胞生长曲线的绘制
3 SphK1/S1P对miR-542-5p表达水平的影响
与vector细胞相比,稳定表达SphK1的细胞系(SphK1-IEC-C1和SphK1-IEC-C2)miR-542-5p表达下降(P<0.05)。在IEC-6细胞培养液中直接加入S1P (0.5~10 μmol/L),共同孵育4 h,miR-542-5p的表达降低,其中S1P在2.5 μmol/L时的抑制率最高(P<0.05),见图6。
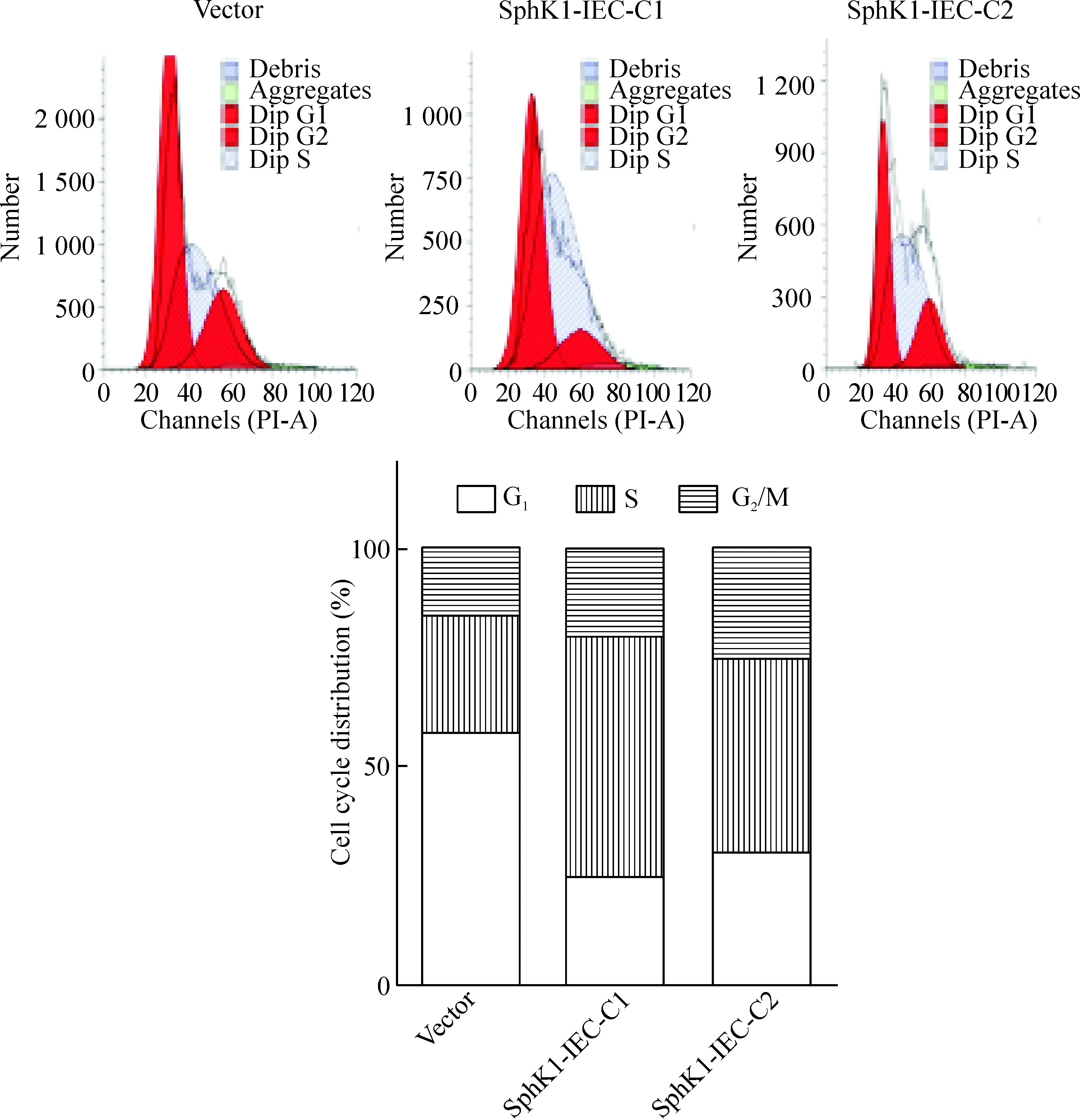
Figure 5.Cell cycle analysis of control vector and stable SphK1-expressing cells were determined by flow cytometry 36 h after cells were cultured.
图5 稳定表达SphK1的细胞系细胞周期分布情况

Figure 6.The levels of miR-542-5p in control vector and stable SphK1-expressing cells (A) and the levels of miR-542-5p in IEC-6 cells treated with S1P (0.5~10 μmol/L) for 4 h (B) were examined by RT-qPCR analysis. Mean±SD.n=3.*P<0.05vsvector cells;#P<0.05vs0 μmol/L.
图6 稳定表达SphK1的细胞系中miR-542-5p表达的测定以及IEC-6细胞培养液加入S1P对miR-542-5p表达的影响
4 RNA干扰抑制IEC-6细胞SphK1表达对miR-542-5p水平的影响
与空白对照及C-siRNA细胞相比,IEC-6细胞转染siSphK1 48 h后,SphK1蛋白表达下降约80%,miR-542-5p的表达显著升高(P<0.05),见图7。
5 在稳定表达SphK1细胞系转染mimic-miR-542-5p对细胞周期分布的影响
在稳定表达SphK1的细胞系(SphK1-IEC-C1和SphK1-IEC-C2)转染mimic-miR-542-5p,升高细胞内miR-542-5p的表达。与转染阴性对照scramble的细胞相比,转染mimic-miR-542-5p的SphK1-IEC-C1和SphK1-IEC-C2细胞中,S期细胞的所占比例下降,见图8;在转染后的第3天和第5天细胞数量降低(P<0.01),见图9。
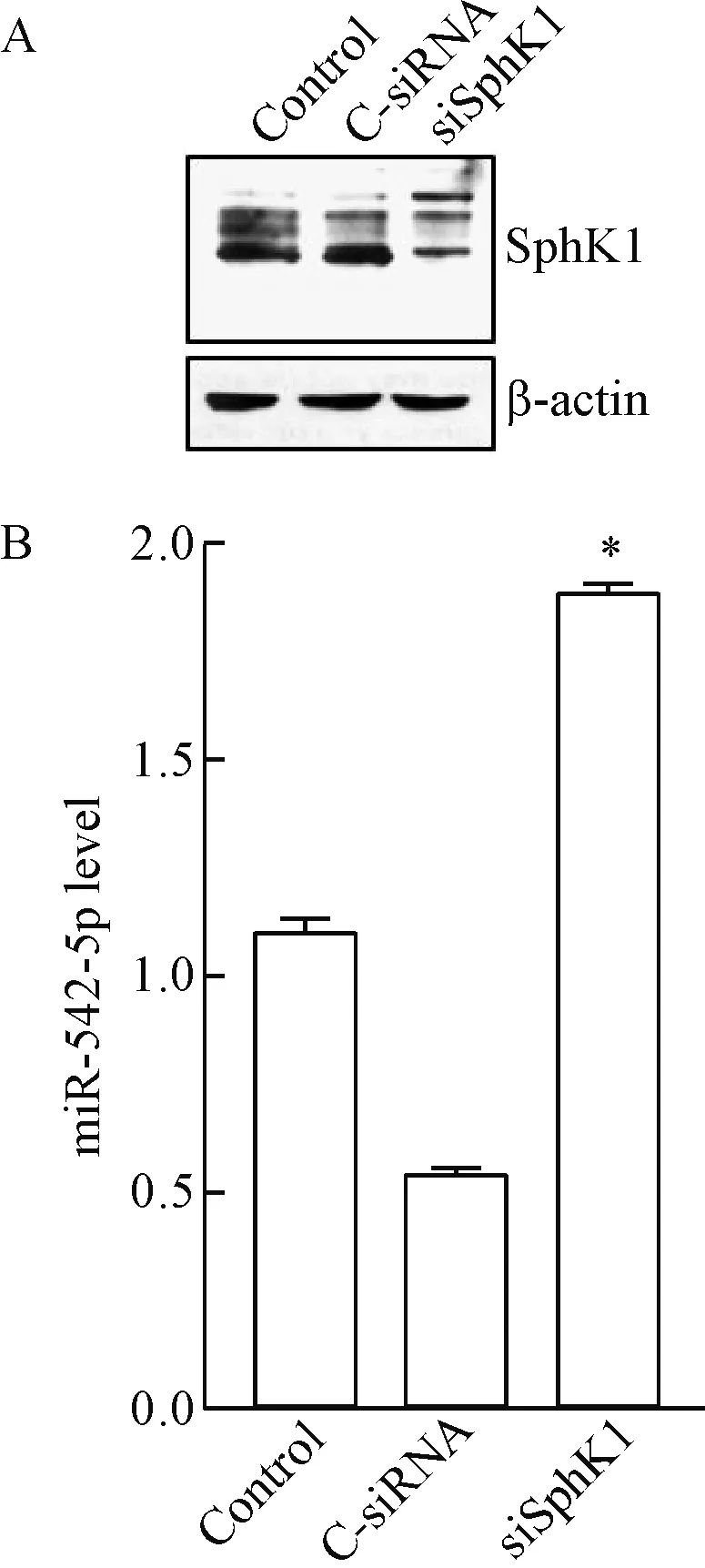
Figure 7.The expression of SphK1 (A) and miR-542-5p (B) in IEC-6 cells transfected with C-siRNA or siSphK1 Mean±SD.n=3.*P<0.05vsC-siRNA cells.
图7 siRNA抑制IEC-6细胞SphK1蛋白表达对miR-542-5p表达的影响
讨 论
鞘磷脂的代谢产物包括神经酰胺(ceramide,Cer)、Sph和S1P,Cer和Sph是细胞增殖的负调控因子,抑制细胞生长,诱导细胞凋亡;S1P则刺激细胞生长,抑制细胞凋亡[2]。细胞内的Cer、Sph和S1P可以发生相互转化,并通过酶促反应维持其动态平衡。本研究在IEC-6细胞建立稳定表达SphK1的细胞系,升高SphK1酶活性,打破酶促反应的平衡,促进细胞内S1P的生成和细胞外S1P的分泌,用以探讨SphK1/S1P系统促进细胞增殖的机制。
MicroRNA在细胞的增殖、分化、凋亡等方面都具有重要的调节作用,研究已证实SphK1是micro-RNA的作用靶点[13-14],microRNA的活性也受SphK1的调控[15]。miR-542-5p是新发现的肿瘤抑制因子,能抑制神经母细胞瘤的增殖[17]。本研究中稳定表达SphK1的2个细胞系(SphK1-IEC-C1和SphK1-IEC-C2),细胞增殖速度加快的同时miR-542-5p表达降低,相反,通过RNA干扰抑制IEC-6细胞SphK1蛋白的表达,则miR-542-5p的表达升高。这提示SphK1催化而生成的产物S1P可能是通过抑制miR-542-5p的表达,促进细胞增殖。目前已经知道S1P可以通过2种方式产生促细胞增殖的效应,一是分泌至细胞外,与细胞膜上的G蛋白偶联受体S1PR结合发挥效应[3, 18],另一种是直接在细胞内发挥第二信使的作用,触发Ca2+动员[19-20]。本研究中直接在IEC-6细胞的培养液中加入S1P,也能降低miR-542-5p表达,提示S1P能通过细胞外途径抑制miR-542-5p的表达。
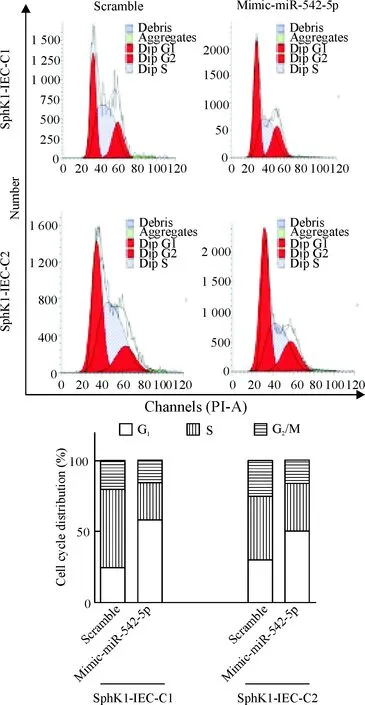
Figure 8.Effects of mimic-miR-542-5p on the cell cycle of stable SphK1-expressing cells (SphK1-IEC-C1 and SphK1-IEC-C2) determined by flow cytometry.
图8 在SphK1-IEC-C1和 SphK1-IEC-C2细胞分别转染mimic-miR-542-5p对细胞周期分布的影响
目前已经知道SphK1/S1P信号通路能对细胞周期产生影响。Kohno等[19]在大鼠肠上皮细胞转染腺病毒载体升高SphK1的表达,S期细胞所占比例升高;反之,使用N,N-二甲基鞘氨醇抑制SphK1表达,S期细胞所占比例下降;敲除了SphK1的ApcMin/+SphK1-/-小鼠肠息肉组织中细胞周期蛋白依赖性激酶4(cyclin-dependent kinase 4, CDK4)蛋白表达降低。Kalhori等[21]使用FTY720抑制甲状腺癌细胞S1P1受体表达,细胞增殖速度减慢,停留在G1期的细胞比例增多,CDK的抑制因子p2l和p27蛋白表达升高。上述研究提示,SphK1/S1P系统促细胞增殖效应与调控细胞周期有关。本研究中,高表达SphK1的细胞,miR-542-5p表达降低,S期细胞所占比例升高,细胞生长加快。反之,在稳定表达SphK1的细胞(SphK1-IEC-C1和SphK1-IEC-C2)转染mi-mic-miR-542-5p,升高miR-542-5p表达,则表现为停留在G1期的细胞增多,细胞生长速度减慢,提示miR-542-5p能通过调控IEC-6细胞的细胞周期,调节细胞生长。
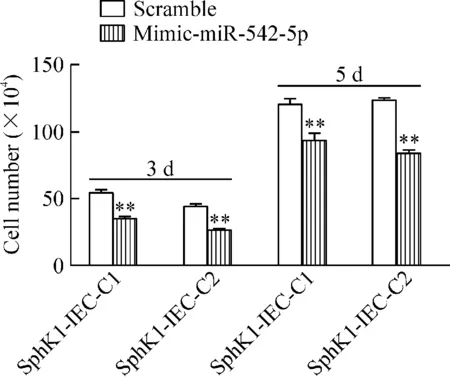
Figure 9.The numbers of stable SphK1-expressing cells (SphK1-IEC-C1 and SphK1-IEC-C2) transfected with scramble or mimic-miR-542-5p. Mean±SD.n=3.**P<0.01vsscramble.
图9 在SphK1-IEC-C1和 SphK1-IEC-C2细胞分别转染mimic-miR-542-5p对细胞数量的影响
综上所述,本研究的结果显示在IEC-6细胞上稳定表达SphK1,能促进S1P合成与分泌,后者通过抑制miR-542-5p的表达,促进细胞周期由G1期向S期转换,促进细胞增殖。CDK4等细胞周期调控因子可能是miR-542-5p的靶基因和靶蛋白,其具体机制如何在今后研究工作中进一步探索。
[1] Zhao Y, Kalari SK, Usatyuk PV, et al. Intracellular generation of sphingosine 1-phosphate in human lung endothelial cells: role of lipid phosphate phosphatase-1 and sphingosine kinase 1[J]. J Biol Chem, 2007, 282(19): 14165-14177.
[2] Strub GM, Maceyka M, Hait NC, et al. Extracellular and intracellular actions of sphingosine-1-phosphate[J]. Adv Exp Med Biol, 2010, 688: 141-155.
[3] Gairhe S, Joshi SR, Bastola MM, et al. Sphingosine-1-phosphate is involved in the occlusive arteriopathy of pulmonary arterial hypertension[J]. Pulm Circ, 2016, 6(3): 369-380.
[4] Hernández-Coronado CG, Guzmán A, Rodríguez A, et al. Sphingosine-1- phosphate, regulated by FSH and VEGF, stimulates granulosa cell proliferation [J]. Gen Comp Endocrinol, 2016, 236(15):1-8.
[5] Sysol JR, Natarajan V, Machado RF. PDGF induces SphK1 expression via Egr-1 to promote pulmonary artery smooth muscle cell proliferation[J]. Am J Physiol Cell Physiol, 2016, 310(11):C983-C992.
[6] Aoki H, Aoki M, Katsuta E, et al. Host sphingosine kinase 1 worsens pancreatic cancer peritoneal carcinomatosis[J]. J Surg Res, 2016, 205(2):510-517.
[7] Bao Y, Li K, Guo Y, et al. Tumor suppressor PRSS8 targets Sphk1/S1P/Stat3/Akt signaling in colorectal cancer[J]. Oncotarget, 2016, 7(18): 26780-26792.
[8] Wang Z, Yao H, Lin S, et al. Transcriptional and epigenetic regulation of human microRNAs[J]. Cancer Lett, 2013, 331(1):1-10.
[9] Rane JK, Ylipää A, Adamson R, et al. Construction of therapeutically relevant human prostate epithelial fate map by utilising miRNA and mRNA microarray expression data[J]. Br J Cancer, 2015, 113(4):611-615.
[10]Althoff K, Lindner S, Odersky A, et al. miR-542-3p exerts tumor suppressive functions in neuroblastoma by downregulating survivin[J]. Int J Cancer, 2015, 136(6):1308-1320.
[11]Zhou M, Wang H, Zhou K, et al. A novel EGFR isoform confers increased invasiveness to cancer cells[J]. Cancer Res, 2013, 73(23): 7056-7067.
[12]Wang B, Li J, Sun M, et al. miRNA expression in breast cancer varies with lymph node metastasis and other clinicopathologic features[J]. IUBMB Life, 2014, 66(5): 371-377.
[13]Chen MB, Yang L, Lu PH, et al. MicroRNA-101 down-regulates sphingosine kinase 1 in colorectal cancer cells[J]. Biochem Biophys Res Commun, 2015, 463(4):954-960.
[14]Zhao X, He W, Li J, et al. MiRNA-125b inhibits proliferation and migration by targeting SphK1 in bladder cancer[J]. Am J Transl Res, 2015, 7(11):2346-2354.
[15]Liu X, Hong Q, Wang Z, et al. Transforming growth factor-β-sphingosine kinase 1/S1P signaling upregulates microRNA-21 to promote fibrosis in renal tubular epithelial cells[J]. Exp Biol Med (Maywood), 2016, 241(3):265-272.
[16]Mitra P, Payne SG, Milstien S, et al. A rapid and sensitive method to measure secretion of sphingosine-1-phosphate[J]. Methods Enzymol, 2007, 434:257-264.
[17]Bray I, Tivnan A, Bryan K, et al. MicroRNA-542-5p as a novel tumor suppressor in neuroblastoma[J]. Cancer Lett, 2011, 303(1): 56-64.
[18]Chen J, Tang H, Sysol JR, et al. The sphingosine kinase 1/sphingosine-1-phosphate pathway in pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2014, 190(9):1032-1043.
[19]Kohno M, Momoi M, Oo ML, et al. Intracellular role for sphingosine kinase 1 in intestinal adenoma cell proliferation[J]. Mol Cell Biol, 2006, 26(19):7211-7223.
[20]Meyer zu Heringdorf D1, Liliom K, Schaefer M, et al. Photolysis of intracellular caged sphingosine-1-phosphate causes Ca2+mobilization independently of G-protein-coupled receptors[J]. FEBS Lett, 2003, 554(3):443-449.
[21]Kalhori V, Magnusson M, Asghar MY, et al. FTY720 (Fingolimod) attenuates basal and sphingosine-1-phosphate-evoked thyroid cancer cell invasion[J]. Endocr Relat Cancer, 2016, 23(5): 457-468.
(责任编辑: 陈妙玲, 罗 森)
miR-542-5p down-regulates IEC-6 cell proliferation induced by sphingosine-1-phosphate
JIANG Ping1, MU Pan-wei2, LI Jing1, Mengkegale1, NIE Yong-mei1, GU Xiao-yan1, WU Gui-xia1
(1DepartmentofPhysiology,SchoolofBasicMedicine,XinjiangMedicalUniversity,Urumqi830011,China;2DepartmentofEndocrinology,TheThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China.E-mail:wuguixia_good@163.com)
AIM: To observe the effects of miR-542-5p on the proliferation of rat small intestine crypt epithe-lial IEC-6 cells induced by sphingosine-1-phosphate (S1P). METHODS: Two IEC-6 cell lines (SphK1-IEC-C1 and SphK1-IEC-C2) were established, which expressed sphingosine kinase-1 (SphK1) stably. Radioactive tracer was used to detect SphK1 activity and S1P secretion. The cell proliferation was observed by cell counting and described by drawing growth curve, and the cell cycle analysis was carried out by flow cytometry. The level of miR-542-5p was evaluated by RT-qPCR. RESULTS: Compared with control vector cells without SphK1 cDNA, both SphK1-IEC-C1 and SphK1-IEC-C2 cell lines showed that Sphk1 was elevated, both intracellular and extracellular S1P increased dramatically, the rate of cell growth was faster, the percentage of the cells in S phase increased, and miR-542-5p expression decreased. S1P (0.5~10 μmol/L) led to the decrease in miR-542-5p expression. On the contrary,SphK1 silencing resulted in the increase in miR-542-5p expression in the IEC-6 cells. The miR-542-5p was elevated in SphK1-IEC-C1 cells and SphK1-IEC-C2 cells, which caused the decrease in the percentage of the cells in S phase. The cell growth rate in the above-mentioned 2 cell lines decreased compared with negative control group. CONCLUSION: In IEC-6 cells, S1P promotes proliferation by inhibiting miR-542-5p expression, which induces the cell cycle transferring from G1phase to S phase.
miR-542-5p; Sphingosine-1-phosphate; Sphingosine kinase-1; IEC-6 cells; Cell proliferation
1000- 4718(2017)07- 1184- 07
2016- 11- 02
2017- 01- 06
新疆维吾尔自治区自然科学基金资助项目(No. 2013211A072)
R363.2+1
A
10.3969/j.issn.1000- 4718.2017.07.005
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0991-4362449; E-mail: wuguixia_good@163.com
